1.3氧化还原反应(第一课时)课件(共18张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3氧化还原反应(第一课时)课件(共18张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-21 18:59:50 | ||
图片预览






文档简介
(共18张PPT)
第一章 物质及其变化
第三节 氧化还原反应
第1课时
苹果变色
铁钉生锈
在生活中我们能看到一些常见的现象,为什么会出现这些神奇的现象呢?
氧化还原反应
变化
反应
空气中的氧气
新的物质
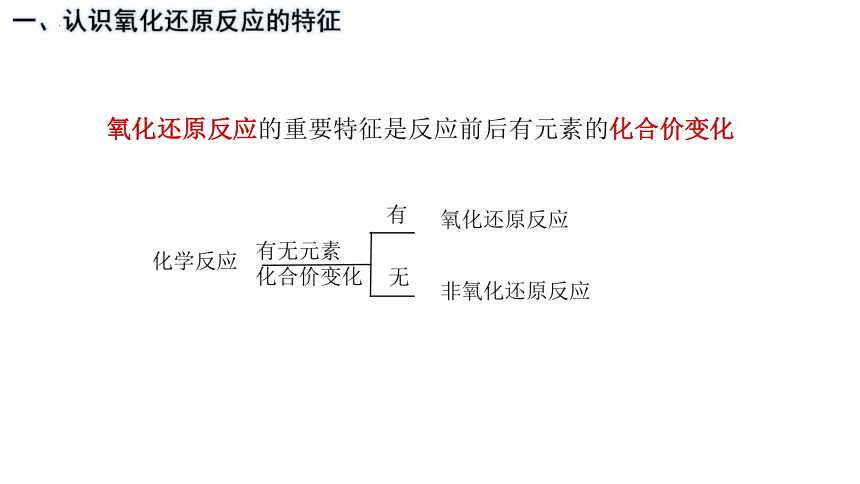
一、认识氧化还原反应的特征
氧化反应:得到氧的反应
还原反应:失去氧的反应
思考与讨论
2CuO + C══ 2Cu + CO2↑
得到氧
失去氧
高温
?
思考与讨论
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质 C、CO 氧化反应
失氧物质 CuO、Fe2O3 还原反应
表格
总结
1.氧化反应和还原反应是在同一个反应中发生的
2.物质发生了变化
宏观
物质层面出现了变化,那还有其他哪里发生了变化?
氧化还原反应的概念P22
化合价
+2
0
0
+4
在反应前后,化合价出现了变化
+3
+2
0
+4
哪些物质所含元素化合价发生了变化呢?有什么规律?
化合价升高
化合价降低
C、CO
CuO、Fe2O3
得氧物质 C、CO 氧化反应
失氧物质 CuO、Fe2O3 还原反应
总结:所含元素化合价升高的物质如C、CO,发生的反应都是氧化反应
所含元素化合价降低的物质如CuO、Fe2O3,发生的反应都是还原反应
一、认识氧化还原反应的特征
氧化还原反应的重要特征是反应前后有元素的化合价变化
化学反应
有无元素
化合价变化
有
无
氧化还原反应
非氧化还原反应
一、认识氧化还原反应的特征
如果按照化合价升降的角度判断,Fe+CuSO4══Cu+FeSO4
是否为氧化还原反应?
思考:
只要有化合价变化即为氧化还原反应,不限于是否有氧的得失。
+2
0
0
+4
+3
+2
0
+4
一、认识氧化还原反应的特征
0
+2
0
+2
观察下列氧化还原反应中所有元素的化合价,寻找氧化还原反应中元素化合价变化的规律
氧化还原反应中元素化合价有升有降
元素化合价的升高总数与降低总数相等
氧化还原反应中有的元素的化合价可能不变
总结
二、认识氧化还原反应的本质
是什么导致了化合价的升降?
2Na + Cl2 ══ 2NaCl
△
判断:金属钠与氯气在加热条件下生成氯化钠的反应属于氧化还原反应吗?
根据右侧氯化钠的形成示意图分析,是什么原因导致元素的化合价发生反应?
原子最外层电子的转移
二、认识氧化还原反应的本质
Cl在反应中得到电子,化合价降低
化合价的变化是电子转移的结果,
氧化还原反应的本质是电子的转移
2Na + Cl2 ══ 2NaCl
△
Na在反应中
失去电子,化合价升高
失去2e-
得到2e-
+12
8
2
2
+12
8
2
+8
6
2
+8
8
2
Mg2+
O2-
化合价的变化是电子转移的结果
氧化还原反应的本质是电子的转移
二、认识氧化还原反应的本质
2Mg + O2 ══ 2MgO
点燃
H2 + Cl2══ 2HCl
二、认识氧化还原反应的本质
H Cl
H Cl
氧化还原反应的本质:共用电子对的偏移
2
8
7
+17
+1
1
H
Cl
+1
-1
H2 + Cl2 2HCl
点燃
1.定义
没有电子转移的化学反应称为非氧化还原反应
2.特点
3.实质
有电子转移的化学反应
元素化合价发生升降变化
电子转移
电子的得失和电子对的偏移
二、认识氧化还原反应的本质
氧化还原反应
特征
本质
化合价升降
判断依据
电子转移
化合价变化
记忆口诀:
升失氧——还原剂化合价升高,失电子,发生氧化反应,被氧化
降得还——氧化剂化合价降低,得电子,发生还原反应,被还原
总结
二、认识氧化还原反应的本质
分解反应
化合反应
C + O2 == CO2
CaO + CO2 == CaCO3
化合反应
有单质参加时是氧化还原反应
2H2O == 2H2↑ + O2↑
NH4Cl == NH3 ↑ + HCl↑
分解反应
有单质生成时是氧化还原反应
点燃
通电
△
Fe + 2AgNO3 == Fe(NO3) 2 + 2Ag
C + 2CuO == 2Cu + CO2
置换反应
△
全都是是氧化还原反应
Ba(OH) 2 + H2SO4 == BaSO4 + H2O CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
复分解反应
全不是氧化还原反应
置换反应
复分解
反应
氧化还原反应
三、巩固提升
判断下列反应是否为氧化还原反应:
C + O2══CO2 CaO + CO2 ══CaCO3
2H2O══ 2H2↑ + O2↑ NH4Cl══ NH3 ↑ + HCl↑
Fe + 2AgNO3 ══ Fe(NO3) 2 + 2Ag C + 2CuO ══2Cu + CO2
Ba(OH) 2 + H2SO4 ══ BaSO4 + H2O
CaCO3 + 2HCl ══ CaCl2 + H2O + CO2↑
点燃
通电
△
△
√
√
√
√
×
×
×
×
三、巩固提升
△
△
以下说法是否正确?
(1)有单质参加的化合反应和有单质生成的分解反应一定是氧化还原反应。
(2)有单质参加或生成的反应一定是氧化还原反应。
同素异形体之间的转化不是氧化还原反应。
√
×
三、巩固提升
第一章 物质及其变化
第三节 氧化还原反应
第1课时
苹果变色
铁钉生锈
在生活中我们能看到一些常见的现象,为什么会出现这些神奇的现象呢?
氧化还原反应
变化
反应
空气中的氧气
新的物质
一、认识氧化还原反应的特征
氧化反应:得到氧的反应
还原反应:失去氧的反应
思考与讨论
2CuO + C══ 2Cu + CO2↑
得到氧
失去氧
高温
?
思考与讨论
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质 C、CO 氧化反应
失氧物质 CuO、Fe2O3 还原反应
表格
总结
1.氧化反应和还原反应是在同一个反应中发生的
2.物质发生了变化
宏观
物质层面出现了变化,那还有其他哪里发生了变化?
氧化还原反应的概念P22
化合价
+2
0
0
+4
在反应前后,化合价出现了变化
+3
+2
0
+4
哪些物质所含元素化合价发生了变化呢?有什么规律?
化合价升高
化合价降低
C、CO
CuO、Fe2O3
得氧物质 C、CO 氧化反应
失氧物质 CuO、Fe2O3 还原反应
总结:所含元素化合价升高的物质如C、CO,发生的反应都是氧化反应
所含元素化合价降低的物质如CuO、Fe2O3,发生的反应都是还原反应
一、认识氧化还原反应的特征
氧化还原反应的重要特征是反应前后有元素的化合价变化
化学反应
有无元素
化合价变化
有
无
氧化还原反应
非氧化还原反应
一、认识氧化还原反应的特征
如果按照化合价升降的角度判断,Fe+CuSO4══Cu+FeSO4
是否为氧化还原反应?
思考:
只要有化合价变化即为氧化还原反应,不限于是否有氧的得失。
+2
0
0
+4
+3
+2
0
+4
一、认识氧化还原反应的特征
0
+2
0
+2
观察下列氧化还原反应中所有元素的化合价,寻找氧化还原反应中元素化合价变化的规律
氧化还原反应中元素化合价有升有降
元素化合价的升高总数与降低总数相等
氧化还原反应中有的元素的化合价可能不变
总结
二、认识氧化还原反应的本质
是什么导致了化合价的升降?
2Na + Cl2 ══ 2NaCl
△
判断:金属钠与氯气在加热条件下生成氯化钠的反应属于氧化还原反应吗?
根据右侧氯化钠的形成示意图分析,是什么原因导致元素的化合价发生反应?
原子最外层电子的转移
二、认识氧化还原反应的本质
Cl在反应中得到电子,化合价降低
化合价的变化是电子转移的结果,
氧化还原反应的本质是电子的转移
2Na + Cl2 ══ 2NaCl
△
Na在反应中
失去电子,化合价升高
失去2e-
得到2e-
+12
8
2
2
+12
8
2
+8
6
2
+8
8
2
Mg2+
O2-
化合价的变化是电子转移的结果
氧化还原反应的本质是电子的转移
二、认识氧化还原反应的本质
2Mg + O2 ══ 2MgO
点燃
H2 + Cl2══ 2HCl
二、认识氧化还原反应的本质
H Cl
H Cl
氧化还原反应的本质:共用电子对的偏移
2
8
7
+17
+1
1
H
Cl
+1
-1
H2 + Cl2 2HCl
点燃
1.定义
没有电子转移的化学反应称为非氧化还原反应
2.特点
3.实质
有电子转移的化学反应
元素化合价发生升降变化
电子转移
电子的得失和电子对的偏移
二、认识氧化还原反应的本质
氧化还原反应
特征
本质
化合价升降
判断依据
电子转移
化合价变化
记忆口诀:
升失氧——还原剂化合价升高,失电子,发生氧化反应,被氧化
降得还——氧化剂化合价降低,得电子,发生还原反应,被还原
总结
二、认识氧化还原反应的本质
分解反应
化合反应
C + O2 == CO2
CaO + CO2 == CaCO3
化合反应
有单质参加时是氧化还原反应
2H2O == 2H2↑ + O2↑
NH4Cl == NH3 ↑ + HCl↑
分解反应
有单质生成时是氧化还原反应
点燃
通电
△
Fe + 2AgNO3 == Fe(NO3) 2 + 2Ag
C + 2CuO == 2Cu + CO2
置换反应
△
全都是是氧化还原反应
Ba(OH) 2 + H2SO4 == BaSO4 + H2O CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
复分解反应
全不是氧化还原反应
置换反应
复分解
反应
氧化还原反应
三、巩固提升
判断下列反应是否为氧化还原反应:
C + O2══CO2 CaO + CO2 ══CaCO3
2H2O══ 2H2↑ + O2↑ NH4Cl══ NH3 ↑ + HCl↑
Fe + 2AgNO3 ══ Fe(NO3) 2 + 2Ag C + 2CuO ══2Cu + CO2
Ba(OH) 2 + H2SO4 ══ BaSO4 + H2O
CaCO3 + 2HCl ══ CaCl2 + H2O + CO2↑
点燃
通电
△
△
√
√
√
√
×
×
×
×
三、巩固提升
△
△
以下说法是否正确?
(1)有单质参加的化合反应和有单质生成的分解反应一定是氧化还原反应。
(2)有单质参加或生成的反应一定是氧化还原反应。
同素异形体之间的转化不是氧化还原反应。
√
×
三、巩固提升
