人教版必修一第二章 海水中的重要元素——钠和氯第三节物质的量第三课时物质的量浓度(共24张PPT)
文档属性
| 名称 | 人教版必修一第二章 海水中的重要元素——钠和氯第三节物质的量第三课时物质的量浓度(共24张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-21 19:13:02 | ||
图片预览








文档简介
(共24张PPT)
第三课时
物质的量浓度
学习目标
生活中经常用到溶液,像0.9%的氯化钠注射液常用做生理盐水。0.9%就是溶液中氯化钠的质量分数。
它是怎样配制的呢?
复习引入:如何配制100g质量分数为5%的NaCl溶液?
环节一、一定质量分数溶液的配制
交流讨论1
1、取多少?(溶质NaCl、溶剂H2O的量各取多少?)
2、如何取?(用到什么仪器?)
3、如何溶解?(用到什么仪器?)
溶质NaCl
溶剂H2O
取多少?
取多少?
计算
计算
怎么取?
怎么取?
称量
量取
溶解
如何溶解?
配制100g质量分数为5%的NaCl溶液。
说出实验步骤和仪器。
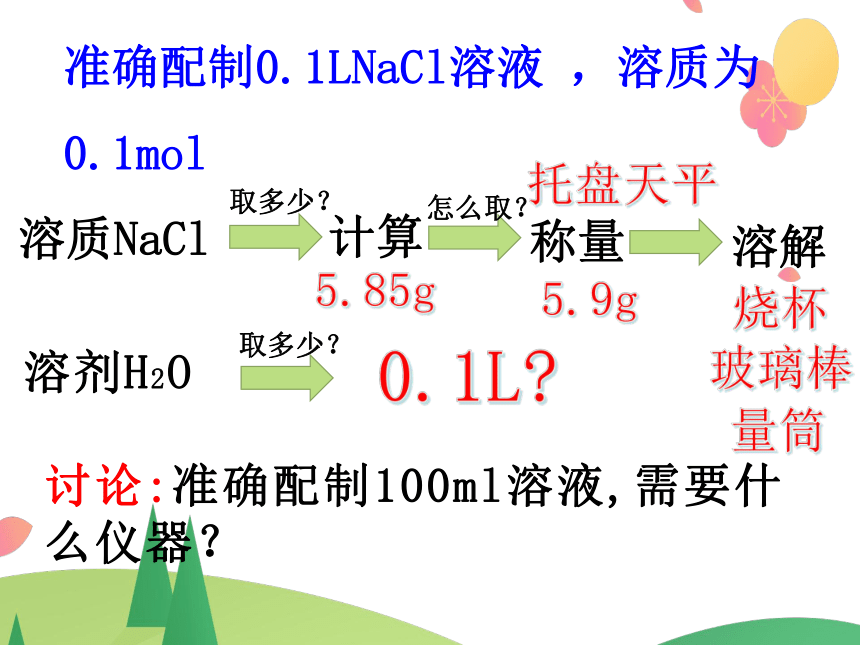
环节二、准确配制0.1LNaCl溶液 ,溶质为0.1mol
交流讨论2
1、取多少?(溶质NaCl、溶剂H2O的量各取多少?)
2、如何取?(用到什么仪器?)
3、如何保证准确配制时m、V的精确性?
溶质NaCl
取多少?
计算
怎么取?
称量
溶解
溶剂H2O
取多少?
讨论:准确配制100ml溶液,需要什么仪器?
准确配制0.1LNaCl溶液 ,溶质为0.1mol
容量瓶
选用原则:等大或稍大。
检查容量瓶是否漏液操作
溶质NaCl
溶剂H2O
计算
称量
溶解
讨论:具体的实验步骤和仪器的选择
转移
洗涤
定容
摇匀
装瓶
环节三、物质的量浓度的概念和应用
交流讨论3
1、列举生活中常见的表示溶液浓度(或组成)的方法。
2、结合配制过程,请同学们讨论可以怎样表示该溶液的组成?
物质的量浓度
1.表达式: cB=
2、单位:
结合配制过程,请同学们讨论可以怎样表示该溶液的组成?
我们刚刚配制的0.1L含0.1molNaCl 的溶液,其物质的量浓度是多少?C(Na+)?
mol/L或mol·L-1 。
思考:下列说法是否正确?
1.将1molNaCl溶于1 L水中配成溶液,其物质的量浓度为1 mol·L-1。
2、从100 mL 0.2 mol·L-1的NaCl溶液中,取出50 mL,所取出的溶液的
物质的量浓度为0.1 mol·L-1。
3、误差分析
(1)如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了
表达式: cB=
=
m
MV
(2)如果在定容时,仰视或者俯视容量瓶上的刻度线,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了?
俯视
仰视
偏高
偏低
世界卫生组织提议,凡是已知相对分子质量的物质在体液内的含量均应用物质的量浓度表示。物质的量浓度在医学上已逐渐推广使用。
怎么用18.4 mol·L-1的浓硫酸配制100 mL 1.84 mol·L-1的稀硫酸?
思考:
基本思路
1、取多少?(浓硫酸、溶剂H2O的量各取多少?)
2、如何取?(用到什么仪器?)
3、如何稀释?(用到什么仪器?)
第三课时
物质的量浓度
学习目标
生活中经常用到溶液,像0.9%的氯化钠注射液常用做生理盐水。0.9%就是溶液中氯化钠的质量分数。
它是怎样配制的呢?
复习引入:如何配制100g质量分数为5%的NaCl溶液?
环节一、一定质量分数溶液的配制
交流讨论1
1、取多少?(溶质NaCl、溶剂H2O的量各取多少?)
2、如何取?(用到什么仪器?)
3、如何溶解?(用到什么仪器?)
溶质NaCl
溶剂H2O
取多少?
取多少?
计算
计算
怎么取?
怎么取?
称量
量取
溶解
如何溶解?
配制100g质量分数为5%的NaCl溶液。
说出实验步骤和仪器。
环节二、准确配制0.1LNaCl溶液 ,溶质为0.1mol
交流讨论2
1、取多少?(溶质NaCl、溶剂H2O的量各取多少?)
2、如何取?(用到什么仪器?)
3、如何保证准确配制时m、V的精确性?
溶质NaCl
取多少?
计算
怎么取?
称量
溶解
溶剂H2O
取多少?
讨论:准确配制100ml溶液,需要什么仪器?
准确配制0.1LNaCl溶液 ,溶质为0.1mol
容量瓶
选用原则:等大或稍大。
检查容量瓶是否漏液操作
溶质NaCl
溶剂H2O
计算
称量
溶解
讨论:具体的实验步骤和仪器的选择
转移
洗涤
定容
摇匀
装瓶
环节三、物质的量浓度的概念和应用
交流讨论3
1、列举生活中常见的表示溶液浓度(或组成)的方法。
2、结合配制过程,请同学们讨论可以怎样表示该溶液的组成?
物质的量浓度
1.表达式: cB=
2、单位:
结合配制过程,请同学们讨论可以怎样表示该溶液的组成?
我们刚刚配制的0.1L含0.1molNaCl 的溶液,其物质的量浓度是多少?C(Na+)?
mol/L或mol·L-1 。
思考:下列说法是否正确?
1.将1molNaCl溶于1 L水中配成溶液,其物质的量浓度为1 mol·L-1。
2、从100 mL 0.2 mol·L-1的NaCl溶液中,取出50 mL,所取出的溶液的
物质的量浓度为0.1 mol·L-1。
3、误差分析
(1)如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了
表达式: cB=
=
m
MV
(2)如果在定容时,仰视或者俯视容量瓶上的刻度线,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了?
俯视
仰视
偏高
偏低
世界卫生组织提议,凡是已知相对分子质量的物质在体液内的含量均应用物质的量浓度表示。物质的量浓度在医学上已逐渐推广使用。
怎么用18.4 mol·L-1的浓硫酸配制100 mL 1.84 mol·L-1的稀硫酸?
思考:
基本思路
1、取多少?(浓硫酸、溶剂H2O的量各取多少?)
2、如何取?(用到什么仪器?)
3、如何稀释?(用到什么仪器?)
