第一章 第二节 第3课时 考查离子反应的三大热点题型 (89张PPT)
文档属性
| 名称 | 第一章 第二节 第3课时 考查离子反应的三大热点题型 (89张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-21 19:40:27 | ||
图片预览











文档简介
(共89张PPT)
第一章 第二节
第3课时 考查离子反应的三大热点题型
1.根据离子反应发生的条件及题目限定条件,建立正确解答离子共存问题的思
维模型。
2.熟知离子方程式书写中常见的错误,学会离子方程式正误的判断方法。
3.掌握离子推断题的解析方法。
核心素养
发展目标
一、判断溶液中离子能否大量共存
二、离子方程式的书写与正误判断
课时对点练
内容索引
随堂演练 知识落实
三、离子的检验与推断
判断溶液中离子能否大量共存
一
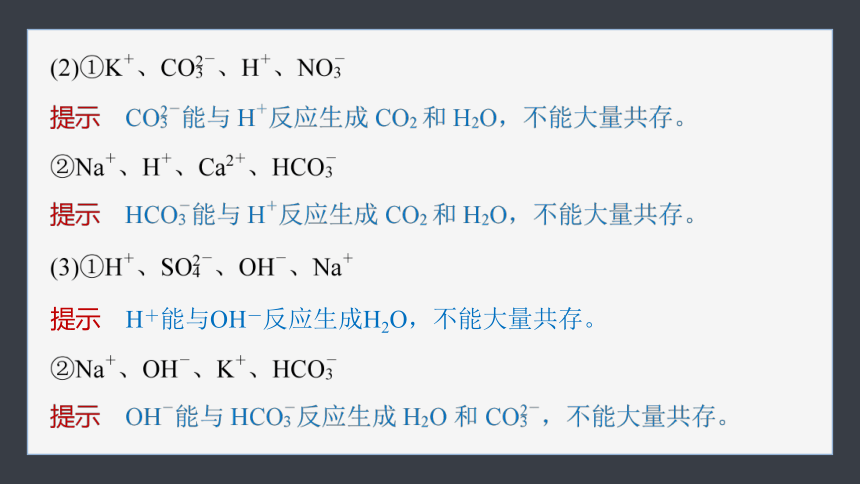
1.判断下列各组离子在溶液中能否大量共存,不能大量共存的请说明理由。
提示 Mg2+能与OH-反应生成Mg(OH)2沉淀,不能大量共存。
提示 H+能与OH-反应生成H2O,不能大量共存。
2.在下列条件的溶液中,各组离子能否大量共存,若不能大量共存则指出其原因。
提示 不能,使酚酞溶液变红的溶液为碱性溶液,Fe3+会与OH-反应生成Fe(OH)3沉淀而不能大量共存。
提示 不能,高锰酸根离子为有色离子。
提示 能。
思维建模
“三看法”判断溶液中离子能否大量共存
(1)看题目要求
是“能大量共存”还是“不能大量共存”;是“一定能大量共存”还是“可能大量共存”。
(2)看隐含条件
①无色透明溶液:不可能含有Cu2+、Fe3+、Fe2+、 等有颜色的离子;也不可能含有相互反应而使溶液变浑浊的离子。
思维建模
②酸性环境:“强酸性溶液”“使石蕊变红的溶液”“常温下pH<7的溶液”等,一定含有大量的H+。
③碱性环境:“强碱性溶液”“使酚酞变红的溶液”“常温下pH>7的溶液”等,一定含有大量的OH-。
(3)看是否反应
①能否生成难溶物或微溶物。如Mg2+与OH-,Ca2+与
都不能大量共存。
思维建模
②能否生成水。如在酸性溶液中OH-不能大量存在,在碱性溶液中H+不能大量存在。
③能否生成挥发性物质。如H+与 等不能大量共存。
应用体验
1.下列各组中的离子,能在溶液中大量共存的是
A项中的OH-与H+不能大量共存;
√
应用体验
2.(2023·四川内江高一检测)常温下,下列各组离子能在指定溶液中大量共存的是
√
返回
Na+、Cu2+、Cl-、 相互之间不反应,可以大量共存,A正确;
强酸性溶液中,氢离子可以和碳酸根离子反应生成水和二氧化碳,不能共存,B错误;
小苏打溶液中,碳酸氢根离子可以和氢氧根离子反应生成水和碳酸根离子,不能共存,C错误;
强碱性溶液中氢氧根离子可以和铝离子反应生成Al(OH)3,不能共存,D错误。
离子方程式的书写与正误判断
二
1.离子方程式的正误判断
判断下列反应的离子方程式是否正确,不正确的说明原因并写出正确的离子方程式。
(1)铁与稀硫酸反应:2Fe+6H+===2Fe3++3H2↑
提示 该反应应生成Fe2+,而不是Fe3+,不符合客观事实;Fe+2H+===Fe2++H2↑。
提示 碳酸钙不能拆写成离子的形式;CaCO3+2H+===Ca2++H2O+CO2↑。
(4)铜与硝酸银溶液反应:Cu+Ag+===Cu2++Ag
提示 方程式两端电荷不守恒; Cu+2Ag+===Cu2++2Ag。
提示 没看清题目要求,CO2是少量的;CO2+Ca2++2OH-===
CaCO3↓+H2O。
思维建模
“六看法”判断离子方程式书写正误
(1)看离子反应是否符合客观事实,不可主观臆造产物及反应。
(2)看各物质的化学式拆写是否正确。
(3)看是否漏写参加反应的离子。
(4)看原子和电荷是否守恒。
(5)看反应物或生成物的配比是否正确。
(6)看是否符合题设条件。
2.与量有关的离子方程式的书写
类型1 一种物质过量后会与生成的产物继续反应的
方法:写出两步反应方程式,进行方程式加和去掉中间产物,写出总反应方程式再改写成离子方程式或者根据最终产物找到两个反应物的比例,直接书写离子方程式。
过量二氧化碳通入澄清石灰水中发生反应的离子方程式:_________
______________。
例1
CO2+
由过量二氧化碳通入澄清石灰水的现象为先浑浊后变澄清可知,最终生成的产物是可溶的Ca(HCO3)2,即CO2与OH-反应生成 ,可以得出CO2和OH-按1∶1反应即可。
类型2 告知两种反应物的比例或者能根据信息得到比例关系的
方法:根据比例关系写出化学方程式再改写成离子方程式。
KHSO4溶液与Ba(OH)2溶液反应,写出下列情况下的离子方程式:
(1)恰好完全沉淀:______________________________________。
例2
KHSO4溶液与Ba(OH)2溶液恰好完全沉淀, 与Ba2+的比例为1∶1,即KHSO4与Ba(OH)2的比例为1∶1,其化学方程式为KHSO4+Ba(OH)2===BaSO4↓+H2O+KOH,再改写成离子方程式。
(2)恰好显中性:__________________________________________。
KHSO4溶液与Ba(OH)2溶液混合恰好显中性,H+与OH-的比例为1∶1,即KHSO4与Ba(OH)2的比例为2∶1,其化学方程式为2KHSO4+Ba(OH)2===BaSO4↓+2H2O+K2SO4,再改写成离子方程式。
类型3 两种物质反应,一种过量一种少量
方法:把量少的物质定为1,按组成比拆写成离子并仅写参与反应的离子,量多的物质所拆出的离子按需要书写。
写出下列反应的离子方程式:
(1)少量的NaHCO3与Ca(OH)2溶液的反应:______________________
_________________。
例3
CaCO3↓+H2O
(2)少量的Ca(OH)2与NaHCO3溶液的反应:______________________
_________________________。
应用体验
1.(2023·广州四十七中高一检测)下列离子方程式,书写正确的是
A.铁与硝酸银溶液反应:Fe+Ag+===Ag+Fe2+
B.醋酸溶液与水垢中的碳酸钙反应:CaCO3+2H+===Ca2++H2O
+CO2↑
C.向碳酸氢钠溶液中滴加盐酸: +2H+=== H2O+CO2↑
D.澄清石灰水与碳酸钠溶液反应:Ca2++ ===CaCO3↓
√
题给离子方程式电荷不守恒,正确的离子方程式为Fe+2Ag+===2Ag+Fe2+,A错误;
醋酸为弱酸,离子方程式中不可拆分,B错误;
碳酸氢钠在水溶液中电离生成钠离子和碳酸氢根离子,向碳酸氢钠溶液中滴加盐酸的离子方程式为 +H+=== H2O+CO2↑,C错误。
应用体验
2.下列离子方程式正确的是
A.将饱和氯化铁溶液滴入沸水中制取氢氧化铁胶体:Fe3++3H2O
Fe(OH)3↓+3H+
B.CO2通入CaCl2溶液:Ca2++CO2+H2O===CaCO3↓+2H+
C.金属镁与稀盐酸反应:Mg+2H++2Cl-===MgCl2+H2↑
D.向碳酸氢钙溶液中加入少量烧碱溶液:Ca2++ +OH-===
CaCO3↓+H2O
√
选项A中不能生成氢氧化铁沉淀,正确的离子方程式应为 Fe3++3H2O
Fe(OH)3(胶体)+3H+;
选项B中CO2与CaCl2不反应;
选项C中氯化镁为强电解质,应拆成离子。
返回
离子的检验与推断
三
某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种。请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是___________。
Cu2+、Fe3+
无色透明溶液中不可能含有Cu2+、Fe3+等有色离子。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_______。
Ag+
加盐酸有不溶于稀硝酸的白色沉淀生成,则肯定存在Ag+。
(3)取(2)中的滤液,加入过量的氢氧化钠溶液,出现白色沉淀,说明原溶液中肯定有______,有关的离子方程式为___________________
__________________________。
Mg2+
加氢氧化钠溶液有白色沉淀出现,肯定含有Mg2+。
H++OH-===H2O、
Mg2++2OH-===Mg(OH)2↓
(4)原溶液可能大量共存的阴离子是_____(填字母)。
B
思维建模
解析离子推断题的“四项原则”
(1)肯定性原则:据现象推断肯定存在或肯定不存在的离子。
(2)互斥性原则:如溶液中含有Ba2+,则不存在
(3)进出性原则:要注意所加试剂引入什么离子,是否造成干扰。
(4)守恒原则(电中性原则):阳离子和阴离子同时存在于溶液中且正、负电荷总量相等。
应用体验
(1)向溶液中滴加2~3滴紫色石蕊溶液,溶液变为红色;
(2)向溶液中滴加氯化钡溶液和稀盐酸,有白色沉淀生成;
(3)将(2)中所得沉淀过滤,向滤液中加入硝酸银溶液和稀硝酸,有白色沉淀生成。
应用体验
下列结论正确的是
A.该实验无法确定是否含有③
B.肯定含有的离子是①②⑥
C.可能含有的离子是①③
D.肯定不含的离子有④⑤⑦
√
因溶液是无色的,则溶液中不含Cu2+;
(3)将(2)中所得沉淀过滤,向滤液中加入硝酸银溶液和稀硝酸,有白色沉淀氯化银生成,因(2)中引入了Cl-,故无法说明原溶液中是否含有Cl-;
由于每种离子的数目均相等,且溶液呈电中性,则溶液中一定含有Na+,一定不含Cl-。
返回
随堂演练 知识落实
1
2
3
1.(2023·上海高一检测)在酸性溶液中能大量共存且溶液为无色透明的离子组是
随堂演练
√
2.(2022·湖南邵阳高一期中)下列离子方程式正确的是
A.稀硝酸与氢氧化钠溶液反应:H++OH-===H2O
B.将氢氧化铁放入盐酸中:Fe(OH)3+H+===Fe3++3H2O
C.稀硫酸与锌反应:H2SO4+Zn===Zn2++ +H2↑
D.稀硫酸与氢氧化钡溶液混合产生沉淀:Ba(OH)2+2H+===Ba2+
+2H2O
√
随堂演练
1
2
3
随堂演练
1
2
3
稀硝酸与氢氧化钠溶液发生中和反应生成硝酸钠和水,硝酸钠、硝酸和氢氧化钠均溶于水,所以反应的离子方程式为H++OH-===
H2O,故A正确;
硫酸是溶于水能电离的电解质,在离子方程式里要写成离子,故C错误。
3.某白色粉末可能含有Ba(NO3)2、CaCl2、K2CO3,进行如下实验:
①将少量粉末加入水中,振荡,有白色沉淀生成
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生
③取少量②的溶液,滴入AgNO3溶液,有白色沉淀生成
依据实验现象,下列关于白色粉末的判断正确的是
A.只含有K2CO3
B.一定含有K2CO3、CaCl2和Ba(NO3)2
C.一定含有K2CO3和CaCl2,可能含有Ba(NO3)2
D.一定含有K2CO3,还含有CaCl2和Ba(NO3)2中的一种
√
随堂演练
1
2
3
①将少量粉末加入水中,振荡,有白色沉淀生成,该沉淀是碳酸钡或碳酸钙,一定含有K2CO3,至少含有Ba(NO3)2和CaCl2中的一种;
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生,说明含有碳酸根离子;
③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成,该沉淀一定是AgCl,故确定原溶液含有Cl-。
根据以上分析,原固体混合物中肯定含有K2CO3、CaCl2,可能含有Ba(NO3)2。
随堂演练
1
2
3
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 离子共存
1.(2023·福州四中高一检测)下列离子在溶液中一定能大量共存的是
10
11
12
13
15
对点训练
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2.常温下,下列各组离子在指定溶液中一定能大量共存的是
2
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2
使酚酞变红色的溶液呈碱性,Fe3+不能大量存在,B不符合题意;
含大量CH3COO-的溶液中,H+与CH3COO-会生成弱酸CH3COOH,
D不符合题意。
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2
14
题组二 离子方程式的正误判断
4.下列化学反应的离子方程式书写正确的是
A.金属铝与CuSO4溶液反应:Al+Cu2+===Cu+Al3+
B.金属铁与稀盐酸:2Fe+6H+===2Fe3++3H2↑
C.H2SO4溶液中滴入Ba(OH)2溶液:Ba2++OH-+H++ ===BaSO4↓
+H2O
D.澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2===CaCO3↓
+H2O
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
√
2
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2
金属铝与CuSO4溶液反应生成硫酸铝和铜:2Al+3Cu2+===3Cu+2Al3+,故A错误;
金属铁与稀盐酸反应生成氯化亚铁和氢气:Fe+2H+===Fe2++H2↑,故B错误;
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
5.下列反应的离子方程式书写正确的是
2
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
NaHSO4溶液与Ba(OH)2溶液混合后溶液恰好显中性,氢离子与氢氧根离子恰好完全反应,正确的离子方程式为Ba2++2OH-+2H++
===BaSO4↓+2H2O,A项错误;
向澄清石灰水中通入过量CO2,反应的离子方程式为OH-+CO2=== ,B项正确;
碳酸钡与盐酸反应生成氯化钡、二氧化碳和水,碳酸钡不能拆写,正确的离子方程式为BaCO3+2H+===Ba2++H2O+CO2↑,D项错误。
2
14
6.下列离子方程式正确的是
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
√
2
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2
CH3COOH不能拆开,B错误;
NaHCO3少量,其化学计量数应为1,D错误。
14
题组三 离子的检验与推断
7.某研究性学习小组欲分析某矿石的主要成分,粉碎后将其溶于过量稀盐酸中充分反应,过滤后用所得滤液进行如下实验,下列说法正确的是
A.取少量滤液,向其中滴加少量Na2CO3溶液,无白色沉淀,说明矿石中一定不
含Ca2+
B.取少量滤液,向其中滴加过量BaCl2溶液,产生白色沉淀,说明矿石中含有
C.取少量滤液,向其中滴加适量NaOH溶液,产生白色沉淀,说明矿石中一定含
有Mg2+
D.取少量滤液,向其中加入硝酸酸化的硝酸银溶液,产生白色沉淀,说明矿石
中一定含有Cl-
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
√
2
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
因盐酸过量,加入的少量Na2CO3溶液应先和H+反应,即使有Ca2+存在,也不会产生白色沉淀,A项错误;
加入NaOH溶液产生的白色沉淀不一定是Mg(OH)2,Al(OH)3、Zn(OH)2也是白色沉淀,C项错误;
溶液中加入硝酸酸化的硝酸银溶液,产生白色沉淀,不能说明原矿石中含有Cl-,因为在矿石溶解时,加入了过量的稀盐酸,引入了Cl-,D项错误。
2
14
8.某无色溶液中只可能大量含有K+、Ag+、Ba2+、Fe3+、Cl-、OH-、
中若干种,对其进行如下实验操作:
(1)取少量该溶液,测得其pH=13.5;
(2)另取少量该溶液,加入少量BaCl2溶液,产生白色沉淀;
(3)向(2)所得体系中加入足量盐酸,沉淀部分溶解,并有无色气体生成,过滤;
(4)向(3)所得滤液中加入AgNO3溶液,有白色沉淀生成。
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2
14
下列对该溶液的说法正确的是(已知AgOH难溶于水且易分解为Ag2O固体)
A.一定含有K+、OH-、
B.可能含有Cl-、OH-
C.一定不含有Ag+、Ba2+、Fe3+、Cl-
D.无法判断该溶液中离子的存在情况
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
该溶液无色,其中一定不含Fe3+;取少量该溶液,测得其pH=13.5,则该溶液中一定含有OH-,一定不含有Ag+;另取少量该溶液,加入足量BaCl2溶液,产生白色沉淀,则该溶液中至少含有 中的一种;
向(2)所得体系中加入足量盐酸,沉淀部分溶解,并有无色气体生成,证明(2)所得体系中含有碳酸钡和硫酸钡两种沉淀,碳酸钡溶于盐酸生成无色气体CO2,硫酸钡不溶于盐酸,则该溶液中一定含有
,一定不含Ba2+;
2
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
向(3)所得滤液中加入AgNO3溶液,有白色沉淀生成,因(2)和(3)中均引入了Cl-,故不能确定该溶液中是否含Cl-;
根据溶液呈电中性可知,该溶液中一定含有K+。综上可知,该溶液中一定含有K+、OH-、 ,一定不含Ba2+、Fe3+、Ag+,可能含有Cl-,故A项正确。
2
14
9.某溶液中含有较多的Cl-、 、OH-三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A.③②④②① B.④②①②③
C.①②③②④ D.④②③②①
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
2
综合强化
检验氯离子选择硝酸银溶液,检验氢氧根离子选择硝酸镁溶液,检验碳酸根离子选择硝酸钡溶液;
而硝酸银溶液与氯离子、碳酸根离子都生成白色沉淀,而与氢氧根离子结合生成的氢氧化银不稳定,所以不能先检验氯离子;
硝酸镁溶液与碳酸根离子和氢氧根离子均能生成白色沉淀;
硝酸钡溶液只与碳酸根离子生成白色的碳酸钡沉淀,所以先检验碳酸根离子再检验氢氧根离子,最后检验氯离子;
实验顺序为滴加硝酸钡溶液至沉淀不再增加,过滤;再滴加硝酸镁溶液至沉淀不再增加,过滤;最后加入硝酸银溶液。
14
10.有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如图实验,从实验可以判断
A.该固体粉末中一定不含有BaCl2
B.该固体粉末中一定含有KNO3
C.它的组成可能是CaCO3、BaCl2、Na2SO4
D.它的组成一定是CaCO3、Na2SO4、KNO3
1
3
4
5
6
7
8
9
10
11
12
13
15
2
综合强化
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
由题给流程图可知,固体粉末中一定含有CaCO3、KNO3,Na2SO4和BaCl2不会同时存在,则组成可能为CaCO3、Na2SO4、KNO3或CaCO3、KNO3、BaCl2。
2
综合强化
14
11.下列各组离子或分子能大量共存,当加入相应试剂后会发生化学反应,且发生反应的离子方程式书写正确的是
1
3
4
5
6
7
8
9
10
11
12
13
15
2
综合强化
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
2
综合强化
加入Ba(OH)2溶液,漏写Mg2+与OH-的反应,故A错误;
14
下列有关说法错误的是
A.NaOH的作用是除去Cu2+
B.试剂a为Na2CO3,试剂b为BaCl2
C.操作X为过滤,试剂c为稀盐酸
D.检验 是否除尽可取适量待测溶液,先加入盐酸,再加入BaCl2溶液
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
√
2
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
14
13.某河道两旁有甲、乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、 6种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是______、______、______(填写离子符号)。
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
OH-
Cl-
K+
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
甲厂的废水明显呈碱性,即含大量OH-,而Ag+、Fe3+与OH-不能大量共存,故Ag+、Fe3+只能在乙厂废水中,由于Cl-与Ag+不能大量共存,故Cl-在甲厂废水中,根据电荷守恒,甲厂废水中必含的阳离子只能为K+。所以甲厂废水中含OH-、Cl-、K+,乙厂废水中含Ag+、Fe3+、 。
14
(2)乙厂的废水中含有另外三种离子。如果加一定量________(填“活性炭”或“铁粉”),可以回收其中的______(填写金属元素符号)。
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
加入铁粉回收银的反应:Fe+2Ag+===Fe2++2Ag。
铁粉
Ag
14
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的______________________(填离子符号)转化为沉淀。经过滤后的废水主要含________________,可用来浇灌农田。
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
混合后OH-与Fe3+、Cl-与Ag+转化为沉淀,剩下的只有KNO3。
OH-、Cl-、Ag+、Fe3+
KNO3(或硝酸钾)
14
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
已知:氨气可以使湿润的石
蕊试纸变蓝色。
请回答下列问题:
(1)操作a的名称是______。
过滤
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
样品溶液与足量硝酸钡反应
生成的沉淀A可全部溶于足
量盐酸,则沉淀A为碳酸钡,
样品溶液中一定含
溶液B与硝酸银反应生成不溶于硝酸的沉淀C,则沉淀C为AgCl,可知样品溶液中一定含Cl-;
2
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
另一份溶液与NaOH浓溶液加热生成的气体能使湿润的石蕊试纸变蓝,说明生成了氨气,则样品溶液中有 ,不能确定是否含有Na+、K+。
由流程可知,操作a得到沉淀和溶液,为过滤操作。
2
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
(2)沉淀A的化学式为__________,沉淀A加入足量的盐酸全部溶解的离子方程式为_________________________________。
BaCO3
BaCO3+2H+===Ba2++H2O+CO2↑
由上述分析可知,沉淀A的化学式为BaCO3;碳酸钡与盐酸反应生成氯化钡、水和二氧化碳,故离子方程式为BaCO3+2H+===Ba2++H2O+CO2↑。
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
(3)生成沉淀C的离子方程式为____________________。
Ag++Cl-===AgCl↓
由上述分析可知,沉淀C是氯化银,生成氯化银的离子方程式为Ag++Cl-===AgCl↓。
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
(4)混合物中,一定存在的离子有Cl-和_____________,一定不存在的离子有_____,可能存在的离子是__________。
Na+、K+
2
14
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________(填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
2
③⑤
离子反应是有离子参加的反应,发生的条件是化合物在一定的条件下必须电离出能反应的离子,则必须是电解质发生电离,所以选③⑤。
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
Ⅰ.取少量溶液滴入紫色石蕊溶液,溶液呈蓝色。
Ⅱ.取少许溶液滴入BaCl2溶液,无白色沉淀产生。
Ⅲ.另取少许溶液先滴加硝酸再加AgNO3溶液,产生白色沉淀。
Ⅳ.再取少许原溶液滴入少量H2SO4溶液,有白色沉淀产生。
①根据以上现象判断,原溶液中肯定不存在的离子是_________________
______;肯定存在的离子是_________________。
Ba2+、OH-、Cl-
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
由于是无色溶液,则溶液中不含Fe3+;
溶液使紫色石蕊溶液呈蓝色,说明溶液含OH-,不含Mg2+;
另取溶液,滴加AgNO3溶液产生白色沉淀,则存在Cl-;
再取少许原溶液滴入H2SO4溶液,有白色沉淀产生,则有Ba2+;
肯定存在的离子是Ba2+、OH-、Cl-,不能确定的离子有K+。
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
返回
②写出实验Ⅲ和Ⅳ中可能发生反应的离子方程式:
Ⅲ:______________________________________。
Ⅳ:______________________________________。
③如溶液中各种离子的个数相等,确定溶液中_____(填“有”或“无”)
K+,判断依据是________________________________________________
_____________。
H++OH-===H2O、Cl-+Ag+===AgCl↓
无
溶液中一定有Ba2+、Cl-、OH- ,个数相等时电荷守恒,所以无K+
14
本课结束
第一章 第二节
第3课时 考查离子反应的三大热点题型
1.根据离子反应发生的条件及题目限定条件,建立正确解答离子共存问题的思
维模型。
2.熟知离子方程式书写中常见的错误,学会离子方程式正误的判断方法。
3.掌握离子推断题的解析方法。
核心素养
发展目标
一、判断溶液中离子能否大量共存
二、离子方程式的书写与正误判断
课时对点练
内容索引
随堂演练 知识落实
三、离子的检验与推断
判断溶液中离子能否大量共存
一
1.判断下列各组离子在溶液中能否大量共存,不能大量共存的请说明理由。
提示 Mg2+能与OH-反应生成Mg(OH)2沉淀,不能大量共存。
提示 H+能与OH-反应生成H2O,不能大量共存。
2.在下列条件的溶液中,各组离子能否大量共存,若不能大量共存则指出其原因。
提示 不能,使酚酞溶液变红的溶液为碱性溶液,Fe3+会与OH-反应生成Fe(OH)3沉淀而不能大量共存。
提示 不能,高锰酸根离子为有色离子。
提示 能。
思维建模
“三看法”判断溶液中离子能否大量共存
(1)看题目要求
是“能大量共存”还是“不能大量共存”;是“一定能大量共存”还是“可能大量共存”。
(2)看隐含条件
①无色透明溶液:不可能含有Cu2+、Fe3+、Fe2+、 等有颜色的离子;也不可能含有相互反应而使溶液变浑浊的离子。
思维建模
②酸性环境:“强酸性溶液”“使石蕊变红的溶液”“常温下pH<7的溶液”等,一定含有大量的H+。
③碱性环境:“强碱性溶液”“使酚酞变红的溶液”“常温下pH>7的溶液”等,一定含有大量的OH-。
(3)看是否反应
①能否生成难溶物或微溶物。如Mg2+与OH-,Ca2+与
都不能大量共存。
思维建模
②能否生成水。如在酸性溶液中OH-不能大量存在,在碱性溶液中H+不能大量存在。
③能否生成挥发性物质。如H+与 等不能大量共存。
应用体验
1.下列各组中的离子,能在溶液中大量共存的是
A项中的OH-与H+不能大量共存;
√
应用体验
2.(2023·四川内江高一检测)常温下,下列各组离子能在指定溶液中大量共存的是
√
返回
Na+、Cu2+、Cl-、 相互之间不反应,可以大量共存,A正确;
强酸性溶液中,氢离子可以和碳酸根离子反应生成水和二氧化碳,不能共存,B错误;
小苏打溶液中,碳酸氢根离子可以和氢氧根离子反应生成水和碳酸根离子,不能共存,C错误;
强碱性溶液中氢氧根离子可以和铝离子反应生成Al(OH)3,不能共存,D错误。
离子方程式的书写与正误判断
二
1.离子方程式的正误判断
判断下列反应的离子方程式是否正确,不正确的说明原因并写出正确的离子方程式。
(1)铁与稀硫酸反应:2Fe+6H+===2Fe3++3H2↑
提示 该反应应生成Fe2+,而不是Fe3+,不符合客观事实;Fe+2H+===Fe2++H2↑。
提示 碳酸钙不能拆写成离子的形式;CaCO3+2H+===Ca2++H2O+CO2↑。
(4)铜与硝酸银溶液反应:Cu+Ag+===Cu2++Ag
提示 方程式两端电荷不守恒; Cu+2Ag+===Cu2++2Ag。
提示 没看清题目要求,CO2是少量的;CO2+Ca2++2OH-===
CaCO3↓+H2O。
思维建模
“六看法”判断离子方程式书写正误
(1)看离子反应是否符合客观事实,不可主观臆造产物及反应。
(2)看各物质的化学式拆写是否正确。
(3)看是否漏写参加反应的离子。
(4)看原子和电荷是否守恒。
(5)看反应物或生成物的配比是否正确。
(6)看是否符合题设条件。
2.与量有关的离子方程式的书写
类型1 一种物质过量后会与生成的产物继续反应的
方法:写出两步反应方程式,进行方程式加和去掉中间产物,写出总反应方程式再改写成离子方程式或者根据最终产物找到两个反应物的比例,直接书写离子方程式。
过量二氧化碳通入澄清石灰水中发生反应的离子方程式:_________
______________。
例1
CO2+
由过量二氧化碳通入澄清石灰水的现象为先浑浊后变澄清可知,最终生成的产物是可溶的Ca(HCO3)2,即CO2与OH-反应生成 ,可以得出CO2和OH-按1∶1反应即可。
类型2 告知两种反应物的比例或者能根据信息得到比例关系的
方法:根据比例关系写出化学方程式再改写成离子方程式。
KHSO4溶液与Ba(OH)2溶液反应,写出下列情况下的离子方程式:
(1)恰好完全沉淀:______________________________________。
例2
KHSO4溶液与Ba(OH)2溶液恰好完全沉淀, 与Ba2+的比例为1∶1,即KHSO4与Ba(OH)2的比例为1∶1,其化学方程式为KHSO4+Ba(OH)2===BaSO4↓+H2O+KOH,再改写成离子方程式。
(2)恰好显中性:__________________________________________。
KHSO4溶液与Ba(OH)2溶液混合恰好显中性,H+与OH-的比例为1∶1,即KHSO4与Ba(OH)2的比例为2∶1,其化学方程式为2KHSO4+Ba(OH)2===BaSO4↓+2H2O+K2SO4,再改写成离子方程式。
类型3 两种物质反应,一种过量一种少量
方法:把量少的物质定为1,按组成比拆写成离子并仅写参与反应的离子,量多的物质所拆出的离子按需要书写。
写出下列反应的离子方程式:
(1)少量的NaHCO3与Ca(OH)2溶液的反应:______________________
_________________。
例3
CaCO3↓+H2O
(2)少量的Ca(OH)2与NaHCO3溶液的反应:______________________
_________________________。
应用体验
1.(2023·广州四十七中高一检测)下列离子方程式,书写正确的是
A.铁与硝酸银溶液反应:Fe+Ag+===Ag+Fe2+
B.醋酸溶液与水垢中的碳酸钙反应:CaCO3+2H+===Ca2++H2O
+CO2↑
C.向碳酸氢钠溶液中滴加盐酸: +2H+=== H2O+CO2↑
D.澄清石灰水与碳酸钠溶液反应:Ca2++ ===CaCO3↓
√
题给离子方程式电荷不守恒,正确的离子方程式为Fe+2Ag+===2Ag+Fe2+,A错误;
醋酸为弱酸,离子方程式中不可拆分,B错误;
碳酸氢钠在水溶液中电离生成钠离子和碳酸氢根离子,向碳酸氢钠溶液中滴加盐酸的离子方程式为 +H+=== H2O+CO2↑,C错误。
应用体验
2.下列离子方程式正确的是
A.将饱和氯化铁溶液滴入沸水中制取氢氧化铁胶体:Fe3++3H2O
Fe(OH)3↓+3H+
B.CO2通入CaCl2溶液:Ca2++CO2+H2O===CaCO3↓+2H+
C.金属镁与稀盐酸反应:Mg+2H++2Cl-===MgCl2+H2↑
D.向碳酸氢钙溶液中加入少量烧碱溶液:Ca2++ +OH-===
CaCO3↓+H2O
√
选项A中不能生成氢氧化铁沉淀,正确的离子方程式应为 Fe3++3H2O
Fe(OH)3(胶体)+3H+;
选项B中CO2与CaCl2不反应;
选项C中氯化镁为强电解质,应拆成离子。
返回
离子的检验与推断
三
某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种。请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是___________。
Cu2+、Fe3+
无色透明溶液中不可能含有Cu2+、Fe3+等有色离子。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是_______。
Ag+
加盐酸有不溶于稀硝酸的白色沉淀生成,则肯定存在Ag+。
(3)取(2)中的滤液,加入过量的氢氧化钠溶液,出现白色沉淀,说明原溶液中肯定有______,有关的离子方程式为___________________
__________________________。
Mg2+
加氢氧化钠溶液有白色沉淀出现,肯定含有Mg2+。
H++OH-===H2O、
Mg2++2OH-===Mg(OH)2↓
(4)原溶液可能大量共存的阴离子是_____(填字母)。
B
思维建模
解析离子推断题的“四项原则”
(1)肯定性原则:据现象推断肯定存在或肯定不存在的离子。
(2)互斥性原则:如溶液中含有Ba2+,则不存在
(3)进出性原则:要注意所加试剂引入什么离子,是否造成干扰。
(4)守恒原则(电中性原则):阳离子和阴离子同时存在于溶液中且正、负电荷总量相等。
应用体验
(1)向溶液中滴加2~3滴紫色石蕊溶液,溶液变为红色;
(2)向溶液中滴加氯化钡溶液和稀盐酸,有白色沉淀生成;
(3)将(2)中所得沉淀过滤,向滤液中加入硝酸银溶液和稀硝酸,有白色沉淀生成。
应用体验
下列结论正确的是
A.该实验无法确定是否含有③
B.肯定含有的离子是①②⑥
C.可能含有的离子是①③
D.肯定不含的离子有④⑤⑦
√
因溶液是无色的,则溶液中不含Cu2+;
(3)将(2)中所得沉淀过滤,向滤液中加入硝酸银溶液和稀硝酸,有白色沉淀氯化银生成,因(2)中引入了Cl-,故无法说明原溶液中是否含有Cl-;
由于每种离子的数目均相等,且溶液呈电中性,则溶液中一定含有Na+,一定不含Cl-。
返回
随堂演练 知识落实
1
2
3
1.(2023·上海高一检测)在酸性溶液中能大量共存且溶液为无色透明的离子组是
随堂演练
√
2.(2022·湖南邵阳高一期中)下列离子方程式正确的是
A.稀硝酸与氢氧化钠溶液反应:H++OH-===H2O
B.将氢氧化铁放入盐酸中:Fe(OH)3+H+===Fe3++3H2O
C.稀硫酸与锌反应:H2SO4+Zn===Zn2++ +H2↑
D.稀硫酸与氢氧化钡溶液混合产生沉淀:Ba(OH)2+2H+===Ba2+
+2H2O
√
随堂演练
1
2
3
随堂演练
1
2
3
稀硝酸与氢氧化钠溶液发生中和反应生成硝酸钠和水,硝酸钠、硝酸和氢氧化钠均溶于水,所以反应的离子方程式为H++OH-===
H2O,故A正确;
硫酸是溶于水能电离的电解质,在离子方程式里要写成离子,故C错误。
3.某白色粉末可能含有Ba(NO3)2、CaCl2、K2CO3,进行如下实验:
①将少量粉末加入水中,振荡,有白色沉淀生成
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生
③取少量②的溶液,滴入AgNO3溶液,有白色沉淀生成
依据实验现象,下列关于白色粉末的判断正确的是
A.只含有K2CO3
B.一定含有K2CO3、CaCl2和Ba(NO3)2
C.一定含有K2CO3和CaCl2,可能含有Ba(NO3)2
D.一定含有K2CO3,还含有CaCl2和Ba(NO3)2中的一种
√
随堂演练
1
2
3
①将少量粉末加入水中,振荡,有白色沉淀生成,该沉淀是碳酸钡或碳酸钙,一定含有K2CO3,至少含有Ba(NO3)2和CaCl2中的一种;
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生,说明含有碳酸根离子;
③取少量②的溶液滴入AgNO3溶液,有白色沉淀生成,该沉淀一定是AgCl,故确定原溶液含有Cl-。
根据以上分析,原固体混合物中肯定含有K2CO3、CaCl2,可能含有Ba(NO3)2。
随堂演练
1
2
3
返回
课时对点练
1
2
3
4
5
6
7
8
9
题组一 离子共存
1.(2023·福州四中高一检测)下列离子在溶液中一定能大量共存的是
10
11
12
13
15
对点训练
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2.常温下,下列各组离子在指定溶液中一定能大量共存的是
2
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2
使酚酞变红色的溶液呈碱性,Fe3+不能大量存在,B不符合题意;
含大量CH3COO-的溶液中,H+与CH3COO-会生成弱酸CH3COOH,
D不符合题意。
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2
14
题组二 离子方程式的正误判断
4.下列化学反应的离子方程式书写正确的是
A.金属铝与CuSO4溶液反应:Al+Cu2+===Cu+Al3+
B.金属铁与稀盐酸:2Fe+6H+===2Fe3++3H2↑
C.H2SO4溶液中滴入Ba(OH)2溶液:Ba2++OH-+H++ ===BaSO4↓
+H2O
D.澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2===CaCO3↓
+H2O
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
√
2
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2
金属铝与CuSO4溶液反应生成硫酸铝和铜:2Al+3Cu2+===3Cu+2Al3+,故A错误;
金属铁与稀盐酸反应生成氯化亚铁和氢气:Fe+2H+===Fe2++H2↑,故B错误;
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
5.下列反应的离子方程式书写正确的是
2
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
NaHSO4溶液与Ba(OH)2溶液混合后溶液恰好显中性,氢离子与氢氧根离子恰好完全反应,正确的离子方程式为Ba2++2OH-+2H++
===BaSO4↓+2H2O,A项错误;
向澄清石灰水中通入过量CO2,反应的离子方程式为OH-+CO2=== ,B项正确;
碳酸钡与盐酸反应生成氯化钡、二氧化碳和水,碳酸钡不能拆写,正确的离子方程式为BaCO3+2H+===Ba2++H2O+CO2↑,D项错误。
2
14
6.下列离子方程式正确的是
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
√
2
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2
CH3COOH不能拆开,B错误;
NaHCO3少量,其化学计量数应为1,D错误。
14
题组三 离子的检验与推断
7.某研究性学习小组欲分析某矿石的主要成分,粉碎后将其溶于过量稀盐酸中充分反应,过滤后用所得滤液进行如下实验,下列说法正确的是
A.取少量滤液,向其中滴加少量Na2CO3溶液,无白色沉淀,说明矿石中一定不
含Ca2+
B.取少量滤液,向其中滴加过量BaCl2溶液,产生白色沉淀,说明矿石中含有
C.取少量滤液,向其中滴加适量NaOH溶液,产生白色沉淀,说明矿石中一定含
有Mg2+
D.取少量滤液,向其中加入硝酸酸化的硝酸银溶液,产生白色沉淀,说明矿石
中一定含有Cl-
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
√
2
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
因盐酸过量,加入的少量Na2CO3溶液应先和H+反应,即使有Ca2+存在,也不会产生白色沉淀,A项错误;
加入NaOH溶液产生的白色沉淀不一定是Mg(OH)2,Al(OH)3、Zn(OH)2也是白色沉淀,C项错误;
溶液中加入硝酸酸化的硝酸银溶液,产生白色沉淀,不能说明原矿石中含有Cl-,因为在矿石溶解时,加入了过量的稀盐酸,引入了Cl-,D项错误。
2
14
8.某无色溶液中只可能大量含有K+、Ag+、Ba2+、Fe3+、Cl-、OH-、
中若干种,对其进行如下实验操作:
(1)取少量该溶液,测得其pH=13.5;
(2)另取少量该溶液,加入少量BaCl2溶液,产生白色沉淀;
(3)向(2)所得体系中加入足量盐酸,沉淀部分溶解,并有无色气体生成,过滤;
(4)向(3)所得滤液中加入AgNO3溶液,有白色沉淀生成。
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2
14
下列对该溶液的说法正确的是(已知AgOH难溶于水且易分解为Ag2O固体)
A.一定含有K+、OH-、
B.可能含有Cl-、OH-
C.一定不含有Ag+、Ba2+、Fe3+、Cl-
D.无法判断该溶液中离子的存在情况
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
2
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
该溶液无色,其中一定不含Fe3+;取少量该溶液,测得其pH=13.5,则该溶液中一定含有OH-,一定不含有Ag+;另取少量该溶液,加入足量BaCl2溶液,产生白色沉淀,则该溶液中至少含有 中的一种;
向(2)所得体系中加入足量盐酸,沉淀部分溶解,并有无色气体生成,证明(2)所得体系中含有碳酸钡和硫酸钡两种沉淀,碳酸钡溶于盐酸生成无色气体CO2,硫酸钡不溶于盐酸,则该溶液中一定含有
,一定不含Ba2+;
2
14
1
3
4
5
6
7
8
9
10
11
12
13
15
对点训练
向(3)所得滤液中加入AgNO3溶液,有白色沉淀生成,因(2)和(3)中均引入了Cl-,故不能确定该溶液中是否含Cl-;
根据溶液呈电中性可知,该溶液中一定含有K+。综上可知,该溶液中一定含有K+、OH-、 ,一定不含Ba2+、Fe3+、Ag+,可能含有Cl-,故A项正确。
2
14
9.某溶液中含有较多的Cl-、 、OH-三种阴离子,如果只取一次该溶液就能够分别将三种阴离子依次检验出来,下列实验操作顺序正确的是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A.③②④②① B.④②①②③
C.①②③②④ D.④②③②①
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
2
综合强化
检验氯离子选择硝酸银溶液,检验氢氧根离子选择硝酸镁溶液,检验碳酸根离子选择硝酸钡溶液;
而硝酸银溶液与氯离子、碳酸根离子都生成白色沉淀,而与氢氧根离子结合生成的氢氧化银不稳定,所以不能先检验氯离子;
硝酸镁溶液与碳酸根离子和氢氧根离子均能生成白色沉淀;
硝酸钡溶液只与碳酸根离子生成白色的碳酸钡沉淀,所以先检验碳酸根离子再检验氢氧根离子,最后检验氯离子;
实验顺序为滴加硝酸钡溶液至沉淀不再增加,过滤;再滴加硝酸镁溶液至沉淀不再增加,过滤;最后加入硝酸银溶液。
14
10.有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如图实验,从实验可以判断
A.该固体粉末中一定不含有BaCl2
B.该固体粉末中一定含有KNO3
C.它的组成可能是CaCO3、BaCl2、Na2SO4
D.它的组成一定是CaCO3、Na2SO4、KNO3
1
3
4
5
6
7
8
9
10
11
12
13
15
2
综合强化
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
由题给流程图可知,固体粉末中一定含有CaCO3、KNO3,Na2SO4和BaCl2不会同时存在,则组成可能为CaCO3、Na2SO4、KNO3或CaCO3、KNO3、BaCl2。
2
综合强化
14
11.下列各组离子或分子能大量共存,当加入相应试剂后会发生化学反应,且发生反应的离子方程式书写正确的是
1
3
4
5
6
7
8
9
10
11
12
13
15
2
综合强化
√
14
1
3
4
5
6
7
8
9
10
11
12
13
15
2
综合强化
加入Ba(OH)2溶液,漏写Mg2+与OH-的反应,故A错误;
14
下列有关说法错误的是
A.NaOH的作用是除去Cu2+
B.试剂a为Na2CO3,试剂b为BaCl2
C.操作X为过滤,试剂c为稀盐酸
D.检验 是否除尽可取适量待测溶液,先加入盐酸,再加入BaCl2溶液
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
√
2
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
14
13.某河道两旁有甲、乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl-、OH-、 6种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是______、______、______(填写离子符号)。
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
OH-
Cl-
K+
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
甲厂的废水明显呈碱性,即含大量OH-,而Ag+、Fe3+与OH-不能大量共存,故Ag+、Fe3+只能在乙厂废水中,由于Cl-与Ag+不能大量共存,故Cl-在甲厂废水中,根据电荷守恒,甲厂废水中必含的阳离子只能为K+。所以甲厂废水中含OH-、Cl-、K+,乙厂废水中含Ag+、Fe3+、 。
14
(2)乙厂的废水中含有另外三种离子。如果加一定量________(填“活性炭”或“铁粉”),可以回收其中的______(填写金属元素符号)。
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
加入铁粉回收银的反应:Fe+2Ag+===Fe2++2Ag。
铁粉
Ag
14
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的______________________(填离子符号)转化为沉淀。经过滤后的废水主要含________________,可用来浇灌农田。
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
混合后OH-与Fe3+、Cl-与Ag+转化为沉淀,剩下的只有KNO3。
OH-、Cl-、Ag+、Fe3+
KNO3(或硝酸钾)
14
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
2
已知:氨气可以使湿润的石
蕊试纸变蓝色。
请回答下列问题:
(1)操作a的名称是______。
过滤
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
样品溶液与足量硝酸钡反应
生成的沉淀A可全部溶于足
量盐酸,则沉淀A为碳酸钡,
样品溶液中一定含
溶液B与硝酸银反应生成不溶于硝酸的沉淀C,则沉淀C为AgCl,可知样品溶液中一定含Cl-;
2
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
另一份溶液与NaOH浓溶液加热生成的气体能使湿润的石蕊试纸变蓝,说明生成了氨气,则样品溶液中有 ,不能确定是否含有Na+、K+。
由流程可知,操作a得到沉淀和溶液,为过滤操作。
2
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
(2)沉淀A的化学式为__________,沉淀A加入足量的盐酸全部溶解的离子方程式为_________________________________。
BaCO3
BaCO3+2H+===Ba2++H2O+CO2↑
由上述分析可知,沉淀A的化学式为BaCO3;碳酸钡与盐酸反应生成氯化钡、水和二氧化碳,故离子方程式为BaCO3+2H+===Ba2++H2O+CO2↑。
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
(3)生成沉淀C的离子方程式为____________________。
Ag++Cl-===AgCl↓
由上述分析可知,沉淀C是氯化银,生成氯化银的离子方程式为Ag++Cl-===AgCl↓。
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
(4)混合物中,一定存在的离子有Cl-和_____________,一定不存在的离子有_____,可能存在的离子是__________。
Na+、K+
2
14
1
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
15.离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________(填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
2
③⑤
离子反应是有离子参加的反应,发生的条件是化合物在一定的条件下必须电离出能反应的离子,则必须是电解质发生电离,所以选③⑤。
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
Ⅰ.取少量溶液滴入紫色石蕊溶液,溶液呈蓝色。
Ⅱ.取少许溶液滴入BaCl2溶液,无白色沉淀产生。
Ⅲ.另取少许溶液先滴加硝酸再加AgNO3溶液,产生白色沉淀。
Ⅳ.再取少许原溶液滴入少量H2SO4溶液,有白色沉淀产生。
①根据以上现象判断,原溶液中肯定不存在的离子是_________________
______;肯定存在的离子是_________________。
Ba2+、OH-、Cl-
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
由于是无色溶液,则溶液中不含Fe3+;
溶液使紫色石蕊溶液呈蓝色,说明溶液含OH-,不含Mg2+;
另取溶液,滴加AgNO3溶液产生白色沉淀,则存在Cl-;
再取少许原溶液滴入H2SO4溶液,有白色沉淀产生,则有Ba2+;
肯定存在的离子是Ba2+、OH-、Cl-,不能确定的离子有K+。
14
1
3
4
5
6
7
8
9
10
11
12
13
15
综合强化
2
返回
②写出实验Ⅲ和Ⅳ中可能发生反应的离子方程式:
Ⅲ:______________________________________。
Ⅳ:______________________________________。
③如溶液中各种离子的个数相等,确定溶液中_____(填“有”或“无”)
K+,判断依据是________________________________________________
_____________。
H++OH-===H2O、Cl-+Ag+===AgCl↓
无
溶液中一定有Ba2+、Cl-、OH- ,个数相等时电荷守恒,所以无K+
14
本课结束
