2023秋高中化学选择性必修3 有机化学基础 第三章 第4节 课时14 羧酸 酯类 课时练(含答案)
文档属性
| 名称 | 2023秋高中化学选择性必修3 有机化学基础 第三章 第4节 课时14 羧酸 酯类 课时练(含答案) |  | |
| 格式 | DOC | ||
| 文件大小 | 348.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-21 22:24:51 | ||
图片预览



文档简介
第四节 羧酸 羧酸衍生物
课时14 羧酸 酯类
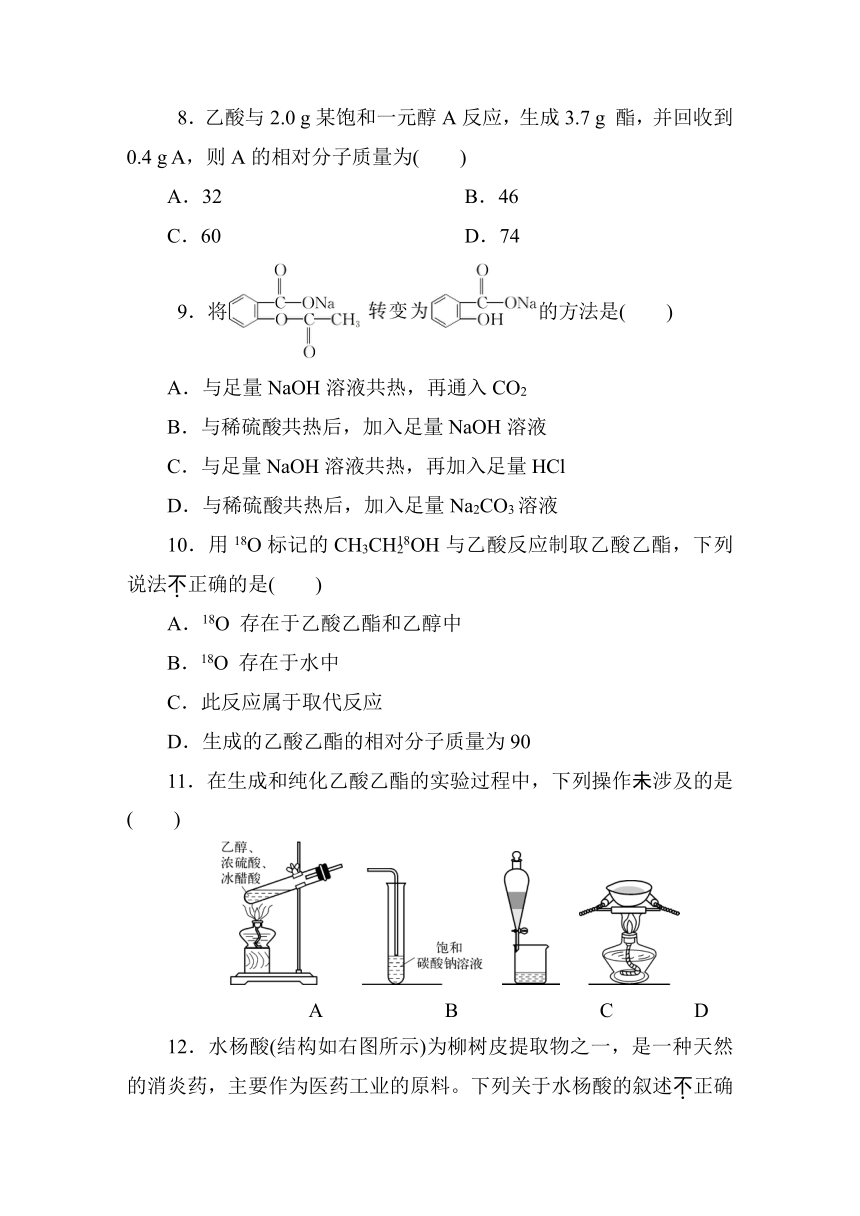
1.下列说法中,正确的是( )
A.RCO18OH与R′OH发生酯化反应时生成R—CO18OR′
B.能与NaOH溶液反应,分子式为C2H4O2的有机物一定是酸
C.甲酸乙酯、乙酸甲酯、丙酸互为同分异构体
D.甲醛与乙酸乙酯的最简式相同
2.下列哪一种试剂可以鉴别乙醇、乙醛、乙酸、甲酸四种无色溶液( )
A.银氨溶液
B.浓溴水
C.新制Cu(OH)2悬浊液
D.FeCl3溶液
3.下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是( )
A.属于酯类的有4种
B.属于羧酸类的有2种
C.存在分子中含有六元环的同分异构体
D.既含有羟基又含有醛基的有3种
4.酯类物质广泛存在于香蕉、梨等水果中。某实验小组先从梨中分离出一种酯,然后将分离出的酯水解,得到乙酸和另一种化学式为C6H14O的物质。对于此过程,下列分析中不正确的是( )
A.C6H14O分子中含有羟基
B.C6H14O可与金属钠发生反应
C.实验小组分离出的酯可表示为
CH3COOC6H13
D.不需要催化剂,这种酯在水中加热即可大量水解
5.某甲酸溶液中可能存在甲醛,下列操作能证明此猜想的是( )
A.加入新制Cu(OH)2悬浊液加热,有砖红色沉淀生成,证明一定存在甲醛
B.能发生银镜反应,证明含甲醛
C.试液与足量NaOH溶液混合,其蒸馏产物可发生银镜反应,则有甲醛
D.先将试液充分进行酯化反应,收集生成物进行银镜反应,有银镜产生,则含甲醛
6.在阿司匹林的结构简式(见下图)中,①②③④⑤⑥分别标出了其分子中的不同的键。将阿司匹林与足量NaOH溶液共热,发生反应时断键的位置是( )
A.①④ B.②⑤
C.③④ D.②⑥
7.分子式为C8H16O2的有机物A,能在酸性条件下水解生成B和C,且B在一定条件下能转化成C。则有机物A的可能结构有( )
A.1种 B.2种
C.3种 D.4种
8.乙酸与2.0 g某饱和一元醇A反应,生成3.7 g 酯,并回收到0.4 g A,则A的相对分子质量为( )
A.32 B.46
C.60 D.74
9.将的方法是( )
A.与足量NaOH溶液共热,再通入CO2
B.与稀硫酸共热后,加入足量NaOH溶液
C.与足量NaOH溶液共热,再加入足量HCl
D.与稀硫酸共热后,加入足量Na2CO3溶液
10.用18O标记的CH3CHOH与乙酸反应制取乙酸乙酯,下列说法不正确的是( )
A.18O 存在于乙酸乙酯和乙醇中
B.18O 存在于水中
C.此反应属于取代反应
D.生成的乙酸乙酯的相对分子质量为90
11.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是( )
A B C D
12.水杨酸(结构如右图所示)为柳树皮提取物之一,是一种天然的消炎药,主要作为医药工业的原料。下列关于水杨酸的叙述不正确的是( )
A.分子式为C7H6O3
B.能发生加成、酯化、中和等反应
C.苯环上的二氯取代物有5种
D.所有原子均可能在同一平面上
13.按要求回答下列问题。
(1) 常用药物阿司匹林的结构简式为,写出它与足量NaOH溶液充分反应的化学方程式:_____________________________________________ __________________________________________________________________。
(2) 某中草药成分中含有七叶树内酯,其结构简式为,具有抗菌作用。写出它与足量NaOH溶液充分反应的化学方程式:___________________ ___________________________________________________________________。
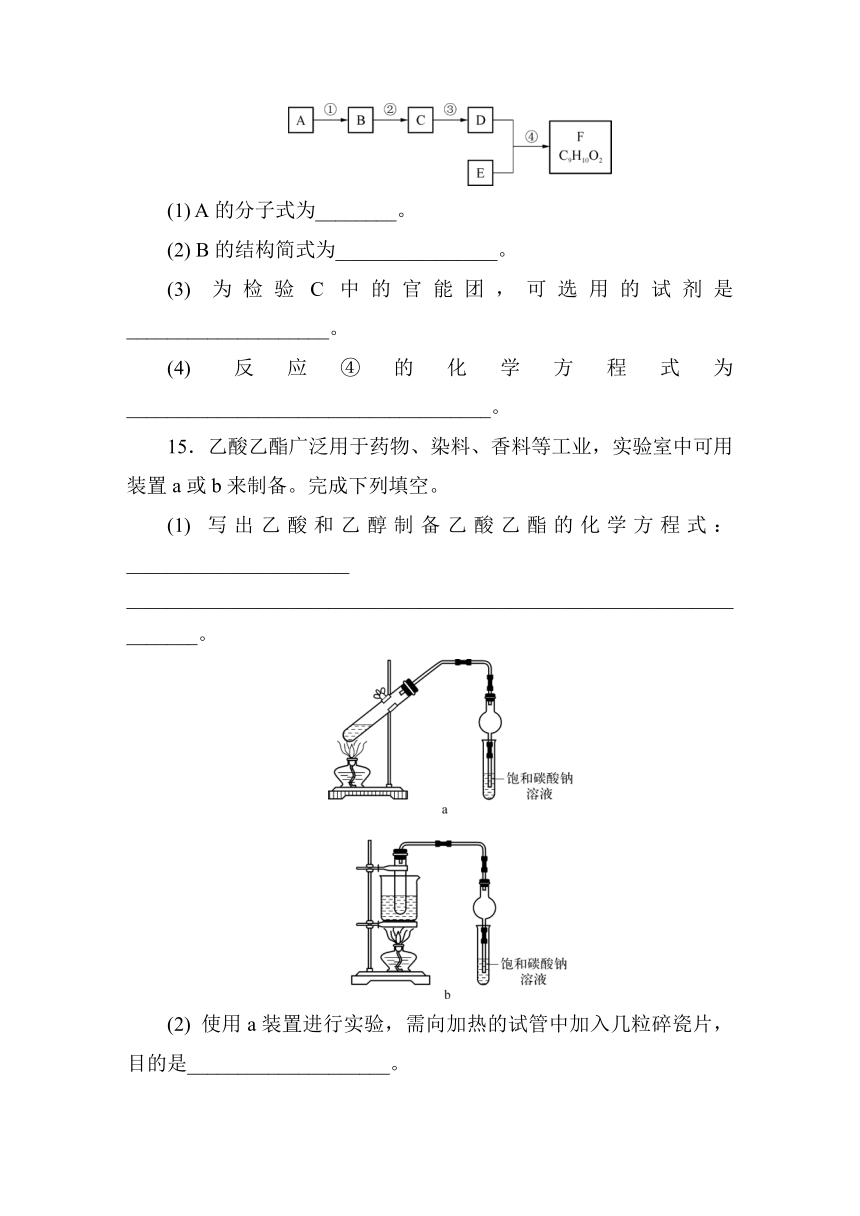
14.有机物F(C9H10O2) 是一种有茉莉花香味的酯。用下图所示的方法可以合成F,其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志;E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链。回答有关问题。
(1) A的分子式为________。
(2) B的结构简式为________________。
(3) 为检验C中的官能团,可选用的试剂是____________________。
(4) 反应④的化学方程式为____________________________________。
15.乙酸乙酯广泛用于药物、染料、香料等工业,实验室中可用装置a或b来制备。完成下列填空。
(1) 写出乙酸和乙醇制备乙酸乙酯的化学方程式:______________________ ___________________________________________________________________。
(2) 使用a装置进行实验,需向加热的试管中加入几粒碎瓷片,目的是____________________。
(3) 下列措施可以提高乙酸平衡转化率的是________(填字母)。
A.加入过量的乙醇
B.延长反应时间
C.加入过量冰醋酸
D.加入数滴浓硫酸即能起催化作用,但实际用量多于此量
(4) 饱和Na2CO3溶液的作用是__________________、__________________、___________________。
(5) 反应结束后,产品的分离操作是____________。
(6) 采用b装置可使反应物均匀受热、准确控制反应温度,其目的是____________________________。装置中的球形干燥管有冷凝、导气和____________作用。
(7) 30 g乙酸与46 g乙醇充分反应,纯化后得到乙酸乙酯的质量为29.5 g,乙酸乙酯的产率为________(保留到百分位)。
第四节 羧酸 羧酸衍生物
课时14 羧酸 酯类
1.C
2.C [解析] 乙醇、乙醛不能溶解新制Cu(OH)2悬浊液,但乙醛与新制Cu(OH)2悬浊液共热时生成砖红色沉淀;甲酸和乙酸都能溶解新制Cu(OH)2悬浊液,但甲酸与过量新制Cu(OH)2悬浊液共热时生成砖红色沉淀。C项符合题意。
3.D [解析] C4H8O2的有机物属于酯类的共有4种,分别是HCOOCH2CH2CH3、、CH3COOC2H5、CH3CH2COOCH3,A项正确;属于羧酸类的共有2种,分别是CH3CH2CH2COOH、,B项正确;C4H8O2的有机物中含有六元环的是等,C项正确;C4H8O2的有机物属于羟基醛时,可以是、、HOCH2CH2CH2CHO、,共5种,D项错误。
4.D [解析] 酯水解生成羧酸和醇,因此C6H14O中存在—OH,A项正确;醇能与Na发生反应,B项正确;根据酯化反应原理,该酯的结构简式可表示为CH3COOC6H13,C项正确;其水解需要酸等作催化剂,D项错误。
5.C [解析] 甲酸()与甲醛()含有相同的结构,因此二者均可发生银镜反应,或与新制Cu(OH)2悬浊液反应产生砖红色沉淀,A、B项错误。若要证明试液中存在甲醛,可使试液与足量NaOH溶液反应,生成沸点高的甲酸钠溶液,蒸馏得到沸点低的甲醛,可用银氨溶液或新制Cu(OH)2悬浊液加以鉴定,C项正确。D项中将试液进行酯化反应,由于酯化反应是可逆反应,生成物中还是含有甲酸,并且生成的甲酸酯中也含有醛基,因而无法鉴别,D项错误。
6.D [解析] 阿司匹林中含有羧基和酯基,与足量NaOH溶液共热可发生中和反应(断⑥号键)和酯的水解反应(断②号键)。
7.B [解析] B应为含4个碳的醇,C为含4个碳的羧酸。B能生成C(氧化),说明B与C的官能团的位置是一样的,丁酸只有2种,所以结构有2种。
8.A [解析] CH3COOH+A―→酯+H2O,设A的相对分子质量为x,参加反应的A的质量=2.0 g-0.4 g=1.6 g。设参加反应的乙酸的物质的量为n,乙酸的相对分子质量为60,根据质量守恒得60n+1.6=3.7+18n,解得n=0.05。即参加反应的A的物质的量为0.05 mol,所以A的相对分子质量x==32。
9.A [解析] 根据酸性强弱顺序,HCl>CH3COOH>H2CO3>苯酚,故H2CO3可将苯环上的ONa转变为OH,而不影响COONa。故选A。
10.B [解析] 乙酸与乙醇反应,乙酸脱去羟基,醇脱去羟基中的氢原子,结合生成水,其余部分互相结合生成酯,所以CH3CHOH与乙酸反应的化学方程式为CH3COOH+CH3CHOHCH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,故18O只存在于乙醇和乙酸乙酯中,A项正确,B项错误;乙酸与乙醇发生的酯化反应属于取代反应,C项正确;生成的乙酸乙酯为CH3CO18OCH2CH3,该酯的相对分子质量为90,D项正确。
11.D [解析] 乙酸乙酯由乙醇、浓硫酸和乙酸的混合溶液加热生成,生成的乙酸乙酯混有乙酸、乙醇,通过饱和碳酸钠溶液吸收乙醇、中和乙酸、降低乙酸乙酯的溶解度,利用分液的方法得到乙酸乙酯。蒸发皿是加热蒸发溶液的仪器,未涉及。
12.C [解析] 根据水杨酸的结构简式可知,水杨酸的分子式为C7H6O3,A项正确;水杨酸分子中含有苯环、羧基和羟基,苯环能与氢气发生加成反应,羧基和羟基能发生酯化反应,羧基能发生中和反应,B项正确;该分子苯环上存在4种不同的氢,其二氯代物有,共6种,C项错误;以苯环(12原子共平面)和碳氧双键(4个原子共平面)为基础,可以画出结构图,故所有原子可能共平面,D项正确。
13.(1)
(2)
14.(1) C2H4 (2) CH3CH2OH (3) 银氨溶液[或新制Cu(OH)2悬浊液]
(4) CH3COOH++H2O
15.(1) CH3COOH+C2H5OHCH3COOC2H5+H2O (2) 防止暴沸 (3) AD (4) 溶解乙醇 中和乙酸 降低乙酸乙酯在水中的溶解度 (5) 分液 (6) 减少原料损失(或减少副反应发生) 防倒吸 (7) 67% [解析] (3) 加入过量的乙醇,有利于平衡正向移动,能提高乙酸平衡转化率,A项正确;延长反应时间,不改变化学平衡状态,不能提高乙酸平衡转化率,B项错误;加入过量冰醋酸,有利于平衡正向进行,但乙酸平衡转化率反而降低,C项错误;浓硫酸能吸水,有利于平衡正向移动,能提高乙酸平衡转化率,D项正确。(4) 碳酸钠溶液能够吸收乙醇,能与乙酸反应中和乙酸,且乙酸乙酯在饱和Na2CO3溶液中的溶解度更小,有利于分层。(5) 乙酸乙酯和饱和碳酸钠溶液互不相溶,可用分液的方法分离。(6) 乙醇、乙酸的沸点均不高,加热温度过高易造成挥发,浪费原料,同时温度过高可能发生消去反应生成乙烯或乙醚。反应过程中乙醇和乙酸加热时会挥发,两者又易溶于饱和碳酸钠溶液,可能发生倒吸,加一个干燥管可以起到防倒吸作用。(7) 30 g乙酸的物质的量为0.5 mol,46 g乙醇的物质的量为1 mol,制备乙酸乙酯的反应为CH3COOH+C2H5OHCH3COOC2H5+H2O,则乙醇过量,0.5 mol CH3COOH生成CH3COOC2H5的理论产量为0.5 mol,质量为0.5 mol×88 g·mol-1=44 g,产率为×100%≈67%。
课时14 羧酸 酯类
1.下列说法中,正确的是( )
A.RCO18OH与R′OH发生酯化反应时生成R—CO18OR′
B.能与NaOH溶液反应,分子式为C2H4O2的有机物一定是酸
C.甲酸乙酯、乙酸甲酯、丙酸互为同分异构体
D.甲醛与乙酸乙酯的最简式相同
2.下列哪一种试剂可以鉴别乙醇、乙醛、乙酸、甲酸四种无色溶液( )
A.银氨溶液
B.浓溴水
C.新制Cu(OH)2悬浊液
D.FeCl3溶液
3.下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是( )
A.属于酯类的有4种
B.属于羧酸类的有2种
C.存在分子中含有六元环的同分异构体
D.既含有羟基又含有醛基的有3种
4.酯类物质广泛存在于香蕉、梨等水果中。某实验小组先从梨中分离出一种酯,然后将分离出的酯水解,得到乙酸和另一种化学式为C6H14O的物质。对于此过程,下列分析中不正确的是( )
A.C6H14O分子中含有羟基
B.C6H14O可与金属钠发生反应
C.实验小组分离出的酯可表示为
CH3COOC6H13
D.不需要催化剂,这种酯在水中加热即可大量水解
5.某甲酸溶液中可能存在甲醛,下列操作能证明此猜想的是( )
A.加入新制Cu(OH)2悬浊液加热,有砖红色沉淀生成,证明一定存在甲醛
B.能发生银镜反应,证明含甲醛
C.试液与足量NaOH溶液混合,其蒸馏产物可发生银镜反应,则有甲醛
D.先将试液充分进行酯化反应,收集生成物进行银镜反应,有银镜产生,则含甲醛
6.在阿司匹林的结构简式(见下图)中,①②③④⑤⑥分别标出了其分子中的不同的键。将阿司匹林与足量NaOH溶液共热,发生反应时断键的位置是( )
A.①④ B.②⑤
C.③④ D.②⑥
7.分子式为C8H16O2的有机物A,能在酸性条件下水解生成B和C,且B在一定条件下能转化成C。则有机物A的可能结构有( )
A.1种 B.2种
C.3种 D.4种
8.乙酸与2.0 g某饱和一元醇A反应,生成3.7 g 酯,并回收到0.4 g A,则A的相对分子质量为( )
A.32 B.46
C.60 D.74
9.将的方法是( )
A.与足量NaOH溶液共热,再通入CO2
B.与稀硫酸共热后,加入足量NaOH溶液
C.与足量NaOH溶液共热,再加入足量HCl
D.与稀硫酸共热后,加入足量Na2CO3溶液
10.用18O标记的CH3CHOH与乙酸反应制取乙酸乙酯,下列说法不正确的是( )
A.18O 存在于乙酸乙酯和乙醇中
B.18O 存在于水中
C.此反应属于取代反应
D.生成的乙酸乙酯的相对分子质量为90
11.在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是( )
A B C D
12.水杨酸(结构如右图所示)为柳树皮提取物之一,是一种天然的消炎药,主要作为医药工业的原料。下列关于水杨酸的叙述不正确的是( )
A.分子式为C7H6O3
B.能发生加成、酯化、中和等反应
C.苯环上的二氯取代物有5种
D.所有原子均可能在同一平面上
13.按要求回答下列问题。
(1) 常用药物阿司匹林的结构简式为,写出它与足量NaOH溶液充分反应的化学方程式:_____________________________________________ __________________________________________________________________。
(2) 某中草药成分中含有七叶树内酯,其结构简式为,具有抗菌作用。写出它与足量NaOH溶液充分反应的化学方程式:___________________ ___________________________________________________________________。
14.有机物F(C9H10O2) 是一种有茉莉花香味的酯。用下图所示的方法可以合成F,其中A是相对分子质量为28的烃,其产量常作为衡量石油化工发展水平的标志;E是只含碳、氢、氧的芳香族化合物,且苯环上只有一个侧链。回答有关问题。
(1) A的分子式为________。
(2) B的结构简式为________________。
(3) 为检验C中的官能团,可选用的试剂是____________________。
(4) 反应④的化学方程式为____________________________________。
15.乙酸乙酯广泛用于药物、染料、香料等工业,实验室中可用装置a或b来制备。完成下列填空。
(1) 写出乙酸和乙醇制备乙酸乙酯的化学方程式:______________________ ___________________________________________________________________。
(2) 使用a装置进行实验,需向加热的试管中加入几粒碎瓷片,目的是____________________。
(3) 下列措施可以提高乙酸平衡转化率的是________(填字母)。
A.加入过量的乙醇
B.延长反应时间
C.加入过量冰醋酸
D.加入数滴浓硫酸即能起催化作用,但实际用量多于此量
(4) 饱和Na2CO3溶液的作用是__________________、__________________、___________________。
(5) 反应结束后,产品的分离操作是____________。
(6) 采用b装置可使反应物均匀受热、准确控制反应温度,其目的是____________________________。装置中的球形干燥管有冷凝、导气和____________作用。
(7) 30 g乙酸与46 g乙醇充分反应,纯化后得到乙酸乙酯的质量为29.5 g,乙酸乙酯的产率为________(保留到百分位)。
第四节 羧酸 羧酸衍生物
课时14 羧酸 酯类
1.C
2.C [解析] 乙醇、乙醛不能溶解新制Cu(OH)2悬浊液,但乙醛与新制Cu(OH)2悬浊液共热时生成砖红色沉淀;甲酸和乙酸都能溶解新制Cu(OH)2悬浊液,但甲酸与过量新制Cu(OH)2悬浊液共热时生成砖红色沉淀。C项符合题意。
3.D [解析] C4H8O2的有机物属于酯类的共有4种,分别是HCOOCH2CH2CH3、、CH3COOC2H5、CH3CH2COOCH3,A项正确;属于羧酸类的共有2种,分别是CH3CH2CH2COOH、,B项正确;C4H8O2的有机物中含有六元环的是等,C项正确;C4H8O2的有机物属于羟基醛时,可以是、、HOCH2CH2CH2CHO、,共5种,D项错误。
4.D [解析] 酯水解生成羧酸和醇,因此C6H14O中存在—OH,A项正确;醇能与Na发生反应,B项正确;根据酯化反应原理,该酯的结构简式可表示为CH3COOC6H13,C项正确;其水解需要酸等作催化剂,D项错误。
5.C [解析] 甲酸()与甲醛()含有相同的结构,因此二者均可发生银镜反应,或与新制Cu(OH)2悬浊液反应产生砖红色沉淀,A、B项错误。若要证明试液中存在甲醛,可使试液与足量NaOH溶液反应,生成沸点高的甲酸钠溶液,蒸馏得到沸点低的甲醛,可用银氨溶液或新制Cu(OH)2悬浊液加以鉴定,C项正确。D项中将试液进行酯化反应,由于酯化反应是可逆反应,生成物中还是含有甲酸,并且生成的甲酸酯中也含有醛基,因而无法鉴别,D项错误。
6.D [解析] 阿司匹林中含有羧基和酯基,与足量NaOH溶液共热可发生中和反应(断⑥号键)和酯的水解反应(断②号键)。
7.B [解析] B应为含4个碳的醇,C为含4个碳的羧酸。B能生成C(氧化),说明B与C的官能团的位置是一样的,丁酸只有2种,所以结构有2种。
8.A [解析] CH3COOH+A―→酯+H2O,设A的相对分子质量为x,参加反应的A的质量=2.0 g-0.4 g=1.6 g。设参加反应的乙酸的物质的量为n,乙酸的相对分子质量为60,根据质量守恒得60n+1.6=3.7+18n,解得n=0.05。即参加反应的A的物质的量为0.05 mol,所以A的相对分子质量x==32。
9.A [解析] 根据酸性强弱顺序,HCl>CH3COOH>H2CO3>苯酚,故H2CO3可将苯环上的ONa转变为OH,而不影响COONa。故选A。
10.B [解析] 乙酸与乙醇反应,乙酸脱去羟基,醇脱去羟基中的氢原子,结合生成水,其余部分互相结合生成酯,所以CH3CHOH与乙酸反应的化学方程式为CH3COOH+CH3CHOHCH3CO18OCH2CH3+H2O,由于酯化反应是可逆反应,故乙醇仍存在,故18O只存在于乙醇和乙酸乙酯中,A项正确,B项错误;乙酸与乙醇发生的酯化反应属于取代反应,C项正确;生成的乙酸乙酯为CH3CO18OCH2CH3,该酯的相对分子质量为90,D项正确。
11.D [解析] 乙酸乙酯由乙醇、浓硫酸和乙酸的混合溶液加热生成,生成的乙酸乙酯混有乙酸、乙醇,通过饱和碳酸钠溶液吸收乙醇、中和乙酸、降低乙酸乙酯的溶解度,利用分液的方法得到乙酸乙酯。蒸发皿是加热蒸发溶液的仪器,未涉及。
12.C [解析] 根据水杨酸的结构简式可知,水杨酸的分子式为C7H6O3,A项正确;水杨酸分子中含有苯环、羧基和羟基,苯环能与氢气发生加成反应,羧基和羟基能发生酯化反应,羧基能发生中和反应,B项正确;该分子苯环上存在4种不同的氢,其二氯代物有,共6种,C项错误;以苯环(12原子共平面)和碳氧双键(4个原子共平面)为基础,可以画出结构图,故所有原子可能共平面,D项正确。
13.(1)
(2)
14.(1) C2H4 (2) CH3CH2OH (3) 银氨溶液[或新制Cu(OH)2悬浊液]
(4) CH3COOH++H2O
15.(1) CH3COOH+C2H5OHCH3COOC2H5+H2O (2) 防止暴沸 (3) AD (4) 溶解乙醇 中和乙酸 降低乙酸乙酯在水中的溶解度 (5) 分液 (6) 减少原料损失(或减少副反应发生) 防倒吸 (7) 67% [解析] (3) 加入过量的乙醇,有利于平衡正向移动,能提高乙酸平衡转化率,A项正确;延长反应时间,不改变化学平衡状态,不能提高乙酸平衡转化率,B项错误;加入过量冰醋酸,有利于平衡正向进行,但乙酸平衡转化率反而降低,C项错误;浓硫酸能吸水,有利于平衡正向移动,能提高乙酸平衡转化率,D项正确。(4) 碳酸钠溶液能够吸收乙醇,能与乙酸反应中和乙酸,且乙酸乙酯在饱和Na2CO3溶液中的溶解度更小,有利于分层。(5) 乙酸乙酯和饱和碳酸钠溶液互不相溶,可用分液的方法分离。(6) 乙醇、乙酸的沸点均不高,加热温度过高易造成挥发,浪费原料,同时温度过高可能发生消去反应生成乙烯或乙醚。反应过程中乙醇和乙酸加热时会挥发,两者又易溶于饱和碳酸钠溶液,可能发生倒吸,加一个干燥管可以起到防倒吸作用。(7) 30 g乙酸的物质的量为0.5 mol,46 g乙醇的物质的量为1 mol,制备乙酸乙酯的反应为CH3COOH+C2H5OHCH3COOC2H5+H2O,则乙醇过量,0.5 mol CH3COOH生成CH3COOC2H5的理论产量为0.5 mol,质量为0.5 mol×88 g·mol-1=44 g,产率为×100%≈67%。
