1.3.2氧化还原反应课件(共39张PPT)2023-2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.2氧化还原反应课件(共39张PPT)2023-2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 728.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-22 08:42:17 | ||
图片预览










文档简介
(共39张PPT)
氧化还原反应(第二课时)
活动1 请根据上节课学过的氧化还原反应知识,分析以下反应的特征、实质和反应类型。
任务一 认识物质的性质
CuSO4 + Fe Cu + FeSO4
Ag2O + Zn 2Ag + ZnO
+2 0 0 +2
活动1 请根据上节课学过的氧化还原反应知识,分析以下反应的特征、实质和反应类型。
请思考 观察上述反应中物质的变化特征,你能对反应物进行分类吗?
任务一 认识物质的性质
CuSO4 + Fe Cu + FeSO4
Ag2O + Zn 2Ag + ZnO
+1 0 0 +2
+2 0 0 +2
从化合价升降观点分析氧化还原反应
物质所含元素 化合价升高 的 反应 是 氧化反应
化合价降低,
被还原
化合价升高,
被氧化
(氧化剂)
(还原剂)
CuO + H2 = Cu + H2O
+2
-2
0
0
+1
-2
物质所含元素 化合价降低 的 反应 是 还原反应
所含元素 化合价升高 的 物质 是 还原剂
所含元素 化合价降低 的 物质 是 氧化剂
小结1
反应物
所含元素的化合价升高
即失去电子(或电子对偏离)
任务一 认识物质的性质
CuSO4 + Fe Cu + FeSO4
+2 0 0 +2
所含元素的化合价降低
即得到电子(或电子对偏向)
还原剂
氧化剂
还原剂
氧化剂
0
0
+1
-1
化合价降低
被还原
化合价升高
被氧化
失去2e-
得到2e-
还原剂
氧化剂
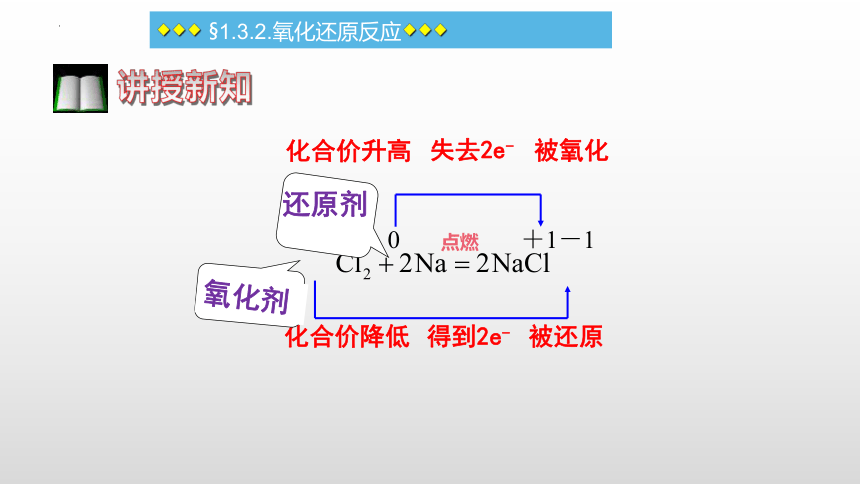
◆◆◆ §1.3.2.氧化还原反应◆◆◆
讲授新知
点燃
讲授新知
反应物中失去电子(元素化合价升高)的物质—被氧化
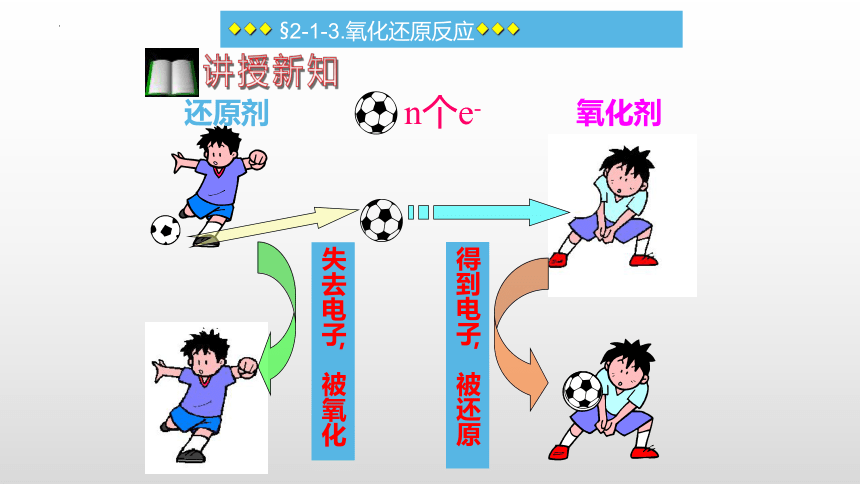
◆◆◆ §2-1-3.氧化还原反应◆◆◆
二.氧化剂和还原剂
1. 定义:
反应物中得到电子(元素化合价降低)的物质—被还原
氧化剂:
还原剂:
氧化剂
还原剂
得到电子,被还原
n个e-
◆◆◆ §2-1-3.氧化还原反应◆◆◆
讲授新知
失去电子,被氧化
小结2
任务一 认识物质的性质
e-
1.反应中转移的电子数等于还原剂失去的电子数等于氧化剂得到的电子数。
2.反应中转移的电子数等于一个原子转移的电子数目乘以被氧化或被还原的原子数目。
还原剂
氧化剂
讲授新知
◆◆◆ §2-1-3.氧化还原反应◆◆◆
二.氧化剂和还原剂
说明:
①.氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。
②.氧化剂本身被还原,发生还原反应,得到的产物是还原产物
③.还原剂本身被氧化,发生氧化反应,得到的产物是氧化产物。
《九年级化学》
氧气在氧化反应中提供氧,它具有氧化性。
木炭是使氧化铜还原为铜的物质,它具有还原性。
任务一 认识物质的性质
氧化剂和还原剂
氧化剂: 定义: 得到电子(或电子对偏向)的物质
表现: 所含元素化合价降低,被还原
还原剂: 定义: 失去电子(或电子对偏离)的物质
表现: 所含元素化合价升高,被氧化
氧化性: 得电子的性质( 氧化剂的性质 )
还原性:失电子的性质( 还原剂的性质 )
任务一 认识物质的性质
活动3 请你分析下列每组反应中氧化剂或还原剂是否具有相同的作用,若有,说出它们体现的性质。
CuO + H2 Cu + H2O
△
高温
2CuO+ C 2Cu + CO2↑
3CO + Fe2O3 2Fe + 3CO2
高温
CO + CuO Cu + CO2
△
还原剂
被还原
体现还原性
任务一 认识物质的性质
活动3 请你分析下列每组反应中氧化剂或还原剂是否具有相同的作用,若有,说出它们体现的性质。
CuO + H2 Cu + H2O
△
高温
2CuO+ C 2Cu + CO2↑
3CO + Fe2O3 2Fe + 3CO2
高温
CO + CuO Cu + CO2
△
氧化剂
还原剂
被还原
被氧化
体现还原性
体现氧化性
小结3
任务一 认识物质的性质
1.氧化剂具有氧化性,反应时使物质氧化,本身被还原。
2.还原剂具有还原性,反应时使物质还原,本身被氧化。
任务一 认识物质的性质
活动4 基于元素的化合价,判断下列物质或离子是否具有氧化性或还原性。
KMnO4
+7
化合价有降低趋势可能有氧化性
Fe
Fe2+
0
+2
+6
Mn
+4
+7
+1
-2
任务一 认识物质的性质
活动4 基于元素的化合价,判断下列物质或离子是否具有氧化性或还原性。
KMnO4
+7
化合价有降低趋势可能有氧化性
Fe
0
Fe2+
+2
0
+2
+6
Mn
+4
+7
化合价有升高趋势可能有还原性
既可能有氧化性又可能有还原性
+1
-2
0
+2
Fe
+3
小结4
任务一 认识物质的性质
1.元素处于最高价,只具有氧化性
2.元素处于最低价,只具有还原性
3.元素处于中间价,既具有氧化性,又具有还原性
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7
失去e- ,
化合价升高,
被氧化,
作还原剂
得到e- ,
作氧化剂
化合价降低,
被还原,
◆◆◆ §2-1-3.氧化还原反应◆◆◆
讲授新知
化合价升降与得失电子的关系
任务一 认识物质的性质
活动5 根据下列物质中所含元素的常见化合价,判断下列物质或离子的氧化性、还原性。
Cl2 I-
浓硫酸(H2SO4)
HNO3
0
-1
(元素的常见化合价:-1、0、+1、+5、+7)
任务一 认识物质的性质
活动5 根据下列物质中所含元素的常见化合价,判断下列物质或离子的氧化性、还原性。
Cl2 I-
浓硫酸(H2SO4)
HNO3
0
+6
+5
-1
(元素的常见化合价:-1、0、+1、+5、+7)
(硫元素的常见化合价:-2、0、+4、+6)
(氮元素的常见化合价:-3、0、+2、+4、+5)
小结5 归纳中学化学中常见的氧化剂和还原剂
O2 Cl2
浓硫酸 HNO3
MnO4- Fe3+
……
常见氧化剂
常见还原剂
Al Zn Fe
C H2
CO
I- Fe2+
……
任务一 认识物质的性质
应用1
维生素C又称“抗坏血酸”,在人体内有重要的功能。
例如,能帮助人体将从食物中获取的、不易被吸收的Fe3+
转变为易被吸收的Fe2+,这说明维生素C具有
(填“氧化性”或“还原性”)
还原性
任务一 认识物质的性质
CuO + H2==Cu + H2O
+2 0 0 +1
失去2e-,化合价升高,被氧化
得到 2e-,化合价降低,被还原
氧化剂 还原剂
氧化产物: 还原剂失电子( 被氧化 ) 后的生成物
还原产物: 氧化剂得电子 ( 被还原 )后的生成物
还原产物 氧化产物
讲授新知
三.氧化产物和还原产物
氧化产物:还原剂失去电子生成的产物—(元素化合价升高)生成物
还原产物:氧化剂得到电子生成的物质—(元素化合价降低)生成物
2HCl+Fe =FeCl2+H2↑
还原剂
还原产物
氧化剂
◆◆◆ §2-1-3.氧化还原反应◆◆◆
氧化产物
技巧总结
高温
氧化剂
还原剂
( )产物
( )产物
2Mg + CO2 2MgO + C
+4
0
0
+2
氧化
还原
低价 高价
高价 低价
高价氧化,
低价还。
氧化剂、还原剂;氧化产物、还原产物概念:
氧化剂:得到电子(或电子对偏向)的物质。
反应物中所含元素化合价降低的物质。
还原剂:失去电子(或电子对偏离)的物质。
反应物中所含元素化合价升高的物质。
氧化产物:还原剂发生氧化反应后的生成物。
还原产物:氧化剂发生还原反应后的生成物。
生成物中所含元素化合价升高的物质。
生成物中所含元素化合价降低的物质。
讲授新知
氧化剂+还原剂=氧化产物+还原产物
化合价降低,得到电子,被还原,发生还原反应
化合价升高,失去电子,被氧化,发生氧化反应
◆◆◆ §1-3-2.氧化还原反应◆◆◆
口诀:
“升 失 氧 还原剂,降 得 还 氧化剂”
升失氧(3)还
还:还原剂
具有还原性
失:电子
升:化合价
氧:被氧化
发生氧化反应
生成氧化产物
降得还(2)氧
氧:氧化剂
具有氧化性
得:电子
降:化合价
还:被还原
发生还原反应
生成还原产物
例2:2HCl+Fe =FeCl2+H2↑
氧化剂 还原剂
元素被氧化 元素被还原
+1 0 +2 0
课堂练兵
HCl
Fe
铁
氢
例3:MnO2+4HCl(浓)MnCl2+Cl2 +2H2O
氧化剂 还原剂
被氧化 被还原
元素被氧化 元素被还原
氧化产物 还原产物
0
-1
-1
+4
+2
MnO2
HCl
HCl
MnO2
Cl2
MnCl2
氯
锰
练习2:指出下列反应中哪种物质是氧化剂 、哪种物质是还原剂以及氧化产物、还原产物。
⑴ Zn + CuSO4 = ZnSO4 + Cu
还原剂 Zn 氧化剂 CuSO4
氧化产物 ZnSO4 还原产物 Cu
(2) 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
还原剂 Cl2 氧化剂 Cl2
氧化产物 KClO3 还原产物 KCl
课堂练兵
练习2:指出下列反应中哪种物质是氧化剂 、哪种物质是还原剂以及氧化产物、还原产物。
还原剂 H2O 氧化剂 H2O
氧化产物 O2 还原产物 H2
还原剂 HCl 氧化剂 MnO2
氧化产物 Cl2 还原产物 MnO2
(3) 2H2O === 2H2↑ + O2↑
电解
(4) MnO2 + 4HCl == MnCl2 + Cl2↑+2H2O
△
还原剂_________,氧化剂_________,
氧化产物__________,还原产物_________,
被氧化的物质________,发生氧化反应的物质_______,
被还原的物质________,发生还原反应的物质_______。
(1) 2KMnO4+16HCl==2MnCl2+2KCl+5Cl2↑+8H2O
(2) 5H2S+2KMnO4+3H2SO4=K2SO4+2MnSO4+5S↓+8H2O
还原剂_________,氧化剂_________,
氧化产物__________,还原产物_________,
被氧化的物质________,发生氧化反应的物质_______,
被还原的物质________,发生还原反应的物质_______。
+7 -1 +2 0
HCl
KMnO4
Cl2
MnCl2
HCl
HCl
KMnO4
KMnO4
-2 +7 +2 0
H2S
KMnO4
S
MnSO4
H2S
H2S
KMnO4
KMnO4
失、升、氧、还; 得、降、还、氧
练习3:
练习:
Fe FeCl2
CuO Cu
HCl Cl2
HCl H2
Fe3+ Fe
需加 剂
需加 剂
是 反应
是 反应
需加 剂
氧化
还原
氧化
还原
还原
思考:在氧化还原反应中一种元素被氧化,则一定有另一种元素被还原,这句话对吗?
氧化剂 、还原剂 可以为同一物质,同样,氧化产物、还原产物也可以为同一物质。如:
不对。可以是同一种元素既被氧化、又还原。如:
Cl2 + 2NaOH = NaCl + NaClO + H2O
氧化剂
还原剂
2Mg + O2 = 2MgO
还原产物
氧化产物
练习:下列反应中,HCl为还原剂的是( ) HCl为氧化剂的是( ) HCl不是氧化剂也不是还原剂的是( )
A.Zn + 2HCl == ZnCl2 + H2↑
B.NaOH + HCl == NaCl + H2O
C.MnO2 + 4HCl == MnCl2 + Cl2↑+ 2H2O
D.NH3 + HCl == NH4Cl
C
A
BD
反应物
性质
实质
特征
反应
反应产物
氧化剂
具有氧化性
得电子
化合价降低
发生还原反应(被还原)
还原产物
还原剂
具有还原性
失电子
化合价升高
发生氧化反应(被氧化)
氧化产物
口诀:升 失 氧 还原剂 ,降 得 还 氧化剂。
氧化还原反应中各概念之间的关系:
谢
谢
观
看
氧化还原反应(第二课时)
活动1 请根据上节课学过的氧化还原反应知识,分析以下反应的特征、实质和反应类型。
任务一 认识物质的性质
CuSO4 + Fe Cu + FeSO4
Ag2O + Zn 2Ag + ZnO
+2 0 0 +2
活动1 请根据上节课学过的氧化还原反应知识,分析以下反应的特征、实质和反应类型。
请思考 观察上述反应中物质的变化特征,你能对反应物进行分类吗?
任务一 认识物质的性质
CuSO4 + Fe Cu + FeSO4
Ag2O + Zn 2Ag + ZnO
+1 0 0 +2
+2 0 0 +2
从化合价升降观点分析氧化还原反应
物质所含元素 化合价升高 的 反应 是 氧化反应
化合价降低,
被还原
化合价升高,
被氧化
(氧化剂)
(还原剂)
CuO + H2 = Cu + H2O
+2
-2
0
0
+1
-2
物质所含元素 化合价降低 的 反应 是 还原反应
所含元素 化合价升高 的 物质 是 还原剂
所含元素 化合价降低 的 物质 是 氧化剂
小结1
反应物
所含元素的化合价升高
即失去电子(或电子对偏离)
任务一 认识物质的性质
CuSO4 + Fe Cu + FeSO4
+2 0 0 +2
所含元素的化合价降低
即得到电子(或电子对偏向)
还原剂
氧化剂
还原剂
氧化剂
0
0
+1
-1
化合价降低
被还原
化合价升高
被氧化
失去2e-
得到2e-
还原剂
氧化剂
◆◆◆ §1.3.2.氧化还原反应◆◆◆
讲授新知
点燃
讲授新知
反应物中失去电子(元素化合价升高)的物质—被氧化
◆◆◆ §2-1-3.氧化还原反应◆◆◆
二.氧化剂和还原剂
1. 定义:
反应物中得到电子(元素化合价降低)的物质—被还原
氧化剂:
还原剂:
氧化剂
还原剂
得到电子,被还原
n个e-
◆◆◆ §2-1-3.氧化还原反应◆◆◆
讲授新知
失去电子,被氧化
小结2
任务一 认识物质的性质
e-
1.反应中转移的电子数等于还原剂失去的电子数等于氧化剂得到的电子数。
2.反应中转移的电子数等于一个原子转移的电子数目乘以被氧化或被还原的原子数目。
还原剂
氧化剂
讲授新知
◆◆◆ §2-1-3.氧化还原反应◆◆◆
二.氧化剂和还原剂
说明:
①.氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。
②.氧化剂本身被还原,发生还原反应,得到的产物是还原产物
③.还原剂本身被氧化,发生氧化反应,得到的产物是氧化产物。
《九年级化学》
氧气在氧化反应中提供氧,它具有氧化性。
木炭是使氧化铜还原为铜的物质,它具有还原性。
任务一 认识物质的性质
氧化剂和还原剂
氧化剂: 定义: 得到电子(或电子对偏向)的物质
表现: 所含元素化合价降低,被还原
还原剂: 定义: 失去电子(或电子对偏离)的物质
表现: 所含元素化合价升高,被氧化
氧化性: 得电子的性质( 氧化剂的性质 )
还原性:失电子的性质( 还原剂的性质 )
任务一 认识物质的性质
活动3 请你分析下列每组反应中氧化剂或还原剂是否具有相同的作用,若有,说出它们体现的性质。
CuO + H2 Cu + H2O
△
高温
2CuO+ C 2Cu + CO2↑
3CO + Fe2O3 2Fe + 3CO2
高温
CO + CuO Cu + CO2
△
还原剂
被还原
体现还原性
任务一 认识物质的性质
活动3 请你分析下列每组反应中氧化剂或还原剂是否具有相同的作用,若有,说出它们体现的性质。
CuO + H2 Cu + H2O
△
高温
2CuO+ C 2Cu + CO2↑
3CO + Fe2O3 2Fe + 3CO2
高温
CO + CuO Cu + CO2
△
氧化剂
还原剂
被还原
被氧化
体现还原性
体现氧化性
小结3
任务一 认识物质的性质
1.氧化剂具有氧化性,反应时使物质氧化,本身被还原。
2.还原剂具有还原性,反应时使物质还原,本身被氧化。
任务一 认识物质的性质
活动4 基于元素的化合价,判断下列物质或离子是否具有氧化性或还原性。
KMnO4
+7
化合价有降低趋势可能有氧化性
Fe
Fe2+
0
+2
+6
Mn
+4
+7
+1
-2
任务一 认识物质的性质
活动4 基于元素的化合价,判断下列物质或离子是否具有氧化性或还原性。
KMnO4
+7
化合价有降低趋势可能有氧化性
Fe
0
Fe2+
+2
0
+2
+6
Mn
+4
+7
化合价有升高趋势可能有还原性
既可能有氧化性又可能有还原性
+1
-2
0
+2
Fe
+3
小结4
任务一 认识物质的性质
1.元素处于最高价,只具有氧化性
2.元素处于最低价,只具有还原性
3.元素处于中间价,既具有氧化性,又具有还原性
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7
失去e- ,
化合价升高,
被氧化,
作还原剂
得到e- ,
作氧化剂
化合价降低,
被还原,
◆◆◆ §2-1-3.氧化还原反应◆◆◆
讲授新知
化合价升降与得失电子的关系
任务一 认识物质的性质
活动5 根据下列物质中所含元素的常见化合价,判断下列物质或离子的氧化性、还原性。
Cl2 I-
浓硫酸(H2SO4)
HNO3
0
-1
(元素的常见化合价:-1、0、+1、+5、+7)
任务一 认识物质的性质
活动5 根据下列物质中所含元素的常见化合价,判断下列物质或离子的氧化性、还原性。
Cl2 I-
浓硫酸(H2SO4)
HNO3
0
+6
+5
-1
(元素的常见化合价:-1、0、+1、+5、+7)
(硫元素的常见化合价:-2、0、+4、+6)
(氮元素的常见化合价:-3、0、+2、+4、+5)
小结5 归纳中学化学中常见的氧化剂和还原剂
O2 Cl2
浓硫酸 HNO3
MnO4- Fe3+
……
常见氧化剂
常见还原剂
Al Zn Fe
C H2
CO
I- Fe2+
……
任务一 认识物质的性质
应用1
维生素C又称“抗坏血酸”,在人体内有重要的功能。
例如,能帮助人体将从食物中获取的、不易被吸收的Fe3+
转变为易被吸收的Fe2+,这说明维生素C具有
(填“氧化性”或“还原性”)
还原性
任务一 认识物质的性质
CuO + H2==Cu + H2O
+2 0 0 +1
失去2e-,化合价升高,被氧化
得到 2e-,化合价降低,被还原
氧化剂 还原剂
氧化产物: 还原剂失电子( 被氧化 ) 后的生成物
还原产物: 氧化剂得电子 ( 被还原 )后的生成物
还原产物 氧化产物
讲授新知
三.氧化产物和还原产物
氧化产物:还原剂失去电子生成的产物—(元素化合价升高)生成物
还原产物:氧化剂得到电子生成的物质—(元素化合价降低)生成物
2HCl+Fe =FeCl2+H2↑
还原剂
还原产物
氧化剂
◆◆◆ §2-1-3.氧化还原反应◆◆◆
氧化产物
技巧总结
高温
氧化剂
还原剂
( )产物
( )产物
2Mg + CO2 2MgO + C
+4
0
0
+2
氧化
还原
低价 高价
高价 低价
高价氧化,
低价还。
氧化剂、还原剂;氧化产物、还原产物概念:
氧化剂:得到电子(或电子对偏向)的物质。
反应物中所含元素化合价降低的物质。
还原剂:失去电子(或电子对偏离)的物质。
反应物中所含元素化合价升高的物质。
氧化产物:还原剂发生氧化反应后的生成物。
还原产物:氧化剂发生还原反应后的生成物。
生成物中所含元素化合价升高的物质。
生成物中所含元素化合价降低的物质。
讲授新知
氧化剂+还原剂=氧化产物+还原产物
化合价降低,得到电子,被还原,发生还原反应
化合价升高,失去电子,被氧化,发生氧化反应
◆◆◆ §1-3-2.氧化还原反应◆◆◆
口诀:
“升 失 氧 还原剂,降 得 还 氧化剂”
升失氧(3)还
还:还原剂
具有还原性
失:电子
升:化合价
氧:被氧化
发生氧化反应
生成氧化产物
降得还(2)氧
氧:氧化剂
具有氧化性
得:电子
降:化合价
还:被还原
发生还原反应
生成还原产物
例2:2HCl+Fe =FeCl2+H2↑
氧化剂 还原剂
元素被氧化 元素被还原
+1 0 +2 0
课堂练兵
HCl
Fe
铁
氢
例3:MnO2+4HCl(浓)MnCl2+Cl2 +2H2O
氧化剂 还原剂
被氧化 被还原
元素被氧化 元素被还原
氧化产物 还原产物
0
-1
-1
+4
+2
MnO2
HCl
HCl
MnO2
Cl2
MnCl2
氯
锰
练习2:指出下列反应中哪种物质是氧化剂 、哪种物质是还原剂以及氧化产物、还原产物。
⑴ Zn + CuSO4 = ZnSO4 + Cu
还原剂 Zn 氧化剂 CuSO4
氧化产物 ZnSO4 还原产物 Cu
(2) 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
还原剂 Cl2 氧化剂 Cl2
氧化产物 KClO3 还原产物 KCl
课堂练兵
练习2:指出下列反应中哪种物质是氧化剂 、哪种物质是还原剂以及氧化产物、还原产物。
还原剂 H2O 氧化剂 H2O
氧化产物 O2 还原产物 H2
还原剂 HCl 氧化剂 MnO2
氧化产物 Cl2 还原产物 MnO2
(3) 2H2O === 2H2↑ + O2↑
电解
(4) MnO2 + 4HCl == MnCl2 + Cl2↑+2H2O
△
还原剂_________,氧化剂_________,
氧化产物__________,还原产物_________,
被氧化的物质________,发生氧化反应的物质_______,
被还原的物质________,发生还原反应的物质_______。
(1) 2KMnO4+16HCl==2MnCl2+2KCl+5Cl2↑+8H2O
(2) 5H2S+2KMnO4+3H2SO4=K2SO4+2MnSO4+5S↓+8H2O
还原剂_________,氧化剂_________,
氧化产物__________,还原产物_________,
被氧化的物质________,发生氧化反应的物质_______,
被还原的物质________,发生还原反应的物质_______。
+7 -1 +2 0
HCl
KMnO4
Cl2
MnCl2
HCl
HCl
KMnO4
KMnO4
-2 +7 +2 0
H2S
KMnO4
S
MnSO4
H2S
H2S
KMnO4
KMnO4
失、升、氧、还; 得、降、还、氧
练习3:
练习:
Fe FeCl2
CuO Cu
HCl Cl2
HCl H2
Fe3+ Fe
需加 剂
需加 剂
是 反应
是 反应
需加 剂
氧化
还原
氧化
还原
还原
思考:在氧化还原反应中一种元素被氧化,则一定有另一种元素被还原,这句话对吗?
氧化剂 、还原剂 可以为同一物质,同样,氧化产物、还原产物也可以为同一物质。如:
不对。可以是同一种元素既被氧化、又还原。如:
Cl2 + 2NaOH = NaCl + NaClO + H2O
氧化剂
还原剂
2Mg + O2 = 2MgO
还原产物
氧化产物
练习:下列反应中,HCl为还原剂的是( ) HCl为氧化剂的是( ) HCl不是氧化剂也不是还原剂的是( )
A.Zn + 2HCl == ZnCl2 + H2↑
B.NaOH + HCl == NaCl + H2O
C.MnO2 + 4HCl == MnCl2 + Cl2↑+ 2H2O
D.NH3 + HCl == NH4Cl
C
A
BD
反应物
性质
实质
特征
反应
反应产物
氧化剂
具有氧化性
得电子
化合价降低
发生还原反应(被还原)
还原产物
还原剂
具有还原性
失电子
化合价升高
发生氧化反应(被氧化)
氧化产物
口诀:升 失 氧 还原剂 ,降 得 还 氧化剂。
氧化还原反应中各概念之间的关系:
谢
谢
观
看
