1.3.3氧化还原反应课件(共20张PPT)2023-2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3.3氧化还原反应课件(共20张PPT)2023-2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 206.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-22 08:42:49 | ||
图片预览







文档简介
(共20张PPT)
氧化还原反应表示方法
导入
Fe+CuSO4=FeSO4+Cu
0 +2 +2 0
化合价上升
化合价下降
Fe:被
Cu:被
氧化
还原
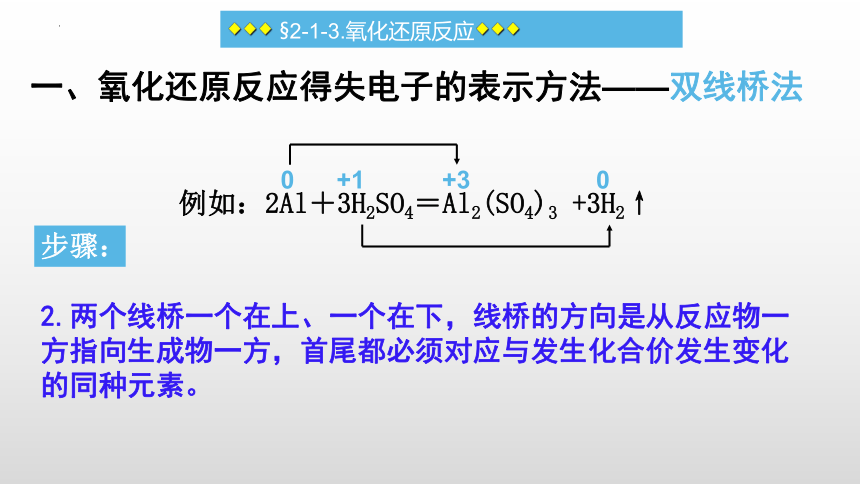
一、氧化还原反应得失电子的表示方法——双线桥法
例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑
1.正确判断各反应物、生成物各元素的化合价及其变化。
0 +1 +3 0
步骤:
一、氧化还原反应得失电子的表示方法——双线桥法
例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑
2.两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应与发生化合价发生变化的同种元素。
0 +1 +3 0
◆◆◆ §2-1-3.氧化还原反应◆◆◆
步骤:
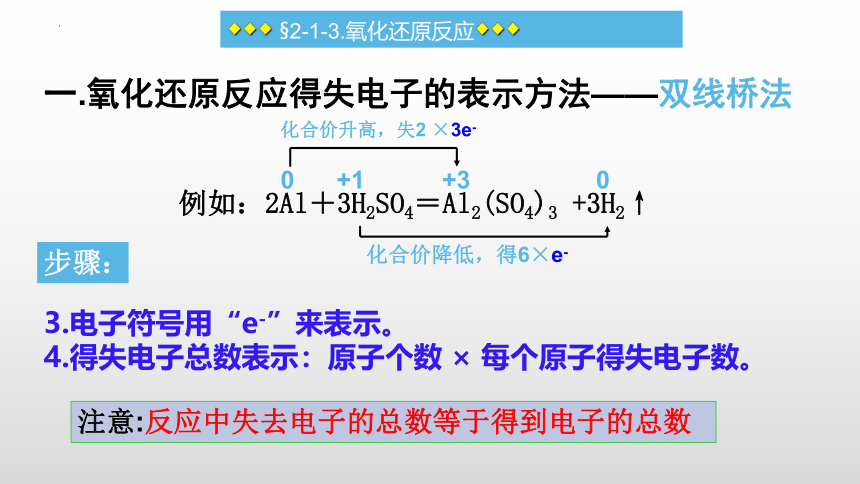
一.氧化还原反应得失电子的表示方法——双线桥法
例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑
3.电子符号用“e-”来表示。
4.得失电子总数表示:原子个数 × 每个原子得失电子数。
0 +1 +3 0
化合价升高,失2 ×3e-
化合价降低,得6×e-
◆◆◆ §2-1-3.氧化还原反应◆◆◆
步骤:
注意:反应中失去电子的总数等于得到电子的总数
氧化还原反应的表示方法
双线桥法
这种用箭头表示同一元素原子的电子转移的情况的表示方法称 “双线桥法”。
方法:
a 找出反应前后化合价发生变化的元素
b 从反应物中被氧化(或被还原)的元素指向 产物中对应的价态变化的元素
c 用e- 表示电子,注明电子得失数
d 查得失电子数是否相等
化合价升高,被氧化,失去2e-
化合价降低,被还原,得2e-
0
+1
+2
0
H2 + CuO Cu + H2O
△
练习:用双线桥法标出下列氧化还原反应中电子转移情况。
(1) 3Cu + 8HNO3 == 3Cu(NO3)2 + 2NO↑+ 4H2O
(2) 2NaBr + Cl2 == 2NaCl + Br2
0
+5
+2
+2
-1
-1
0
0
失去3×2e-,化合价升高,被氧化
得到2×3e-,化合价降低,被还原
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
练习:用双线桥法标出下列氧化还原反应中电子转移情况。
(3) 2H2S + SO2 == 3S↓ + 2H2O
(4) 2FeCl2 + Cl2 == 2FeCl3
失去2×2e-,化合价升高,被氧化
得到4e-,化合价降低,被还原
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
+4
0
-2
-1
+2
+3
0
练习:用双线桥法标出下列氧化还原反应中电子转移情况。
(5) Cl2 + 2NaOH == NaCl + NaClO + H2O
(6) 2Al + 6HCl == 2AlCl3 + 3H2↑
失去e-,化合价升高,被氧化
得到e-,化合价降低,被还原
失去2×3e-,化合价升高,被氧化
得到6×e-,化合价降低,被还原
+1
0
-1
+1
0
+3
0
2、特殊形式氧化还原反应方法及注意点
(1)某一元素部分发生氧化还原反应
MnO2 + 4HCl(浓) MnCl2 + Cl2 ↑ + 2H2O
+4 -1 +2 -1 0
得到2e-
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
0 +5 +2 +5 +2
算系数先找产物
(产物中发生化合价
变化的原子数好找)
失去2e-
失去15e-
(2)用双线桥表示歧化反应电子转移方法。
歧化反应:同一物质中同种元素的价态一部分升高、一部分降低的反应,称歧化反应。
3Cl2 + 6KOH == 5KCl + KClO3 + 3H2O
得到5e-
算系数先找产物
(产物中发生化合价
变化的原子数好找)
Cl2在此反应中起到什么作用?氧化剂和还原剂的物质的量之比为?
(3)用双线桥表示归中反应电子转移方法。
归中反应:同种元素不同价态之间发生反应,元素由高价态与低价态反应生成中间价态的物质,称归中反应。
NO + NO2 + 2NaOH = 2NaNO2 + H2O
失去1e-
得到1e-
NaNO2在此反应中为?氧化产物和还原产物的物质的量之比?
氧化产物是由什么物质而来?还原产物呢?
归中反应先找反应物
(氧化产物和还原产物
为同一物质,很难找其系数)
二、氧化还原反应得失电子的表示方法——单线桥法
单线桥法的基本写法思路:
标价态——正确注明氧化还原反应中同一元素的化合价,判断其升、降,确定电子转移数目连单线——连接方程式左边得、失电子的元素,箭头指向得电子的元素
注数目——标出转移电子的总数目
注意事项:
Ⅰ.单线桥表示反应物中变价元素原子得失电子的情况;
Ⅱ.不需标明“得”或“失”,只标明电子转移数目;
Ⅲ.箭头标明电子转移的方向;
Ⅳ.单线桥箭头从失电子的元素原子指向得电子的元素原子。
2.单线桥法:
①反应物间建桥,不标“得到”或“失去”字样;
②箭头从失去电子元素(升高)出发,指向得到电子(降低)的元素。
CuO + H2 == Cu + H2O
△
得到2e-,化合价降低,被还原
失去2×e-,化合价升高,被氧化
CuO + H2 == Cu + H2O
△
0
+1
+2
0
2e-
Fe+CuSO4=FeSO4+Cu
2e-
二、氧化还原反应得失电子的表示方法——单线桥法
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
6e-
3S+6KOH=2K2S+K2SO3+3H2O
4e-
2H2S + SO2 = 3S + 2H2O
4e-
KClO3 + 6HCl = KCl + 3Cl2 ↑ + H2O
5e-
氧化剂 + 还原剂 还原产物 + 氧化产物
-ne-
+ne-
一般: 氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
(1)根据反应方程式进行判断
氧化性和还原性强弱的判断:
H2 + CuO Cu + H2O
氧化性:
还原性:
CuO > H2O
H2 > Cu
氧化剂
还原剂
氧化产物
还原产物
价态律——元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要呈现一种性质。
谢
谢
观
看
氧化还原反应表示方法
导入
Fe+CuSO4=FeSO4+Cu
0 +2 +2 0
化合价上升
化合价下降
Fe:被
Cu:被
氧化
还原
一、氧化还原反应得失电子的表示方法——双线桥法
例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑
1.正确判断各反应物、生成物各元素的化合价及其变化。
0 +1 +3 0
步骤:
一、氧化还原反应得失电子的表示方法——双线桥法
例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑
2.两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应与发生化合价发生变化的同种元素。
0 +1 +3 0
◆◆◆ §2-1-3.氧化还原反应◆◆◆
步骤:
一.氧化还原反应得失电子的表示方法——双线桥法
例如:2Al+3H2SO4=Al2(SO4)3 +3H2↑
3.电子符号用“e-”来表示。
4.得失电子总数表示:原子个数 × 每个原子得失电子数。
0 +1 +3 0
化合价升高,失2 ×3e-
化合价降低,得6×e-
◆◆◆ §2-1-3.氧化还原反应◆◆◆
步骤:
注意:反应中失去电子的总数等于得到电子的总数
氧化还原反应的表示方法
双线桥法
这种用箭头表示同一元素原子的电子转移的情况的表示方法称 “双线桥法”。
方法:
a 找出反应前后化合价发生变化的元素
b 从反应物中被氧化(或被还原)的元素指向 产物中对应的价态变化的元素
c 用e- 表示电子,注明电子得失数
d 查得失电子数是否相等
化合价升高,被氧化,失去2e-
化合价降低,被还原,得2e-
0
+1
+2
0
H2 + CuO Cu + H2O
△
练习:用双线桥法标出下列氧化还原反应中电子转移情况。
(1) 3Cu + 8HNO3 == 3Cu(NO3)2 + 2NO↑+ 4H2O
(2) 2NaBr + Cl2 == 2NaCl + Br2
0
+5
+2
+2
-1
-1
0
0
失去3×2e-,化合价升高,被氧化
得到2×3e-,化合价降低,被还原
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
练习:用双线桥法标出下列氧化还原反应中电子转移情况。
(3) 2H2S + SO2 == 3S↓ + 2H2O
(4) 2FeCl2 + Cl2 == 2FeCl3
失去2×2e-,化合价升高,被氧化
得到4e-,化合价降低,被还原
失去2×e-,化合价升高,被氧化
得到2×e-,化合价降低,被还原
+4
0
-2
-1
+2
+3
0
练习:用双线桥法标出下列氧化还原反应中电子转移情况。
(5) Cl2 + 2NaOH == NaCl + NaClO + H2O
(6) 2Al + 6HCl == 2AlCl3 + 3H2↑
失去e-,化合价升高,被氧化
得到e-,化合价降低,被还原
失去2×3e-,化合价升高,被氧化
得到6×e-,化合价降低,被还原
+1
0
-1
+1
0
+3
0
2、特殊形式氧化还原反应方法及注意点
(1)某一元素部分发生氧化还原反应
MnO2 + 4HCl(浓) MnCl2 + Cl2 ↑ + 2H2O
+4 -1 +2 -1 0
得到2e-
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
0 +5 +2 +5 +2
算系数先找产物
(产物中发生化合价
变化的原子数好找)
失去2e-
失去15e-
(2)用双线桥表示歧化反应电子转移方法。
歧化反应:同一物质中同种元素的价态一部分升高、一部分降低的反应,称歧化反应。
3Cl2 + 6KOH == 5KCl + KClO3 + 3H2O
得到5e-
算系数先找产物
(产物中发生化合价
变化的原子数好找)
Cl2在此反应中起到什么作用?氧化剂和还原剂的物质的量之比为?
(3)用双线桥表示归中反应电子转移方法。
归中反应:同种元素不同价态之间发生反应,元素由高价态与低价态反应生成中间价态的物质,称归中反应。
NO + NO2 + 2NaOH = 2NaNO2 + H2O
失去1e-
得到1e-
NaNO2在此反应中为?氧化产物和还原产物的物质的量之比?
氧化产物是由什么物质而来?还原产物呢?
归中反应先找反应物
(氧化产物和还原产物
为同一物质,很难找其系数)
二、氧化还原反应得失电子的表示方法——单线桥法
单线桥法的基本写法思路:
标价态——正确注明氧化还原反应中同一元素的化合价,判断其升、降,确定电子转移数目连单线——连接方程式左边得、失电子的元素,箭头指向得电子的元素
注数目——标出转移电子的总数目
注意事项:
Ⅰ.单线桥表示反应物中变价元素原子得失电子的情况;
Ⅱ.不需标明“得”或“失”,只标明电子转移数目;
Ⅲ.箭头标明电子转移的方向;
Ⅳ.单线桥箭头从失电子的元素原子指向得电子的元素原子。
2.单线桥法:
①反应物间建桥,不标“得到”或“失去”字样;
②箭头从失去电子元素(升高)出发,指向得到电子(降低)的元素。
CuO + H2 == Cu + H2O
△
得到2e-,化合价降低,被还原
失去2×e-,化合价升高,被氧化
CuO + H2 == Cu + H2O
△
0
+1
+2
0
2e-
Fe+CuSO4=FeSO4+Cu
2e-
二、氧化还原反应得失电子的表示方法——单线桥法
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
6e-
3S+6KOH=2K2S+K2SO3+3H2O
4e-
2H2S + SO2 = 3S + 2H2O
4e-
KClO3 + 6HCl = KCl + 3Cl2 ↑ + H2O
5e-
氧化剂 + 还原剂 还原产物 + 氧化产物
-ne-
+ne-
一般: 氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
(1)根据反应方程式进行判断
氧化性和还原性强弱的判断:
H2 + CuO Cu + H2O
氧化性:
还原性:
CuO > H2O
H2 > Cu
氧化剂
还原剂
氧化产物
还原产物
价态律——元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要呈现一种性质。
谢
谢
观
看
