2024鲁科版新教材高中化学必修第一册同步练习--第3课时 不同价态含硫物质的转化(含解析)
文档属性
| 名称 | 2024鲁科版新教材高中化学必修第一册同步练习--第3课时 不同价态含硫物质的转化(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 349.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-22 08:58:27 | ||
图片预览



文档简介
2024鲁科版新教材高中化学必修第一册
第3课时 不同价态含硫物质的转化
基础过关练
题组一 硫及其化合物的性质
1.(2022山东潍坊期末)物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的“价—类”二维图。下列说法错误的是( )
A.c能使紫色石蕊溶液变红
B.b在纯氧中燃烧可生成d
C.g既具有氧化性也具有还原性
D.硫酸型酸雨的形成过程中会发生e到f的转化
2.(2022北京昌平期末)依据下列实验操作及现象,体现S的还原性的是( )
序号 操作 现象
A 向Na2SO3溶液中加入足量盐酸 产生气泡
B 向Na2SO3溶液中加入酸性高锰酸钾溶液 溶液褪色
C 向Na2SO3溶液中加入BaCl2溶液 产生白色沉淀
D 向Na2SO3溶液中加入酸性Na2S溶液 产生黄色沉淀
题组二 含硫物质的相互转化
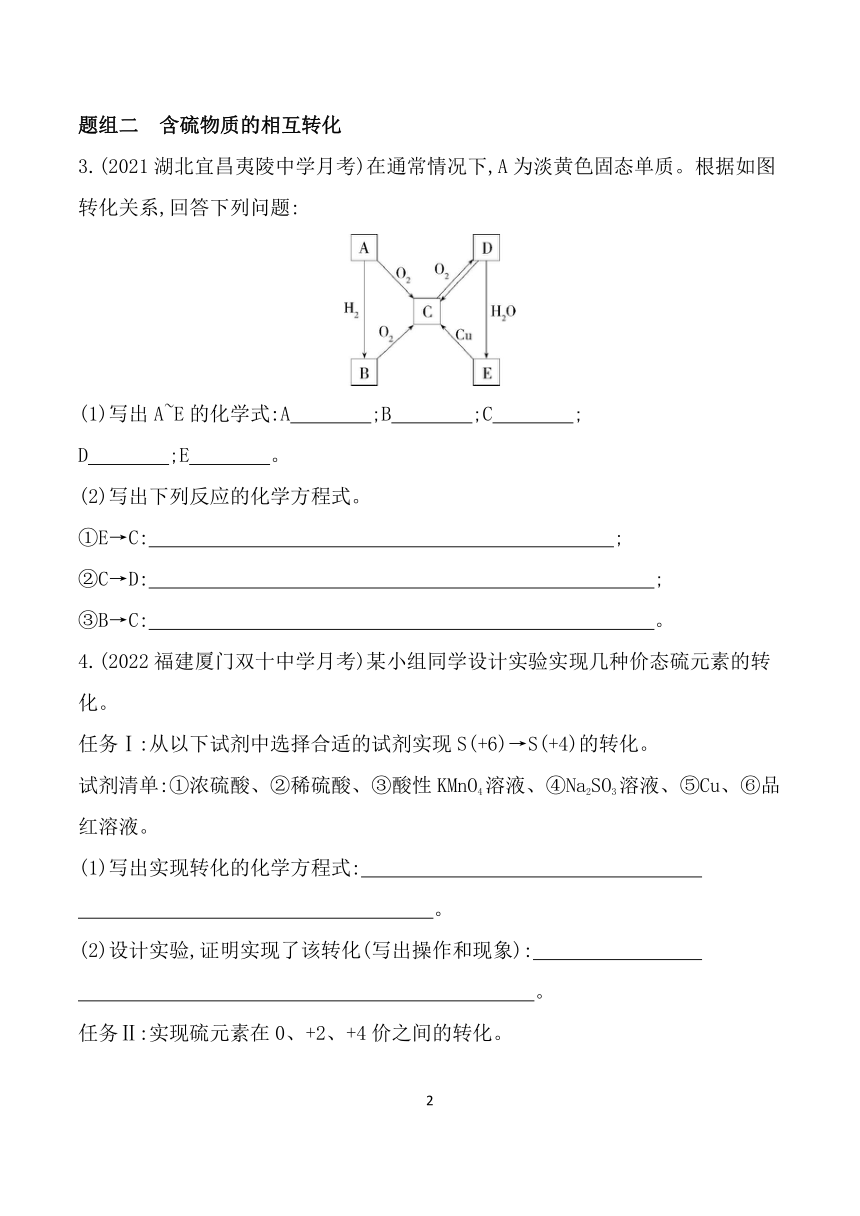
3.(2021湖北宜昌夷陵中学月考)在通常情况下,A为淡黄色固态单质。根据如图转化关系,回答下列问题:
(1)写出A~E的化学式:A ;B ;C ;
D ;E 。
(2)写出下列反应的化学方程式。
①E→C: ;
②C→D: ;
③B→C: 。
4.(2022福建厦门双十中学月考)某小组同学设计实验实现几种价态硫元素的转化。
任务Ⅰ:从以下试剂中选择合适的试剂实现S(+6)→S(+4)的转化。
试剂清单:①浓硫酸、②稀硫酸、③酸性KMnO4溶液、④Na2SO3溶液、⑤Cu、⑥品红溶液。
(1)写出实现转化的化学方程式: 。
(2)设计实验,证明实现了该转化(写出操作和现象): 。
任务Ⅱ:实现硫元素在0、+2、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
SO2 Na2SO3溶液 Na2S2O3溶液 产生淡黄色沉淀和刺激性气味的气体
(3)过程ⅰ中加入的物质是 ,该转化利用SO2具有 (填“酸性氧化物”或“碱性氧化物”)的性质。
(4)过程ⅱ中试剂X为 (填“氧化剂”或“还原剂”)。
(5)写出过程ⅲ反应的离子方程式: 。
能力提升练
题组一 不同价态含硫物质间的相互转化
1.(2022山东烟台招远二中月考)硫及其化合物的“价—类”二维图如下,请回答下列问题。
(1)自然界中有斜方硫和单斜硫,它们互为 ,它们之间的转化属于 变化。
(2)图中属于酸性氧化物的物质是 (填化学式)。
(3)不同价态的硫元素可以相互转化,请写出以下转化。
①反应前后存在3种价态的硫元素,写出反应的离子方程式: (任写一个即可)。
②反应前后存在4种价态的硫元素,写出反应的化学方程式: (任写一个即可)。
(4)如果有反应Z M,H2S N,M是下列物质中的 (填字母)。
a.Na2SO4 b.CuSO4 c.FeSO4 d.Fe2(SO4)2
写出H2S生成N的离子方程式 ;Q可以是 (用化学式表示,写出至少3类物质)。
2.(2022北京昌平期末)研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。
Ⅰ.硫元素形成的部分物质的“价—类”二维图及相互转化的部分信息如图所示。
(1)A是一种钠盐,它的电离方程式是 。通入氯气,可完成从A→B的转化,氯气做 (填“氧化剂”或“还原剂”)。
(2)D的化学式是 ,写出C→D的化学方程式: 。
(3)写出E→C的化学方程式: 。
Ⅱ.双碱法脱除烟气中SO2的过程如图所示。
(4)过程Ⅰ的化学方程式是 。
(5)过程Ⅱ中含硫元素物质发生了 反应(填“氧化”或“还原”),反应中氧化剂是 。写出该反应的化学方程式: 。
(6)该过程中可以循环利用的物质是 。
题组二 以含硫物质为载体的综合实验探究
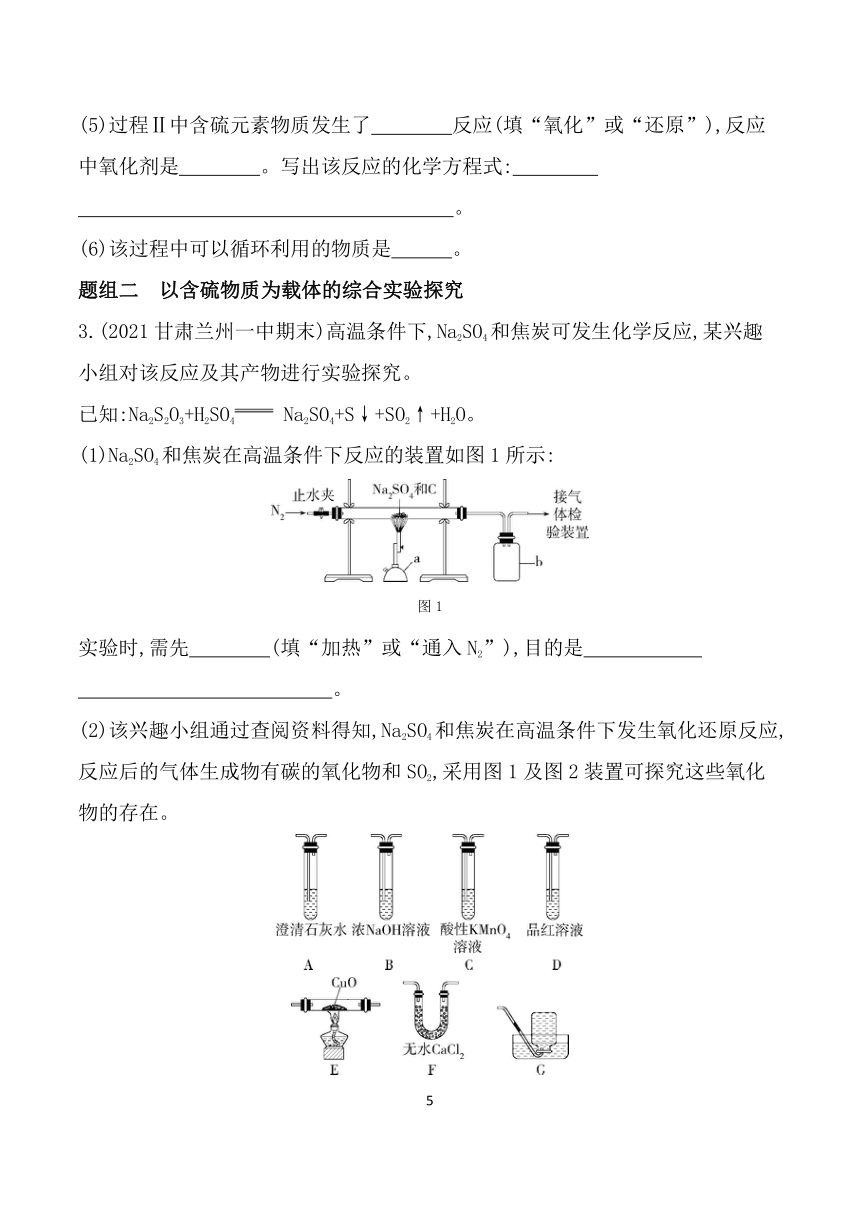
3.(2021甘肃兰州一中期末)高温条件下,Na2SO4和焦炭可发生化学反应,某兴趣小组对该反应及其产物进行实验探究。
已知:Na2S2O3+H2SO4 Na2SO4+S↓+SO2↑+H2O。
(1)Na2SO4和焦炭在高温条件下反应的装置如图1所示:
图1
实验时,需先 (填“加热”或“通入N2”),目的是 。
(2)该兴趣小组通过查阅资料得知,Na2SO4和焦炭在高温条件下发生氧化还原反应,反应后的气体生成物有碳的氧化物和SO2,采用图1及图2装置可探究这些氧化物的存在。
图2
①仪器连接的合理顺序是图1→D→C→ (仪器可重复使用)。
②酸性KMnO4溶液的作用是 ,浓NaOH溶液的作用是 。
③实验结束后,装置E中的黑色固体变为红色,则说明Na2SO4和焦炭在高温条件下反应生成的气体中有 (写化学式)。
(3)取上述实验后的固体于试管中,加少量稀硫酸,生成的气体通入盛有CuSO4溶液的试管中,溶液变黑,静置后,试管底部有少量淡黄色固体,则Na2SO4和焦炭在高温条件下反应后的固体可能是 (填字母)。
A.Na2S和Na2SO4 B.Na2S和Na2SO3
C.Na2S和Na2S2O3 D.Na2S2O3和Na2SO4
4.(2022山东烟台期末)中药常采用硫黄熏蒸法以达到防霉、防虫等目的。我国规定党参等中药SO2残留量不得超过400 mg·kg-1。某小组欲检测某药厂所售党参是否合格,查阅资料后得知:①SO2残留量是指残留硫的总量,以SO2计;②中药中残留的SO2已大部分转化为S。
(1)将200 g所售党参研碎,用500 mL 0.01 mol·L-1NaOH溶液充分浸泡,得无色浸泡液X,将X分成两等份。
①配制500 mL 0.01 mol·L-1 NaOH溶液需要的仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、试剂瓶、 ;
②用NaOH溶液浸泡的目的是 (用化学方程式表示)。
(2)甲同学取一份X溶液采用如下方案测定党参中SO2残留量:
判断BaCl2溶液已过量的操作为 ;判断沉淀是否洗净所选用的试剂为 ;党参中SO2残留量的表达式为 mg·kg-1(用含m的式子表示)。
(3)乙同学取另一份X溶液采用如下方案进行测定(整个过程无气体放出),判断该党参 (填“符合”或“不符合”)国家标准。
答案全解全析
基础过关练
1.B 根据“价—类”二维图可知,c为SO2,SO2能使紫色石蕊溶液变红,故A正确;b为硫单质,S在纯氧中燃烧只能生成SO2,故B错误;g中硫元素的化合价为+4价,处于中间价态,所以g既具有氧化性也具有还原性,故C正确;SO2与水反应生成H2SO3,H2SO3易被空气中的氧气氧化成H2SO4,故D正确。
2.B A项,向Na2SO3溶液中加入足量盐酸发生反应Na2SO3+2HCl 2NaCl+SO2↑+H2O,生成SO2气体,说明亚硫酸的酸性比HCl弱;B项,向Na2SO3溶液中加入酸性高锰酸钾溶液,溶液褪色,S将高锰酸根离子还原,体现了S的还原性;C项,向Na2SO3溶液中加入BaCl2溶液,发生复分解反应,生成亚硫酸钡白色沉淀;D项,向Na2SO3溶液中加入酸性Na2S溶液,生成硫单质,S将S2-氧化,体现了S的氧化性;故选B。
3.答案 (1)S H2S SO2 SO3 H2SO4
(2)①Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O ②2SO2+O2 2SO3 ③2H2S+3O2 2SO2+2H2O
解析 (1)通常情况下,A为淡黄色固态单质,则A为S,根据题图转化关系可知,B为H2S,C为SO2,D为SO3,E为H2SO4。(2)①E→C是铜和浓硫酸在加热条件下反应,化学方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;②C→D是二氧化硫和氧气在催化剂、加热条件下反应生成三氧化硫,化学方程式为2SO2+O2 2SO3;③B→C是硫化氢在氧气中燃烧,化学方程式为2H2S+3O2 2SO2+2H2O。
4.答案 (1)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(2)将产生的气体通入品红溶液中,溶液褪色,加热又恢复红色
(3)NaOH溶液 酸性氧化物
(4)还原剂
(5)2H++S2 S↓+SO2↑+H2O
解析 (1)铜与浓硫酸在加热条件下反应生成CuSO4、SO2和H2O,化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。(2)证明实现S(+6)→S(+4)的转化,只要证明有SO2生成即可。(3)SO2是酸性氧化物,与碱反应生成盐和水,根据过程ⅰ可知,SO2与NaOH溶液反应生成Na2SO3。(4)Na2SO3中硫元素的化合价为+4价,Na2S2O3中硫元素的化合价为+2价,Na2SO3→Na2S2O3过程中硫元素的化合价降低,所以实现过程ⅱ转化需要加还原剂。(5)Na2S2O3中硫元素的化合价为+2价,根据“+2价硫在酸性条件下不稳定,易发生自身氧化还原反应”和“产生淡黄色沉淀和刺激性气味的气体”可知,S2与H+反应生成了S、SO2和H2O,反应的离子方程式为2H++S2 S↓+SO2↑+H2O。
能力提升练
1.答案 (1)同素异形体 化学
(2)SO2、SO3
(3)①3S+6OH- 2S2-+S+3H2O(或2S2-+S+6H+ 3S↓+3H2O) ②H2S+H2SO4(浓) S↓+SO2↑+2H2O
(4)b H2S+Cu2+ CuS↓+2H+ Cu、CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3
解析 (1)斜方硫和单斜硫是由硫元素组成的不同单质,互为同素异形体,两者间的转化属于化学变化。(2)根据“价—类”二维图可知X、Y对应的氧化物分别为SO2、SO3,均属于酸性氧化物。(3)①反应前后存在三种价态的硫元素,可能是在反应中同一物质中硫元素的化合价部分升高、降低,如3S+6OH- 2S2-+S+3H2O;也可能是两种含不同价态硫元素的物质反应转化为一种含有硫元素的物质,如2S2-+S+6H+ 3S↓+3H2O等。②反应前后存在四种价态的硫元素的反应可能为H2S+H2SO4(浓) S↓+SO2↑+2H2O。(4)根据“价—类”二维图可知Z为H2SO4,N为金属硫化物,根据“Z M”可知,M为硫酸盐;H2S与Na2SO4、FeSO4不反应,H2S与Fe2(SO4)3发生氧化还原反应不能生成金属硫化物,H2S与CuSO4反应能生成CuS,符合“H2S N”的转化,故选b;H2S与CuSO4反应的离子方程式为H2S+Cu2+ CuS↓+2H+;M为CuSO4,实现H2SO4→ CuSO4转化的物质可以是Cu、CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3等。
2.答案 (1)Na2S 2Na++S2- 氧化剂
(2)H2SO3 SO2+H2O H2SO3
(3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
(4)SO2+2NaOH Na2SO3+H2O
(5)氧化 O2 2Ca(OH)2+O2+2Na2SO3 4NaOH+2CaSO4
(6)NaOH
解析 钠盐A中硫元素的化合价为-2价,则A为Na2S;根据“价—类”二维图及相互转化关系可知,B为S单质,C为SO2,D为H2SO3,E为H2SO4。(1)Na2S的电离方程式为Na2S 2Na++S2-;在Na2S溶液中通入氯气,发生反应Na2S+Cl2 2NaCl+S↓,氯元素化合价降低,氯气做氧化剂。(2)D是H2SO3、C是SO2,SO2和水反应生成H2SO3,反应的化学方程式为SO2+H2O H2SO3。(3)浓硫酸和铜在加热条件下反应的化学方程式是Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。(4)根据图示可知,过程Ⅰ是SO2和NaOH反应生成Na2SO3和H2O,反应的化学方程式是SO2+2NaOH Na2SO3+H2O。(5)过程Ⅱ中Na2SO3、O2、Ca(OH)2反应生成CaSO4和NaOH,反应的化学方程式是2Ca(OH)2+O2+2Na2SO3 4NaOH+2CaSO4。(6)过程Ⅰ消耗氢氧化钠、过程Ⅱ生成氢氧化钠,该过程中可以循环利用的物质是NaOH。
3.答案 (1)通入N2 排尽装置中的空气
(2)①D→A→B→A→F→E→A→G ②除去SO2 除去CO2 ③CO
(3)BC
解析 实验前,装置中有空气,会干扰Na2SO4和焦炭的反应,所以实验时,要先通入N2,排尽装置中的空气;Na2SO4和焦炭反应生成的气体产物通过图2中装置检验,检验气体的顺序是SO2→CO2→CO。
(1)根据上述分析可知,实验时,要先通入N2,排尽装置中的空气。
(2)①检验气体的顺序是SO2→CO2→CO,故仪器连接顺序为图1→D→C→D→A→B→A→F→E→A→G。②利用酸性KMnO4溶液的氧化性除去SO2,NaOH溶液与CO2反应,达到除去CO2的目的。③装置E中的固体由黑色变为红色,说明Na2SO4和焦炭在高温下反应生成的气体中含有还原性气体,该气体为CO。
(3)CuSO4溶液变黑,说明生成CuS沉淀;有淡黄色固体生成,说明生成S;结合反应2H2S+SO2 3S↓+2H2O可以推知:取实验后的固体于试管中,加少量稀硫酸,生成的气体一定有H2S,可能有SO2。Na2S和稀硫酸反应可生成H2S,但Na2SO4不能和稀硫酸反应,不符合条件,故A不选;Na2S和稀硫酸反应生成H2S,Na2SO3和稀硫酸反应生成二氧化硫,符合条件,故B选;Na2S和稀硫酸反应生成H2S,Na2S2O3和稀硫酸反应生成二氧化硫,符合条件,故C选;Na2S2O3和稀硫酸反应生成二氧化硫,Na2SO4不能和稀硫酸反应,不符合条件,故D不选。
4.答案 (1)①胶头滴管、500 mL容量瓶 ②SO2+2NaOH Na2SO3+H2O
(2)静置片刻,向上层清液中继续滴加BaCl2溶液,无白色沉淀生成,证明BaCl2已过量 稀HNO3、AgNO3溶液
(3)不符合
解析 (1)①配制500 mL 0.01 mol·L-1NaOH溶液,除题述仪器外,还需要胶头滴管、500 mL容量瓶;②用NaOH溶液浸泡是为了吸收SO2,反应的化学方程式为SO2+2NaOH Na2SO3+H2O。(2)证明BaCl2溶液已过量则需要证明溶液中不存在S,实验操作为静置片刻,向上层清液中继续滴加BaCl2溶液,无白色沉淀生成,证明BaCl2已过量;判断沉淀是否洗净即证明是否存在Cl-,所选用的试剂为稀HNO3和AgNO3溶液;BaSO4的质量为m g,所以n(S)=n(BaSO4)= mol,由得失电子守恒可得关系式SO2~H2O2~S,所以n(SO2)= mol,质量为 g,所以党参中SO2残留量的表达式为 mg·kg-1。(3)m(SO2残留量)=0.005 L×0.100 0 mol·L-1××64 g·mol-1×1 000 mg·g-1/0.1 kg=800 mg·kg-1,大于400 mg·kg-1,不符合国家标准。
12
第3课时 不同价态含硫物质的转化
基础过关练
题组一 硫及其化合物的性质
1.(2022山东潍坊期末)物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的“价—类”二维图。下列说法错误的是( )
A.c能使紫色石蕊溶液变红
B.b在纯氧中燃烧可生成d
C.g既具有氧化性也具有还原性
D.硫酸型酸雨的形成过程中会发生e到f的转化
2.(2022北京昌平期末)依据下列实验操作及现象,体现S的还原性的是( )
序号 操作 现象
A 向Na2SO3溶液中加入足量盐酸 产生气泡
B 向Na2SO3溶液中加入酸性高锰酸钾溶液 溶液褪色
C 向Na2SO3溶液中加入BaCl2溶液 产生白色沉淀
D 向Na2SO3溶液中加入酸性Na2S溶液 产生黄色沉淀
题组二 含硫物质的相互转化
3.(2021湖北宜昌夷陵中学月考)在通常情况下,A为淡黄色固态单质。根据如图转化关系,回答下列问题:
(1)写出A~E的化学式:A ;B ;C ;
D ;E 。
(2)写出下列反应的化学方程式。
①E→C: ;
②C→D: ;
③B→C: 。
4.(2022福建厦门双十中学月考)某小组同学设计实验实现几种价态硫元素的转化。
任务Ⅰ:从以下试剂中选择合适的试剂实现S(+6)→S(+4)的转化。
试剂清单:①浓硫酸、②稀硫酸、③酸性KMnO4溶液、④Na2SO3溶液、⑤Cu、⑥品红溶液。
(1)写出实现转化的化学方程式: 。
(2)设计实验,证明实现了该转化(写出操作和现象): 。
任务Ⅱ:实现硫元素在0、+2、+4价之间的转化。
查阅资料:+2价硫在酸性条件下不稳定,易发生自身氧化还原反应。
SO2 Na2SO3溶液 Na2S2O3溶液 产生淡黄色沉淀和刺激性气味的气体
(3)过程ⅰ中加入的物质是 ,该转化利用SO2具有 (填“酸性氧化物”或“碱性氧化物”)的性质。
(4)过程ⅱ中试剂X为 (填“氧化剂”或“还原剂”)。
(5)写出过程ⅲ反应的离子方程式: 。
能力提升练
题组一 不同价态含硫物质间的相互转化
1.(2022山东烟台招远二中月考)硫及其化合物的“价—类”二维图如下,请回答下列问题。
(1)自然界中有斜方硫和单斜硫,它们互为 ,它们之间的转化属于 变化。
(2)图中属于酸性氧化物的物质是 (填化学式)。
(3)不同价态的硫元素可以相互转化,请写出以下转化。
①反应前后存在3种价态的硫元素,写出反应的离子方程式: (任写一个即可)。
②反应前后存在4种价态的硫元素,写出反应的化学方程式: (任写一个即可)。
(4)如果有反应Z M,H2S N,M是下列物质中的 (填字母)。
a.Na2SO4 b.CuSO4 c.FeSO4 d.Fe2(SO4)2
写出H2S生成N的离子方程式 ;Q可以是 (用化学式表示,写出至少3类物质)。
2.(2022北京昌平期末)研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。
Ⅰ.硫元素形成的部分物质的“价—类”二维图及相互转化的部分信息如图所示。
(1)A是一种钠盐,它的电离方程式是 。通入氯气,可完成从A→B的转化,氯气做 (填“氧化剂”或“还原剂”)。
(2)D的化学式是 ,写出C→D的化学方程式: 。
(3)写出E→C的化学方程式: 。
Ⅱ.双碱法脱除烟气中SO2的过程如图所示。
(4)过程Ⅰ的化学方程式是 。
(5)过程Ⅱ中含硫元素物质发生了 反应(填“氧化”或“还原”),反应中氧化剂是 。写出该反应的化学方程式: 。
(6)该过程中可以循环利用的物质是 。
题组二 以含硫物质为载体的综合实验探究
3.(2021甘肃兰州一中期末)高温条件下,Na2SO4和焦炭可发生化学反应,某兴趣小组对该反应及其产物进行实验探究。
已知:Na2S2O3+H2SO4 Na2SO4+S↓+SO2↑+H2O。
(1)Na2SO4和焦炭在高温条件下反应的装置如图1所示:
图1
实验时,需先 (填“加热”或“通入N2”),目的是 。
(2)该兴趣小组通过查阅资料得知,Na2SO4和焦炭在高温条件下发生氧化还原反应,反应后的气体生成物有碳的氧化物和SO2,采用图1及图2装置可探究这些氧化物的存在。
图2
①仪器连接的合理顺序是图1→D→C→ (仪器可重复使用)。
②酸性KMnO4溶液的作用是 ,浓NaOH溶液的作用是 。
③实验结束后,装置E中的黑色固体变为红色,则说明Na2SO4和焦炭在高温条件下反应生成的气体中有 (写化学式)。
(3)取上述实验后的固体于试管中,加少量稀硫酸,生成的气体通入盛有CuSO4溶液的试管中,溶液变黑,静置后,试管底部有少量淡黄色固体,则Na2SO4和焦炭在高温条件下反应后的固体可能是 (填字母)。
A.Na2S和Na2SO4 B.Na2S和Na2SO3
C.Na2S和Na2S2O3 D.Na2S2O3和Na2SO4
4.(2022山东烟台期末)中药常采用硫黄熏蒸法以达到防霉、防虫等目的。我国规定党参等中药SO2残留量不得超过400 mg·kg-1。某小组欲检测某药厂所售党参是否合格,查阅资料后得知:①SO2残留量是指残留硫的总量,以SO2计;②中药中残留的SO2已大部分转化为S。
(1)将200 g所售党参研碎,用500 mL 0.01 mol·L-1NaOH溶液充分浸泡,得无色浸泡液X,将X分成两等份。
①配制500 mL 0.01 mol·L-1 NaOH溶液需要的仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、试剂瓶、 ;
②用NaOH溶液浸泡的目的是 (用化学方程式表示)。
(2)甲同学取一份X溶液采用如下方案测定党参中SO2残留量:
判断BaCl2溶液已过量的操作为 ;判断沉淀是否洗净所选用的试剂为 ;党参中SO2残留量的表达式为 mg·kg-1(用含m的式子表示)。
(3)乙同学取另一份X溶液采用如下方案进行测定(整个过程无气体放出),判断该党参 (填“符合”或“不符合”)国家标准。
答案全解全析
基础过关练
1.B 根据“价—类”二维图可知,c为SO2,SO2能使紫色石蕊溶液变红,故A正确;b为硫单质,S在纯氧中燃烧只能生成SO2,故B错误;g中硫元素的化合价为+4价,处于中间价态,所以g既具有氧化性也具有还原性,故C正确;SO2与水反应生成H2SO3,H2SO3易被空气中的氧气氧化成H2SO4,故D正确。
2.B A项,向Na2SO3溶液中加入足量盐酸发生反应Na2SO3+2HCl 2NaCl+SO2↑+H2O,生成SO2气体,说明亚硫酸的酸性比HCl弱;B项,向Na2SO3溶液中加入酸性高锰酸钾溶液,溶液褪色,S将高锰酸根离子还原,体现了S的还原性;C项,向Na2SO3溶液中加入BaCl2溶液,发生复分解反应,生成亚硫酸钡白色沉淀;D项,向Na2SO3溶液中加入酸性Na2S溶液,生成硫单质,S将S2-氧化,体现了S的氧化性;故选B。
3.答案 (1)S H2S SO2 SO3 H2SO4
(2)①Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O ②2SO2+O2 2SO3 ③2H2S+3O2 2SO2+2H2O
解析 (1)通常情况下,A为淡黄色固态单质,则A为S,根据题图转化关系可知,B为H2S,C为SO2,D为SO3,E为H2SO4。(2)①E→C是铜和浓硫酸在加热条件下反应,化学方程式为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;②C→D是二氧化硫和氧气在催化剂、加热条件下反应生成三氧化硫,化学方程式为2SO2+O2 2SO3;③B→C是硫化氢在氧气中燃烧,化学方程式为2H2S+3O2 2SO2+2H2O。
4.答案 (1)Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
(2)将产生的气体通入品红溶液中,溶液褪色,加热又恢复红色
(3)NaOH溶液 酸性氧化物
(4)还原剂
(5)2H++S2 S↓+SO2↑+H2O
解析 (1)铜与浓硫酸在加热条件下反应生成CuSO4、SO2和H2O,化学方程式为Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。(2)证明实现S(+6)→S(+4)的转化,只要证明有SO2生成即可。(3)SO2是酸性氧化物,与碱反应生成盐和水,根据过程ⅰ可知,SO2与NaOH溶液反应生成Na2SO3。(4)Na2SO3中硫元素的化合价为+4价,Na2S2O3中硫元素的化合价为+2价,Na2SO3→Na2S2O3过程中硫元素的化合价降低,所以实现过程ⅱ转化需要加还原剂。(5)Na2S2O3中硫元素的化合价为+2价,根据“+2价硫在酸性条件下不稳定,易发生自身氧化还原反应”和“产生淡黄色沉淀和刺激性气味的气体”可知,S2与H+反应生成了S、SO2和H2O,反应的离子方程式为2H++S2 S↓+SO2↑+H2O。
能力提升练
1.答案 (1)同素异形体 化学
(2)SO2、SO3
(3)①3S+6OH- 2S2-+S+3H2O(或2S2-+S+6H+ 3S↓+3H2O) ②H2S+H2SO4(浓) S↓+SO2↑+2H2O
(4)b H2S+Cu2+ CuS↓+2H+ Cu、CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3
解析 (1)斜方硫和单斜硫是由硫元素组成的不同单质,互为同素异形体,两者间的转化属于化学变化。(2)根据“价—类”二维图可知X、Y对应的氧化物分别为SO2、SO3,均属于酸性氧化物。(3)①反应前后存在三种价态的硫元素,可能是在反应中同一物质中硫元素的化合价部分升高、降低,如3S+6OH- 2S2-+S+3H2O;也可能是两种含不同价态硫元素的物质反应转化为一种含有硫元素的物质,如2S2-+S+6H+ 3S↓+3H2O等。②反应前后存在四种价态的硫元素的反应可能为H2S+H2SO4(浓) S↓+SO2↑+2H2O。(4)根据“价—类”二维图可知Z为H2SO4,N为金属硫化物,根据“Z M”可知,M为硫酸盐;H2S与Na2SO4、FeSO4不反应,H2S与Fe2(SO4)3发生氧化还原反应不能生成金属硫化物,H2S与CuSO4反应能生成CuS,符合“H2S N”的转化,故选b;H2S与CuSO4反应的离子方程式为H2S+Cu2+ CuS↓+2H+;M为CuSO4,实现H2SO4→ CuSO4转化的物质可以是Cu、CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3等。
2.答案 (1)Na2S 2Na++S2- 氧化剂
(2)H2SO3 SO2+H2O H2SO3
(3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
(4)SO2+2NaOH Na2SO3+H2O
(5)氧化 O2 2Ca(OH)2+O2+2Na2SO3 4NaOH+2CaSO4
(6)NaOH
解析 钠盐A中硫元素的化合价为-2价,则A为Na2S;根据“价—类”二维图及相互转化关系可知,B为S单质,C为SO2,D为H2SO3,E为H2SO4。(1)Na2S的电离方程式为Na2S 2Na++S2-;在Na2S溶液中通入氯气,发生反应Na2S+Cl2 2NaCl+S↓,氯元素化合价降低,氯气做氧化剂。(2)D是H2SO3、C是SO2,SO2和水反应生成H2SO3,反应的化学方程式为SO2+H2O H2SO3。(3)浓硫酸和铜在加热条件下反应的化学方程式是Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。(4)根据图示可知,过程Ⅰ是SO2和NaOH反应生成Na2SO3和H2O,反应的化学方程式是SO2+2NaOH Na2SO3+H2O。(5)过程Ⅱ中Na2SO3、O2、Ca(OH)2反应生成CaSO4和NaOH,反应的化学方程式是2Ca(OH)2+O2+2Na2SO3 4NaOH+2CaSO4。(6)过程Ⅰ消耗氢氧化钠、过程Ⅱ生成氢氧化钠,该过程中可以循环利用的物质是NaOH。
3.答案 (1)通入N2 排尽装置中的空气
(2)①D→A→B→A→F→E→A→G ②除去SO2 除去CO2 ③CO
(3)BC
解析 实验前,装置中有空气,会干扰Na2SO4和焦炭的反应,所以实验时,要先通入N2,排尽装置中的空气;Na2SO4和焦炭反应生成的气体产物通过图2中装置检验,检验气体的顺序是SO2→CO2→CO。
(1)根据上述分析可知,实验时,要先通入N2,排尽装置中的空气。
(2)①检验气体的顺序是SO2→CO2→CO,故仪器连接顺序为图1→D→C→D→A→B→A→F→E→A→G。②利用酸性KMnO4溶液的氧化性除去SO2,NaOH溶液与CO2反应,达到除去CO2的目的。③装置E中的固体由黑色变为红色,说明Na2SO4和焦炭在高温下反应生成的气体中含有还原性气体,该气体为CO。
(3)CuSO4溶液变黑,说明生成CuS沉淀;有淡黄色固体生成,说明生成S;结合反应2H2S+SO2 3S↓+2H2O可以推知:取实验后的固体于试管中,加少量稀硫酸,生成的气体一定有H2S,可能有SO2。Na2S和稀硫酸反应可生成H2S,但Na2SO4不能和稀硫酸反应,不符合条件,故A不选;Na2S和稀硫酸反应生成H2S,Na2SO3和稀硫酸反应生成二氧化硫,符合条件,故B选;Na2S和稀硫酸反应生成H2S,Na2S2O3和稀硫酸反应生成二氧化硫,符合条件,故C选;Na2S2O3和稀硫酸反应生成二氧化硫,Na2SO4不能和稀硫酸反应,不符合条件,故D不选。
4.答案 (1)①胶头滴管、500 mL容量瓶 ②SO2+2NaOH Na2SO3+H2O
(2)静置片刻,向上层清液中继续滴加BaCl2溶液,无白色沉淀生成,证明BaCl2已过量 稀HNO3、AgNO3溶液
(3)不符合
解析 (1)①配制500 mL 0.01 mol·L-1NaOH溶液,除题述仪器外,还需要胶头滴管、500 mL容量瓶;②用NaOH溶液浸泡是为了吸收SO2,反应的化学方程式为SO2+2NaOH Na2SO3+H2O。(2)证明BaCl2溶液已过量则需要证明溶液中不存在S,实验操作为静置片刻,向上层清液中继续滴加BaCl2溶液,无白色沉淀生成,证明BaCl2已过量;判断沉淀是否洗净即证明是否存在Cl-,所选用的试剂为稀HNO3和AgNO3溶液;BaSO4的质量为m g,所以n(S)=n(BaSO4)= mol,由得失电子守恒可得关系式SO2~H2O2~S,所以n(SO2)= mol,质量为 g,所以党参中SO2残留量的表达式为 mg·kg-1。(3)m(SO2残留量)=0.005 L×0.100 0 mol·L-1××64 g·mol-1×1 000 mg·g-1/0.1 kg=800 mg·kg-1,大于400 mg·kg-1,不符合国家标准。
12
