2024鲁科版新教材高中化学选择性必修1同步练习--第2课时 电解原理的工业应用(含解析)
文档属性
| 名称 | 2024鲁科版新教材高中化学选择性必修1同步练习--第2课时 电解原理的工业应用(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 551.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-22 00:00:00 | ||
图片预览




文档简介
2024鲁科版新教材高中化学选择性必修1
第2课时 电解原理的工业应用
基础过关练
题组一 氯碱工业
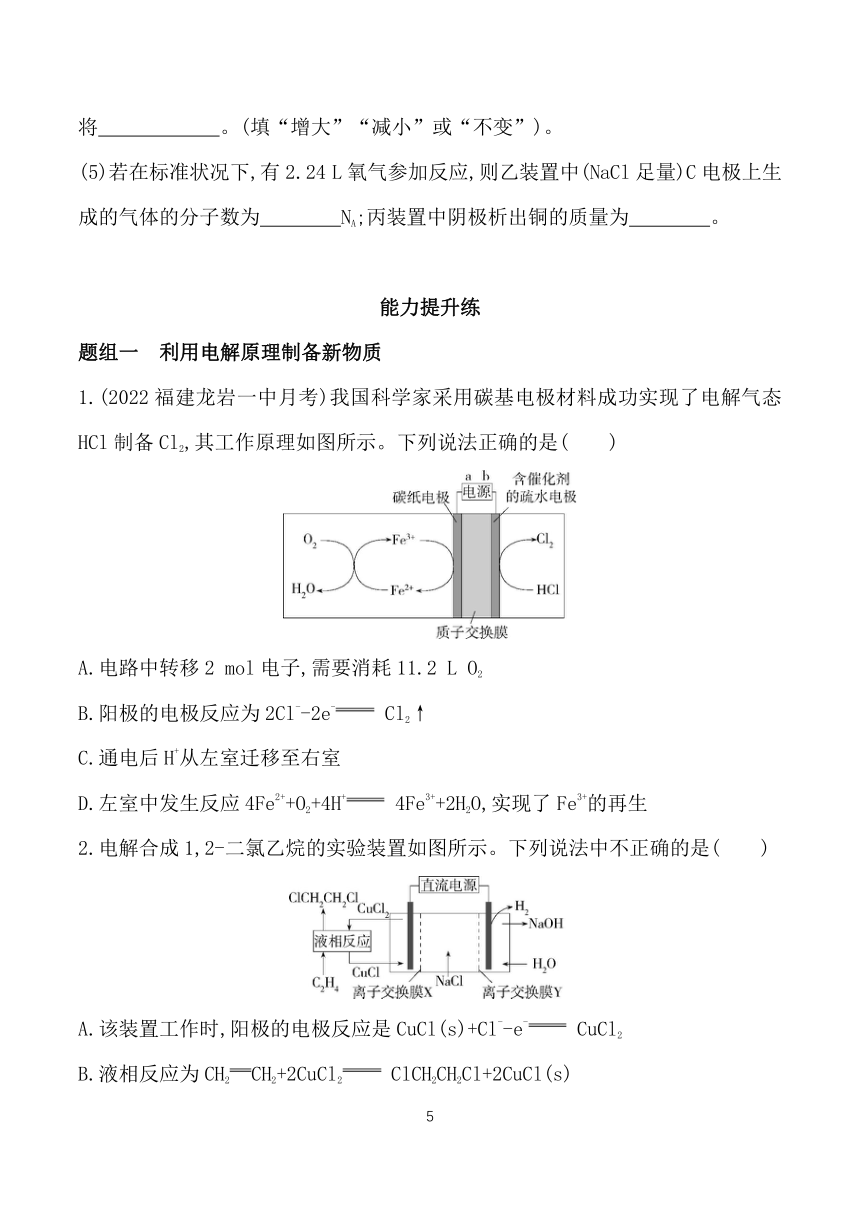
1.如图为电解饱和食盐水的简易装置,下列有关说法正确的是( )
A.通电一段时间后,向蛋壳内的溶液中滴加几滴酚酞试液,溶液呈红色
B.蛋壳表面缠绕的铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠接触
2.如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )
A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为Cl-+2H+ Cl2↑+H2↑
D.该装置是将电能转化为化学能的装置
3.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置,c、d都为石墨电极。回答下列问题:
(1)a为电源的 (填“正”或“负”)极,c为电解池的 极(填“阴”或“阳”)。
(2)d电极上的电极反应式为 ,电解产生消毒液的总反应式为 。
题组二 电解精炼
4.(2021福建三明一中月考)金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+A.阳极发生还原反应,其电极反应:Ni2++2e- Ni
B.电解过程中,阳极减少的质量与阴极增加的质量相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
题组三 电镀
5.(2021黑龙江、吉林两省十校联考)下列有关铜片镀银的说法不正确的是( )
A.阳极的电极反应为Ag-e- Ag+
B.铜片应与电源正极相连
C.电解液为AgNO3溶液
D.镀银过程中电能转化为化学能
6.下列关于电解精炼铜与电镀的说法正确的是( )
A.电解精炼铜时,将电能转化为化学能,电路中每通过2 mol e-,阳极就会溶解64 g铜
B.电解精炼铜时,阳极为粗铜,阴极为精铜,电解过程中电解质溶液中Cu2+的浓度不变
C.在铁制器皿上镀铝,熔融氧化铝作电解质,铁制器皿作阴极,铝棒作阳极
D.电镀过程中电镀液必须不断更换题组四 电解冶炼
7.在冶金工业中,钠、镁、铝等金属常用电解法制备,其原因是( )
A.都属于轻金属
B.都属于活泼金属
C.成本低廉
D.这些金属的化合物熔点较低
8.(2021北京首都师大附中入学考试)下列叙述不正确的是( )
①工业上用电解氯化钠溶液的方法制取钠
②可以用钠加入氯化镁的饱和溶液中制取金属镁
③用于电解冶炼铝的原料是氯化铝
④炭在高温下能还原氧化镁制取镁
A.①②③④ B.①②③ C.①③ D.①
9.(2021黑龙江哈尔滨期中)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法不正确的是( )
A.由TiO2制得1 mol金属Ti,理论上外电路转移4 mol电子
B.阳极的电极反应式为2O2--4e- O2↑
C.在制备金属钛前后,整套装置中CaO的总量不会减少
D.装置中石墨电极材料需要定期更换
题组五 电解原理的综合应用
10.(2021四川南充阆中中学期中)如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答下列问题:
(1)通入氢气的电极为 (填“正极”或“负极”),正极的电极反应为 。
(2)石墨电极(C)为 (填“阳极”或“阴极”),铁电极的电极反应为 。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在 (填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银、金等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将 。(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中(NaCl足量)C电极上生成的气体的分子数为 NA;丙装置中阴极析出铜的质量为 。
能力提升练
题组一 利用电解原理制备新物质
1.(2022福建龙岩一中月考)我国科学家采用碳基电极材料成功实现了电解气态HCl制备Cl2,其工作原理如图所示。下列说法正确的是( )
A.电路中转移2 mol电子,需要消耗11.2 L O2
B.阳极的电极反应为2Cl--2e- Cl2↑
C.通电后H+从左室迁移至右室
D.左室中发生反应4Fe2++O2+4H+ 4Fe3++2H2O,实现了Fe3+的再生
2.电解合成1,2-二氯乙烷的实验装置如图所示。下列说法中不正确的是( )
A.该装置工作时,阳极的电极反应是CuCl(s)+Cl--e- CuCl2
B.液相反应为CH2CH2+2CuCl2 ClCH2CH2Cl+2CuCl(s)
C.X、Y依次为阳离子交换膜、阴离子交换膜
D.该装置总反应为CH2CH2+2NaCl+2H2O ClCH2CH2Cl+2NaOH+H2↑
题组二 利用电解原理处理废水、废气
3.煤电解脱硫装置如图,下列说法错误的是( )
A.a为正极
B.阴极的电极反应式为Mn3++e- Mn2+
C.电解开始时,观察到阴极石墨棒上有无色气体产生
D.理论上,电路中每转移15 mol电子,可处理1 mol FeS2
4.电浮选凝聚法处理酸性污水的工作原理如图所示。下列说法不正确的是( )
A.铁电极的电极反应式为Fe-2e- Fe2+
B.污水中的阴离子向石墨电极移动
C.通入甲烷的石墨电极的电极反应式为CH4+4C-8e- 5CO2+2H2O
D.为了增强污水的导电能力,可向污水中加入适量工业盐亚硝酸钠
题组三 膜电解技术的应用
5.(2022山东实验中学期中)一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是( )
A.b为直流电源的负极
B.阴极反应式为2H++2e- H2↑
C.工作时,乙池中溶液的pH不变
D.若有1 mol离子通过A膜,理论上阳极生成0.25 mol气体
6.采用双极膜电渗析一步法由盐制酸碱的技术进入了工业化阶段,某科研小组研究采用BMED膜堆(如图所示),模拟以精制浓海水为原料直接制备酸和碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(A、D)。已知:在直流电源的作用下,双极膜内中间界面层发生水的解离生成H+和OH-。下列说法不正确的是( )
A.电极b连接电源的负极
B.Ⅱ室口排出的是淡水
C.电解质选用Na2SO4,可避免有害气体的产生
D.C为阴离子交换膜
题组四 电解原理在生产、生活中应用的综合考查
7.(2022山东济钢高中教学检测)已知实验装置如图所示,下列判断不正确的是( )
A.若为电解精炼铜,则a极是粗铜,电解质溶液浓度随着电解过程会减小
B.若在铁钉上镀铜,则a极是镀件,电解质溶液可用CuSO4溶液
C.若用此装置防止铁被腐蚀,则b极是铁,a极可用惰性电极
D.若用此装置电解饱和食盐水,则a极产生的气体能使湿润的淀粉KI试纸变蓝
8.(2021河南省实验中学期中)电化学方法是化工生产及生活中常用的一种方法。回答下列问题:
(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。用电解法制取ClO2的新工艺如图所示。
①图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。产生ClO2的电极应连接电源的 (填“正极”或“负极”),对应的电极反应为 。
②a极区pH (填“增大”“减小”或“不变”)。
③图中应使用 (填“阴”或“阳”)离子交换膜。
(2)电解K2MnO4溶液制备KMnO4。工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为
。用镍片作阳极(镍不参与反应),铁板为阴极,电解K2MnO4溶液可制备KMnO4。上述过程用流程图表示如下:
则D的化学式为 ;阳极的电极反应为
。
答案全解全析
基础过关练
1.D 2.C 4.D 5.B 6.C 7.B 8.A 9.B
1.D 电解饱和食盐水时碳棒作阳极,铁丝作阴极,阳极反应式为2Cl--2e- Cl2↑,少量Cl2溶解在溶液中,使溶液显酸性,滴入酚酞试液,溶液不变红色,A错误;阴极反应式为2H2O+2e- H2↑+2OH-(或2H++2e- H2↑),铁丝自身并未发生反应,B错误;铁丝表面生成的气体是氢气,不能使湿润的淀粉碘化钾试纸变蓝,C错误;蛋壳将两极产物分开,防止产物之间发生反应,D正确。
2.C 由题图可知①处的物质为电解池阳极产生的氯气,②处的物质为电解池阴极产生的氢气,A正确;题图中的离子交换膜只能让阳离子通过,不能让阴离子通过,能防止氯气与氢氧化钠反应,且在阴极区得到浓度较高的氢氧化钠溶液,B正确;电解饱和食盐水的离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-,C错误;该装置是将电能转化为化学能的装置,D正确。
3.答案 (1)负 阳 (2)2H2O+2e- H2↑+2OH-(或2H++2e- H2↑) NaCl+H2O NaClO+H2↑
解析 要生成NaClO,Cl2需被NaOH充分吸收,则应在c电极上产生Cl2,故a为负极,b为正极,c为阳极,d为阴极。
4.D 阳极发生氧化反应,电极反应为Ni-2e- Ni2+、Fe-2e- Fe2+、Zn-2e- Zn2+,故A错误;电解过程中阳极上Fe、Zn、Ni放电,阴极上析出的是镍,根据得失电子守恒,可知阳极减少的质量与阴极增加的质量不相等,故B错误;电解后,溶液中存在的金属阳离子有Fe2+、Zn2+、Ni2+,故C错误;粗镍中含有少量Fe、Zn、Cu、Pt等杂质,铜和铂不放电,沉降电解池底部形成阳极泥,所以电解后,电解槽底部的阳极泥中只有Cu和Pt,故D正确。
5.B 铜片镀银时,Ag作阳极、Cu作阴极,电解液为AgNO3溶液,阳极的电极反应式为Ag-e- Ag+,故A、C正确;Cu作阴极,与电源的负极相连,故B不正确;铜片镀银是利用电解原理,镀银过程中电能转化为化学能,故D正确。
6.C 电解精炼铜时,阳极为粗铜,比铜活泼的金属杂质也会反应,电解初期,电路中每通过2 mol e-,阳极溶解的铜的质量小于64 g,A项错误;电解精炼铜时,比铜活泼的金属杂质在阳极优先失去电子,电解质溶液中的铜离子在阴极上得到电子转化为铜单质,电解质溶液中的铜离子浓度减小,B项错误;在铁制器皿上镀铝,若用含有铝离子的溶液充当电解质溶液,则氢离子先得电子,不能达到镀铝的目的,应用熔融氧化铝作电解质,铁制器皿作阴极,铝棒作阳极,C项正确;电镀时,可用镀层金属作阳极材料,含镀层金属离子的盐溶液作电镀液,此种情况下电镀液不需要更换,D项错误。
7.B 金属冶炼方法选择的主要依据是金属的活泼性强弱,不活泼的金属可以用热分解法制备,如加热氧化汞得到汞;比较活泼的金属用热还原法制备,如用焦炭炼铁;活泼的金属的离子很难被其他还原剂还原,通常用电解法制备。由于钠、镁、铝是活泼金属,所以用电解法制备。
8.A ①活泼金属通常采用电解其熔融盐或氧化物的方法冶炼,钠是活泼金属,工业上采用电解熔融氯化钠的方法制取,错误;②将钠加入氯化镁的饱和溶液中,钠先和水反应生成氢氧化钠和氢气,氢氧化钠再和氯化镁发生复分解反应生成氢氧化镁和氯化钠,得不到镁,错误;③铝是活泼金属,工业上采用电解氧化铝的方法冶炼铝,错误;④镁是活泼金属,通常用电解熔融氯化镁的方法冶炼镁,错误;故选A。
9.B 钙还原二氧化钛反应的化学方程式为2Ca+TiO2 Ti+2CaO,由TiO2制得1 mol金属Ti,理论上外电路转移4 mol电子,A正确;阳极的电极反应式为C+2O2--4e- CO2↑,B错误;2Ca+TiO2 Ti+2CaO,整套装置中CaO的总量不会减少,C正确;阳极的电极反应式为C+2O2--4e- CO2↑,C不断被消耗,因此装置中石墨电极材料需要定期更换,D正确。
10.答案 (1)负极 O2+4e-+2H2O 4OH-
(2)阳极 2H++2e- H2↑
(3)铁极
(4)减小
(5)0.2 12.8 g
解析 (1)氢氧燃料电池中,负极上氢气失去电子发生氧化反应,正极上氧气得到电子发生还原反应,电极反应为O2+4e-+2H2O 4OH-。
(2)铁电极连接原电池负极,作电解池阴极,碳作阳极,电解饱和氯化钠溶液时,阴极上氢离子放电,电极反应为2H++2e- H2↑。
(3)乙装置中铁是阴极,碳是阳极,阳极上氯离子放电生成氯气,阴极上氢离子放电,导致阴极附近氢氧根离子浓度增大,所以乙装置中生成氢氧化钠主要在铁极区。
(4)粗铜中含有锌、银、金等杂质,阳极上锌比铜优先放电,阴极上一直是铜离子放电,反应一段时间后,硫酸铜溶液的浓度减小。
(5)若在标准状况下,有2.24 L氧气参加反应,乙装置中碳电极上氯离子放电生成氯气,根据得失电子守恒可得,乙装置中碳电极上生成氯气的分子数为×NA=0.2NA;丙装置中阴极上铜离子得电子生成铜单质,析出铜的质量=×64 g/mol=12.8 g。
能力提升练
1.D 2.C 3.B 4.B 5.D 6.D 7.B
1.D 根据图示可知碳纸电极为阴极,电极反应为Fe3++e- Fe2+,根据关系式4Fe2+~O2~4e-可知,电路中转移2 mol电子,需要消耗0.5 mol O2,在标准状况下0.5 mol氧气的体积为11.2 L,故A错误;含催化剂的疏水电极为阳极,电极反应为2HCl-2e- Cl2↑+2H+,故B错误;电解池中阳离子移向阴极,通电后H+从右室迁移至左室,故C错误;左室中发生反应4Fe2++O2+4H+ 4Fe3++2H2O,实现了Fe3+的再生,故D正确。
2.C 在该电解池装置中,阳极的电极反应为CuCl(s)+Cl--e- CuCl2,故A正确;根据装置图可知,液相反应为C2H4+2CuCl2 ClCH2CH2Cl+2CuCl(s),故B正确;离子交换膜Y为阳离子交换膜,离子交换膜X为阴离子交换膜,故C错误;该装置总反应为CH2CH2+2H2O+2NaCl H2↑+2NaOH+ClCH2CH2Cl,故D正确。
3.B 从图中可以看出,左侧石墨电极上Mn2+转化为Mn3+,则此电极为阳极,a为正极,b为负极,与b相连的右侧石墨电极为阴极。a为电源的正极,A正确;右侧的石墨电极为阴极,阴极上H+得电子生成H2,电极反应式为2H++2e- H2↑,阴极石墨棒上有无色气体(H2)产生,B错误,C正确;由图可知,电解质溶液中发生的反应为FeS2+15Mn3++8H2O Fe3++15Mn2++2S+16H+,则理论上,电路中每转移15 mol电子,可处理1 mol FeS2,D正确。
4.B 右池为原电池,通入空气的一极为正极,左池为电解池,铁与正极相连,是阳极,电极反应式为Fe-2e- Fe2+,故A正确;由A项分析知,左池中石墨电极为阴极,污水中的阴离子向阳极移动,即向铁电极移动,故B错误;通入甲烷的石墨电极是原电池的负极,电极反应式为CH4+4C-8e- 5CO2+2H2O,故C正确;亚硝酸钠是电解质,加入污水中,可增强污水的导电能力,故D正确。
5.D 该装置制备高纯铬和硫酸,甲池中Cr电极上Cr3+得电子发生还原反应,则Cr为阴极,阴极连接电源的负极,则a为负极,b为正极,A错误;阴极反应式为Cr3++3e- Cr,B错误;甲池中硫酸根离子通过阴膜进入乙池,丙池中生成的氢离子通过A膜进入乙池,所以乙池中硫酸浓度增大,溶液的pH减小,C错误;若有1 mol离子通过A膜,即丙池生成1 mol H+,根据阳极反应式2H2O-4e- O2↑+4H+可知,理论上阳极生成0.25 mol气体,D正确。
方法技巧
电解池电极反应式的书写可总结为五步:一判、二看、三分、四写、五平。
一判:判断阴、阳极。
二看:阳极要看清电极材料。对于铁、铝、铜、银等活性电极,则阳极金属电极失电子变成阳离子进入溶液,溶液中的阴离子不失电子;如果是惰性电极(Pt、Au、石墨等)材料,应是溶液中的阴离子失电子。
三分:将离子分成阳离子组、阴离子组(注意:水溶液中一定不要漏掉H+、OH-),阳离子向阴极移动,阴离子向阳极移动。
四写:由离子放电顺序及信息确定电极反应和电极产物。
五平:依据原子守恒、电荷守恒进行配平 。
6.D 由题图可知电极b是阴极,应连接电源的负极,故A正确;钠离子移向Ⅲ室,氯离子移向Ⅰ室,Ⅱ室口排出的是淡水,故B正确;加入Na2SO4,可增强溶液的导电性,Ⅱ室中的氯离子移向Ⅰ室,A处生成的H+进入Ⅰ室,在Ⅰ室得到HCl,可避免有害气体的产生,故C正确;钠离子通过C移向Ⅲ室,C为阳离子交换膜,故D错误。
7.B 若为电解精炼铜,粗铜作阳极,与电源的正极相连,则a极是粗铜,由于阳极上不止铜放电,但阴极上只有铜离子放电,则电解质溶液浓度随着电解过程会减小,A正确;若在铁钉上镀铜,镀层金属作阳极,与电源的正极相连,则a极是镀层金属,b极是镀件,电解质溶液可用CuSO4溶液,B错误;若用此装置防止铁被腐蚀,铁应作阴极,则b极是铁,a极可用惰性电极,C正确;若用此装置电解饱和食盐水,a电极和电源正极相连,作阳极,阳极上氯离子放电生成氯气,则a极产生的气体能使湿润的淀粉KI试纸变蓝,D正确。
8.答案 (1)①正极 Cl--5e-+2H2O ClO2↑+4H+ ②增大 ③阳
(2)2MnO2+4KOH+O2 2K2MnO4+2H2O KOH Mn-e- Mn
解析 (1)①图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。Cl-失去电子,发生氧化反应产生ClO2,所以产生ClO2的电极为阳极,应连接电源的正极,阳极的电极反应为Cl--5e-+2H2O ClO2↑+4H+。②b极为阳极,a极为阴极,在阴极区水电离产生的H+得到电子发生还原反应产生H2,H+不断放电,a极区c(H+)减小,c(OH-)增大,因此溶液pH增大。③根据图示可知,离子通过离子交换膜由阳极区进入阴极区,由于阳极b电极上Cl-不断放电,使阳离子浓度增大,为维持平衡,溶液中的阳离子通过离子交换膜进入阴极区,故图中使用的离子交换膜是阳离子交换膜。
(2)根据题意可知,MnO2、KOH和O2在加热条件下发生氧化还原反应产生K2MnO4,反应的化学方程式为2MnO2+4KOH+O2 2K2MnO4+2H2O;电解K2MnO4溶液,Mn在阳极室发生氧化反应,电极反应为Mn-e- Mn,阴极的电极反应为2H2O+2e- H2↑+2OH-,离子交换膜为阳离子交换膜,阳极室的K+通过阳离子交换膜进入阴极室,所以D是KOH。
15
第2课时 电解原理的工业应用
基础过关练
题组一 氯碱工业
1.如图为电解饱和食盐水的简易装置,下列有关说法正确的是( )
A.通电一段时间后,向蛋壳内的溶液中滴加几滴酚酞试液,溶液呈红色
B.蛋壳表面缠绕的铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠接触
2.如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )
A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为Cl-+2H+ Cl2↑+H2↑
D.该装置是将电能转化为化学能的装置
3.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置,c、d都为石墨电极。回答下列问题:
(1)a为电源的 (填“正”或“负”)极,c为电解池的 极(填“阴”或“阳”)。
(2)d电极上的电极反应式为 ,电解产生消毒液的总反应式为 。
题组二 电解精炼
4.(2021福建三明一中月考)金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+
B.电解过程中,阳极减少的质量与阴极增加的质量相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
题组三 电镀
5.(2021黑龙江、吉林两省十校联考)下列有关铜片镀银的说法不正确的是( )
A.阳极的电极反应为Ag-e- Ag+
B.铜片应与电源正极相连
C.电解液为AgNO3溶液
D.镀银过程中电能转化为化学能
6.下列关于电解精炼铜与电镀的说法正确的是( )
A.电解精炼铜时,将电能转化为化学能,电路中每通过2 mol e-,阳极就会溶解64 g铜
B.电解精炼铜时,阳极为粗铜,阴极为精铜,电解过程中电解质溶液中Cu2+的浓度不变
C.在铁制器皿上镀铝,熔融氧化铝作电解质,铁制器皿作阴极,铝棒作阳极
D.电镀过程中电镀液必须不断更换题组四 电解冶炼
7.在冶金工业中,钠、镁、铝等金属常用电解法制备,其原因是( )
A.都属于轻金属
B.都属于活泼金属
C.成本低廉
D.这些金属的化合物熔点较低
8.(2021北京首都师大附中入学考试)下列叙述不正确的是( )
①工业上用电解氯化钠溶液的方法制取钠
②可以用钠加入氯化镁的饱和溶液中制取金属镁
③用于电解冶炼铝的原料是氯化铝
④炭在高温下能还原氧化镁制取镁
A.①②③④ B.①②③ C.①③ D.①
9.(2021黑龙江哈尔滨期中)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法不正确的是( )
A.由TiO2制得1 mol金属Ti,理论上外电路转移4 mol电子
B.阳极的电极反应式为2O2--4e- O2↑
C.在制备金属钛前后,整套装置中CaO的总量不会减少
D.装置中石墨电极材料需要定期更换
题组五 电解原理的综合应用
10.(2021四川南充阆中中学期中)如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答下列问题:
(1)通入氢气的电极为 (填“正极”或“负极”),正极的电极反应为 。
(2)石墨电极(C)为 (填“阳极”或“阴极”),铁电极的电极反应为 。
(3)反应一段时间后,乙装置中生成氢氧化钠主要在 (填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银、金等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将 。(填“增大”“减小”或“不变”)。
(5)若在标准状况下,有2.24 L氧气参加反应,则乙装置中(NaCl足量)C电极上生成的气体的分子数为 NA;丙装置中阴极析出铜的质量为 。
能力提升练
题组一 利用电解原理制备新物质
1.(2022福建龙岩一中月考)我国科学家采用碳基电极材料成功实现了电解气态HCl制备Cl2,其工作原理如图所示。下列说法正确的是( )
A.电路中转移2 mol电子,需要消耗11.2 L O2
B.阳极的电极反应为2Cl--2e- Cl2↑
C.通电后H+从左室迁移至右室
D.左室中发生反应4Fe2++O2+4H+ 4Fe3++2H2O,实现了Fe3+的再生
2.电解合成1,2-二氯乙烷的实验装置如图所示。下列说法中不正确的是( )
A.该装置工作时,阳极的电极反应是CuCl(s)+Cl--e- CuCl2
B.液相反应为CH2CH2+2CuCl2 ClCH2CH2Cl+2CuCl(s)
C.X、Y依次为阳离子交换膜、阴离子交换膜
D.该装置总反应为CH2CH2+2NaCl+2H2O ClCH2CH2Cl+2NaOH+H2↑
题组二 利用电解原理处理废水、废气
3.煤电解脱硫装置如图,下列说法错误的是( )
A.a为正极
B.阴极的电极反应式为Mn3++e- Mn2+
C.电解开始时,观察到阴极石墨棒上有无色气体产生
D.理论上,电路中每转移15 mol电子,可处理1 mol FeS2
4.电浮选凝聚法处理酸性污水的工作原理如图所示。下列说法不正确的是( )
A.铁电极的电极反应式为Fe-2e- Fe2+
B.污水中的阴离子向石墨电极移动
C.通入甲烷的石墨电极的电极反应式为CH4+4C-8e- 5CO2+2H2O
D.为了增强污水的导电能力,可向污水中加入适量工业盐亚硝酸钠
题组三 膜电解技术的应用
5.(2022山东实验中学期中)一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是( )
A.b为直流电源的负极
B.阴极反应式为2H++2e- H2↑
C.工作时,乙池中溶液的pH不变
D.若有1 mol离子通过A膜,理论上阳极生成0.25 mol气体
6.采用双极膜电渗析一步法由盐制酸碱的技术进入了工业化阶段,某科研小组研究采用BMED膜堆(如图所示),模拟以精制浓海水为原料直接制备酸和碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(A、D)。已知:在直流电源的作用下,双极膜内中间界面层发生水的解离生成H+和OH-。下列说法不正确的是( )
A.电极b连接电源的负极
B.Ⅱ室口排出的是淡水
C.电解质选用Na2SO4,可避免有害气体的产生
D.C为阴离子交换膜
题组四 电解原理在生产、生活中应用的综合考查
7.(2022山东济钢高中教学检测)已知实验装置如图所示,下列判断不正确的是( )
A.若为电解精炼铜,则a极是粗铜,电解质溶液浓度随着电解过程会减小
B.若在铁钉上镀铜,则a极是镀件,电解质溶液可用CuSO4溶液
C.若用此装置防止铁被腐蚀,则b极是铁,a极可用惰性电极
D.若用此装置电解饱和食盐水,则a极产生的气体能使湿润的淀粉KI试纸变蓝
8.(2021河南省实验中学期中)电化学方法是化工生产及生活中常用的一种方法。回答下列问题:
(1)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。用电解法制取ClO2的新工艺如图所示。
①图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。产生ClO2的电极应连接电源的 (填“正极”或“负极”),对应的电极反应为 。
②a极区pH (填“增大”“减小”或“不变”)。
③图中应使用 (填“阴”或“阳”)离子交换膜。
(2)电解K2MnO4溶液制备KMnO4。工业上,通常以软锰矿(主要成分是MnO2)与KOH的混合物在铁坩埚(熔融池)中混合均匀,小火加热至熔融,即可得到绿色的K2MnO4,化学方程式为
。用镍片作阳极(镍不参与反应),铁板为阴极,电解K2MnO4溶液可制备KMnO4。上述过程用流程图表示如下:
则D的化学式为 ;阳极的电极反应为
。
答案全解全析
基础过关练
1.D 2.C 4.D 5.B 6.C 7.B 8.A 9.B
1.D 电解饱和食盐水时碳棒作阳极,铁丝作阴极,阳极反应式为2Cl--2e- Cl2↑,少量Cl2溶解在溶液中,使溶液显酸性,滴入酚酞试液,溶液不变红色,A错误;阴极反应式为2H2O+2e- H2↑+2OH-(或2H++2e- H2↑),铁丝自身并未发生反应,B错误;铁丝表面生成的气体是氢气,不能使湿润的淀粉碘化钾试纸变蓝,C错误;蛋壳将两极产物分开,防止产物之间发生反应,D正确。
2.C 由题图可知①处的物质为电解池阳极产生的氯气,②处的物质为电解池阴极产生的氢气,A正确;题图中的离子交换膜只能让阳离子通过,不能让阴离子通过,能防止氯气与氢氧化钠反应,且在阴极区得到浓度较高的氢氧化钠溶液,B正确;电解饱和食盐水的离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-,C错误;该装置是将电能转化为化学能的装置,D正确。
3.答案 (1)负 阳 (2)2H2O+2e- H2↑+2OH-(或2H++2e- H2↑) NaCl+H2O NaClO+H2↑
解析 要生成NaClO,Cl2需被NaOH充分吸收,则应在c电极上产生Cl2,故a为负极,b为正极,c为阳极,d为阴极。
4.D 阳极发生氧化反应,电极反应为Ni-2e- Ni2+、Fe-2e- Fe2+、Zn-2e- Zn2+,故A错误;电解过程中阳极上Fe、Zn、Ni放电,阴极上析出的是镍,根据得失电子守恒,可知阳极减少的质量与阴极增加的质量不相等,故B错误;电解后,溶液中存在的金属阳离子有Fe2+、Zn2+、Ni2+,故C错误;粗镍中含有少量Fe、Zn、Cu、Pt等杂质,铜和铂不放电,沉降电解池底部形成阳极泥,所以电解后,电解槽底部的阳极泥中只有Cu和Pt,故D正确。
5.B 铜片镀银时,Ag作阳极、Cu作阴极,电解液为AgNO3溶液,阳极的电极反应式为Ag-e- Ag+,故A、C正确;Cu作阴极,与电源的负极相连,故B不正确;铜片镀银是利用电解原理,镀银过程中电能转化为化学能,故D正确。
6.C 电解精炼铜时,阳极为粗铜,比铜活泼的金属杂质也会反应,电解初期,电路中每通过2 mol e-,阳极溶解的铜的质量小于64 g,A项错误;电解精炼铜时,比铜活泼的金属杂质在阳极优先失去电子,电解质溶液中的铜离子在阴极上得到电子转化为铜单质,电解质溶液中的铜离子浓度减小,B项错误;在铁制器皿上镀铝,若用含有铝离子的溶液充当电解质溶液,则氢离子先得电子,不能达到镀铝的目的,应用熔融氧化铝作电解质,铁制器皿作阴极,铝棒作阳极,C项正确;电镀时,可用镀层金属作阳极材料,含镀层金属离子的盐溶液作电镀液,此种情况下电镀液不需要更换,D项错误。
7.B 金属冶炼方法选择的主要依据是金属的活泼性强弱,不活泼的金属可以用热分解法制备,如加热氧化汞得到汞;比较活泼的金属用热还原法制备,如用焦炭炼铁;活泼的金属的离子很难被其他还原剂还原,通常用电解法制备。由于钠、镁、铝是活泼金属,所以用电解法制备。
8.A ①活泼金属通常采用电解其熔融盐或氧化物的方法冶炼,钠是活泼金属,工业上采用电解熔融氯化钠的方法制取,错误;②将钠加入氯化镁的饱和溶液中,钠先和水反应生成氢氧化钠和氢气,氢氧化钠再和氯化镁发生复分解反应生成氢氧化镁和氯化钠,得不到镁,错误;③铝是活泼金属,工业上采用电解氧化铝的方法冶炼铝,错误;④镁是活泼金属,通常用电解熔融氯化镁的方法冶炼镁,错误;故选A。
9.B 钙还原二氧化钛反应的化学方程式为2Ca+TiO2 Ti+2CaO,由TiO2制得1 mol金属Ti,理论上外电路转移4 mol电子,A正确;阳极的电极反应式为C+2O2--4e- CO2↑,B错误;2Ca+TiO2 Ti+2CaO,整套装置中CaO的总量不会减少,C正确;阳极的电极反应式为C+2O2--4e- CO2↑,C不断被消耗,因此装置中石墨电极材料需要定期更换,D正确。
10.答案 (1)负极 O2+4e-+2H2O 4OH-
(2)阳极 2H++2e- H2↑
(3)铁极
(4)减小
(5)0.2 12.8 g
解析 (1)氢氧燃料电池中,负极上氢气失去电子发生氧化反应,正极上氧气得到电子发生还原反应,电极反应为O2+4e-+2H2O 4OH-。
(2)铁电极连接原电池负极,作电解池阴极,碳作阳极,电解饱和氯化钠溶液时,阴极上氢离子放电,电极反应为2H++2e- H2↑。
(3)乙装置中铁是阴极,碳是阳极,阳极上氯离子放电生成氯气,阴极上氢离子放电,导致阴极附近氢氧根离子浓度增大,所以乙装置中生成氢氧化钠主要在铁极区。
(4)粗铜中含有锌、银、金等杂质,阳极上锌比铜优先放电,阴极上一直是铜离子放电,反应一段时间后,硫酸铜溶液的浓度减小。
(5)若在标准状况下,有2.24 L氧气参加反应,乙装置中碳电极上氯离子放电生成氯气,根据得失电子守恒可得,乙装置中碳电极上生成氯气的分子数为×NA=0.2NA;丙装置中阴极上铜离子得电子生成铜单质,析出铜的质量=×64 g/mol=12.8 g。
能力提升练
1.D 2.C 3.B 4.B 5.D 6.D 7.B
1.D 根据图示可知碳纸电极为阴极,电极反应为Fe3++e- Fe2+,根据关系式4Fe2+~O2~4e-可知,电路中转移2 mol电子,需要消耗0.5 mol O2,在标准状况下0.5 mol氧气的体积为11.2 L,故A错误;含催化剂的疏水电极为阳极,电极反应为2HCl-2e- Cl2↑+2H+,故B错误;电解池中阳离子移向阴极,通电后H+从右室迁移至左室,故C错误;左室中发生反应4Fe2++O2+4H+ 4Fe3++2H2O,实现了Fe3+的再生,故D正确。
2.C 在该电解池装置中,阳极的电极反应为CuCl(s)+Cl--e- CuCl2,故A正确;根据装置图可知,液相反应为C2H4+2CuCl2 ClCH2CH2Cl+2CuCl(s),故B正确;离子交换膜Y为阳离子交换膜,离子交换膜X为阴离子交换膜,故C错误;该装置总反应为CH2CH2+2H2O+2NaCl H2↑+2NaOH+ClCH2CH2Cl,故D正确。
3.B 从图中可以看出,左侧石墨电极上Mn2+转化为Mn3+,则此电极为阳极,a为正极,b为负极,与b相连的右侧石墨电极为阴极。a为电源的正极,A正确;右侧的石墨电极为阴极,阴极上H+得电子生成H2,电极反应式为2H++2e- H2↑,阴极石墨棒上有无色气体(H2)产生,B错误,C正确;由图可知,电解质溶液中发生的反应为FeS2+15Mn3++8H2O Fe3++15Mn2++2S+16H+,则理论上,电路中每转移15 mol电子,可处理1 mol FeS2,D正确。
4.B 右池为原电池,通入空气的一极为正极,左池为电解池,铁与正极相连,是阳极,电极反应式为Fe-2e- Fe2+,故A正确;由A项分析知,左池中石墨电极为阴极,污水中的阴离子向阳极移动,即向铁电极移动,故B错误;通入甲烷的石墨电极是原电池的负极,电极反应式为CH4+4C-8e- 5CO2+2H2O,故C正确;亚硝酸钠是电解质,加入污水中,可增强污水的导电能力,故D正确。
5.D 该装置制备高纯铬和硫酸,甲池中Cr电极上Cr3+得电子发生还原反应,则Cr为阴极,阴极连接电源的负极,则a为负极,b为正极,A错误;阴极反应式为Cr3++3e- Cr,B错误;甲池中硫酸根离子通过阴膜进入乙池,丙池中生成的氢离子通过A膜进入乙池,所以乙池中硫酸浓度增大,溶液的pH减小,C错误;若有1 mol离子通过A膜,即丙池生成1 mol H+,根据阳极反应式2H2O-4e- O2↑+4H+可知,理论上阳极生成0.25 mol气体,D正确。
方法技巧
电解池电极反应式的书写可总结为五步:一判、二看、三分、四写、五平。
一判:判断阴、阳极。
二看:阳极要看清电极材料。对于铁、铝、铜、银等活性电极,则阳极金属电极失电子变成阳离子进入溶液,溶液中的阴离子不失电子;如果是惰性电极(Pt、Au、石墨等)材料,应是溶液中的阴离子失电子。
三分:将离子分成阳离子组、阴离子组(注意:水溶液中一定不要漏掉H+、OH-),阳离子向阴极移动,阴离子向阳极移动。
四写:由离子放电顺序及信息确定电极反应和电极产物。
五平:依据原子守恒、电荷守恒进行配平 。
6.D 由题图可知电极b是阴极,应连接电源的负极,故A正确;钠离子移向Ⅲ室,氯离子移向Ⅰ室,Ⅱ室口排出的是淡水,故B正确;加入Na2SO4,可增强溶液的导电性,Ⅱ室中的氯离子移向Ⅰ室,A处生成的H+进入Ⅰ室,在Ⅰ室得到HCl,可避免有害气体的产生,故C正确;钠离子通过C移向Ⅲ室,C为阳离子交换膜,故D错误。
7.B 若为电解精炼铜,粗铜作阳极,与电源的正极相连,则a极是粗铜,由于阳极上不止铜放电,但阴极上只有铜离子放电,则电解质溶液浓度随着电解过程会减小,A正确;若在铁钉上镀铜,镀层金属作阳极,与电源的正极相连,则a极是镀层金属,b极是镀件,电解质溶液可用CuSO4溶液,B错误;若用此装置防止铁被腐蚀,铁应作阴极,则b极是铁,a极可用惰性电极,C正确;若用此装置电解饱和食盐水,a电极和电源正极相连,作阳极,阳极上氯离子放电生成氯气,则a极产生的气体能使湿润的淀粉KI试纸变蓝,D正确。
8.答案 (1)①正极 Cl--5e-+2H2O ClO2↑+4H+ ②增大 ③阳
(2)2MnO2+4KOH+O2 2K2MnO4+2H2O KOH Mn-e- Mn
解析 (1)①图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。Cl-失去电子,发生氧化反应产生ClO2,所以产生ClO2的电极为阳极,应连接电源的正极,阳极的电极反应为Cl--5e-+2H2O ClO2↑+4H+。②b极为阳极,a极为阴极,在阴极区水电离产生的H+得到电子发生还原反应产生H2,H+不断放电,a极区c(H+)减小,c(OH-)增大,因此溶液pH增大。③根据图示可知,离子通过离子交换膜由阳极区进入阴极区,由于阳极b电极上Cl-不断放电,使阳离子浓度增大,为维持平衡,溶液中的阳离子通过离子交换膜进入阴极区,故图中使用的离子交换膜是阳离子交换膜。
(2)根据题意可知,MnO2、KOH和O2在加热条件下发生氧化还原反应产生K2MnO4,反应的化学方程式为2MnO2+4KOH+O2 2K2MnO4+2H2O;电解K2MnO4溶液,Mn在阳极室发生氧化反应,电极反应为Mn-e- Mn,阴极的电极反应为2H2O+2e- H2↑+2OH-,离子交换膜为阳离子交换膜,阳极室的K+通过阳离子交换膜进入阴极室,所以D是KOH。
15
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
