人教版(2019) 高中化学必修第二册 6.2化学反应速率与限度提升练(含答案)
文档属性
| 名称 | 人教版(2019) 高中化学必修第二册 6.2化学反应速率与限度提升练(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 832.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-22 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
6.2化学反应速率与限度提升练-人教版高中化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.煤炭燃烧过程中产生的会与发生化学反应,相关反应的热化学方程式如下:
(Ⅰ)
(Ⅱ)
下列措施能使反应Ⅰ、Ⅱ速率均加快的是
A.再加入少量的 B.缩小容器的体积 C.降低温度 D.抽出
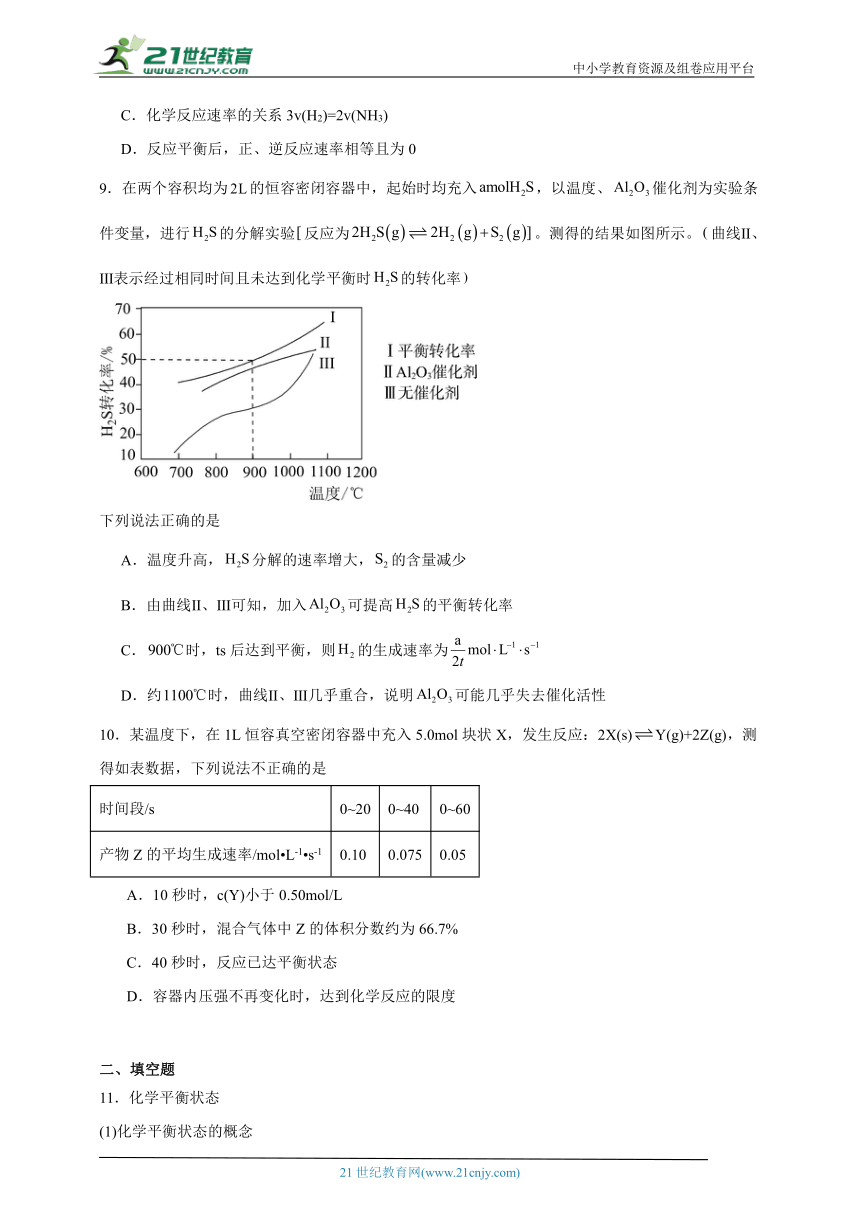
2.一定条件下的密闭容器中,发生反应,I2(g)和HI(g)的物质的量浓度变化如图,下列说法正确的是
A.0~t1的平均速率
B.平衡时
C.t1~t3时间段内,生成HI的物质的量为0.8mol
D.t3与t2相比,体系平均相对分子质量不一定相等
3.合成氨的反应为:3H2+N22NH3的叙述中,错误的是
A.该反应为可逆反应
B.温度降低会使化学反应速率减慢
C.该反应无法达到平衡状态
D.加入催化剂有利于加快化学反应速率
4.用一定质量的锌粒与某浓度的稀硫酸反应制取H2,若要增大反应速率,则下列选项中采取的措施全部正确的是
①滴入几滴CuSO4溶液 ②将锌粒改为锌粉 ③改加浓硫酸 ④适当降低温度
A.①③ B.①② C.②③ D.①④
5.化学与人类生活、生产和社会可持续发展密切相关,下列有关说法正确的是
A.中国天眼FAST用到的高性能碳化硅是一种新型的有机高分子材料
B.中国华为自主研发的5G芯片巴龙5000的主要材料是Si
C.现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键
D.用铜片制成的“纳米铜”具有非常强的化学活性,在空气中可以燃烧,说明“纳米铜”的还原性比铜片更强
6.下列有关工业生产叙述正确的是
A.工业上通常使用电解法制备金属钠、镁、铝等
B.合成氨工业中,将NH3及时液化分离有利于加快反应速率
C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高
D.电解精炼铜时,将粗铜与电源的负极相连
7.一种甲烷催化氧化的反应历程如图所示,*表示吸附在催化剂表面。下列说法正确的是
A.适当提高分压可以加快的反应速率
B.的过程中C被氧化,释放能量
C.产物从催化剂表面脱附的速率对总反应速率无影响
D.与反应生成CO和的过程中只涉及极性键的断裂和生成
8.一定条件下,向某密闭容器中加入一定量的N2和H2发生反应:N2(g) + 3H2(g) 2NH3(g),测得0~10 s内,c(N2)减小了0.25 mol·L-1,下列说法正确的是
A.0~10秒内,v(H2)为0.075 mol·(L·s)-1
B.10~15秒内,c(NH3)增加了0.25 mol·L-1
C.化学反应速率的关系3v(H2)=2v(NH3)
D.反应平衡后,正、逆反应速率相等且为0
9.在两个容积均为的恒容密闭容器中,起始时均充入,以温度、催化剂为实验条件变量,进行的分解实验反应为。测得的结果如图所示。曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时的转化率
下列说法正确的是
A.温度升高,分解的速率增大,的含量减少
B.由曲线Ⅱ、Ⅲ可知,加入可提高的平衡转化率
C.时,ts后达到平衡,则的生成速率为
D.约时,曲线Ⅱ、Ⅲ几乎重合,说明可能几乎失去催化活性
10.某温度下,在1L恒容真空密闭容器中充入5.0mol块状X,发生反应:2X(s)Y(g)+2Z(g),测得如表数据,下列说法不正确的是
时间段/s 0~20 0~40 0~60
产物Z的平均生成速率/mol L-1 s-1 0.10 0.075 0.05
A.10秒时,c(Y)小于0.50mol/L
B.30秒时,混合气体中Z的体积分数约为66.7%
C.40秒时,反应已达平衡状态
D.容器内压强不再变化时,达到化学反应的限度
二、填空题
11.化学平衡状态
(1)化学平衡状态的概念
当 条件不变时,可逆反应进行到 ,反应物和生成物的浓度不再随时间的变化而 。
(2)化学平衡状态的特征
①逆: 反应
②等:
③定:
④动:
⑤变:
12.某化学反应2A(g)B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验序号 0min 10min 20min 30min 40min 50min 60min
1 800℃ 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800℃ c2 0.60 0.50 0.50 0.50 0.50 0.50
3 800℃ c3 0.92 0.75 0.63 0.60 0.60 0.60
4 820℃ 1.0 0.40 0.25 0.20 0.20 0.20 0.20
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内用A表示表示该反应的平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3 1.0mol/L(填>、=、<)。
13.在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)2C(g);△H=QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
实验序号 0 10 20 30 40 50 60
1 80℃ 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 80℃ n2 0.60 0.50 0.50 0.50 0.50 0.50
3 80℃ n3 0.92 0.75 0.63 0.60 0.60 0.60
4 73℃ 1.0 0.90 0.80 0.75 0.70 0.65 0.65
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= mol/(L·min);实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q 0(填“>、=、<”),理由是
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的 。
a.0~15 min可能是升高了温度
b.0~15 min可能是加入了催化剂
c.0 min时可能是缩小了容器体积
d.0 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的7/8。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的7/8。
①a、b、c必须满足的关系是 , 。(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是 。
14.向一个容积为2 L的密闭容器中充入4 mol·L-1 A和6 mol·L-1 B,在恒温恒容下发生反应:,经5 min后达到平衡状态,测得A的浓度为2 mol·L-1、测得D的化学反应速率为。
(1)到达平衡前 (填“>”或者“<”),到达平衡后 (填“>”、“<”或者“=”)。
(2)D的化学计量数x为 。
(3)反应开始至平衡时,以B的浓度变化表示该反应的平均速率 。
(4)到达平衡后A的转化率为 。
(5)该条件下反应一段时间,下列能说明反应达到平衡状态的是___________。
A.气体的密度保持不变 B.气体的压强保持不变
C. D.B与C浓度保持不变
(6)反应前与到达平衡后的压强之比为 。
15.工业合成氨反应:N2+3H2 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可 (填“吸收”或“放出”)热量 kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是 。
(3)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是 。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
16.将一定量的A、B、C三种物质(都是气体)放入固定体积为1L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如下图所示。请回答下列问题:
(1)反应的化学方程式用A、B、C可表示为 。
(2)用A表示在0~10min内的反应速率 。
(3)在该条件达到反应的限度时反应物B的转化率为 。(计算结果用百分数表示,并保留1位小数)
(4)开始时容器中的压强与平衡时的压强之比为 。
17.二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)△H>0。在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率v(H2)= 。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
① P1 P2 (填“<”、“>”或“=")。
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”。下同。),平衡常数 。
③在P1压强下,100℃时,CH3OH(g)CO(g)+ 2H2(g)反应的平衡常数为 (用含a、V的代数式表示)。
18.在2 L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡。
(1)该反应的化学方程式是 。
(2)反应起始至t时刻,Y的平均反应速率是 。
(3)关于该反应的说法,正确的是 。
A.到达t时刻该反应已停止
B.加入催化剂,一定能加快反应速率
C.在t时刻正反应速率等于逆反应速率
D.增大压强,一定能加快反应速率
19.乙烯是现代工业的重要原材料,研究工业制取乙烯有重要的意义。
(1)工业上用CO2氧化C2H6制C2H4是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.C2H6(g)+CO2(g)C2H4(g)+H2O(g)+CO(g)△H1
Ⅱ.C2H6(g)+2CO2(g)4CO(g)+3H2(g)△H2=+430kJ·mol-1
反应的能量变化图如图所示:
①C2H6(g)+2CO(g)+3H2(g)2C2H4(g)+2H2O(g)△H= kJ·mol-1
②反应Ⅱ不利于反应Ⅰ中乙烯生成的原因是 ;一定温度和压强下,为了提高反应速率和乙烯的选择性,应当 。
(2)工业上也可用甲烷催化法制取乙烯,反应如下:2CH4(g)C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T温度时k正与k逆的比值为 ;若将温度升高,速率常数增大的倍数:k正 k逆(填“>”“=”或“<”)。
20.在密闭容器中发生反应CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0,该反应达到平衡后,测得如下数据。
实验 序号 温度(℃) 初始CO浓 度(mol·L-1) 初始H2O浓 度(mol·L-1) CO的平衡 转化率
1 110 1 1 50%
2 100 1 1 x
3 110 0.8 y 60%
(1)实验1中,10h后达到平衡,H2的平均反应速率为 mol·L-1·h-1。在此实验的平衡体系中,再加入0.5molCO和0.5molH2,平衡将 移动(“向左”、“向右”、“不”或“无法确定”)。
(2)实验2中,x的值 (填序号)。
A.等于50% B.大于50%
C.小于50% D.无法确定
(3)实验3中的y值为 。
(4)在100 ℃条件下,能说明该反应达到平衡状态的是 。
A.压强不再变化
B.生成H2O的速率和消耗H2速率相等时
C.混合气体的密度不变
D.H2的质量不再变化
三、实验题
21.某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(已知H2C2O4是弱酸)
实验 序号 实验 温度 KMnO4溶液 H2C2O4溶液 H2O 溶液褪色时间
V(mL) c(mol/L) V(mL) c(mol/L) V(mL) t(s)
A 293K 2 0.05 8 0.25 0 t1
B T1 2 0.05 6 0.25 V1 8
C 313K 2 0.05 6 0.25 2 t2
(1)通过实验A、B,可探究出 的改变对反应速率的影响,其中V1= ,T1= ,t2 8(填“>”、“<”或“=”)。
(2)通过实验 可探究出温度变化对化学反应速率的影响。
(3)若t1<8,则由实验A、B可以得出的结论是 ;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为 。
(4)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式 。
(5)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是 。
22.已知和(草酸)在酸性溶液中会发生氧化还原反应生成气体。甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下(实验中所用溶液均已酸化):
(1)甲组:通过测定单位时间内生成气体体积的量来比较化学反应速率,实验装置如图所示:实验时分液漏斗中溶液一次性加入,、的成分见下表:
序号 溶液 溶液
① 溶液 溶液
② 溶液 溶液
③ 溶液 溶液,少量(催化剂)
该实验探究的是 对化学反应速率的影响。该反应的离子方程式为: 。
(2)乙组:通过测定溶液褪色所需时间的长短来比较化学反应速率。取两支试管各加入溶液,另取两支试管各加入 溶液,将四支试管分成两组(每组各有一支试管盛有溶液和溶液),一组放入冷水中,另一组放入热水中,一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液完全褪色,其原因是 。
23.用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2 + I= H2O + IO;H2O2 + IO= H2O + O2↑+ I。总反应的化学方程式是 。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是 (填字母)。
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I= H2O + IO是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到 ,说明有I2生成。
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ. 。
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是 。
(4)资料4:I+ I I K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 I I I
浓度/ (mol·L-1) 2.5×10-3 a 4.0×10-3
① a = 。
② 该平衡体系中除了含有I、I和I外,一定还含有其他含碘微粒,理由是 。
参考答案:
1.B
2.D
3.C
4.B
5.B
6.A
7.A
8.A
9.D
10.A
11.(1) 外界 一定程度 发生变化
(2) 可逆 v正=v逆 物质恒定 动态平衡,反应没停止 条件变,平衡移动
12. 0.013 1.0 使用催化剂 > >
13. 0.0065 mol L﹣1 min﹣1 用催化剂 > < 温度降低,C的平衡浓度增大,说明正反应放热 abd a+c=5 b+1/2c=3 3<a≤5
14.(1) > =
(2)4
(3)
(4)50%
(5)BD
(6)10∶9
15. 放出 92 合成氨是可逆反应,反应物不能完全转化 a c f
16. 2A(g)+B(g)3C(g) 0.2mol/(L·min) 33.3% 1:1
17. 减小 0.0003mol·L-1·min-1 2CO+4H2CH3OCH3+H2O < 增大 不变 a2/V2
18. 2X 3Y+Z mol/(L·min) C
19. -76 反应Ⅱ有CO生成,CO浓度增大使反应Ⅰ平衡逆向进行,乙烯的产率减小 选择合适的催化剂 >
20. 0.05 不 B 1.2 D
21. 浓度 2 293K < BC 其他条件相同时,增大反应物浓度,反应速率增大 1.25×10-3mol/(L·s) 2MnO42-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 作催化剂
22.(1) 浓度和催化剂 2+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2) 温度 KMnO4溶液过量
23. 2H2O2 = 2H2O+O2↑ a 下层溶液呈紫红色 在水溶液中I2的浓度降低 B试管中产生气泡速率没有明显减小 2.5×10-3 2c(I2) + c(I -) + 3c(I3-)<0.033 mol·L-1
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
6.2化学反应速率与限度提升练-人教版高中化学必修第二册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.煤炭燃烧过程中产生的会与发生化学反应,相关反应的热化学方程式如下:
(Ⅰ)
(Ⅱ)
下列措施能使反应Ⅰ、Ⅱ速率均加快的是
A.再加入少量的 B.缩小容器的体积 C.降低温度 D.抽出
2.一定条件下的密闭容器中,发生反应,I2(g)和HI(g)的物质的量浓度变化如图,下列说法正确的是
A.0~t1的平均速率
B.平衡时
C.t1~t3时间段内,生成HI的物质的量为0.8mol
D.t3与t2相比,体系平均相对分子质量不一定相等
3.合成氨的反应为:3H2+N22NH3的叙述中,错误的是
A.该反应为可逆反应
B.温度降低会使化学反应速率减慢
C.该反应无法达到平衡状态
D.加入催化剂有利于加快化学反应速率
4.用一定质量的锌粒与某浓度的稀硫酸反应制取H2,若要增大反应速率,则下列选项中采取的措施全部正确的是
①滴入几滴CuSO4溶液 ②将锌粒改为锌粉 ③改加浓硫酸 ④适当降低温度
A.①③ B.①② C.②③ D.①④
5.化学与人类生活、生产和社会可持续发展密切相关,下列有关说法正确的是
A.中国天眼FAST用到的高性能碳化硅是一种新型的有机高分子材料
B.中国华为自主研发的5G芯片巴龙5000的主要材料是Si
C.现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键
D.用铜片制成的“纳米铜”具有非常强的化学活性,在空气中可以燃烧,说明“纳米铜”的还原性比铜片更强
6.下列有关工业生产叙述正确的是
A.工业上通常使用电解法制备金属钠、镁、铝等
B.合成氨工业中,将NH3及时液化分离有利于加快反应速率
C.硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高
D.电解精炼铜时,将粗铜与电源的负极相连
7.一种甲烷催化氧化的反应历程如图所示,*表示吸附在催化剂表面。下列说法正确的是
A.适当提高分压可以加快的反应速率
B.的过程中C被氧化,释放能量
C.产物从催化剂表面脱附的速率对总反应速率无影响
D.与反应生成CO和的过程中只涉及极性键的断裂和生成
8.一定条件下,向某密闭容器中加入一定量的N2和H2发生反应:N2(g) + 3H2(g) 2NH3(g),测得0~10 s内,c(N2)减小了0.25 mol·L-1,下列说法正确的是
A.0~10秒内,v(H2)为0.075 mol·(L·s)-1
B.10~15秒内,c(NH3)增加了0.25 mol·L-1
C.化学反应速率的关系3v(H2)=2v(NH3)
D.反应平衡后,正、逆反应速率相等且为0
9.在两个容积均为的恒容密闭容器中,起始时均充入,以温度、催化剂为实验条件变量,进行的分解实验反应为。测得的结果如图所示。曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时的转化率
下列说法正确的是
A.温度升高,分解的速率增大,的含量减少
B.由曲线Ⅱ、Ⅲ可知,加入可提高的平衡转化率
C.时,ts后达到平衡,则的生成速率为
D.约时,曲线Ⅱ、Ⅲ几乎重合,说明可能几乎失去催化活性
10.某温度下,在1L恒容真空密闭容器中充入5.0mol块状X,发生反应:2X(s)Y(g)+2Z(g),测得如表数据,下列说法不正确的是
时间段/s 0~20 0~40 0~60
产物Z的平均生成速率/mol L-1 s-1 0.10 0.075 0.05
A.10秒时,c(Y)小于0.50mol/L
B.30秒时,混合气体中Z的体积分数约为66.7%
C.40秒时,反应已达平衡状态
D.容器内压强不再变化时,达到化学反应的限度
二、填空题
11.化学平衡状态
(1)化学平衡状态的概念
当 条件不变时,可逆反应进行到 ,反应物和生成物的浓度不再随时间的变化而 。
(2)化学平衡状态的特征
①逆: 反应
②等:
③定:
④动:
⑤变:
12.某化学反应2A(g)B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验序号 0min 10min 20min 30min 40min 50min 60min
1 800℃ 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 800℃ c2 0.60 0.50 0.50 0.50 0.50 0.50
3 800℃ c3 0.92 0.75 0.63 0.60 0.60 0.60
4 820℃ 1.0 0.40 0.25 0.20 0.20 0.20 0.20
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内用A表示表示该反应的平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、=、<),且c3 1.0mol/L(填>、=、<)。
13.在实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应: 2A(g)+B(g)2C(g);△H=QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
实验序号 0 10 20 30 40 50 60
1 80℃ 1.0 0.80 0.67 0.57 0.50 0.50 0.50
2 80℃ n2 0.60 0.50 0.50 0.50 0.50 0.50
3 80℃ n3 0.92 0.75 0.63 0.60 0.60 0.60
4 73℃ 1.0 0.90 0.80 0.75 0.70 0.65 0.65
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= mol/(L·min);实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q 0(填“>、=、<”),理由是
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的 。
a.0~15 min可能是升高了温度
b.0~15 min可能是加入了催化剂
c.0 min时可能是缩小了容器体积
d.0 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA(g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的7/8。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的7/8。
①a、b、c必须满足的关系是 , 。(一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是 。
14.向一个容积为2 L的密闭容器中充入4 mol·L-1 A和6 mol·L-1 B,在恒温恒容下发生反应:,经5 min后达到平衡状态,测得A的浓度为2 mol·L-1、测得D的化学反应速率为。
(1)到达平衡前 (填“>”或者“<”),到达平衡后 (填“>”、“<”或者“=”)。
(2)D的化学计量数x为 。
(3)反应开始至平衡时,以B的浓度变化表示该反应的平均速率 。
(4)到达平衡后A的转化率为 。
(5)该条件下反应一段时间,下列能说明反应达到平衡状态的是___________。
A.气体的密度保持不变 B.气体的压强保持不变
C. D.B与C浓度保持不变
(6)反应前与到达平衡后的压强之比为 。
15.工业合成氨反应:N2+3H2 2NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知形成1 mol H-H键、1 mol N-H键、1 mol N≡N键放出能量分别为436 kJ、391 kJ、946 kJ。则:
(1)若1 mol N2完全反应生成NH3可 (填“吸收”或“放出”)热量 kJ。
(2)如果将1 mol N2和3 mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是 。
(3)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是 。
a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
16.将一定量的A、B、C三种物质(都是气体)放入固定体积为1L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如下图所示。请回答下列问题:
(1)反应的化学方程式用A、B、C可表示为 。
(2)用A表示在0~10min内的反应速率 。
(3)在该条件达到反应的限度时反应物B的转化率为 。(计算结果用百分数表示,并保留1位小数)
(4)开始时容器中的压强与平衡时的压强之比为 。
17.二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
请填空:
(1)在一定条件下,反应室1中发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)△H>0。在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。将1.0molCH4和2.0molH2O通入反应室1(假设容积为100L),10min末有0.1molCO生成,则10min内反应的平均速率v(H2)= 。
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气态水,其化学方程式为 。
(3)在压强为0.1MPa条件下,反应室3(容积为VL)中amolCO与2amolH2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)CH3OH(g),CO的平衡转化率与温度、压强的关系如右图所示,则:
① P1 P2 (填“<”、“>”或“=")。
②在其它条件不变的情况下,反应室3再增加amolCO与2amolH2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”。下同。),平衡常数 。
③在P1压强下,100℃时,CH3OH(g)CO(g)+ 2H2(g)反应的平衡常数为 (用含a、V的代数式表示)。
18.在2 L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡。
(1)该反应的化学方程式是 。
(2)反应起始至t时刻,Y的平均反应速率是 。
(3)关于该反应的说法,正确的是 。
A.到达t时刻该反应已停止
B.加入催化剂,一定能加快反应速率
C.在t时刻正反应速率等于逆反应速率
D.增大压强,一定能加快反应速率
19.乙烯是现代工业的重要原材料,研究工业制取乙烯有重要的意义。
(1)工业上用CO2氧化C2H6制C2H4是化工工业的一个新课题,相关主要化学反应有:
Ⅰ.C2H6(g)+CO2(g)C2H4(g)+H2O(g)+CO(g)△H1
Ⅱ.C2H6(g)+2CO2(g)4CO(g)+3H2(g)△H2=+430kJ·mol-1
反应的能量变化图如图所示:
①C2H6(g)+2CO(g)+3H2(g)2C2H4(g)+2H2O(g)△H= kJ·mol-1
②反应Ⅱ不利于反应Ⅰ中乙烯生成的原因是 ;一定温度和压强下,为了提高反应速率和乙烯的选择性,应当 。
(2)工业上也可用甲烷催化法制取乙烯,反应如下:2CH4(g)C2H4(g)+2H2(g)ΔH>0,温度T时,向2L的恒容反应器中充入2molCH4,仅发生上述反应,反应过程中CH4的物质的量随时间变化如图所示:
实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),k正、k逆为速率常数,只与温度有关,T温度时k正与k逆的比值为 ;若将温度升高,速率常数增大的倍数:k正 k逆(填“>”“=”或“<”)。
20.在密闭容器中发生反应CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0,该反应达到平衡后,测得如下数据。
实验 序号 温度(℃) 初始CO浓 度(mol·L-1) 初始H2O浓 度(mol·L-1) CO的平衡 转化率
1 110 1 1 50%
2 100 1 1 x
3 110 0.8 y 60%
(1)实验1中,10h后达到平衡,H2的平均反应速率为 mol·L-1·h-1。在此实验的平衡体系中,再加入0.5molCO和0.5molH2,平衡将 移动(“向左”、“向右”、“不”或“无法确定”)。
(2)实验2中,x的值 (填序号)。
A.等于50% B.大于50%
C.小于50% D.无法确定
(3)实验3中的y值为 。
(4)在100 ℃条件下,能说明该反应达到平衡状态的是 。
A.压强不再变化
B.生成H2O的速率和消耗H2速率相等时
C.混合气体的密度不变
D.H2的质量不再变化
三、实验题
21.某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(已知H2C2O4是弱酸)
实验 序号 实验 温度 KMnO4溶液 H2C2O4溶液 H2O 溶液褪色时间
V(mL) c(mol/L) V(mL) c(mol/L) V(mL) t(s)
A 293K 2 0.05 8 0.25 0 t1
B T1 2 0.05 6 0.25 V1 8
C 313K 2 0.05 6 0.25 2 t2
(1)通过实验A、B,可探究出 的改变对反应速率的影响,其中V1= ,T1= ,t2 8(填“>”、“<”或“=”)。
(2)通过实验 可探究出温度变化对化学反应速率的影响。
(3)若t1<8,则由实验A、B可以得出的结论是 ;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为 。
(4)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式 。
(5)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是 。
22.已知和(草酸)在酸性溶液中会发生氧化还原反应生成气体。甲、乙两个实验小组欲探究影响化学反应速率的因素,设计实验方案如下(实验中所用溶液均已酸化):
(1)甲组:通过测定单位时间内生成气体体积的量来比较化学反应速率,实验装置如图所示:实验时分液漏斗中溶液一次性加入,、的成分见下表:
序号 溶液 溶液
① 溶液 溶液
② 溶液 溶液
③ 溶液 溶液,少量(催化剂)
该实验探究的是 对化学反应速率的影响。该反应的离子方程式为: 。
(2)乙组:通过测定溶液褪色所需时间的长短来比较化学反应速率。取两支试管各加入溶液,另取两支试管各加入 溶液,将四支试管分成两组(每组各有一支试管盛有溶液和溶液),一组放入冷水中,另一组放入热水中,一段时间后,分别混合并振荡,记录溶液褪色所需时间。该实验试图探究 对化学反应速率的影响,但该组同学始终没有看到溶液完全褪色,其原因是 。
23.用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2 + I= H2O + IO;H2O2 + IO= H2O + O2↑+ I。总反应的化学方程式是 。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是 (填字母)。
a.加入KI后改变了反应的路径
b.加入KI后改变了总反应的能量变化
c.H2O2 + I= H2O + IO是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
① 加CCl4并振荡、静置后还可观察到 ,说明有I2生成。
② 气泡明显减少的原因可能是:
ⅰ. H2O2浓度降低;
ⅱ. 。
以下对照实验说明ⅰ不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是 。
(4)资料4:I+ I I K= 640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10 mL 0.10 mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 I I I
浓度/ (mol·L-1) 2.5×10-3 a 4.0×10-3
① a = 。
② 该平衡体系中除了含有I、I和I外,一定还含有其他含碘微粒,理由是 。
参考答案:
1.B
2.D
3.C
4.B
5.B
6.A
7.A
8.A
9.D
10.A
11.(1) 外界 一定程度 发生变化
(2) 可逆 v正=v逆 物质恒定 动态平衡,反应没停止 条件变,平衡移动
12. 0.013 1.0 使用催化剂 > >
13. 0.0065 mol L﹣1 min﹣1 用催化剂 > < 温度降低,C的平衡浓度增大,说明正反应放热 abd a+c=5 b+1/2c=3 3<a≤5
14.(1) > =
(2)4
(3)
(4)50%
(5)BD
(6)10∶9
15. 放出 92 合成氨是可逆反应,反应物不能完全转化 a c f
16. 2A(g)+B(g)3C(g) 0.2mol/(L·min) 33.3% 1:1
17. 减小 0.0003mol·L-1·min-1 2CO+4H2CH3OCH3+H2O < 增大 不变 a2/V2
18. 2X 3Y+Z mol/(L·min) C
19. -76 反应Ⅱ有CO生成,CO浓度增大使反应Ⅰ平衡逆向进行,乙烯的产率减小 选择合适的催化剂 >
20. 0.05 不 B 1.2 D
21. 浓度 2 293K < BC 其他条件相同时,增大反应物浓度,反应速率增大 1.25×10-3mol/(L·s) 2MnO42-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O 作催化剂
22.(1) 浓度和催化剂 2+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2) 温度 KMnO4溶液过量
23. 2H2O2 = 2H2O+O2↑ a 下层溶液呈紫红色 在水溶液中I2的浓度降低 B试管中产生气泡速率没有明显减小 2.5×10-3 2c(I2) + c(I -) + 3c(I3-)<0.033 mol·L-1
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
