人教版(2019) 高中化学选择性必修1 1.2.1盖斯定律提升练(含答案)
文档属性
| 名称 | 人教版(2019) 高中化学选择性必修1 1.2.1盖斯定律提升练(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-22 12:57:28 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
1.2.1盖斯定律提升练-人教版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.已知几种离子反应如下:
①
②
③
④
下列推断正确的是
A.,
B.
C.
D.
2.已知:;。现有0.2mol的碳粉和氢气组成的混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
A.1∶1 B.1∶2 C.2∶3 D.3∶2
3.已知:①2H2(g)+O2(g)=2H2O(g) ΔH1;
②2Fe(s)+ O2(g)=Fe2O3(s) ΔH2;
③2Al(s)+ O2(g)=Al2O3(s) ΔH3;
④2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) ΔH4。
下列关于反应焓变的判断正确的是
A.H2的燃烧热为ΔH1 B.ΔH2=ΔH3+ΔH4
C.增加氧气的量可改变ΔH2、ΔH3的值 D.ΔH3<ΔH2
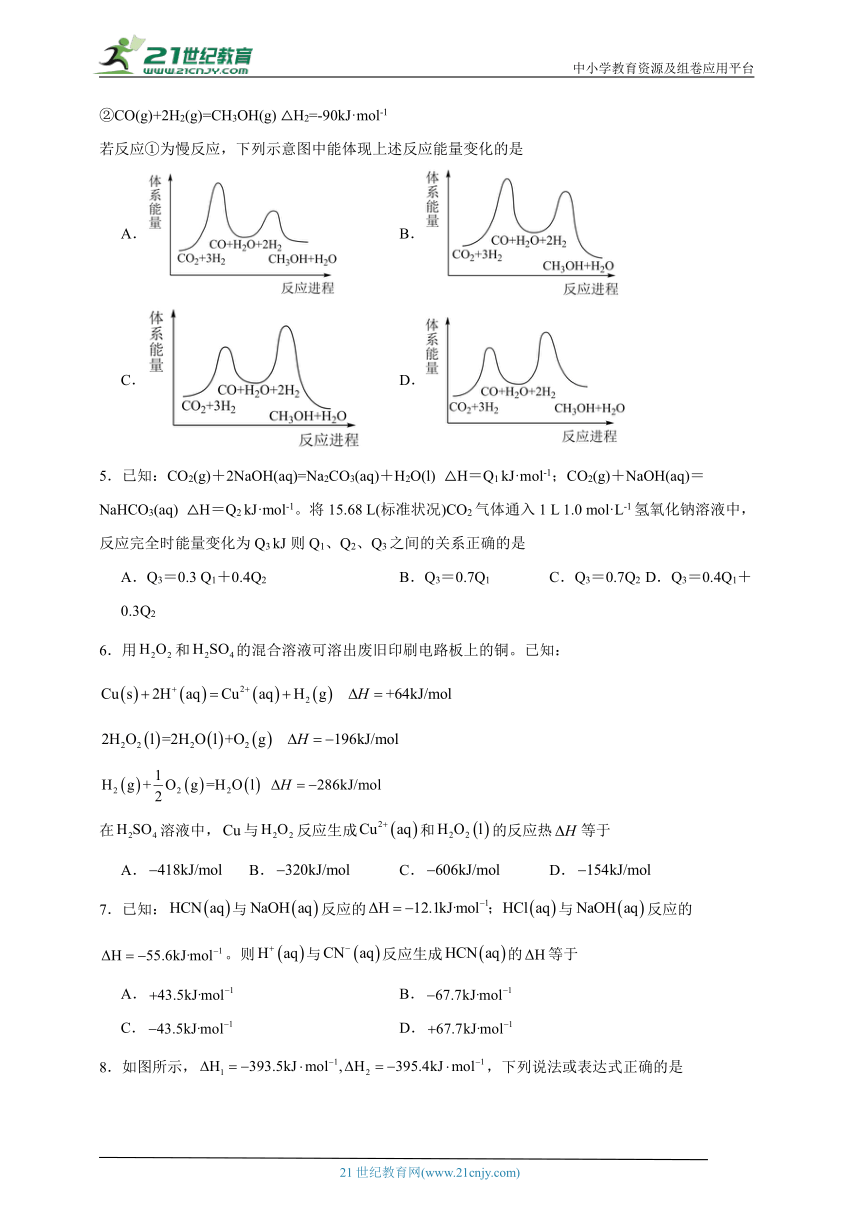
4.二氧化碳加氢制甲醇一般认为通过如下两步反应来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ·mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ·mol-1
若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
A. B.
C. D.
5.已知:CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=Q1 kJ·mol-1;CO2(g)+NaOH(aq)=NaHCO3(aq) △H=Q2 kJ·mol-1。将15.68 L(标准状况)CO2气体通入1 L 1.0 mol·L-1氢氧化钠溶液中,反应完全时能量变化为Q3 kJ则Q1、Q2、Q3之间的关系正确的是
A.Q3=0.3 Q1+0.4Q2 B.Q3=0.7Q1 C.Q3=0.7Q2 D.Q3=0.4Q1+0.3Q2
6.用和的混合溶液可溶出废旧印刷电路板上的铜。已知:
在溶液中,与反应生成和的反应热等于
A. B. C. D.
7.已知:与反应的与反应的。则与反应生成的等于
A. B.
C. D.
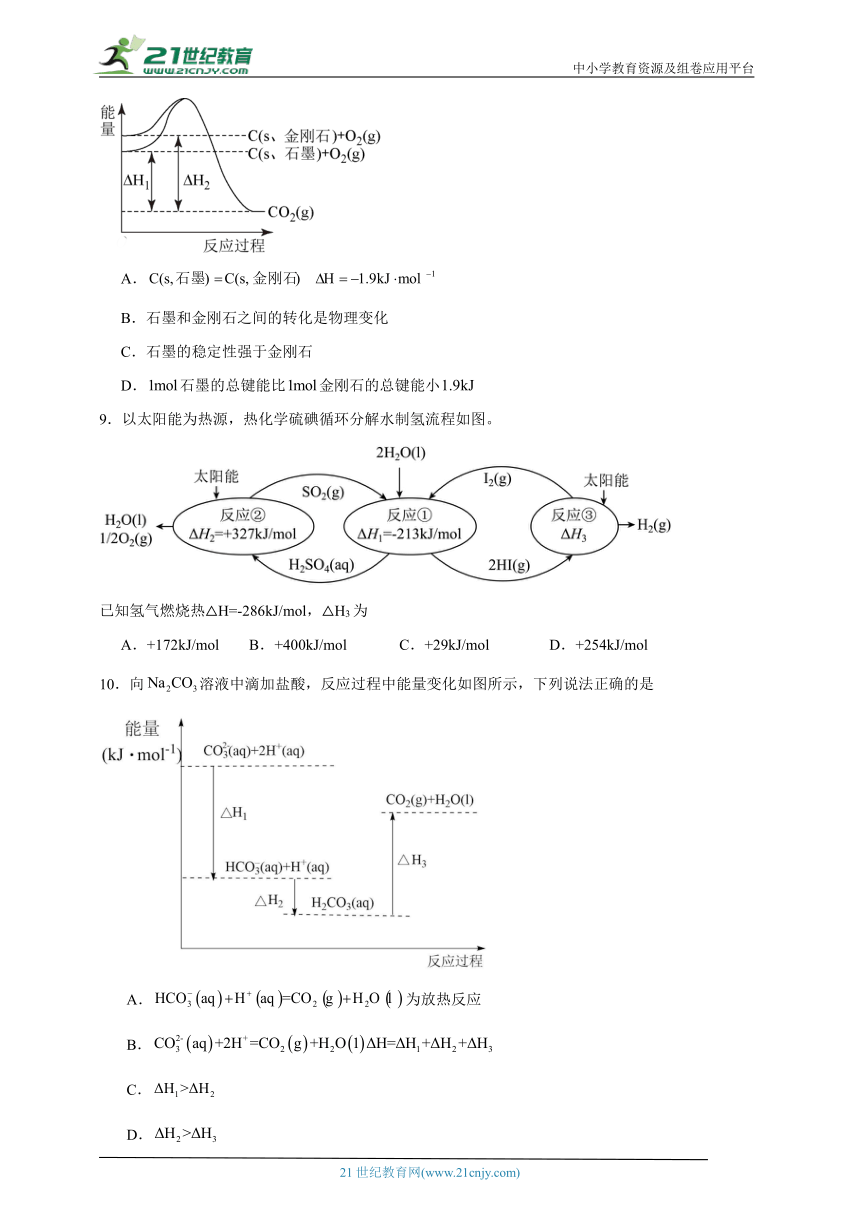
8.如图所示,,下列说法或表达式正确的是
A.
B.石墨和金刚石之间的转化是物理变化
C.石墨的稳定性强于金刚石
D.石墨的总键能比金刚石的总键能小
9.以太阳能为热源,热化学硫碘循环分解水制氢流程如图。
已知氢气燃烧热△H=-286kJ/mol,△H3为
A.+172kJ/mol B.+400kJ/mol C.+29kJ/mol D.+254kJ/mol
10.向溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是
A.为放热反应
B.
C.
D.
二、填空题
11.已知:
C(石墨,s)+O2(g)=CO2(g) ΔH1=-akJ mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-bkJ mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-ckJ mol-1
根据盖斯定律,计算298K时由C(石墨,s)和H2(g)生成1molC2H2(g)反应的焓变ΔH= (用含有a,b,c的式子表示)
12.请回答下列问题:
(1)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:
途径Ⅱ:
(a、b、c、d均为正值)
判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量 (填“大于”“等于”或“小于”)途径Ⅱ放出的热量。的反应中,反应物具有的总能量 (填“大于”“等于”或“小于”)生成物具有的总能量,b与a、c、d的数学关系式是 。
(2)催化重整反应为。
已知:
该催化重整反应的 kJ/mol。
(3)已知:298K时,相关物质的相对能量如图所示。
请根据相关物质的相对能量计算反应的焓变 。
(4)现有下列3个热化学方程式:
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学方程式: 。
13.请回答下列问题:
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下16g SiH4自燃放出热量713.6kJ。SiH4自燃的热化学方程式为 。
(2)标准摩尔生成焓是指在25℃和101kPa时,最稳定的单质生成1mol化合物的焓变。
已知25℃和101kPa时下列反应:①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) H=-3116kJ/mol
②C(石墨,s)+O2(g)=CO2(g) H=-393.5kJ/mol
③2H2(g)+O2(g)=2H2O(l) H=-571.6kJ/mol
写出乙烷标准摩尔生成焓的热化学方程式: 。
(3)肼(N2H4)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1mol化学键需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1mol N-H键需要 kJ的能量。
14.NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g)=N2(g)+O2(g) △H=-180.5kJ·mol-1
2H2O(l)=2H2(g)+O2(g) △H=+571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是 。
15.回答下列问题
(1)某化学兴趣小组要完成中和热的测定实验。实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、温度计、0.5 mol·L-1盐酸、0.55 mol·L-1氢氧化钠溶液。实验尚缺少的玻璃用品是 。若用醋酸代替盐酸做实验,测得的中和热数值 (填“偏大”、“偏小”或“无影响”)。
(2)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,则E1 (填“增大”、“减小”或“不变”,下同),ΔH 。请写出NO2和CO反应的热化学方程式: 。
(3)在25℃、101 kPa时,1 g CH4完全燃烧生成液态水时放出的热量是55.7kJ,则表示甲烷燃烧热的热化学方程式是 。
(4)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5 kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2=-64.4 kJ·mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3= 。
16.CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)在温度高于31.26℃、压强高于7.29×106Pa时,CO2处于超临界状态,称为超临界CO2流体,它可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,用超临界CO2萃取的优点有: (答出一点即可)。
(2)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na—Fe3O4和HMCM—22的表面将CO2转化为烷烃,其过程如图。
图中CO2转化为CO的反应为:CO2(g)+H2(g)= CO(g)+H2O(g) ΔH=+41kJ/mol
已知:2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) ΔH=-128kJ/mol
①则图中CO转化为C2H4的热化学方程式是 。
②按系统命名法,图中X的名称是 。
③关于X与Y的说法正确的是 (填字母)。
a.实验式相同
b.都有4种一氯代物
c.都易使酸性KMnO4溶液褪色
④催化剂中Fe3O4的制备方法如下:将一定比例的FeCl2和FeCl3溶于盐酸,然后在60℃下逐滴加入NaOH溶液至pH≈10,继续搅拌,得Fe3O4。该反应的离子方程式是 。
17.氮及氮的化合物有着重要的用途。
(1)氮元素在周期表中的位置是 ; NH3的电子式是 。
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径 (用化学方程式表示)。
(3)工业合成氨是人工固氮的重要方法。2007年化学家格哈德 埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下图:
下列说法正确的是 (选填字母)。
a 图①表示N2、H2分子中均是单键
b 图②→图③需要吸收能量
c 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)已知:N2(g)+3H2(g)=2NH3(g) △H= -92.4 kJ/mol,2H2(g)+O2(g)=2H2O(g) △H = -483.6kJ/mol,则氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式是 。
(5)水合肼(N2H4 H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,通常在催化剂存在下,用次氯酸钠与氨反应可制备,该反应的化学方程式是 。
18.Ⅰ.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
元素 Al B Be C Cl F Li
X的数值 1.5 2.0 1.5 2.5 2.8 4.0 1.0
元素 Mg Na O P S Si
X的数值 1.2 0.9 3.5 2.1 2.5 1.7
试结合元素周期律知识完成下列问题:
(1)请预测K与Rb元素的X数值的大小关系:K Rb (填“>”、“=”或“<”)。
(2)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键,试推断AlBr3中的化学键类型是 。
(3)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于 原子(填元素符号).
(4)简述第二周期元素(除稀有气体外)的X的数值大小与原子半径之间的关系: 。
Ⅱ.(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
①第一步反应是 反应(选填“放热”或“吸热”),判断依据 。
②1 molNH4+(aq)全部氧化成NO3- (aq)的热化学方程式 。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3= 297 kJ/mol
反应Ⅱ的热化学方程式: 。
(3)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
CO2的量 NaOH的量 放出的热量
22.0 g 750 mL 1.0 mol/L x kJ
1.0 mol 2.0 L 1.0 mol/L y kJ
写出该条件下,CO2与NaOH反应生成NaHCO3的热化学方 。
19.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)此反应的热化学方程式为 。
(2)又已知H2O(g)===H2O(l) ΔH=-44 kJ·mol-1则16 g液态肼与足量液态双氧水反应生成液态水时放出的热量为 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)发射卫星可用气态肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1 N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 气态肼和二氧化氮反应的热化学方程式为 。
(5)反应2H2+O22H2O的能量变化如图所示。
已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ) (填“吸收”或“放出”) kJ。
20.Ⅰ:载人航天器中,利用萨巴蒂尔反应将航天员呼出的转化为,再通过电解获得,实现的再生。
已知:①
②
请回答:
(1)反应②属于 (填“吸热”或“放热”)反应。
(2)反应①消耗时,反应 (填“吸热”或“放热”)热量,其数值为 kJ。
(3)反应②热量变化为时,生成的质量为 。
(4)反应 。
Ⅱ:资源化利用的方法之一是合成二甲醚。催化加氢合成二甲醚的过程中主要发生下列反应:
反应Ⅰ:
反应Ⅱ:
(5)其中,反应Ⅱ:分以下①②两步完成,请写出反应①的热化学方程式。
① 。
②
三、实验题
21.50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”、“不相等”),所求中和热 ,(填“相等”、“不相等”)。
(3)化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是 (填序号)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(4)已知N2(g)+2O2(g)=2NO2(g) H=+67.7 kJ·mol-1, N2H4(g)+O2(g)= N2(g)+2H2O (g) H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式 。
22.铁及碳的化合物在社会生产、生活中有着广泛的应用。请回答下列问题:
i.磁铁矿是工业上冶炼铁的原料之一。
已知:①Fe3O4(s)+4C(s)3Fe(s)+4CO(g) △H=+646.0 kJ mol﹣1
②C(s)+CO2(g)2CO(g) △H=+172.5 kJ mol﹣1
则Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) △H= 。
ii.利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的酸用水冲洗干净;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
使盐酸与NaOH溶液混合均匀的正确操作是 (填字母)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知。为了计算中和热,某学生实验记录数据如下:
实验 序号 起始温度t1/℃ 终止温度t2/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.5 20.6 23.6
依据该学生的实验数据计算,该实验测得的中和热ΔH= (结果保留一位小数)。
(3) (填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是 。
23.实验室利用下列装置模拟工业生产制备少量硝酸。
(1)实验结束时,两种反应气体中需要再持续通入 (填化学式)一段时间。
(2)B中反应的化学方程式为 。
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是_______
A. B. C. D.
(4)已知:①2H2(g)+O2(g)=2H2O(1) △H=-571.5kJ/mol
②N2(g)+2O2(g)=2NO2(g) △H=+68.0kJ/mol
③N2(g)+3H2(g)=2NH3(g) △H=-92.5kJ/mol
则:8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) △H= kJ/mol
(5)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟是 (填化学式)。
②理论上使氨气完全转化为硝酸,则NH3与O2(相同条件下)的体积比应满足V(NH3):V(O2) 。
参考答案:
1.C
2.A
3.D
4.B
5.A
6.B
7.C
8.C
9.A
10.B
11.(c-b)-2akJ mol-1
12.(1) 等于 小于
(2)+247
(3)
(4)
13.(1)SiH4(g)+O2(g)=SiO2(s)+2H2O(l) H=-1427.2kJ/mol
(2)2C(石墨,s)+3H2(g)=C2H6(g) H=-86.4kJ/mol
(3)391
14.2H2(g)+2NO(g)=N2(g)+2H2O(l) △H=-752.1kJ·mol-1
15.(1) 环形玻璃搅拌棒或玻璃搅拌器 偏小
(2) 减小 不变 NO2(g)+CO(g) = CO2(g)+NO(g) ΔH=-234 kJ·mol-1
(3)CH4(g)+2O2(g) = CO2(g)+2H2O(l) ΔH=-891.2 kJ·mol-1
(4)+84.6 kJ·mol-1
16. 萃取剂与溶质更易分离(或萃取剂更环保等) 2CO(g)+4H2(g)=C2H4(g)+2H2O(g) ΔH=-210kJ/mol 2—甲基丁烷 b Fe2++2Fe3++8OH-=Fe3O4↓+4H2O
17. 第2周期VA族 N2 + O22NO bc 4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= -1266 kJ/mol NaClO+2NH3═N2H4 H2O+NaCl
18. > 共价键 N 原子半径越小,X的数值越大 放热 ΔH=-273kJ/mol<0 (或反应物的总能量大于生成物的总能量) NH4+(aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)ΔH=-346 kJ/mol 3SO2(g)+2H2O(g)= 2H2SO4(l)+S(s) ΔH2=-254 kJ/mol NaOH(aq)+CO2(g)=NaHCO3(aq) ΔH=-(4x-y) kJ/mol
19. N2H4(l) + 2H2O2(l)=N2(g) + 4H2O(g) ΔH=-640 kJ·mol-1 408 不产生污染性物质 2N2H4(g) +2NO2(g)== 3N2(g)+4H2O(g) ΔH=-1000.3 kJ·mol-1 放出 1852
20.(1)放热
(2) 放出 252.9
(3)32g
(4)-890.3
(5)CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH= 49.5kJ mol 1
21.(1)环形玻璃搅拌棒
(2) 不相等 相等
(3)c
(4)
22. -44.0 kJ/mol D -51.8 kJ·mol-1 不能 H2SO4与Ba(OH)2反应时生成BaSO4沉淀的生成热会影响反应的中和热
23.(1)O2
(2)3NO2+H2O=2HNO3+NO
(3)B
(4)-3263
(5) NH4NO3 1/2
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
1.2.1盖斯定律提升练-人教版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.已知几种离子反应如下:
①
②
③
④
下列推断正确的是
A.,
B.
C.
D.
2.已知:;。现有0.2mol的碳粉和氢气组成的混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为
A.1∶1 B.1∶2 C.2∶3 D.3∶2
3.已知:①2H2(g)+O2(g)=2H2O(g) ΔH1;
②2Fe(s)+ O2(g)=Fe2O3(s) ΔH2;
③2Al(s)+ O2(g)=Al2O3(s) ΔH3;
④2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) ΔH4。
下列关于反应焓变的判断正确的是
A.H2的燃烧热为ΔH1 B.ΔH2=ΔH3+ΔH4
C.增加氧气的量可改变ΔH2、ΔH3的值 D.ΔH3<ΔH2
4.二氧化碳加氢制甲醇一般认为通过如下两步反应来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) △H1=+41kJ·mol-1
②CO(g)+2H2(g)=CH3OH(g) △H2=-90kJ·mol-1
若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
A. B.
C. D.
5.已知:CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=Q1 kJ·mol-1;CO2(g)+NaOH(aq)=NaHCO3(aq) △H=Q2 kJ·mol-1。将15.68 L(标准状况)CO2气体通入1 L 1.0 mol·L-1氢氧化钠溶液中,反应完全时能量变化为Q3 kJ则Q1、Q2、Q3之间的关系正确的是
A.Q3=0.3 Q1+0.4Q2 B.Q3=0.7Q1 C.Q3=0.7Q2 D.Q3=0.4Q1+0.3Q2
6.用和的混合溶液可溶出废旧印刷电路板上的铜。已知:
在溶液中,与反应生成和的反应热等于
A. B. C. D.
7.已知:与反应的与反应的。则与反应生成的等于
A. B.
C. D.
8.如图所示,,下列说法或表达式正确的是
A.
B.石墨和金刚石之间的转化是物理变化
C.石墨的稳定性强于金刚石
D.石墨的总键能比金刚石的总键能小
9.以太阳能为热源,热化学硫碘循环分解水制氢流程如图。
已知氢气燃烧热△H=-286kJ/mol,△H3为
A.+172kJ/mol B.+400kJ/mol C.+29kJ/mol D.+254kJ/mol
10.向溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法正确的是
A.为放热反应
B.
C.
D.
二、填空题
11.已知:
C(石墨,s)+O2(g)=CO2(g) ΔH1=-akJ mol-1
2H2(g)+O2(g)=2H2O(l) ΔH2=-bkJ mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-ckJ mol-1
根据盖斯定律,计算298K时由C(石墨,s)和H2(g)生成1molC2H2(g)反应的焓变ΔH= (用含有a,b,c的式子表示)
12.请回答下列问题:
(1)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:
途径Ⅱ:
(a、b、c、d均为正值)
判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量 (填“大于”“等于”或“小于”)途径Ⅱ放出的热量。的反应中,反应物具有的总能量 (填“大于”“等于”或“小于”)生成物具有的总能量,b与a、c、d的数学关系式是 。
(2)催化重整反应为。
已知:
该催化重整反应的 kJ/mol。
(3)已知:298K时,相关物质的相对能量如图所示。
请根据相关物质的相对能量计算反应的焓变 。
(4)现有下列3个热化学方程式:
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学方程式: 。
13.请回答下列问题:
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下16g SiH4自燃放出热量713.6kJ。SiH4自燃的热化学方程式为 。
(2)标准摩尔生成焓是指在25℃和101kPa时,最稳定的单质生成1mol化合物的焓变。
已知25℃和101kPa时下列反应:①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) H=-3116kJ/mol
②C(石墨,s)+O2(g)=CO2(g) H=-393.5kJ/mol
③2H2(g)+O2(g)=2H2O(l) H=-571.6kJ/mol
写出乙烷标准摩尔生成焓的热化学方程式: 。
(3)肼(N2H4)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1mol化学键需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1mol N-H键需要 kJ的能量。
14.NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g)=N2(g)+O2(g) △H=-180.5kJ·mol-1
2H2O(l)=2H2(g)+O2(g) △H=+571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是 。
15.回答下列问题
(1)某化学兴趣小组要完成中和热的测定实验。实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、温度计、0.5 mol·L-1盐酸、0.55 mol·L-1氢氧化钠溶液。实验尚缺少的玻璃用品是 。若用醋酸代替盐酸做实验,测得的中和热数值 (填“偏大”、“偏小”或“无影响”)。
(2)如图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,则E1 (填“增大”、“减小”或“不变”,下同),ΔH 。请写出NO2和CO反应的热化学方程式: 。
(3)在25℃、101 kPa时,1 g CH4完全燃烧生成液态水时放出的热量是55.7kJ,则表示甲烷燃烧热的热化学方程式是 。
(4)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)=MgH2(s) ΔH1=-74.5 kJ·mol-1;
Mg2Ni(s)+2H2(g)=Mg2NiH4(s) ΔH2=-64.4 kJ·mol-1;
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s) ΔH3= 。
16.CO2的有效利用可以缓解温室效应和能源短缺问题。
(1)在温度高于31.26℃、压强高于7.29×106Pa时,CO2处于超临界状态,称为超临界CO2流体,它可用作萃取剂提取草药中的有效成分。与用有机溶剂萃取相比,用超临界CO2萃取的优点有: (答出一点即可)。
(2)中科院大连化学物理研究所的科研人员在新型纳米催化剂Na—Fe3O4和HMCM—22的表面将CO2转化为烷烃,其过程如图。
图中CO2转化为CO的反应为:CO2(g)+H2(g)= CO(g)+H2O(g) ΔH=+41kJ/mol
已知:2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) ΔH=-128kJ/mol
①则图中CO转化为C2H4的热化学方程式是 。
②按系统命名法,图中X的名称是 。
③关于X与Y的说法正确的是 (填字母)。
a.实验式相同
b.都有4种一氯代物
c.都易使酸性KMnO4溶液褪色
④催化剂中Fe3O4的制备方法如下:将一定比例的FeCl2和FeCl3溶于盐酸,然后在60℃下逐滴加入NaOH溶液至pH≈10,继续搅拌,得Fe3O4。该反应的离子方程式是 。
17.氮及氮的化合物有着重要的用途。
(1)氮元素在周期表中的位置是 ; NH3的电子式是 。
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径 (用化学方程式表示)。
(3)工业合成氨是人工固氮的重要方法。2007年化学家格哈德 埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下图:
下列说法正确的是 (选填字母)。
a 图①表示N2、H2分子中均是单键
b 图②→图③需要吸收能量
c 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)已知:N2(g)+3H2(g)=2NH3(g) △H= -92.4 kJ/mol,2H2(g)+O2(g)=2H2O(g) △H = -483.6kJ/mol,则氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式是 。
(5)水合肼(N2H4 H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,通常在催化剂存在下,用次氯酸钠与氨反应可制备,该反应的化学方程式是 。
18.Ⅰ.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
元素 Al B Be C Cl F Li
X的数值 1.5 2.0 1.5 2.5 2.8 4.0 1.0
元素 Mg Na O P S Si
X的数值 1.2 0.9 3.5 2.1 2.5 1.7
试结合元素周期律知识完成下列问题:
(1)请预测K与Rb元素的X数值的大小关系:K Rb (填“>”、“=”或“<”)。
(2)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键,试推断AlBr3中的化学键类型是 。
(3)某有机化合物分子中含有S-N键,你认为该共用电子对偏向于 原子(填元素符号).
(4)简述第二周期元素(除稀有气体外)的X的数值大小与原子半径之间的关系: 。
Ⅱ.(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
①第一步反应是 反应(选填“放热”或“吸热”),判断依据 。
②1 molNH4+(aq)全部氧化成NO3- (aq)的热化学方程式 。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ/mol
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3= 297 kJ/mol
反应Ⅱ的热化学方程式: 。
(3)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
CO2的量 NaOH的量 放出的热量
22.0 g 750 mL 1.0 mol/L x kJ
1.0 mol 2.0 L 1.0 mol/L y kJ
写出该条件下,CO2与NaOH反应生成NaHCO3的热化学方 。
19.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4 mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)此反应的热化学方程式为 。
(2)又已知H2O(g)===H2O(l) ΔH=-44 kJ·mol-1则16 g液态肼与足量液态双氧水反应生成液态水时放出的热量为 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)发射卫星可用气态肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1 N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1 气态肼和二氧化氮反应的热化学方程式为 。
(5)反应2H2+O22H2O的能量变化如图所示。
已知拆开1 mol H2、1 molO2和1 mol H—O中的化学键分别需要消耗436 kJ、496 kJ和463 kJ的能量。则反应过程(Ⅱ) (填“吸收”或“放出”) kJ。
20.Ⅰ:载人航天器中,利用萨巴蒂尔反应将航天员呼出的转化为,再通过电解获得,实现的再生。
已知:①
②
请回答:
(1)反应②属于 (填“吸热”或“放热”)反应。
(2)反应①消耗时,反应 (填“吸热”或“放热”)热量,其数值为 kJ。
(3)反应②热量变化为时,生成的质量为 。
(4)反应 。
Ⅱ:资源化利用的方法之一是合成二甲醚。催化加氢合成二甲醚的过程中主要发生下列反应:
反应Ⅰ:
反应Ⅱ:
(5)其中,反应Ⅱ:分以下①②两步完成,请写出反应①的热化学方程式。
① 。
②
三、实验题
21.50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)实验中改用60mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”、“不相等”),所求中和热 ,(填“相等”、“不相等”)。
(3)化学反应中的能量变化,通常主要表现为热量的变化。下列反应中,属于放热反应的是 (填序号)。
a.Ba(OH)2·8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(4)已知N2(g)+2O2(g)=2NO2(g) H=+67.7 kJ·mol-1, N2H4(g)+O2(g)= N2(g)+2H2O (g) H=-534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式 。
22.铁及碳的化合物在社会生产、生活中有着广泛的应用。请回答下列问题:
i.磁铁矿是工业上冶炼铁的原料之一。
已知:①Fe3O4(s)+4C(s)3Fe(s)+4CO(g) △H=+646.0 kJ mol﹣1
②C(s)+CO2(g)2CO(g) △H=+172.5 kJ mol﹣1
则Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) △H= 。
ii.利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的酸用水冲洗干净;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
使盐酸与NaOH溶液混合均匀的正确操作是 (填字母)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知。为了计算中和热,某学生实验记录数据如下:
实验 序号 起始温度t1/℃ 终止温度t2/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.5 20.6 23.6
依据该学生的实验数据计算,该实验测得的中和热ΔH= (结果保留一位小数)。
(3) (填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是 。
23.实验室利用下列装置模拟工业生产制备少量硝酸。
(1)实验结束时,两种反应气体中需要再持续通入 (填化学式)一段时间。
(2)B中反应的化学方程式为 。
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是_______
A. B. C. D.
(4)已知:①2H2(g)+O2(g)=2H2O(1) △H=-571.5kJ/mol
②N2(g)+2O2(g)=2NO2(g) △H=+68.0kJ/mol
③N2(g)+3H2(g)=2NH3(g) △H=-92.5kJ/mol
则:8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) △H= kJ/mol
(5)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟是 (填化学式)。
②理论上使氨气完全转化为硝酸,则NH3与O2(相同条件下)的体积比应满足V(NH3):V(O2) 。
参考答案:
1.C
2.A
3.D
4.B
5.A
6.B
7.C
8.C
9.A
10.B
11.(c-b)-2akJ mol-1
12.(1) 等于 小于
(2)+247
(3)
(4)
13.(1)SiH4(g)+O2(g)=SiO2(s)+2H2O(l) H=-1427.2kJ/mol
(2)2C(石墨,s)+3H2(g)=C2H6(g) H=-86.4kJ/mol
(3)391
14.2H2(g)+2NO(g)=N2(g)+2H2O(l) △H=-752.1kJ·mol-1
15.(1) 环形玻璃搅拌棒或玻璃搅拌器 偏小
(2) 减小 不变 NO2(g)+CO(g) = CO2(g)+NO(g) ΔH=-234 kJ·mol-1
(3)CH4(g)+2O2(g) = CO2(g)+2H2O(l) ΔH=-891.2 kJ·mol-1
(4)+84.6 kJ·mol-1
16. 萃取剂与溶质更易分离(或萃取剂更环保等) 2CO(g)+4H2(g)=C2H4(g)+2H2O(g) ΔH=-210kJ/mol 2—甲基丁烷 b Fe2++2Fe3++8OH-=Fe3O4↓+4H2O
17. 第2周期VA族 N2 + O22NO bc 4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= -1266 kJ/mol NaClO+2NH3═N2H4 H2O+NaCl
18. > 共价键 N 原子半径越小,X的数值越大 放热 ΔH=-273kJ/mol<0 (或反应物的总能量大于生成物的总能量) NH4+(aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)ΔH=-346 kJ/mol 3SO2(g)+2H2O(g)= 2H2SO4(l)+S(s) ΔH2=-254 kJ/mol NaOH(aq)+CO2(g)=NaHCO3(aq) ΔH=-(4x-y) kJ/mol
19. N2H4(l) + 2H2O2(l)=N2(g) + 4H2O(g) ΔH=-640 kJ·mol-1 408 不产生污染性物质 2N2H4(g) +2NO2(g)== 3N2(g)+4H2O(g) ΔH=-1000.3 kJ·mol-1 放出 1852
20.(1)放热
(2) 放出 252.9
(3)32g
(4)-890.3
(5)CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH= 49.5kJ mol 1
21.(1)环形玻璃搅拌棒
(2) 不相等 相等
(3)c
(4)
22. -44.0 kJ/mol D -51.8 kJ·mol-1 不能 H2SO4与Ba(OH)2反应时生成BaSO4沉淀的生成热会影响反应的中和热
23.(1)O2
(2)3NO2+H2O=2HNO3+NO
(3)B
(4)-3263
(5) NH4NO3 1/2
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
