人教版(2019) 高中化学选择性必修1 2.1.3活化能提升练(含答案)
文档属性
| 名称 | 人教版(2019) 高中化学选择性必修1 2.1.3活化能提升练(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-22 12:59:16 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2.1.3活化能提升练-人教版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列说法正确的是
A.增大反应容器内的压强,化学反应速率一定增大
B.增大反应物的浓度,能够增大活化分子的百分数
C.当化学反应速率发生变化时,化学平衡一定发生移动
D.理想的催化剂能大幅度提高目标产物在最终产物中的比例
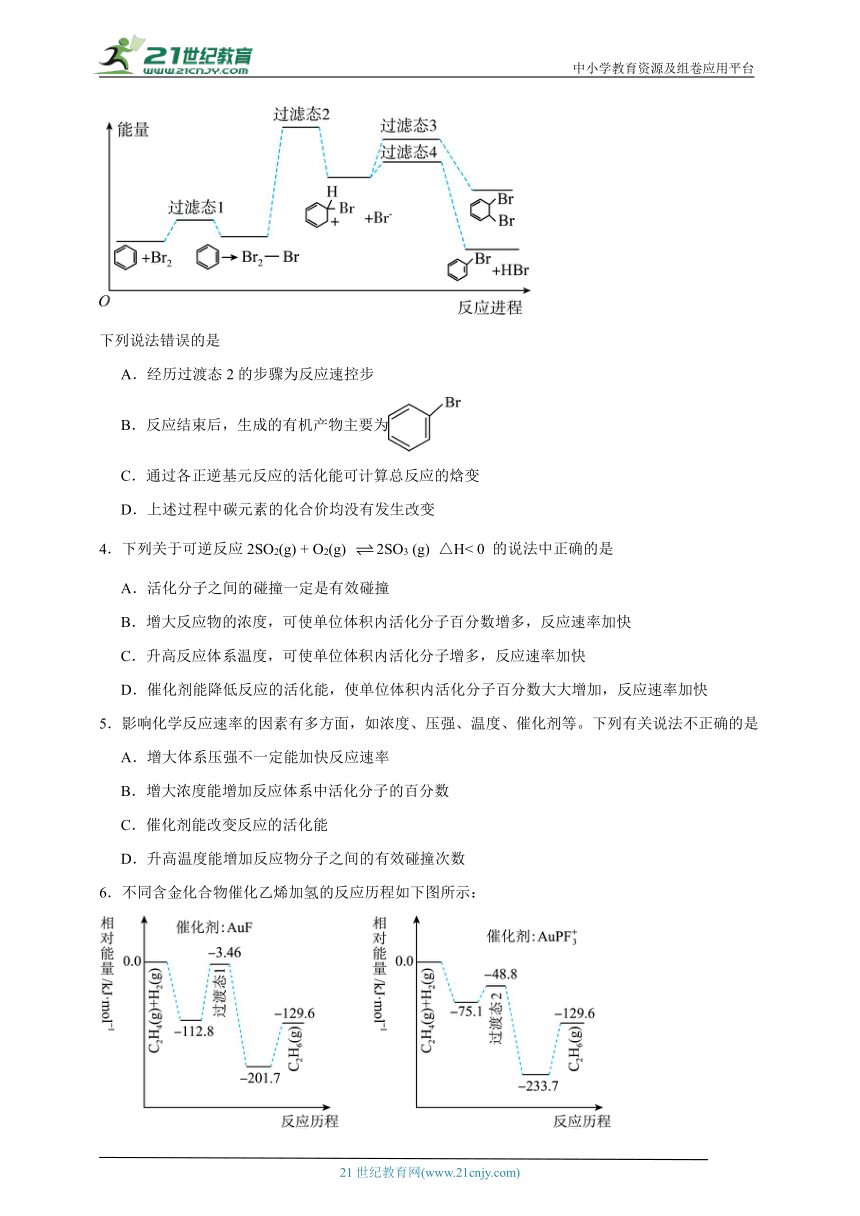
2.Ni可活化C2H6放出CH4,其反应历程如图所示:
下列关于活化历程的说法错误的是
A.此反应的决速步骤:中间体2→中间体3
B.只涉及C—H的断裂和生成
C.在此反应过程中Ni的成键数目发生变化
D.Ni(s)+C2H6(g)=NiCH2(s)+CH4(g) △H=-6.57kJ·mol-1
3.溴单质与苯发生取代反应的部分反应历程可表示为 ,并有副产物 生成,能量变化如图所示。
下列说法错误的是
A.经历过渡态2的步骤为反应速控步
B.反应结束后,生成的有机产物主要为
C.通过各正逆基元反应的活化能可计算总反应的焓变
D.上述过程中碳元素的化合价均没有发生改变
4.下列关于可逆反应2SO2(g) + O2(g) 2SO3 (g) △H< 0 的说法中正确的是
A.活化分子之间的碰撞一定是有效碰撞
B.增大反应物的浓度,可使单位体积内活化分子百分数增多,反应速率加快
C.升高反应体系温度,可使单位体积内活化分子增多,反应速率加快
D.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加,反应速率加快
5.影响化学反应速率的因素有多方面,如浓度、压强、温度、催化剂等。下列有关说法不正确的是
A.增大体系压强不一定能加快反应速率
B.增大浓度能增加反应体系中活化分子的百分数
C.催化剂能改变反应的活化能
D.升高温度能增加反应物分子之间的有效碰撞次数
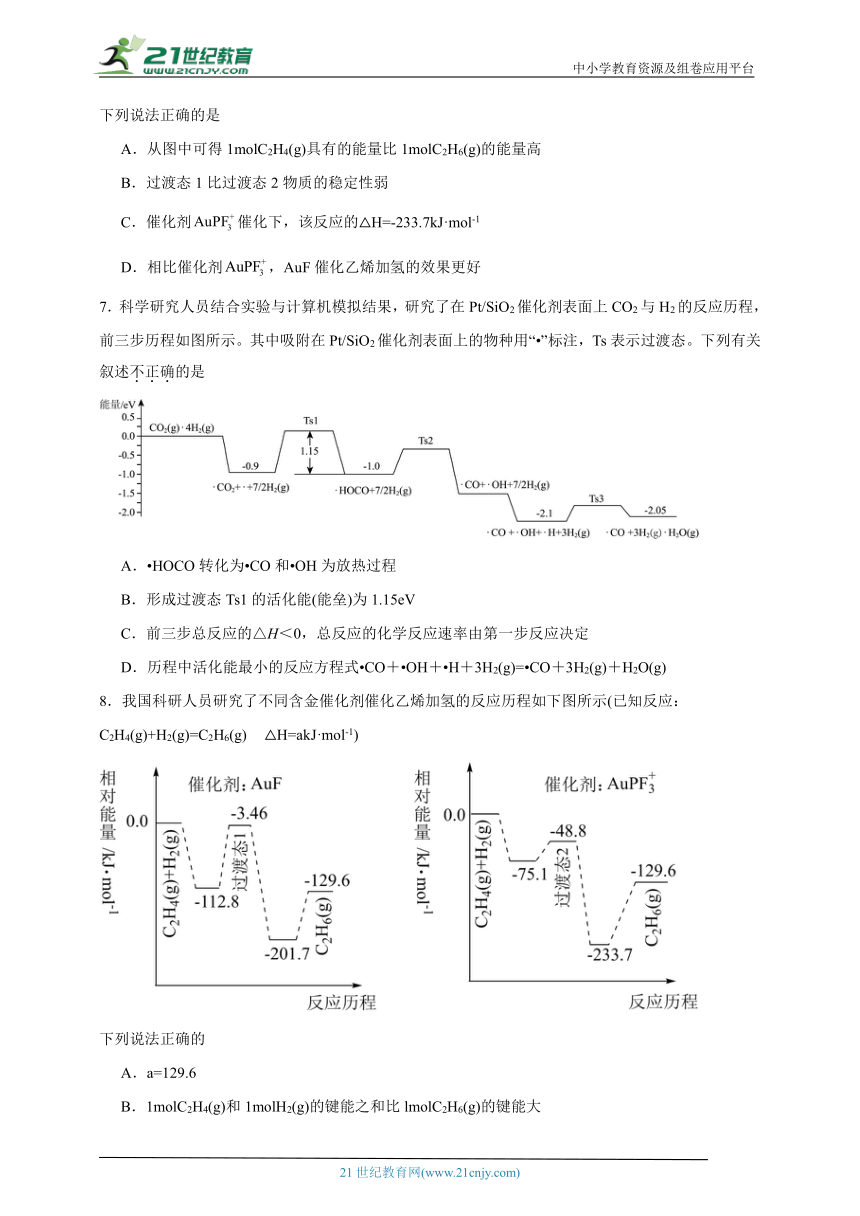
6.不同含金化合物催化乙烯加氢的反应历程如下图所示:
下列说法正确的是
A.从图中可得1molC2H4(g)具有的能量比1molC2H6(g)的能量高
B.过渡态1比过渡态2物质的稳定性弱
C.催化剂催化下,该反应的△H=-233.7kJ·mol-1
D.相比催化剂,AuF催化乙烯加氢的效果更好
7.科学研究人员结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示。其中吸附在Pt/SiO2催化剂表面上的物种用“ ”标注,Ts表示过渡态。下列有关叙述不正确的是
A. HOCO转化为 CO和 OH为放热过程
B.形成过渡态Ts1的活化能(能垒)为1.15eV
C.前三步总反应的△H<0,总反应的化学反应速率由第一步反应决定
D.历程中活化能最小的反应方程式 CO+ OH+ H+3H2(g)= CO+3H2(g)+H2O(g)
8.我国科研人员研究了不同含金催化剂催化乙烯加氢的反应历程如下图所示(已知反应:C2H4(g)+H2(g)=C2H6(g) △H=akJ·mol-1)
下列说法正确的
A.a=129.6
B.1molC2H4(g)和1molH2(g)的键能之和比lmolC2H6(g)的键能大
C.催化乙烯加氢效果较好的催化剂是AuPF
D.稳定性:过渡态1>过渡态2
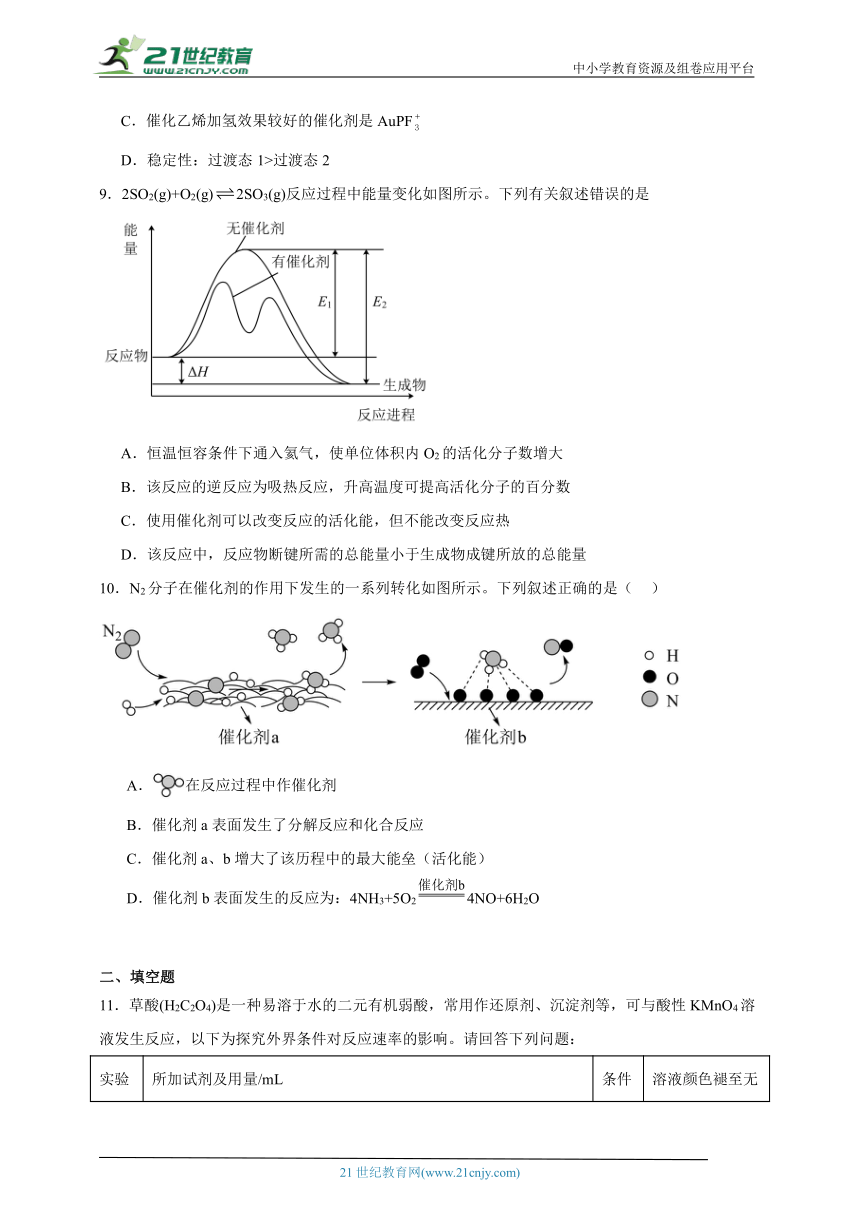
9.2SO2(g)+O2(g)2SO3(g)反应过程中能量变化如图所示。下列有关叙述错误的是
A.恒温恒容条件下通入氦气,使单位体积内O2的活化分子数增大
B.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
C.使用催化剂可以改变反应的活化能,但不能改变反应热
D.该反应中,反应物断键所需的总能量小于生成物成键所放的总能量
10.N2分子在催化剂的作用下发生的一系列转化如图所示。下列叙述正确的是( )
A.在反应过程中作催化剂
B.催化剂a表面发生了分解反应和化合反应
C.催化剂a、b增大了该历程中的最大能垒(活化能)
D.催化剂b表面发生的反应为:4NH3+5O24NO+6H2O
二、填空题
11.草酸(H2C2O4)是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性KMnO4溶液发生反应,以下为探究外界条件对反应速率的影响。请回答下列问题:
实验编号 所加试剂及用量/mL 条件 溶液颜色褪至无色所需时间/min
0.01mol·L-1H2C2O4溶液 0.01mol·L-1KMnO4溶液 3.0mol·L-1稀H2SO4 水 温度/℃
1 12.0 2.0 3.0 3.0 20 t1
2 6.0 2.0 3.0 V1 20 t2
3 V2 2.0 3.0 9.0 30 t3
(1)硫酸酸化的高锰酸钾溶液与草酸溶液反应的离子方程式为 。
(2)完成此实验设计,其中:V1= ,V2= 。
(3)对比实验1、2可探究 对反应速率的影响。
12.在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ·mol-1表示。请认真观察下图,然后回答问题。
(1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)环境先提供能量,该反应的ΔH= (用含E1、E2的代数式表示)
(2)已知:H2(g)+O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1。则其逆反应的活化能为
(3)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能 (填“升高”“降低”或“不变”),对反应热是否有影响 ,原因是
13.三甲胺[N(CH3)3]是重要的化工原料。最近我国科学家实现了使用铜催化剂将N,N-二甲基甲酰胺[(CH3)2NCHO,简称DMF]转化为三甲胺的合成路线。回答下列问题:
(1)结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:
该历程中最大能垒(活化能)= eV,该步骤的化学方程式为 。
(2)该反应变化的ΔH 0(填“<”、“>”或“=”),制备三甲胺的热化学方程式为 。
14.二氧化碳的回收利用是环保领域研究热点。
在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。总反应的化学方程式为 。
15.在日常生活和工农业生产中经常涉及到吸热反应和放热反应,回答下面问题:
(1)下列反应一定属于吸热反应的是 。
A.酸碱中和反应 B.燃烧反应
C. 铝热反应 D.C(s)+CO2(g)2CO(g)
(2)在101kPa时,H2在1.0molO2中完全燃烧,生成2.0mol液态水,放出571.6k的热量,表示氢气燃烧的热化学方程式为 ,氢气的燃烧热为 kJ mol-1。
(3)我国科学家利用计算机模拟了甲醇(CH3OH)与水在铜基催化剂上的反应机理和能量图如图:
①反应I的△H 0(填“<”“>”或“=”),反应Ⅱ的活化能是 kJ mol-1。
②在相同条件下反应I的反应速率 (填“<”“>”或“=”)反应Ⅱ的反应速率。
③写出反应Ⅱ的热化学方程式 。
(4)取30mL0.5mol L-1H2SO4溶液与50mL0.5mol L-1NaOH溶液于小烧杯中,用如图所示:装置进行中和反应反应热的测定实验。
①仪器a的名称是 。
②若实验中测得中和热数值总是偏小,可能的原因是 (答出一条即可)。
16.炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化氧可以快速氧化SO2。活化过程的能量变化模拟计算结果如图所示。
无水情况下,一个氧分子反应的活化能为 ,容易活化氧分子的条件是 (填“有水”或“无水”)。
17.汽车尾气中的氮氧化物是城市空气的主要污染物之一,如何降低汽车尾气污染已成为环保领域的热点。
回答下列问题:
(1)科技工作者用甲烷将氮氧化物还原为 N2和 H2O,涉及的反应如下:
CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+2NO2(g) =CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ/mol
则 CH4(g)还原 NO(g)生成 N2(g)的热化学方程式为 。
(2)使用氢能源可以减少汽车尾气中有害气体的排放。利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g) =CO2(g)+3H2(g) ΔH,该反应过程中的能量变化如图:
①ΔH 0(填“>”“=”或“<”)。
②途径(Ⅰ)的活化能 E= 。
③途径(Ⅰ)变为途径(Ⅱ):改变的条件是 ,反应热(ΔH) (填“增大”“减小”或“不变”)。
18.2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
(1)该反应通常用V2O5作催化剂加快反应的进行,加V2O5会使图中B点 (填“升高”或“降低”)。
(2)E的大小对该反应的反应热有无影响 。
(3)图中A表示SO2(g)和O2(g)的 。
(4)图中△H的意义是 。
(5)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物,四价钒化合物再被氧气氧化。写出该催化过程实际发生反应的化学方程式 , ;
(6)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= 。
19.反应3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g),在一可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率的变化是 (填增大、不变、减小,以下相同),原因是 。
(2)将容器的体积缩小一半,其正反应速率 ,逆反应速率 。
(3)保持体积不变,充入N2使体系压强增大,其正反应速率 ,逆反应速率 。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率 ,逆反应速率 。
20.活化能
(1)有效碰撞理论
①基元反应:大多数的化学反应往往经过多个反应步骤才能实现。其中 都称为基元反应。如2HI=H2+I2的2个基元反应为2HI→H2+2I·、2I·→I2。
②反应机理:先后进行的 反映了化学反应的反应历程,反应历程又称 。
③基元反应发生的先决条件
基元反应发生的先决条件是反应物的分子必须发生 ,但是并不是每一次分子碰撞都能发生化学反应。
④有效碰撞
概念: 。
条件:具有足够的 ;具有合适的 。
与反应速率的关系:有效碰撞的频率越高,则反应速率 。
⑤活化能和活化分子
活化分子:能够发生 的分子。对于某一化学反应来说,在一定条件下,反应物分子中活化分子的百分数是 的。
活化能:活化分子具有的 与反应物分子具有的平均能量之差,叫做反应的活化能。
(2)有效碰撞理论对影响化学反应速率因素的解释
①浓度:反应物浓度增大→单位体积内活化分子数 →单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
②压强:增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数 →单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。即压强对化学反应速率的影响,可转化成浓度对化学反应速率的影响。
③温度:微观解释:升高温度→活化分子的百分数 →单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
④催化剂:使用催化剂→改变了反应的历程,反应的活化能 →活化分子的百分数 →单位时间内有效碰撞的几率 →反应速率 。
三、实验题
21.Ⅰ.为比较和对分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察 的快慢,定性比较得出结论。有同学提出将,改为 ,更为合理,其理由是 ;
(2)定量分析。如图乙所示,实验时均以生成气体为准,其它可能影响实验的因素均己忽略。实验中需要测量的数据是 ;
(3)查阅资料得知:将作为催化剂的溶液加入溶液后,溶液中会发生两个氧化还原反应,且两个反应中均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:和 。
Ⅱ.欲用下图所示实验来证明是分解反应的催化剂。
(4)加入粉末于溶液中,在标准状况下放出气体的体积和时间的关系如图所示,A、B、C、D各点反应速率快慢的顺序为 (从大到小)。
Ⅲ.乙同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 反应温度/ 浓度 稀硫酸
① 20 10.0 0.10 10.0 0.50 0
② 40 0.10 0.50
③ 20 0.10 4.0 0.50
(5)该实验①、②可探究 对反应速率的影响,因此是 。实验①、③可探究硫酸浓度对反应速率的影响,因此 。
22.控制变量法是指实验中只有一个变量,从而直接得出因果关系。根据反应2KMnO4+ 5H2C2O4 +3H2SO4=2MnSO4 +10CO2↑+8H2O+ K2SO4设计下列实验探究外界条件对反应速率的影响:
试管编号 实验目的 KMnO4溶液 H2C2O4溶液 MnSO4 温度
浓度/(mol·L-1) 体积/mL 浓度/(mol·L-1) 体积/mL
I 为实验II~IV作参照 0.01 4.0 0.10 2.0 0 室温
II 0.01 4.0 0.20 2.0 0 室温
III 0.01 4.0 0.10 2.0 0 冰水浴
IV 探究催化剂对反应速率的影响 0.01 4.0 a b 加黄豆大小 室温
(1)实验II的目的是 ; 实验II褪色的时间比实验I的短,是因为 (用活化分子和有效碰撞的概念解释)。
(2)实验Ⅲ的目的是 ;实验I褪色的时间比实验Ⅲ的短,是因为 (填字母)。
A.单位体积内活化分子数目不变 B.活化分子百分数提高
C.较高能量分子碰撞频率不变 D.有效碰撞的几率提高
(3)实验IV缺少的数据a、b依次为 、 。
(4)测得实验IV比实验I褪色时间短得多。若将4.0 mL0.01 mol·L-1 KMnO4溶液逐滴滴入4.0mL0.10mol·L-1H2C2O4溶液中,发现紫色褪去的时间先慢后快,可能原因是 。
23.Ⅰ.50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出
(2)在测定中和热的实验中,计算反应热时需要的数据有
①酸的浓度和体积 ②碱的浓度和体积 ③比热容
④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B.①②③④ C. ②③④⑤ D.①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等”或“不相等”),所放出的热量 (填“相等”或“不相等”)
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 (填“偏大”、“偏小”或“无影响”).
Ⅱ.甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)CH3OH(g)。已知:①下图为反应的能量变化和物质键能
化学键 H-H H-O O=O
键能kJ/mol 436 x 496
②CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式 。
(2)H—O键的键能x为 kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为 kJ/mol。
参考答案:
1.D
2.B
3.D
4.D
5.B
6.B
7.B
8.C
9.A
10.D
11.(1)2MnO+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑
(2) 9.0 6.0
(3)浓度
12. 放热 需要 E2-E1 409.0 kJ·mol-1 降低 无影响 催化剂只能降低反应的活化能,不能改变反应物的总能量和生成物的总能量之差,即反应热不改变
13.(1) 1.19 eV N(CH3)3+OH*+H*=N(CH3)3(g)+H2O(g)
(2) < (CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) ΔH=-1.02NAeV/mol
14.CO2C+O2
15.(1)D
(2) 2H2(g)+O2(g)=2H2O △H=-571.6kJ mol-1 285.8
(3) > a < CO(g)+H2O(g)=CO2(g)+H2(g) △H=-bkJ mol-1或CO(g)+H2O(g)+2H2(g)=CO2(g)+3H2(g) △H=-bkJ mol-1
(4) 环形玻璃搅拌棒 实验装置保温、隔热效果差
16. 0.29eV 有水
17. CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ/mol > E4-E1 加入催化剂 不变
18. 降低 无影响 总能量 2molSO2(g)与 1molO2完全反应生成2molSO3(g)时,反应放出的热量 V2O5+ SO2=SO3+2VO2 4VO2+O2=2V2O5 0.025 mol·L-1·min-1
19.(1) 不变 铁是固体,增加铁的量,没有增加铁的浓度,不能改变反应速率
(2) 增大 增大
(3) 不变 不变
(4) 减小 减小
20. 每一步反应 基元反应 反应机理 碰撞 能够发生化学反应的碰撞 能量 取向 越快 有效碰撞 一定 平均能量 增多 增加 增大 减小 增多 增加 增大 减小 增大 增加 增大 减小 降低 增大 增加 加快
21.(1) 产生气泡 0.05 排出阴离子的干扰
(2)生成40mL气体所需要的时间
(3)2Fe2++H2O2+2H+=2Fe3++2H2O
(4)D>C>B>A
(5) 反应温度 10.0 6.0
22.(1) 探究浓度对反应速率的影响 反应物浓度增大,单位体积内活化分子数增多,有效碰撞次数增多,反应速率加快
(2) 探究温度对反应速率的影响 BD
(3) 0.10 2.0
(4)Mn2+可能是反应的催化剂
23. 无环形玻璃搅拌棒、在大小烧杯间没填满碎纸条
、大小烧杯口不相平 B 相等 不相等 偏小 CH3OH(g)+ O2(g)=CO2(g)+2H2O(l)△H=-757kJ mol-1 462 510
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2.1.3活化能提升练-人教版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列说法正确的是
A.增大反应容器内的压强,化学反应速率一定增大
B.增大反应物的浓度,能够增大活化分子的百分数
C.当化学反应速率发生变化时,化学平衡一定发生移动
D.理想的催化剂能大幅度提高目标产物在最终产物中的比例
2.Ni可活化C2H6放出CH4,其反应历程如图所示:
下列关于活化历程的说法错误的是
A.此反应的决速步骤:中间体2→中间体3
B.只涉及C—H的断裂和生成
C.在此反应过程中Ni的成键数目发生变化
D.Ni(s)+C2H6(g)=NiCH2(s)+CH4(g) △H=-6.57kJ·mol-1
3.溴单质与苯发生取代反应的部分反应历程可表示为 ,并有副产物 生成,能量变化如图所示。
下列说法错误的是
A.经历过渡态2的步骤为反应速控步
B.反应结束后,生成的有机产物主要为
C.通过各正逆基元反应的活化能可计算总反应的焓变
D.上述过程中碳元素的化合价均没有发生改变
4.下列关于可逆反应2SO2(g) + O2(g) 2SO3 (g) △H< 0 的说法中正确的是
A.活化分子之间的碰撞一定是有效碰撞
B.增大反应物的浓度,可使单位体积内活化分子百分数增多,反应速率加快
C.升高反应体系温度,可使单位体积内活化分子增多,反应速率加快
D.催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加,反应速率加快
5.影响化学反应速率的因素有多方面,如浓度、压强、温度、催化剂等。下列有关说法不正确的是
A.增大体系压强不一定能加快反应速率
B.增大浓度能增加反应体系中活化分子的百分数
C.催化剂能改变反应的活化能
D.升高温度能增加反应物分子之间的有效碰撞次数
6.不同含金化合物催化乙烯加氢的反应历程如下图所示:
下列说法正确的是
A.从图中可得1molC2H4(g)具有的能量比1molC2H6(g)的能量高
B.过渡态1比过渡态2物质的稳定性弱
C.催化剂催化下,该反应的△H=-233.7kJ·mol-1
D.相比催化剂,AuF催化乙烯加氢的效果更好
7.科学研究人员结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示。其中吸附在Pt/SiO2催化剂表面上的物种用“ ”标注,Ts表示过渡态。下列有关叙述不正确的是
A. HOCO转化为 CO和 OH为放热过程
B.形成过渡态Ts1的活化能(能垒)为1.15eV
C.前三步总反应的△H<0,总反应的化学反应速率由第一步反应决定
D.历程中活化能最小的反应方程式 CO+ OH+ H+3H2(g)= CO+3H2(g)+H2O(g)
8.我国科研人员研究了不同含金催化剂催化乙烯加氢的反应历程如下图所示(已知反应:C2H4(g)+H2(g)=C2H6(g) △H=akJ·mol-1)
下列说法正确的
A.a=129.6
B.1molC2H4(g)和1molH2(g)的键能之和比lmolC2H6(g)的键能大
C.催化乙烯加氢效果较好的催化剂是AuPF
D.稳定性:过渡态1>过渡态2
9.2SO2(g)+O2(g)2SO3(g)反应过程中能量变化如图所示。下列有关叙述错误的是
A.恒温恒容条件下通入氦气,使单位体积内O2的活化分子数增大
B.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
C.使用催化剂可以改变反应的活化能,但不能改变反应热
D.该反应中,反应物断键所需的总能量小于生成物成键所放的总能量
10.N2分子在催化剂的作用下发生的一系列转化如图所示。下列叙述正确的是( )
A.在反应过程中作催化剂
B.催化剂a表面发生了分解反应和化合反应
C.催化剂a、b增大了该历程中的最大能垒(活化能)
D.催化剂b表面发生的反应为:4NH3+5O24NO+6H2O
二、填空题
11.草酸(H2C2O4)是一种易溶于水的二元有机弱酸,常用作还原剂、沉淀剂等,可与酸性KMnO4溶液发生反应,以下为探究外界条件对反应速率的影响。请回答下列问题:
实验编号 所加试剂及用量/mL 条件 溶液颜色褪至无色所需时间/min
0.01mol·L-1H2C2O4溶液 0.01mol·L-1KMnO4溶液 3.0mol·L-1稀H2SO4 水 温度/℃
1 12.0 2.0 3.0 3.0 20 t1
2 6.0 2.0 3.0 V1 20 t2
3 V2 2.0 3.0 9.0 30 t3
(1)硫酸酸化的高锰酸钾溶液与草酸溶液反应的离子方程式为 。
(2)完成此实验设计,其中:V1= ,V2= 。
(3)对比实验1、2可探究 对反应速率的影响。
12.在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ·mol-1表示。请认真观察下图,然后回答问题。
(1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)环境先提供能量,该反应的ΔH= (用含E1、E2的代数式表示)
(2)已知:H2(g)+O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1。则其逆反应的活化能为
(3)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能 (填“升高”“降低”或“不变”),对反应热是否有影响 ,原因是
13.三甲胺[N(CH3)3]是重要的化工原料。最近我国科学家实现了使用铜催化剂将N,N-二甲基甲酰胺[(CH3)2NCHO,简称DMF]转化为三甲胺的合成路线。回答下列问题:
(1)结合实验与计算机模拟结果,研究单一DMF分子在铜催化剂表面的反应历程,如图所示:
该历程中最大能垒(活化能)= eV,该步骤的化学方程式为 。
(2)该反应变化的ΔH 0(填“<”、“>”或“=”),制备三甲胺的热化学方程式为 。
14.二氧化碳的回收利用是环保领域研究热点。
在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。总反应的化学方程式为 。
15.在日常生活和工农业生产中经常涉及到吸热反应和放热反应,回答下面问题:
(1)下列反应一定属于吸热反应的是 。
A.酸碱中和反应 B.燃烧反应
C. 铝热反应 D.C(s)+CO2(g)2CO(g)
(2)在101kPa时,H2在1.0molO2中完全燃烧,生成2.0mol液态水,放出571.6k的热量,表示氢气燃烧的热化学方程式为 ,氢气的燃烧热为 kJ mol-1。
(3)我国科学家利用计算机模拟了甲醇(CH3OH)与水在铜基催化剂上的反应机理和能量图如图:
①反应I的△H 0(填“<”“>”或“=”),反应Ⅱ的活化能是 kJ mol-1。
②在相同条件下反应I的反应速率 (填“<”“>”或“=”)反应Ⅱ的反应速率。
③写出反应Ⅱ的热化学方程式 。
(4)取30mL0.5mol L-1H2SO4溶液与50mL0.5mol L-1NaOH溶液于小烧杯中,用如图所示:装置进行中和反应反应热的测定实验。
①仪器a的名称是 。
②若实验中测得中和热数值总是偏小,可能的原因是 (答出一条即可)。
16.炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化氧可以快速氧化SO2。活化过程的能量变化模拟计算结果如图所示。
无水情况下,一个氧分子反应的活化能为 ,容易活化氧分子的条件是 (填“有水”或“无水”)。
17.汽车尾气中的氮氧化物是城市空气的主要污染物之一,如何降低汽车尾气污染已成为环保领域的热点。
回答下列问题:
(1)科技工作者用甲烷将氮氧化物还原为 N2和 H2O,涉及的反应如下:
CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+2NO2(g) =CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ/mol
则 CH4(g)还原 NO(g)生成 N2(g)的热化学方程式为 。
(2)使用氢能源可以减少汽车尾气中有害气体的排放。利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g) =CO2(g)+3H2(g) ΔH,该反应过程中的能量变化如图:
①ΔH 0(填“>”“=”或“<”)。
②途径(Ⅰ)的活化能 E= 。
③途径(Ⅰ)变为途径(Ⅱ):改变的条件是 ,反应热(ΔH) (填“增大”“减小”或“不变”)。
18.2SO2(g)+O2(g)2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
(1)该反应通常用V2O5作催化剂加快反应的进行,加V2O5会使图中B点 (填“升高”或“降低”)。
(2)E的大小对该反应的反应热有无影响 。
(3)图中A表示SO2(g)和O2(g)的 。
(4)图中△H的意义是 。
(5)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物,四价钒化合物再被氧气氧化。写出该催化过程实际发生反应的化学方程式 , ;
(6)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= 。
19.反应3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g),在一可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其正反应速率的变化是 (填增大、不变、减小,以下相同),原因是 。
(2)将容器的体积缩小一半,其正反应速率 ,逆反应速率 。
(3)保持体积不变,充入N2使体系压强增大,其正反应速率 ,逆反应速率 。
(4)保持压强不变,充入N2使容器的体积增大,其正反应速率 ,逆反应速率 。
20.活化能
(1)有效碰撞理论
①基元反应:大多数的化学反应往往经过多个反应步骤才能实现。其中 都称为基元反应。如2HI=H2+I2的2个基元反应为2HI→H2+2I·、2I·→I2。
②反应机理:先后进行的 反映了化学反应的反应历程,反应历程又称 。
③基元反应发生的先决条件
基元反应发生的先决条件是反应物的分子必须发生 ,但是并不是每一次分子碰撞都能发生化学反应。
④有效碰撞
概念: 。
条件:具有足够的 ;具有合适的 。
与反应速率的关系:有效碰撞的频率越高,则反应速率 。
⑤活化能和活化分子
活化分子:能够发生 的分子。对于某一化学反应来说,在一定条件下,反应物分子中活化分子的百分数是 的。
活化能:活化分子具有的 与反应物分子具有的平均能量之差,叫做反应的活化能。
(2)有效碰撞理论对影响化学反应速率因素的解释
①浓度:反应物浓度增大→单位体积内活化分子数 →单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
②压强:增大压强→气体体积缩小→反应物浓度增大→单位体积内活化分子数 →单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。即压强对化学反应速率的影响,可转化成浓度对化学反应速率的影响。
③温度:微观解释:升高温度→活化分子的百分数 →单位时间内有效碰撞的次数 →反应速率 ;反之,反应速率 。
④催化剂:使用催化剂→改变了反应的历程,反应的活化能 →活化分子的百分数 →单位时间内有效碰撞的几率 →反应速率 。
三、实验题
21.Ⅰ.为比较和对分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察 的快慢,定性比较得出结论。有同学提出将,改为 ,更为合理,其理由是 ;
(2)定量分析。如图乙所示,实验时均以生成气体为准,其它可能影响实验的因素均己忽略。实验中需要测量的数据是 ;
(3)查阅资料得知:将作为催化剂的溶液加入溶液后,溶液中会发生两个氧化还原反应,且两个反应中均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的离子方程式分别是:和 。
Ⅱ.欲用下图所示实验来证明是分解反应的催化剂。
(4)加入粉末于溶液中,在标准状况下放出气体的体积和时间的关系如图所示,A、B、C、D各点反应速率快慢的顺序为 (从大到小)。
Ⅲ.乙同学利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 反应温度/ 浓度 稀硫酸
① 20 10.0 0.10 10.0 0.50 0
② 40 0.10 0.50
③ 20 0.10 4.0 0.50
(5)该实验①、②可探究 对反应速率的影响,因此是 。实验①、③可探究硫酸浓度对反应速率的影响,因此 。
22.控制变量法是指实验中只有一个变量,从而直接得出因果关系。根据反应2KMnO4+ 5H2C2O4 +3H2SO4=2MnSO4 +10CO2↑+8H2O+ K2SO4设计下列实验探究外界条件对反应速率的影响:
试管编号 实验目的 KMnO4溶液 H2C2O4溶液 MnSO4 温度
浓度/(mol·L-1) 体积/mL 浓度/(mol·L-1) 体积/mL
I 为实验II~IV作参照 0.01 4.0 0.10 2.0 0 室温
II 0.01 4.0 0.20 2.0 0 室温
III 0.01 4.0 0.10 2.0 0 冰水浴
IV 探究催化剂对反应速率的影响 0.01 4.0 a b 加黄豆大小 室温
(1)实验II的目的是 ; 实验II褪色的时间比实验I的短,是因为 (用活化分子和有效碰撞的概念解释)。
(2)实验Ⅲ的目的是 ;实验I褪色的时间比实验Ⅲ的短,是因为 (填字母)。
A.单位体积内活化分子数目不变 B.活化分子百分数提高
C.较高能量分子碰撞频率不变 D.有效碰撞的几率提高
(3)实验IV缺少的数据a、b依次为 、 。
(4)测得实验IV比实验I褪色时间短得多。若将4.0 mL0.01 mol·L-1 KMnO4溶液逐滴滴入4.0mL0.10mol·L-1H2C2O4溶液中,发现紫色褪去的时间先慢后快,可能原因是 。
23.Ⅰ.50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出
(2)在测定中和热的实验中,计算反应热时需要的数据有
①酸的浓度和体积 ②碱的浓度和体积 ③比热容
④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B.①②③④ C. ②③④⑤ D.①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热 (填“相等”或“不相等”),所放出的热量 (填“相等”或“不相等”)
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 (填“偏大”、“偏小”或“无影响”).
Ⅱ.甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:CO(g)+2H2(g)CH3OH(g)。已知:①下图为反应的能量变化和物质键能
化学键 H-H H-O O=O
键能kJ/mol 436 x 496
②CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式 。
(2)H—O键的键能x为 kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为 kJ/mol。
参考答案:
1.D
2.B
3.D
4.D
5.B
6.B
7.B
8.C
9.A
10.D
11.(1)2MnO+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑
(2) 9.0 6.0
(3)浓度
12. 放热 需要 E2-E1 409.0 kJ·mol-1 降低 无影响 催化剂只能降低反应的活化能,不能改变反应物的总能量和生成物的总能量之差,即反应热不改变
13.(1) 1.19 eV N(CH3)3+OH*+H*=N(CH3)3(g)+H2O(g)
(2) < (CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) ΔH=-1.02NAeV/mol
14.CO2C+O2
15.(1)D
(2) 2H2(g)+O2(g)=2H2O △H=-571.6kJ mol-1 285.8
(3) > a < CO(g)+H2O(g)=CO2(g)+H2(g) △H=-bkJ mol-1或CO(g)+H2O(g)+2H2(g)=CO2(g)+3H2(g) △H=-bkJ mol-1
(4) 环形玻璃搅拌棒 实验装置保温、隔热效果差
16. 0.29eV 有水
17. CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ/mol > E4-E1 加入催化剂 不变
18. 降低 无影响 总能量 2molSO2(g)与 1molO2完全反应生成2molSO3(g)时,反应放出的热量 V2O5+ SO2=SO3+2VO2 4VO2+O2=2V2O5 0.025 mol·L-1·min-1
19.(1) 不变 铁是固体,增加铁的量,没有增加铁的浓度,不能改变反应速率
(2) 增大 增大
(3) 不变 不变
(4) 减小 减小
20. 每一步反应 基元反应 反应机理 碰撞 能够发生化学反应的碰撞 能量 取向 越快 有效碰撞 一定 平均能量 增多 增加 增大 减小 增多 增加 增大 减小 增大 增加 增大 减小 降低 增大 增加 加快
21.(1) 产生气泡 0.05 排出阴离子的干扰
(2)生成40mL气体所需要的时间
(3)2Fe2++H2O2+2H+=2Fe3++2H2O
(4)D>C>B>A
(5) 反应温度 10.0 6.0
22.(1) 探究浓度对反应速率的影响 反应物浓度增大,单位体积内活化分子数增多,有效碰撞次数增多,反应速率加快
(2) 探究温度对反应速率的影响 BD
(3) 0.10 2.0
(4)Mn2+可能是反应的催化剂
23. 无环形玻璃搅拌棒、在大小烧杯间没填满碎纸条
、大小烧杯口不相平 B 相等 不相等 偏小 CH3OH(g)+ O2(g)=CO2(g)+2H2O(l)△H=-757kJ mol-1 462 510
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
