人教版(2019) 高中化学选择性必修1 3.1.3电离平衡常数提升练(含答案)
文档属性
| 名称 | 人教版(2019) 高中化学选择性必修1 3.1.3电离平衡常数提升练(含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-22 13:02:47 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
3.1.3电离平衡常数提升练-人教版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下表是几种弱酸常温下的电离平衡常数:
则下列说法不正确的是
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸增大
D.向弱酸溶液中加少量溶液,电离常数不变
2.某小组为了探究不同离子与OH—反应的先后相关问题,分别在1L0.1mol L-1NH4HCO3溶液、1L0.1mol L-1NH4HSO3溶液中加一定量NaOH固体后并恢复到常温(体积变化忽略不计),并测得其中相关粒子浓度变化情况分别如图1、图2所示[已知:Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.61×10-11,Ka1(H2SO3)=1.52×10-2,Ka2(H2SO3)=1.02×10-7,Kb(NH3 H2O)=1.75×10-5],下列说法正确的是
图11L0.1mol L-1NH4HCO3溶液中加入一定量NaOH后各粒子浓度变化曲线
图21L0.1mol L-1NH4HSO3溶液中加入一定量NaOH后各粒子浓度变化曲线
A.由上述实验可知与OH—反应的先后顺序为HSO>NH>HCO
B.图1中,当n(NaOH)=0.05mol时,只发生反应OH—+NH=NH3 H2O
C.图2中,当n(NaOH)<0.1mol时,主要发生反应HSO+OH—=H2O+SO
D.上述实验说明,离子反应的先后顺序与反应平衡常数大小无关
3.已知三种酸的电离平衡常数,下列说法不正确的是
弱酸 醋酸 次氯酸 碳酸
电离平衡常数
A.三种酸的酸性由强到弱的顺序是:
B.少量的与溶液反应生成与
C.结合的能力:
D.向溶液中滴加醋酸,可生成,使杀菌、消毒能力增强
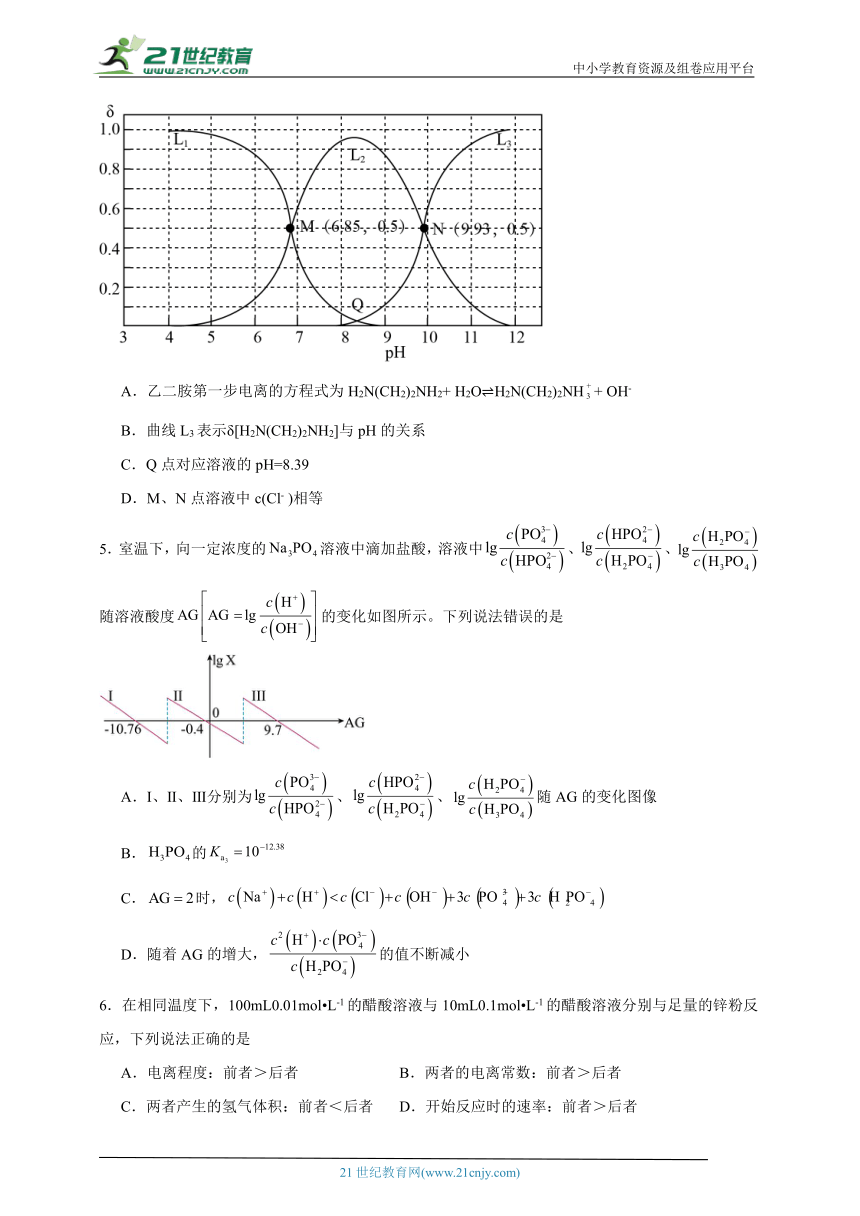
4.乙二胺[H2N(CH2 )2NH2 ]是一种二元弱碱,在水中的电离方式与氨相似。25℃时,用 HCl调节0.10mol·L-1乙二胺溶液的pH,溶液中含氮物种的分布系数(δ)与pH的关系如图所示(如乙二胺的分布系数δ[ H2N(CH2)2NH2]= )。下列说法错误的是
A.乙二胺第一步电离的方程式为H2N(CH2)2NH2+ H2O H2N(CH2)2NH+ OH-
B.曲线L3表示δ[H2N(CH2)2NH2]与pH的关系
C.Q点对应溶液的pH=8.39
D.M、N点溶液中c(Cl- )相等
5.室温下,向一定浓度的溶液中滴加盐酸,溶液中、、随溶液酸度的变化如图所示。下列说法错误的是
A.Ⅰ、Ⅱ、Ⅲ分别为、、随AG的变化图像
B.的
C.时,
D.随着AG的增大,的值不断减小
6.在相同温度下,100mL0.01mol L-1的醋酸溶液与10mL0.1mol L-1的醋酸溶液分别与足量的锌粉反应,下列说法正确的是
A.电离程度:前者>后者 B.两者的电离常数:前者>后者
C.两者产生的氢气体积:前者<后者 D.开始反应时的速率:前者>后者
7.某温度下,相同体积、相同的氨水和氢氧化钠溶液加水稀释时的变化曲线如图所示,下列判断正确的是
A.点导电能力比点强
B.点的值大于点
C.与盐酸完全反应时,消耗盐酸体积
D.、两点的相等
8.常温下,部分弱电解质的电离常数如表:
弱电解质
电离常数
下列说法中正确的是
A.的醋酸稀释过程中所有离子的浓度都在减小
B.结合质子的能力:
C.的平衡常数为
D.向溶液中通入的离子方程式:
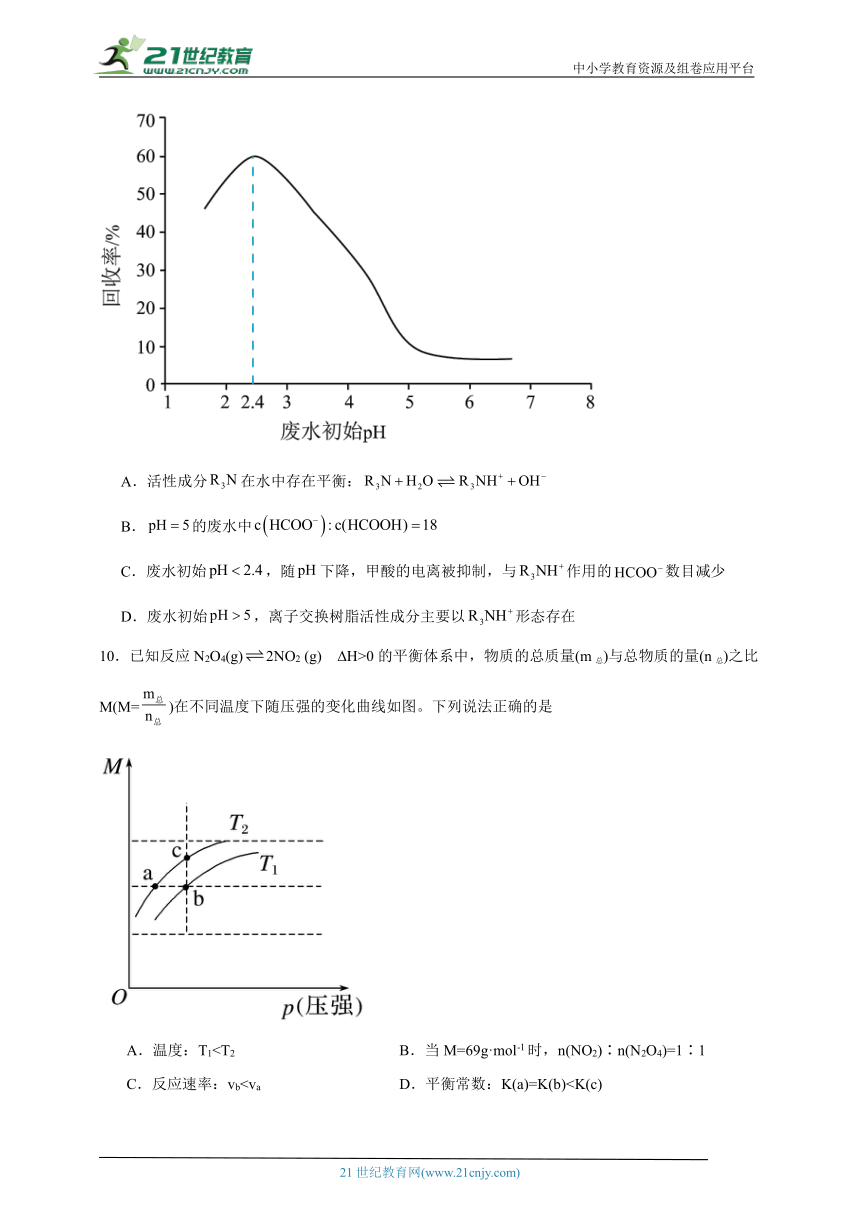
9.甲酸是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始关系如图(已知甲酸),下列说法不正确的是
A.活性成分在水中存在平衡:
B.的废水中
C.废水初始,随下降,甲酸的电离被抑制,与作用的数目减少
D.废水初始,离子交换树脂活性成分主要以形态存在
10.已知反应N2O4(g)2NO2 (g) ΔH>0的平衡体系中,物质的总质量(m总)与总物质的量(n总)之比M(M=)在不同温度下随压强的变化曲线如图。下列说法正确的是
A.温度:T1C.反应速率:vb二、填空题
11.完成下列填空
(1)氯化钠晶体不能导电,在熔融状态下能导电,原因是 。
(2)甲胺(CH3NH2)易溶于水,在水中的电离方式与氨相似,写出甲胺在水中的电离方程式 。
12.常温下,部分酸的电离平衡常数如下:
化学式
电离常数
(1)相同的三种酸,则的浓度从大到小为 。
(2)的溶液中,为 ,使此溶液中的电离程度增大且也增大的方法是 。
(3)中和等量的,消耗等的氢氟酸和硫酸的体积分别为,则a b(填“大于”、“小于”或“等于”,下同)。中和等浓度、等体积的氢氟酸和硫酸需要的物质的量为,则 。
(4)向中通入少量的,发生的离子方程式为 。
(5)设计实验证明氢氟酸比盐酸的酸性弱 。
13.25℃时,有0.01mol·L-1的醋酸溶液,试回答下列问题:
(1)写出醋酸的电离平衡常数表达式: 。
(2)达到平衡时,溶液中c(H+)= (25℃时,醋酸的Ka=1.75×10-5)。
(3)当向该溶液中加入一定量的盐酸时,溶液中的c(H+) (填“增大”“减小”或“不变”,下同),c(CH3COO-) ,电离常数 。
14.下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
酸 HCN HClO
电离平衡常数()
(1)可以证明醋酸是弱酸的事实是 (填字母序号)
A.醋酸和水能以任意比例混溶
B.在醋酸水溶液中还含有未电离的醋酸分子
C.醋酸与溶液反应放出气体
D.1的醋酸水溶液能使紫色石蕊溶液变红色
E.等体积等pH的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,最强的酸分别是 (用化学式表示)。
②下列能使醋酸溶液中的电离程度增大,而电离平衡常数不变的操作是 。
A.升高温度 B.加水稀释 C.加少量的固体
D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式 。
(3)已知草酸是一种二元弱酸,其电离常数,,试从电离平衡移动的角度解释的原因 。
(4)已知水溶液中和的关系如图所示:
①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是 。
②若A点到E点,可采用的措施是 (填序号,下同);促进水的电离平衡正向移动的措施是 。
a.升温 b.加入少量的盐酸 c.加入少量的NaOH
③室温下,在由水电离产生的浓度为的溶液中,一定能大量共存的离子组是 。
a.、、、 b.、、、
c.、、、 d.、、、
e.、、、
15.已知Ka(CH3COOH)=1.75×10-5,试计算0.1 mol·L-1 CH3COOH溶液中H+的浓度(写出计算过程) 。
16.下表是几种常见弱酸的电离平衡常数(25℃)
酸 电离方程式 电离平衡常数K
回答下列问题:
(1)写出碳酸在水中的电离方程式 ,
(2)当温度升高时,K值 (填“增大”“减小”或“不变)。
(3)若把、、、、、、、都看作是酸,其中酸性最强的是 。
(4)过量的通入溶液的离子方程式为 。
17.I.25℃时,三种酸的电离平衡常数如表:
化学式 HClO
电离平衡常数
请回答下列问题:
(1)下列反应不能发生的是 (填序号)。
a.
b.
c.
d.
(2)用蒸馏水稀释的HClO溶液,下列各式表示的数值随水量的增加而增大的是 (填序号)。
a. b. c.
II.研究表明常温下,溶液中微粒物质的量分数与溶液pH之间的关系如图所示:
(3)常温下,的电离平衡常数 。
(4)若用和NaOH反应制取,溶液的pH最好控制在 以上。
18.已知时,HCOOH:,HCN:。
(1)相同条件下,等浓度、等体积的HCOOH和HCN,导电性HCOOH HCN,完全中和两溶液所需NaOH的物质的量HCOOH HCN (填>、<或=)。
(2)一定浓度的稀HCN溶液,能使HCN电离程度增大的是 ,能使溶液酸性增强的是 (以上均填字母代号)
a.滴加少量浓度更大的HCN溶液 b.加水稀释 c.加入少量NaCN固体 d.加入少量NaOH固体
(3)下列反应不能发生的是_______
A.
B.
C.
D.
19.弱电解质的电离能力。一定温度下,K值越大,弱电解质的电离程度越 ,酸(或碱)性越 。
20.25 ℃时部分弱酸的电离平衡常数如下表:
弱酸 HCOOH HClO H2CO3 H2SO3
电离平衡 常数/(mol·L-1) Ka=1.8×10-4 Ka=4.7×10-8 Ka1=4.2×10-7 Ka2=5.6×10-11 Ka1=1.54×10-2 Ka2=1.02×10-7
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为 。
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3,溶液的pH由大到小的关系为 。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO、CO、HSO、HCO浓度由大到小的顺序为 。
(4)下列离子方程式书写正确的是 (填字母)。
a.2ClO-+H2O+CO2=2HClO+CO
b.2HCOOH+CO=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO
d.Cl2+H2O+2CO=2HCO+Cl-+ClO-
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
三、实验题
21.乙二酸(H2C2O4)俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。回答下列问题:
Ⅰ.查阅资料可知,常温下,部分弱酸的电离平衡常数如下表:
弱酸 HF H2C2O4
电离平衡常数
(1)常温下,pH=11的NaOH溶液与pH=3的氢氟酸溶液等体积混合,溶液显 性(填“酸”“碱”或“中”)。
(2)向等体积、等pH的草酸和氢氟酸溶液中加入大小相同的锌粒,初始速率分别是v1、v2,其大小关系为v1 v2(填“>”“<”或“=”)。
(3)向Na2C2O4溶液中通入过量的HF,反应的化学方程式为 。
Ⅱ.已知草酸晶体(H2C2O4·XH2O)可溶于水,并可与酸性高锰酸钾溶液完全反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,三次结果如下:
第一次滴定 第二次滴定 第三次滴定
待测溶液体积(mL) 25.00 25.00 25.00
标准溶液体积(mL) 9.99 10.01 10.00
已知:H2C2O4的相对分子质量为90。
(4)滴定时,KMnO4标准溶液应该装在 (填“酸式”或“碱式”)滴定管中。
(5)到达滴定终点的标志是 。
(6)根据上述数据计算X= 。
(7)误差分析:若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值 (填“偏高”“偏低”或“无影响”)。
22.实验室模拟拉希法用氨和次氯酸钠酸钠反应制备肼(),并探究肼的性质。制备装置如图1所示。
回答下列问题:
(1)装置A试管中的试剂为 。
(2)仪器a的作用是 。
(3)装置B中制备肼的化学方程式为 。
(4)上述装置存在一处缺陷,会导致肼的产率降低,改进方法是 。
(5)①探究肼的性质。
已知是二元弱碱,在水中的电离与相似,请写出肼的第二步电离方程式: 。室温下向水溶液中滴加某强酸,溶液的pH与离子浓度的变化关系如图2所示,下列说法正确的是 (填标号)。
A.在水溶液中的第二步电离平衡常数为0.1
B.的平衡常数为
C.溶液中的水解能力大于其电离能力
D.溶液中:
②测定产品中肼的质量分数。
称取m g装置B中溶液,加入适量固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成100 mL溶液,移取25.00 mL该溶液置于锥形瓶中,并滴加2~3滴指示剂,用c mol·L的碘标准溶液滴定,滴定过程中有无色、无味、无毒气体产生。滴定过程中指示剂可选用 ;若达到滴定终点平均消耗标准溶液的体积为V mL,则产品中肼的质量分数为 (用含m、c和V的代数式表示)。
23.云南省某校化学兴趣小组设计如下实验方案。用浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示:
请回答下列问题:
(1)打开分液漏斗的旋塞,仪器a中的浓硫酸不能顺利流下,原因可能是 (填序号)。
A.分液漏斗上端玻璃塞上的凹槽没有与漏斗上的小孔对齐
B.分液漏斗上端玻璃塞未打开
C.浓硫酸浓度过大
(2)若撤去酒精灯,实验室利用装置A制备SO2时发生的化学方程式是
(3)装置B的作用是 。
(4)设计装置C的目的是验证SO2的 性,装置C中反应的离子方程式是 。
(5)若装置D中生成的正盐与酸式盐的物质的量之比为1:2时,D中反应的离子方程式是 。
(6)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.与ClO-恰好反应 II.NaClO不足 III.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知:H2SO3:Ka1=1.54×10-2,Ka2=1.02×10-7;H2CO3:Ka1=4.3×10-7,Ka2=5.61×10-11;HClO:Ka=3×10-8)
序号 实验操作 现象 结论
① 加入少量CaCO3粉末 I或II
② 滴加少量淀粉-KI溶液,振荡 溶液先变蓝后褪色
③ 滴加少量溴水,振荡 II
参考答案:
1.C
2.C
3.B
4.D
5.D
6.A
7.D
8.C
9.D
10.B
11.(1)氯化钠晶体中,Na+与以离子键结合,作用力强,在熔融状态下离子键被削弱,形成自由移动的离子,因而具有导电性
(2)
12.(1)c(HCN)>c(H2CO3)>c(HF)
(2) 2×10-6 升温
(3) 小于 小于
(4)CN-+CO2+H2O=HCN+HCO
(5)测定等浓度的两种酸的pH,氢氟酸的pH大或等浓度的两种酸分别与Zn反应,初始氢氟酸冒气泡慢
13.(1)K=
(2)4.18×10-4mol·L-1或mol·L-1
(3) 增大 减小 不变
14.(1)BE
(2) BE
(3)由于一级电离产生氢离子,增大了溶液中氢离子浓度,使电离平衡向左移动
(4) B>C>A=D c a ce
15.c平(H+)=1.32×10-3 mol·L-1
16.(1)
(2)增大
(3)
(4)
17.(1)cd
(2)b
(3)10-6.37
(4)12
18.(1) > =
(2) bd a
(3)A
19. 大 强
20.(1)Ka越大,酸性越强
(2)③>②>④>①
(3)c(SO)>c(CO)>c(HCO)>c(HSO)
(4)bd
(5)c(HCOO-)>c(Na+)>c(H+)>c(OH-)
21.(1)酸
(2)=
(3)Na2C2O4+HF= NaHC2O4+NaF
(4)酸式
(5)当滴入最后半滴KMnO4溶液,溶液变为浅紫红色,且30s内红色不褪去,说明滴定达到终点
(6)2
(7)偏高
22.(1)氯化铵和氢氧化钙固体
(2)将氨气通入装置B中,且可防倒吸
(3)
(4)在装置B、C之间增加盛有饱和食盐水的洗气瓶
(5) BC 淀粉溶液
23.(1)AB
(2)Na2SO3+H2SO4(浓) =Na2SO4+H2O+SO2↑
(3)防倒吸
(4) 还原 SO2 +Br2+2H2O = 4H+++2Br-
(5)3SO2 +4OH-=+2+H2O
(6) 有气泡产生 III 溴水褪色
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
3.1.3电离平衡常数提升练-人教版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下表是几种弱酸常温下的电离平衡常数:
则下列说法不正确的是
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸增大
D.向弱酸溶液中加少量溶液,电离常数不变
2.某小组为了探究不同离子与OH—反应的先后相关问题,分别在1L0.1mol L-1NH4HCO3溶液、1L0.1mol L-1NH4HSO3溶液中加一定量NaOH固体后并恢复到常温(体积变化忽略不计),并测得其中相关粒子浓度变化情况分别如图1、图2所示[已知:Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.61×10-11,Ka1(H2SO3)=1.52×10-2,Ka2(H2SO3)=1.02×10-7,Kb(NH3 H2O)=1.75×10-5],下列说法正确的是
图11L0.1mol L-1NH4HCO3溶液中加入一定量NaOH后各粒子浓度变化曲线
图21L0.1mol L-1NH4HSO3溶液中加入一定量NaOH后各粒子浓度变化曲线
A.由上述实验可知与OH—反应的先后顺序为HSO>NH>HCO
B.图1中,当n(NaOH)=0.05mol时,只发生反应OH—+NH=NH3 H2O
C.图2中,当n(NaOH)<0.1mol时,主要发生反应HSO+OH—=H2O+SO
D.上述实验说明,离子反应的先后顺序与反应平衡常数大小无关
3.已知三种酸的电离平衡常数,下列说法不正确的是
弱酸 醋酸 次氯酸 碳酸
电离平衡常数
A.三种酸的酸性由强到弱的顺序是:
B.少量的与溶液反应生成与
C.结合的能力:
D.向溶液中滴加醋酸,可生成,使杀菌、消毒能力增强
4.乙二胺[H2N(CH2 )2NH2 ]是一种二元弱碱,在水中的电离方式与氨相似。25℃时,用 HCl调节0.10mol·L-1乙二胺溶液的pH,溶液中含氮物种的分布系数(δ)与pH的关系如图所示(如乙二胺的分布系数δ[ H2N(CH2)2NH2]= )。下列说法错误的是
A.乙二胺第一步电离的方程式为H2N(CH2)2NH2+ H2O H2N(CH2)2NH+ OH-
B.曲线L3表示δ[H2N(CH2)2NH2]与pH的关系
C.Q点对应溶液的pH=8.39
D.M、N点溶液中c(Cl- )相等
5.室温下,向一定浓度的溶液中滴加盐酸,溶液中、、随溶液酸度的变化如图所示。下列说法错误的是
A.Ⅰ、Ⅱ、Ⅲ分别为、、随AG的变化图像
B.的
C.时,
D.随着AG的增大,的值不断减小
6.在相同温度下,100mL0.01mol L-1的醋酸溶液与10mL0.1mol L-1的醋酸溶液分别与足量的锌粉反应,下列说法正确的是
A.电离程度:前者>后者 B.两者的电离常数:前者>后者
C.两者产生的氢气体积:前者<后者 D.开始反应时的速率:前者>后者
7.某温度下,相同体积、相同的氨水和氢氧化钠溶液加水稀释时的变化曲线如图所示,下列判断正确的是
A.点导电能力比点强
B.点的值大于点
C.与盐酸完全反应时,消耗盐酸体积
D.、两点的相等
8.常温下,部分弱电解质的电离常数如表:
弱电解质
电离常数
下列说法中正确的是
A.的醋酸稀释过程中所有离子的浓度都在减小
B.结合质子的能力:
C.的平衡常数为
D.向溶液中通入的离子方程式:
9.甲酸是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始关系如图(已知甲酸),下列说法不正确的是
A.活性成分在水中存在平衡:
B.的废水中
C.废水初始,随下降,甲酸的电离被抑制,与作用的数目减少
D.废水初始,离子交换树脂活性成分主要以形态存在
10.已知反应N2O4(g)2NO2 (g) ΔH>0的平衡体系中,物质的总质量(m总)与总物质的量(n总)之比M(M=)在不同温度下随压强的变化曲线如图。下列说法正确的是
A.温度:T1
11.完成下列填空
(1)氯化钠晶体不能导电,在熔融状态下能导电,原因是 。
(2)甲胺(CH3NH2)易溶于水,在水中的电离方式与氨相似,写出甲胺在水中的电离方程式 。
12.常温下,部分酸的电离平衡常数如下:
化学式
电离常数
(1)相同的三种酸,则的浓度从大到小为 。
(2)的溶液中,为 ,使此溶液中的电离程度增大且也增大的方法是 。
(3)中和等量的,消耗等的氢氟酸和硫酸的体积分别为,则a b(填“大于”、“小于”或“等于”,下同)。中和等浓度、等体积的氢氟酸和硫酸需要的物质的量为,则 。
(4)向中通入少量的,发生的离子方程式为 。
(5)设计实验证明氢氟酸比盐酸的酸性弱 。
13.25℃时,有0.01mol·L-1的醋酸溶液,试回答下列问题:
(1)写出醋酸的电离平衡常数表达式: 。
(2)达到平衡时,溶液中c(H+)= (25℃时,醋酸的Ka=1.75×10-5)。
(3)当向该溶液中加入一定量的盐酸时,溶液中的c(H+) (填“增大”“减小”或“不变”,下同),c(CH3COO-) ,电离常数 。
14.下表是几种常见弱酸的电离平衡常数(25℃),回答下列各题:
酸 HCN HClO
电离平衡常数()
(1)可以证明醋酸是弱酸的事实是 (填字母序号)
A.醋酸和水能以任意比例混溶
B.在醋酸水溶液中还含有未电离的醋酸分子
C.醋酸与溶液反应放出气体
D.1的醋酸水溶液能使紫色石蕊溶液变红色
E.等体积等pH的醋酸和盐酸分别与足量氢氧化钠溶液充分反应,醋酸消耗的氢氧化钠更多
(2)结合表中给出的电离常数回答下列问题:
①上述四种酸中,最强的酸分别是 (用化学式表示)。
②下列能使醋酸溶液中的电离程度增大,而电离平衡常数不变的操作是 。
A.升高温度 B.加水稀释 C.加少量的固体
D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式 。
(3)已知草酸是一种二元弱酸,其电离常数,,试从电离平衡移动的角度解释的原因 。
(4)已知水溶液中和的关系如图所示:
①图中A、B、C、D四点对应的水的离子积常数由大到小的顺序是 。
②若A点到E点,可采用的措施是 (填序号,下同);促进水的电离平衡正向移动的措施是 。
a.升温 b.加入少量的盐酸 c.加入少量的NaOH
③室温下,在由水电离产生的浓度为的溶液中,一定能大量共存的离子组是 。
a.、、、 b.、、、
c.、、、 d.、、、
e.、、、
15.已知Ka(CH3COOH)=1.75×10-5,试计算0.1 mol·L-1 CH3COOH溶液中H+的浓度(写出计算过程) 。
16.下表是几种常见弱酸的电离平衡常数(25℃)
酸 电离方程式 电离平衡常数K
回答下列问题:
(1)写出碳酸在水中的电离方程式 ,
(2)当温度升高时,K值 (填“增大”“减小”或“不变)。
(3)若把、、、、、、、都看作是酸,其中酸性最强的是 。
(4)过量的通入溶液的离子方程式为 。
17.I.25℃时,三种酸的电离平衡常数如表:
化学式 HClO
电离平衡常数
请回答下列问题:
(1)下列反应不能发生的是 (填序号)。
a.
b.
c.
d.
(2)用蒸馏水稀释的HClO溶液,下列各式表示的数值随水量的增加而增大的是 (填序号)。
a. b. c.
II.研究表明常温下,溶液中微粒物质的量分数与溶液pH之间的关系如图所示:
(3)常温下,的电离平衡常数 。
(4)若用和NaOH反应制取,溶液的pH最好控制在 以上。
18.已知时,HCOOH:,HCN:。
(1)相同条件下,等浓度、等体积的HCOOH和HCN,导电性HCOOH HCN,完全中和两溶液所需NaOH的物质的量HCOOH HCN (填>、<或=)。
(2)一定浓度的稀HCN溶液,能使HCN电离程度增大的是 ,能使溶液酸性增强的是 (以上均填字母代号)
a.滴加少量浓度更大的HCN溶液 b.加水稀释 c.加入少量NaCN固体 d.加入少量NaOH固体
(3)下列反应不能发生的是_______
A.
B.
C.
D.
19.弱电解质的电离能力。一定温度下,K值越大,弱电解质的电离程度越 ,酸(或碱)性越 。
20.25 ℃时部分弱酸的电离平衡常数如下表:
弱酸 HCOOH HClO H2CO3 H2SO3
电离平衡 常数/(mol·L-1) Ka=1.8×10-4 Ka=4.7×10-8 Ka1=4.2×10-7 Ka2=5.6×10-11 Ka1=1.54×10-2 Ka2=1.02×10-7
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为 。
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3,溶液的pH由大到小的关系为 。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO、CO、HSO、HCO浓度由大到小的顺序为 。
(4)下列离子方程式书写正确的是 (填字母)。
a.2ClO-+H2O+CO2=2HClO+CO
b.2HCOOH+CO=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO
d.Cl2+H2O+2CO=2HCO+Cl-+ClO-
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为 。
三、实验题
21.乙二酸(H2C2O4)俗称草酸,是二元弱酸,在实验研究和化学工业中应用广泛。回答下列问题:
Ⅰ.查阅资料可知,常温下,部分弱酸的电离平衡常数如下表:
弱酸 HF H2C2O4
电离平衡常数
(1)常温下,pH=11的NaOH溶液与pH=3的氢氟酸溶液等体积混合,溶液显 性(填“酸”“碱”或“中”)。
(2)向等体积、等pH的草酸和氢氟酸溶液中加入大小相同的锌粒,初始速率分别是v1、v2,其大小关系为v1 v2(填“>”“<”或“=”)。
(3)向Na2C2O4溶液中通入过量的HF,反应的化学方程式为 。
Ⅱ.已知草酸晶体(H2C2O4·XH2O)可溶于水,并可与酸性高锰酸钾溶液完全反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,三次结果如下:
第一次滴定 第二次滴定 第三次滴定
待测溶液体积(mL) 25.00 25.00 25.00
标准溶液体积(mL) 9.99 10.01 10.00
已知:H2C2O4的相对分子质量为90。
(4)滴定时,KMnO4标准溶液应该装在 (填“酸式”或“碱式”)滴定管中。
(5)到达滴定终点的标志是 。
(6)根据上述数据计算X= 。
(7)误差分析:若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值 (填“偏高”“偏低”或“无影响”)。
22.实验室模拟拉希法用氨和次氯酸钠酸钠反应制备肼(),并探究肼的性质。制备装置如图1所示。
回答下列问题:
(1)装置A试管中的试剂为 。
(2)仪器a的作用是 。
(3)装置B中制备肼的化学方程式为 。
(4)上述装置存在一处缺陷,会导致肼的产率降低,改进方法是 。
(5)①探究肼的性质。
已知是二元弱碱,在水中的电离与相似,请写出肼的第二步电离方程式: 。室温下向水溶液中滴加某强酸,溶液的pH与离子浓度的变化关系如图2所示,下列说法正确的是 (填标号)。
A.在水溶液中的第二步电离平衡常数为0.1
B.的平衡常数为
C.溶液中的水解能力大于其电离能力
D.溶液中:
②测定产品中肼的质量分数。
称取m g装置B中溶液,加入适量固体(滴定过程中,调节溶液的pH保持在6.5左右),加水配成100 mL溶液,移取25.00 mL该溶液置于锥形瓶中,并滴加2~3滴指示剂,用c mol·L的碘标准溶液滴定,滴定过程中有无色、无味、无毒气体产生。滴定过程中指示剂可选用 ;若达到滴定终点平均消耗标准溶液的体积为V mL,则产品中肼的质量分数为 (用含m、c和V的代数式表示)。
23.云南省某校化学兴趣小组设计如下实验方案。用浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示:
请回答下列问题:
(1)打开分液漏斗的旋塞,仪器a中的浓硫酸不能顺利流下,原因可能是 (填序号)。
A.分液漏斗上端玻璃塞上的凹槽没有与漏斗上的小孔对齐
B.分液漏斗上端玻璃塞未打开
C.浓硫酸浓度过大
(2)若撤去酒精灯,实验室利用装置A制备SO2时发生的化学方程式是
(3)装置B的作用是 。
(4)设计装置C的目的是验证SO2的 性,装置C中反应的离子方程式是 。
(5)若装置D中生成的正盐与酸式盐的物质的量之比为1:2时,D中反应的离子方程式是 。
(6)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
I.与ClO-恰好反应 II.NaClO不足 III.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知:H2SO3:Ka1=1.54×10-2,Ka2=1.02×10-7;H2CO3:Ka1=4.3×10-7,Ka2=5.61×10-11;HClO:Ka=3×10-8)
序号 实验操作 现象 结论
① 加入少量CaCO3粉末 I或II
② 滴加少量淀粉-KI溶液,振荡 溶液先变蓝后褪色
③ 滴加少量溴水,振荡 II
参考答案:
1.C
2.C
3.B
4.D
5.D
6.A
7.D
8.C
9.D
10.B
11.(1)氯化钠晶体中,Na+与以离子键结合,作用力强,在熔融状态下离子键被削弱,形成自由移动的离子,因而具有导电性
(2)
12.(1)c(HCN)>c(H2CO3)>c(HF)
(2) 2×10-6 升温
(3) 小于 小于
(4)CN-+CO2+H2O=HCN+HCO
(5)测定等浓度的两种酸的pH,氢氟酸的pH大或等浓度的两种酸分别与Zn反应,初始氢氟酸冒气泡慢
13.(1)K=
(2)4.18×10-4mol·L-1或mol·L-1
(3) 增大 减小 不变
14.(1)BE
(2) BE
(3)由于一级电离产生氢离子,增大了溶液中氢离子浓度,使电离平衡向左移动
(4) B>C>A=D c a ce
15.c平(H+)=1.32×10-3 mol·L-1
16.(1)
(2)增大
(3)
(4)
17.(1)cd
(2)b
(3)10-6.37
(4)12
18.(1) > =
(2) bd a
(3)A
19. 大 强
20.(1)Ka越大,酸性越强
(2)③>②>④>①
(3)c(SO)>c(CO)>c(HCO)>c(HSO)
(4)bd
(5)c(HCOO-)>c(Na+)>c(H+)>c(OH-)
21.(1)酸
(2)=
(3)Na2C2O4+HF= NaHC2O4+NaF
(4)酸式
(5)当滴入最后半滴KMnO4溶液,溶液变为浅紫红色,且30s内红色不褪去,说明滴定达到终点
(6)2
(7)偏高
22.(1)氯化铵和氢氧化钙固体
(2)将氨气通入装置B中,且可防倒吸
(3)
(4)在装置B、C之间增加盛有饱和食盐水的洗气瓶
(5) BC 淀粉溶液
23.(1)AB
(2)Na2SO3+H2SO4(浓) =Na2SO4+H2O+SO2↑
(3)防倒吸
(4) 还原 SO2 +Br2+2H2O = 4H+++2Br-
(5)3SO2 +4OH-=+2+H2O
(6) 有气泡产生 III 溴水褪色
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
