人教版(2019) 高中化学选择性必修1 3.4.1难溶电解质的沉淀溶解平衡提升练(含答案)
文档属性
| 名称 | 人教版(2019) 高中化学选择性必修1 3.4.1难溶电解质的沉淀溶解平衡提升练(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-22 13:06:05 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
3.4.1难溶电解质的沉淀溶解平衡提升练-人教版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列有关电解质溶液的说法正确的是
A.向0.1 mol L-1CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B.盐酸滴定氢氧化钠的实验中,用甲基橙作指示剂时,滴定终点的pH为7
C.向盐酸中加入氨水至中性,溶液中c(NH)/c(Cl-)>1
D.将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3溶液,生成的沉淀AgCl多
2.将一定量的硫酸钡放入水中,有关的叙述正确的是( )
A.硫酸钡不溶于水,硫酸钡固体质量不会改变
B.最终会得到BaSO4的极稀的饱和溶液
C.因为很容易发生,所以不存在BaSO4(s)Ba2+(aq)+SO42-(aq)的过程
D.因为BaSO4难溶于水,所以改变外界条件也不会改变BaSO4的溶解性
3.在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是
A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点
C.图中a=×10-4
D.T ℃时,Ag2CrO4的Ksp为1×10-8
4.常温下,以Na2S为沉淀剂除去废水中的重金属离子A2+ (M2+、N2+、Q2+、R2+),沉淀与离子关系[pA2+= lg c(A2+),pS2 = lg c(S2 )]图象如图所示。下列说法正确的是
A.Ksp(MS)B.a、c点的pN2+=pQ2+,向含N2+、Q2+且pN2+=pQ2+的混合液中滴加Na2S溶液,先生成QS沉淀
C.若a点时pS2 =14,pN2+=14,则Ksp(NS)=1028
D.b点对应溶液中不能形成QS沉淀
5.常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如图所示。下列有关说法正确的是
A.常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)PbS(s)+2I-(aq)的化学平衡常数为5×1018
B.常温下,PbI2的Ksp为2×10-6
C.温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小
6.下列事实不能用勒夏特列原理解释的是
A.实验室中常用排饱和食盐水的方式收集氯气
B.红棕色的气体,加压后颜色先变深后变浅
C.合成氨工业中使用铁触媒作催化剂
D.对熟石灰的悬浊液加热,悬浊液中固体质量增加
7.化学与生产、生活密切相关,下列说法正确的是
A.牙膏中添加氟化物可预防龋齿
B.沼气的主要成分为甲烷,沼气属于不可再生资源
C.葡萄酒中添加适量二氧化硫,可以起到抗氧化和漂白的作用
D.氢氧化镁和碳酸钠可用作胃酸的中和剂
8.常温常压下,下列有关电解质溶液说法正确的是
A.AgCl能溶于氨水,而AgI不溶于氨水,则
B.,则等浓度的和溶液的pH,前者大于后者
C.等物质的量的草酸()与NaOH混合溶液的,则溶液中
D.浓度均为"的、混合溶液中,
9.室温时,M(OH)2(s)M2+(aq)+2OH-(aq) Ksp=a ,c(M2+)=b mol·L-1时,溶液的pH等于( )
A.14-1/2lg(b/a) B.14-1/2lg(a/b) C.14+1/2lg(a/b) D.14+1/2lg(b/a)
10.在25℃和100℃两种温度下,碳酸钙(CaCO3)在水中的溶解平衡曲线如图所示:下列有关说法正确的是( )
A.CaCO3(s)Ca2+(aq)+CO32-(aq) ΔH<0
B.a、b、c、d四点对应的溶度积Ksp相等
C.25℃时,水分挥发,可使溶液由a点移动到c点
D.25℃,Ksp(CaCO3)=2.8×10-9
二、填空题
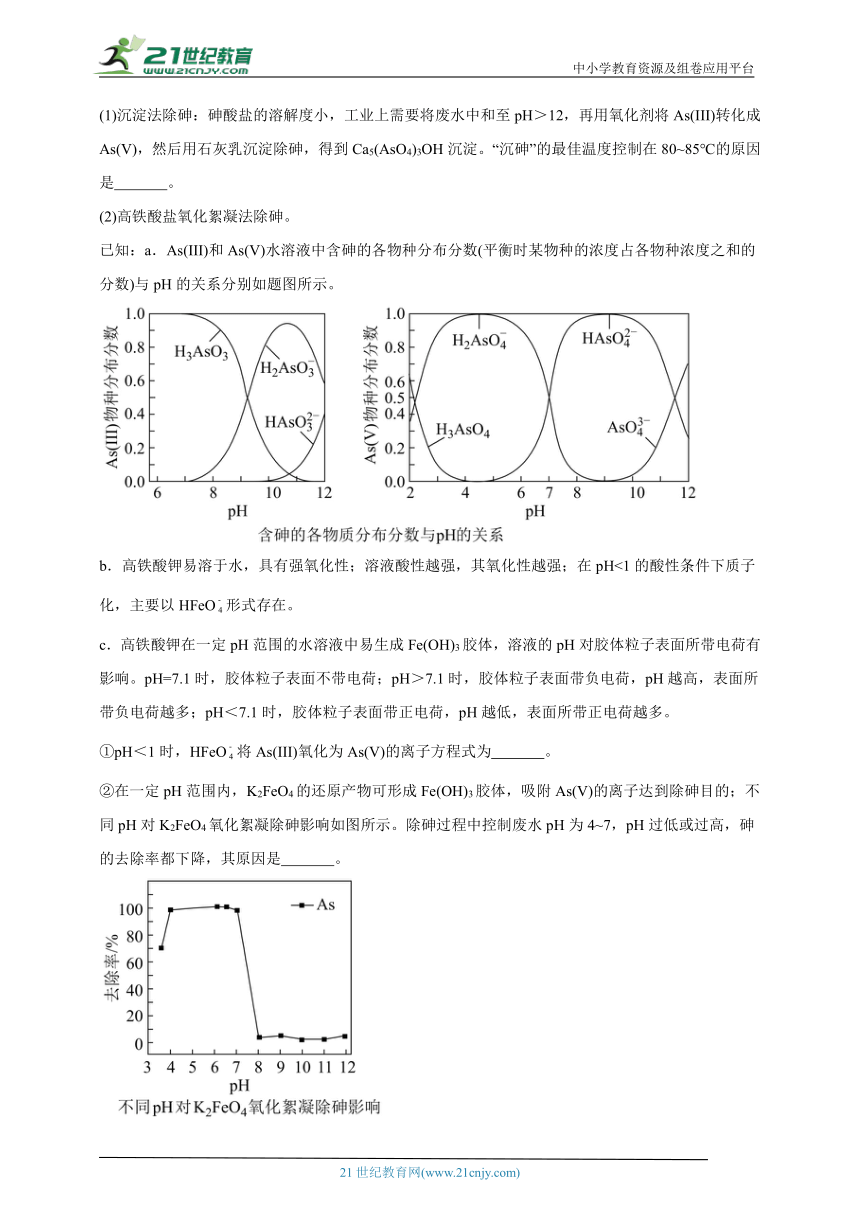
11.砷(As)是一些工厂和矿山废水中的污染元素,其剧毒、难降解且易生物聚集的特点极大的威胁了水环境安全和人体健康。天然水体中砷元素主要以As(III)和As(V)存在,且As(III)的毒性更大。常见除砷的方法有沉淀法、氧化絮凝法和离子交换法等。
(1)沉淀法除砷:砷酸盐的溶解度小,工业上需要将废水中和至pH>12,再用氧化剂将As(III)转化成As(V),然后用石灰乳沉淀除砷,得到Ca5(AsO4)3OH沉淀。“沉砷”的最佳温度控制在80~85℃的原因是 。
(2)高铁酸盐氧化絮凝法除砷。
已知:a.As(III)和As(V)水溶液中含砷的各物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图所示。
b.高铁酸钾易溶于水,具有强氧化性;溶液酸性越强,其氧化性越强;在pH<1的酸性条件下质子化,主要以HFeO形式存在。
c.高铁酸钾在一定pH范围的水溶液中易生成Fe(OH)3胶体,溶液的pH对胶体粒子表面所带电荷有影响。pH=7.1时,胶体粒子表面不带电荷;pH>7.1时,胶体粒子表面带负电荷,pH越高,表面所带负电荷越多;pH<7.1时,胶体粒子表面带正电荷,pH越低,表面所带正电荷越多。
①pH<1时,HFeO将As(III)氧化为As(V)的离子方程式为 。
②在一定pH范围内,K2FeO4的还原产物可形成Fe(OH)3胶体,吸附As(V)的离子达到除砷目的;不同pH对K2FeO4氧化絮凝除砷影响如图所示。除砷过程中控制废水pH为4~7,pH过低或过高,砷的去除率都下降,其原因是 。
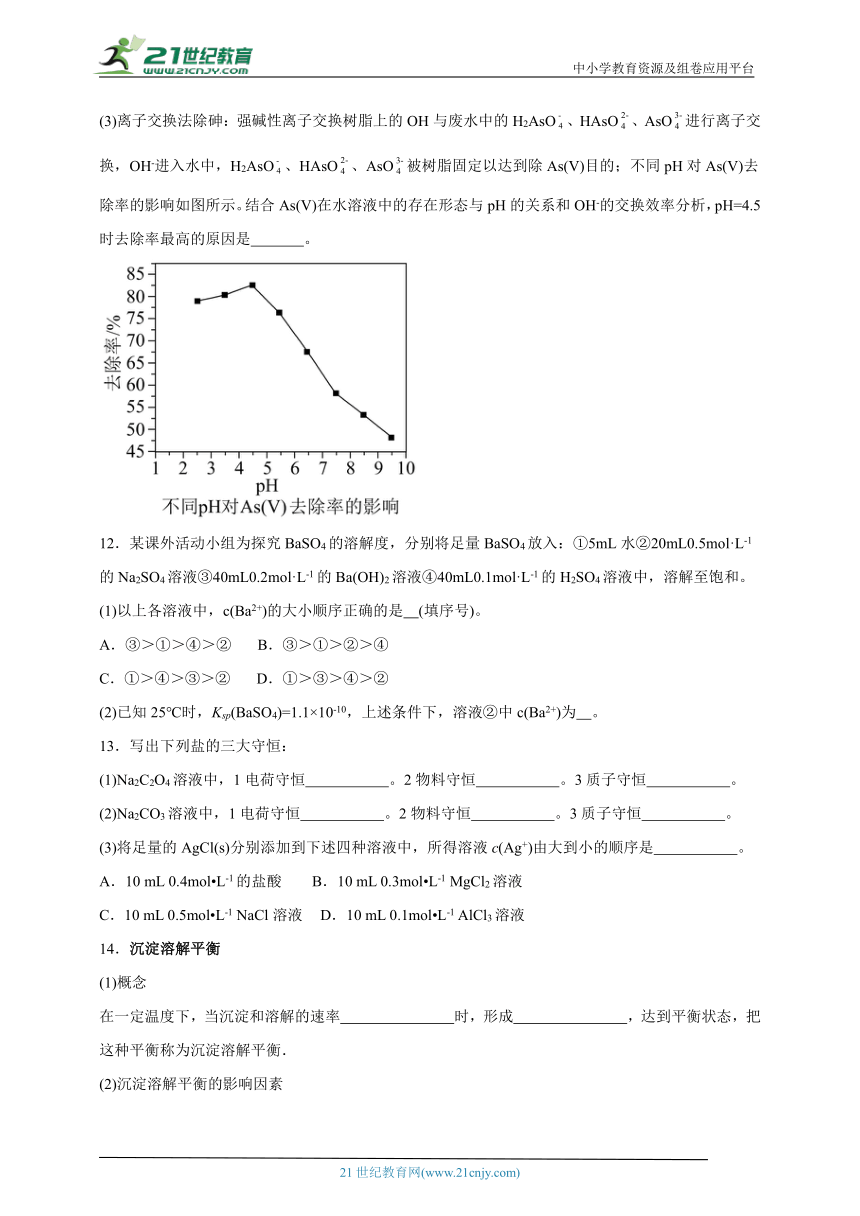
(3)离子交换法除砷:强碱性离子交换树脂上的OH与废水中的H2AsO、HAsO、AsO进行离子交换,OH-进入水中,H2AsO、HAsO、AsO被树脂固定以达到除As(V)目的;不同pH对As(V)去除率的影响如图所示。结合As(V)在水溶液中的存在形态与pH的关系和OH-的交换效率分析,pH=4.5时去除率最高的原因是 。
12.某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:①5mL水②20mL0.5mol·L-1的Na2SO4溶液③40mL0.2mol·L-1的Ba(OH)2溶液④40mL0.1mol·L-1的H2SO4溶液中,溶解至饱和。
(1)以上各溶液中,c(Ba2+)的大小顺序正确的是 (填序号)。
A.③>①>④>② B.③>①>②>④
C.①>④>③>② D.①>③>④>②
(2)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液②中c(Ba2+)为 。
13.写出下列盐的三大守恒:
(1)Na2C2O4溶液中,1电荷守恒 。2物料守恒 。3质子守恒 。
(2)Na2CO3溶液中,1电荷守恒 。2物料守恒 。3质子守恒 。
(3)将足量的AgCl(s)分别添加到下述四种溶液中,所得溶液c(Ag+)由大到小的顺序是 。
A.10 mL 0.4mol L-1的盐酸 B.10 mL 0.3mol L-1 MgCl2溶液
C.10 mL 0.5mol L-1 NaCl溶液 D.10 mL 0.1mol L-1 AlCl3溶液
14.沉淀溶解平衡
(1)概念
在一定温度下,当沉淀和溶解的速率 时,形成 ,达到平衡状态,把这种平衡称为沉淀溶解平衡.
(2)沉淀溶解平衡的影响因素
内因 难溶电解质
外因 温度 升温,大多数溶解平衡向 移动,Ksp增大[升温,Ca(OH)2溶解平衡向生成沉淀的方向移动,Ksp减小]
浓度 加水稀释,平衡向 移动,Ksp不变
相同离子 加入与难溶电解质含有相同离子的物质,平衡向 移动,Ksp不变
反应离子 加入能消耗难溶电解质中所含离子的物质,平衡向 移动,Ksp不变
15.按要求填空
(1)KAl(SO4)2·12H2O可做净水剂,其原理是(用离子方程式表示) 。
(2)将体积相等的NaOH稀溶液和CH3COOH稀溶液充分混合后,若溶液中c(Na+)=c(CH3COO-),则混合前c(NaOH) (填“”“”或“”)c(CH3COOH)。
(3)将AgCl分别放入①5mL H2O、②10mL 0.2mol/L MgCl2溶液、③20mL 0.5mol/L AgNO3溶液、④40mL 0.1mol/L HCl溶液中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是 (用序号填空)。
(4)常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合,若溶液呈中性则CH3COOH的电离平衡常数Ka= 。
(5)室温下,1mol/L相同体积的下列四种溶液①BaCl2、②FeCl3、③HF、④Na2CO3所含阳离子数由少到多的顺序是(用序号填空) 。
(6)标准状况下,将2.24L CO2通入100mL浓度为1.5mol/L的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:2c(Na+)= 。
16.水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a. NH3·H2O b. CH3COONa c. NH4Cl d. NaHSO4
常温下呈酸性的溶液有 (填序号)。
(2)已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示: 、
。
(3)有浓度均为0.1 mol L-1的 ①盐酸 ②硫酸 ③醋酸三种溶液,请用序号填空:
三种溶液的c(H+)大小顺序为 ;若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH的大小关系为 。
(4)25℃时,AgCl的Ksp=1.8×10-10 ,试写出AgCl溶解平衡的Ksp表达式: 。
17.有下列物质:①NaOH②HCl③④⑤⑥⑦⑧⑨⑩,回答下列问题:
(1)上述物质的水溶液显酸性的是 ;其中水解显酸性的是 。
(2)上述物质的水溶液显碱性的是 ;其中水解显碱性的是 。
(3)上述物质的水溶液存在电离平衡的是 。(不包括水的电离平衡)
(4)上述物质促进水的电离的是 。
(5)上述物质抑制水的电离的是 。
(6)上述物质的水溶液可能存在沉淀溶解平衡的是 。
18.回答下列问题:
(1)难溶于水,但可溶于含的溶液中,原因是 (用离子方程式表示,已知在溶液中可稳定存在)。
(2)中,与形成配位键的原子是 (填元素符号)。
19.羟胺()可视为氨分子内的1个氢原子被羟基取代的物质,常用作还原剂,其水溶液显弱碱性。
(1)利用的还原性,可以除去溶液中的:。从氧化产物看,用羟胺作还原剂的优点是 。
(2)的水溶液呈弱碱性的原理与相似,的水溶液中含有的离子是 (填离子符号)。
(3)某离子化合物的组成元素与相同,其水溶液显酸性。该物质是 (填化学式)。
(4)制备(盐酸羟胺)的一种工艺流程如图所示:
①步骤Ⅲ中,X为 (填化学式)。
②要使滤液Y中、的浓度均小于,溶液中浓度应不小于 。[已知,]
20.酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1)氨水是中学常见的碱溶液
① 下列事实可证明NH3·H2O是弱碱的是 (填字母序号)。
A.常温下,0. 1 mol·L-1氨水pH为11
B.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
C.常温下,0. 1mol·L-1氯化铵溶液的pH为5
D.铵盐受热易分解
② 下列方法中,可以使氨水电离程度增大的是 (填字母序号)。
A.加入少量氯化铁固体 B.通入氨气
C.加入少量氯化铵固体 D.加水稀释
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
① 滴定醋酸的曲线是 (填“Ⅰ”或“Ⅱ”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③ V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)常温下将0.2mol/L HCl溶液与0.2mol/L氨水溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,求混合溶液中下列算式的精确计算结果(填具体数字):c(H+)﹣c(NH3﹒H2O)= mol/L.
(4)铵盐和氯化银是中学常见盐
①0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较 (填溶质的化学式)溶液中NH的浓度更大,其原因是
②含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:
①100 mL蒸馏水
②100 mL 0.3 mol·L-1AgNO3溶液
③100 mL 0.1 mol·L-1 MgCl2溶液
充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (填序号)。
三、实验题
21.草酸()是一种常用的化工原料,能形成多种化合物,其中草酸钠是一种常用的化工还原剂,草酸钙可用于陶瓷上釉等,回答下列问题:
(1)中C元素的化合价为 。
(2)某同学用酸性溶液滴定含杂质的测定样品的纯度(已知杂质不参与反应),实验步骤如下:
准确称取1g固体样品,配成溶液,取出于锥形瓶中,再向锥形瓶中加入足量稀溶液,用高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液。
①高锰酸钾溶液应装在 滴定管中,滴定至终点时的实验现象是 。
②下列操作可能使测量结果偏低的是 。
a.盛装的的滴定管没润洗
b.称取的样品部分含有结晶水
c.读数时滴定前俯视,滴定后仰视
d.滴定结束后滴定管尖端悬有一滴溶液
③计算样品中的纯度 。
(3)是五种肾结石里最为常见的一种,患草酸钙结石的病人多饮白开水有利于结石的消融,请用必要的化学原理和简要的文字说明其原因 。
22.Na2S2O4 (保险粉)是一种强还原剂,锌粉法制备Na2S2O4的原理为、,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
(1)仪器a中盛放的药品是 (填名称),导管b的作用是 。
(2)实验开始前,需要向三口烧瓶中充满N2,目的是 。
(3)通入三口烧瓶中的SO2是由铜屑与浓硫酸反应制得的,生成SO2的化学方程式为 。
(4)制备Na2S2O4时,三口烧瓶的加热方式是 。
(5)Zn粉消耗完全后,在搅拌下向三口烧瓶中加入NaOH溶液,充分反应后过滤,向滤液中加入NaCl固体,冷却结晶、过滤、蒸馏水洗涤、酒精洗涤及干燥得产品。加入NaCl固体的作用是 ,酒精洗涤的目的是 。
(6)取a g产品溶于适量NaOH溶液,加入亚甲基蓝指示剂,用的标准溶液滴定,至终点时消耗标准溶液V mL。
已知:被还原为,被氧化为。
①滴定反应的离子方程式为 。
②产品中Na2S2O4的质量分数为 。(列出计算式)。
23.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体A[Coa(NH3)bClc]。回答下列问题:
已知:(1)Coa(NH3)b Clc在溶液中完全电离生成[Coa(NH3)b]c+ 和Cl-。
(2)Ksp[Co(OH)2]=1.09×10-15 Ksp[Co(OH)3]=1.6×10-44
I.A的制取:先向盛有混合物的三颈烧瓶中加入浓氨水,再加入双氧水,控制反应温度在50-60℃,充分反应后,再将反应后的混合物冷却、过滤,除去滤渣中的杂质即可得橙黄色晶体A.制备装置图如下:
(1)滴加氨水时,氨水无法正常流下,其原因可能是 。
(2)采用水浴加热的优点是 。
(3)如果先向溶液中加入双氧水,易生成沉淀,该沉淀为 (填化学式)。
II.A的提纯:提纯的主要过程如下图所示:
(4)趁热过滤的目的是 ;沉淀B中主要的物质是 (填名称)。
(5)有两处操作中加入浓盐酸,其目的是 。
(6)下图为操作Ⅱ中用到的抽滤装置,操作时将物质放在X装置(布氏漏斗)中,打开抽气泵,最终X装置中剩余橙黄色固体,抽滤装置可以加快过滤速率,其工作原理是 。抽滤结束后,向X中加入乙醇,再抽滤,选用乙醇而不用水作沉淀洗涤剂的原因是 。
III.组成测定:精确称取5.350g晶体A,配成溶液后,分为两等份;向一份溶液中加入足量氢氧化钠溶液,加热,所放出的气体能与60mL 1mol/L的盐酸恰好完全反应。向另一份溶液中加入足量硝酸银溶液,生成4.305g白色沉淀;
(7)A的分子式为 。
参考答案:
1.D
2.B
3.D
4.B
5.A
6.C
7.A
8.A
9.C
10.D
11.(1)温度过低,反应速率慢;温度过高,Ca(OH)2溶解度小,沉淀率下降
(2) 2+3H3AsO3+8H+=2Fe3++3H3AsO4+5H2O pH过低,酸性增强,K2FeO4氧化H3AsO3,本身被还原为Fe3+,生成絮凝剂Fe(OH)3胶体较少,此时As(V)主要以H3AsO4分子形式存在,被Fe(OH)3胶体吸附的量少,As的去除率下降。pH过高,K2FeO4氧化性减弱,还原产物Fe3+的量减少,产生 Fe(OH)3胶体的量少;碱性增强,还原产物Fe3+直接生成Fe(OH)3沉淀;As(V)主要以或形式存在,絮凝剂表面所带负电荷增多,静电斥力增加,As的去除率下降。
(3)根据离子交换原理:1个OH-可以交换1个,与交换需要2个OH-,与交换需要3个OH-,不能与H3AsO4交换。pH=4.5时,As(V)主要以形式存在; pH<4.5时,pH越小,H3AsO4比例越高,去除率越低;pH>4.5时,pH越大,和比例越高,去除率越低。
12. A 2.2×10-10mol·L-1
13. c(Na+)+c(H+)=2c(C2O)+c(OH-)+c(HC2O) c(Na+)=2c(C2O)+2c(HC2O)+2c(H2C2O4) c(H+)+ c(HC2O)+2c(H2C2O4)= c(OH-) c(Na+)+c(H+)=2c(CO)+c(OH-)+c(HCO) c(Na+)=2c(CO)+2c(HCO)+2c(H2CO3) c(H+)+ c(HCO)+2c(H2CO3)= c(OH-) DACB
14.(1) 相等 饱和溶液
(2) 本身的性质 沉淀溶解的方向 沉淀溶解的方向 生成沉淀的方向 沉淀溶解的方向
15. Al3++3H2OAl(OH)3(胶体)+3H+ < ③>①>④>② ×10-7 ③<②<①<④ 3c(HCO)+3c(CO)+3c(H2CO3)
16. c、d HCO3-H++CO32- HCO3-+H2OH2CO3+OH- ②>①>③ ①=②>③ Ksp=c(Ag+)·c(Cl-)
17. ②③⑥⑧ ⑥ ①④⑤⑨⑩ ⑤⑨ ③④⑨⑩ ⑤⑥⑨ ①②③④⑧⑩ ⑦⑩
18.(1)
(2)O
19. 氧化产物脱离反应体系,不引入新的杂质,不污染空气 、、
20. A、C A、D I 0.1mol·L-1醋酸溶液 < c(CH3COO-)> c (Na+)> c (H+)> c (OH-)
或[CH3COO-]> [Na+]>[ H+]> [OH-] 1.0×10﹣8 (NH4)2Fe(SO4)2 Fe2+水解显酸性,对NH的水解有抑制作用 ②①③
21. +3 酸式 溶液由无色变为淡紫色,且半分钟不褪色 ab 67% ,多喝水沉淀溶解平衡正向移动,有利于结石的消融
22. 碱石灰(或固体氢氧化钠或生石灰) 平衡气压,使NaOH溶液顺利滴下 排出装置内的空气,防止生成的ZnS2O4被氧化 Cu+2H2SO4(浓)CuSO4+SO2+2H2O 水浴加热 利用同离子小于,减小Na2S2O4的溶解度 使产品快速干燥 2[Fe(CN)6]3-+S2O+4OH-=2[Fe(CN)6]4-+2SO+2H2O
23. 分液漏斗上口的瓶塞没有打开或瓶塞的凹槽没有对准颈部的小孔 受热均匀,易控制温度 Co(OH)3 减少A的损失 活性炭 防止生成Co(OH)3,同时有利于形成A晶体 通过抽气,使锥形瓶中的压强减小,形成压力差,从而达到加快过滤的目的 减少A的溶解 Co (NH3)6Cl3
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
3.4.1难溶电解质的沉淀溶解平衡提升练-人教版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列有关电解质溶液的说法正确的是
A.向0.1 mol L-1CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B.盐酸滴定氢氧化钠的实验中,用甲基橙作指示剂时,滴定终点的pH为7
C.向盐酸中加入氨水至中性,溶液中c(NH)/c(Cl-)>1
D.将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3溶液,生成的沉淀AgCl多
2.将一定量的硫酸钡放入水中,有关的叙述正确的是( )
A.硫酸钡不溶于水,硫酸钡固体质量不会改变
B.最终会得到BaSO4的极稀的饱和溶液
C.因为很容易发生,所以不存在BaSO4(s)Ba2+(aq)+SO42-(aq)的过程
D.因为BaSO4难溶于水,所以改变外界条件也不会改变BaSO4的溶解性
3.在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示。下列说法中不正确的是
A.T ℃时,在Y点和Z点,Ag2CrO4的Ksp相等
B.向饱和Ag2CrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点
C.图中a=×10-4
D.T ℃时,Ag2CrO4的Ksp为1×10-8
4.常温下,以Na2S为沉淀剂除去废水中的重金属离子A2+ (M2+、N2+、Q2+、R2+),沉淀与离子关系[pA2+= lg c(A2+),pS2 = lg c(S2 )]图象如图所示。下列说法正确的是
A.Ksp(MS)
C.若a点时pS2 =14,pN2+=14,则Ksp(NS)=1028
D.b点对应溶液中不能形成QS沉淀
5.常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如图所示。下列有关说法正确的是
A.常温下,Ksp(PbS)=8×10-28,向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq)PbS(s)+2I-(aq)的化学平衡常数为5×1018
B.常温下,PbI2的Ksp为2×10-6
C.温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大
D.温度不变,向PbI2饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小
6.下列事实不能用勒夏特列原理解释的是
A.实验室中常用排饱和食盐水的方式收集氯气
B.红棕色的气体,加压后颜色先变深后变浅
C.合成氨工业中使用铁触媒作催化剂
D.对熟石灰的悬浊液加热,悬浊液中固体质量增加
7.化学与生产、生活密切相关,下列说法正确的是
A.牙膏中添加氟化物可预防龋齿
B.沼气的主要成分为甲烷,沼气属于不可再生资源
C.葡萄酒中添加适量二氧化硫,可以起到抗氧化和漂白的作用
D.氢氧化镁和碳酸钠可用作胃酸的中和剂
8.常温常压下,下列有关电解质溶液说法正确的是
A.AgCl能溶于氨水,而AgI不溶于氨水,则
B.,则等浓度的和溶液的pH,前者大于后者
C.等物质的量的草酸()与NaOH混合溶液的,则溶液中
D.浓度均为"的、混合溶液中,
9.室温时,M(OH)2(s)M2+(aq)+2OH-(aq) Ksp=a ,c(M2+)=b mol·L-1时,溶液的pH等于( )
A.14-1/2lg(b/a) B.14-1/2lg(a/b) C.14+1/2lg(a/b) D.14+1/2lg(b/a)
10.在25℃和100℃两种温度下,碳酸钙(CaCO3)在水中的溶解平衡曲线如图所示:下列有关说法正确的是( )
A.CaCO3(s)Ca2+(aq)+CO32-(aq) ΔH<0
B.a、b、c、d四点对应的溶度积Ksp相等
C.25℃时,水分挥发,可使溶液由a点移动到c点
D.25℃,Ksp(CaCO3)=2.8×10-9
二、填空题
11.砷(As)是一些工厂和矿山废水中的污染元素,其剧毒、难降解且易生物聚集的特点极大的威胁了水环境安全和人体健康。天然水体中砷元素主要以As(III)和As(V)存在,且As(III)的毒性更大。常见除砷的方法有沉淀法、氧化絮凝法和离子交换法等。
(1)沉淀法除砷:砷酸盐的溶解度小,工业上需要将废水中和至pH>12,再用氧化剂将As(III)转化成As(V),然后用石灰乳沉淀除砷,得到Ca5(AsO4)3OH沉淀。“沉砷”的最佳温度控制在80~85℃的原因是 。
(2)高铁酸盐氧化絮凝法除砷。
已知:a.As(III)和As(V)水溶液中含砷的各物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图所示。
b.高铁酸钾易溶于水,具有强氧化性;溶液酸性越强,其氧化性越强;在pH<1的酸性条件下质子化,主要以HFeO形式存在。
c.高铁酸钾在一定pH范围的水溶液中易生成Fe(OH)3胶体,溶液的pH对胶体粒子表面所带电荷有影响。pH=7.1时,胶体粒子表面不带电荷;pH>7.1时,胶体粒子表面带负电荷,pH越高,表面所带负电荷越多;pH<7.1时,胶体粒子表面带正电荷,pH越低,表面所带正电荷越多。
①pH<1时,HFeO将As(III)氧化为As(V)的离子方程式为 。
②在一定pH范围内,K2FeO4的还原产物可形成Fe(OH)3胶体,吸附As(V)的离子达到除砷目的;不同pH对K2FeO4氧化絮凝除砷影响如图所示。除砷过程中控制废水pH为4~7,pH过低或过高,砷的去除率都下降,其原因是 。
(3)离子交换法除砷:强碱性离子交换树脂上的OH与废水中的H2AsO、HAsO、AsO进行离子交换,OH-进入水中,H2AsO、HAsO、AsO被树脂固定以达到除As(V)目的;不同pH对As(V)去除率的影响如图所示。结合As(V)在水溶液中的存在形态与pH的关系和OH-的交换效率分析,pH=4.5时去除率最高的原因是 。
12.某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:①5mL水②20mL0.5mol·L-1的Na2SO4溶液③40mL0.2mol·L-1的Ba(OH)2溶液④40mL0.1mol·L-1的H2SO4溶液中,溶解至饱和。
(1)以上各溶液中,c(Ba2+)的大小顺序正确的是 (填序号)。
A.③>①>④>② B.③>①>②>④
C.①>④>③>② D.①>③>④>②
(2)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液②中c(Ba2+)为 。
13.写出下列盐的三大守恒:
(1)Na2C2O4溶液中,1电荷守恒 。2物料守恒 。3质子守恒 。
(2)Na2CO3溶液中,1电荷守恒 。2物料守恒 。3质子守恒 。
(3)将足量的AgCl(s)分别添加到下述四种溶液中,所得溶液c(Ag+)由大到小的顺序是 。
A.10 mL 0.4mol L-1的盐酸 B.10 mL 0.3mol L-1 MgCl2溶液
C.10 mL 0.5mol L-1 NaCl溶液 D.10 mL 0.1mol L-1 AlCl3溶液
14.沉淀溶解平衡
(1)概念
在一定温度下,当沉淀和溶解的速率 时,形成 ,达到平衡状态,把这种平衡称为沉淀溶解平衡.
(2)沉淀溶解平衡的影响因素
内因 难溶电解质
外因 温度 升温,大多数溶解平衡向 移动,Ksp增大[升温,Ca(OH)2溶解平衡向生成沉淀的方向移动,Ksp减小]
浓度 加水稀释,平衡向 移动,Ksp不变
相同离子 加入与难溶电解质含有相同离子的物质,平衡向 移动,Ksp不变
反应离子 加入能消耗难溶电解质中所含离子的物质,平衡向 移动,Ksp不变
15.按要求填空
(1)KAl(SO4)2·12H2O可做净水剂,其原理是(用离子方程式表示) 。
(2)将体积相等的NaOH稀溶液和CH3COOH稀溶液充分混合后,若溶液中c(Na+)=c(CH3COO-),则混合前c(NaOH) (填“”“”或“”)c(CH3COOH)。
(3)将AgCl分别放入①5mL H2O、②10mL 0.2mol/L MgCl2溶液、③20mL 0.5mol/L AgNO3溶液、④40mL 0.1mol/L HCl溶液中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是 (用序号填空)。
(4)常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合,若溶液呈中性则CH3COOH的电离平衡常数Ka= 。
(5)室温下,1mol/L相同体积的下列四种溶液①BaCl2、②FeCl3、③HF、④Na2CO3所含阳离子数由少到多的顺序是(用序号填空) 。
(6)标准状况下,将2.24L CO2通入100mL浓度为1.5mol/L的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:2c(Na+)= 。
16.水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a. NH3·H2O b. CH3COONa c. NH4Cl d. NaHSO4
常温下呈酸性的溶液有 (填序号)。
(2)已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示: 、
。
(3)有浓度均为0.1 mol L-1的 ①盐酸 ②硫酸 ③醋酸三种溶液,请用序号填空:
三种溶液的c(H+)大小顺序为 ;若三种溶液的pH都为2,分别取10mL上述溶液加水稀释至1000mL,此时三种溶液的pH的大小关系为 。
(4)25℃时,AgCl的Ksp=1.8×10-10 ,试写出AgCl溶解平衡的Ksp表达式: 。
17.有下列物质:①NaOH②HCl③④⑤⑥⑦⑧⑨⑩,回答下列问题:
(1)上述物质的水溶液显酸性的是 ;其中水解显酸性的是 。
(2)上述物质的水溶液显碱性的是 ;其中水解显碱性的是 。
(3)上述物质的水溶液存在电离平衡的是 。(不包括水的电离平衡)
(4)上述物质促进水的电离的是 。
(5)上述物质抑制水的电离的是 。
(6)上述物质的水溶液可能存在沉淀溶解平衡的是 。
18.回答下列问题:
(1)难溶于水,但可溶于含的溶液中,原因是 (用离子方程式表示,已知在溶液中可稳定存在)。
(2)中,与形成配位键的原子是 (填元素符号)。
19.羟胺()可视为氨分子内的1个氢原子被羟基取代的物质,常用作还原剂,其水溶液显弱碱性。
(1)利用的还原性,可以除去溶液中的:。从氧化产物看,用羟胺作还原剂的优点是 。
(2)的水溶液呈弱碱性的原理与相似,的水溶液中含有的离子是 (填离子符号)。
(3)某离子化合物的组成元素与相同,其水溶液显酸性。该物质是 (填化学式)。
(4)制备(盐酸羟胺)的一种工艺流程如图所示:
①步骤Ⅲ中,X为 (填化学式)。
②要使滤液Y中、的浓度均小于,溶液中浓度应不小于 。[已知,]
20.酸、碱、盐均属于电解质,它们的水溶液中存在各种平衡。
(1)氨水是中学常见的碱溶液
① 下列事实可证明NH3·H2O是弱碱的是 (填字母序号)。
A.常温下,0. 1 mol·L-1氨水pH为11
B.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
C.常温下,0. 1mol·L-1氯化铵溶液的pH为5
D.铵盐受热易分解
② 下列方法中,可以使氨水电离程度增大的是 (填字母序号)。
A.加入少量氯化铁固体 B.通入氨气
C.加入少量氯化铵固体 D.加水稀释
(2)盐酸和醋酸是中学常见酸
用0.1 mol·L-1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
① 滴定醋酸的曲线是 (填“Ⅰ”或“Ⅱ”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③ V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)常温下将0.2mol/L HCl溶液与0.2mol/L氨水溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,求混合溶液中下列算式的精确计算结果(填具体数字):c(H+)﹣c(NH3﹒H2O)= mol/L.
(4)铵盐和氯化银是中学常见盐
①0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较 (填溶质的化学式)溶液中NH的浓度更大,其原因是
②含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:
AgCl(s)Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:
①100 mL蒸馏水
②100 mL 0.3 mol·L-1AgNO3溶液
③100 mL 0.1 mol·L-1 MgCl2溶液
充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为 (填序号)。
三、实验题
21.草酸()是一种常用的化工原料,能形成多种化合物,其中草酸钠是一种常用的化工还原剂,草酸钙可用于陶瓷上釉等,回答下列问题:
(1)中C元素的化合价为 。
(2)某同学用酸性溶液滴定含杂质的测定样品的纯度(已知杂质不参与反应),实验步骤如下:
准确称取1g固体样品,配成溶液,取出于锥形瓶中,再向锥形瓶中加入足量稀溶液,用高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液。
①高锰酸钾溶液应装在 滴定管中,滴定至终点时的实验现象是 。
②下列操作可能使测量结果偏低的是 。
a.盛装的的滴定管没润洗
b.称取的样品部分含有结晶水
c.读数时滴定前俯视,滴定后仰视
d.滴定结束后滴定管尖端悬有一滴溶液
③计算样品中的纯度 。
(3)是五种肾结石里最为常见的一种,患草酸钙结石的病人多饮白开水有利于结石的消融,请用必要的化学原理和简要的文字说明其原因 。
22.Na2S2O4 (保险粉)是一种强还原剂,锌粉法制备Na2S2O4的原理为、,制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
(1)仪器a中盛放的药品是 (填名称),导管b的作用是 。
(2)实验开始前,需要向三口烧瓶中充满N2,目的是 。
(3)通入三口烧瓶中的SO2是由铜屑与浓硫酸反应制得的,生成SO2的化学方程式为 。
(4)制备Na2S2O4时,三口烧瓶的加热方式是 。
(5)Zn粉消耗完全后,在搅拌下向三口烧瓶中加入NaOH溶液,充分反应后过滤,向滤液中加入NaCl固体,冷却结晶、过滤、蒸馏水洗涤、酒精洗涤及干燥得产品。加入NaCl固体的作用是 ,酒精洗涤的目的是 。
(6)取a g产品溶于适量NaOH溶液,加入亚甲基蓝指示剂,用的标准溶液滴定,至终点时消耗标准溶液V mL。
已知:被还原为,被氧化为。
①滴定反应的离子方程式为 。
②产品中Na2S2O4的质量分数为 。(列出计算式)。
23.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体A[Coa(NH3)bClc]。回答下列问题:
已知:(1)Coa(NH3)b Clc在溶液中完全电离生成[Coa(NH3)b]c+ 和Cl-。
(2)Ksp[Co(OH)2]=1.09×10-15 Ksp[Co(OH)3]=1.6×10-44
I.A的制取:先向盛有混合物的三颈烧瓶中加入浓氨水,再加入双氧水,控制反应温度在50-60℃,充分反应后,再将反应后的混合物冷却、过滤,除去滤渣中的杂质即可得橙黄色晶体A.制备装置图如下:
(1)滴加氨水时,氨水无法正常流下,其原因可能是 。
(2)采用水浴加热的优点是 。
(3)如果先向溶液中加入双氧水,易生成沉淀,该沉淀为 (填化学式)。
II.A的提纯:提纯的主要过程如下图所示:
(4)趁热过滤的目的是 ;沉淀B中主要的物质是 (填名称)。
(5)有两处操作中加入浓盐酸,其目的是 。
(6)下图为操作Ⅱ中用到的抽滤装置,操作时将物质放在X装置(布氏漏斗)中,打开抽气泵,最终X装置中剩余橙黄色固体,抽滤装置可以加快过滤速率,其工作原理是 。抽滤结束后,向X中加入乙醇,再抽滤,选用乙醇而不用水作沉淀洗涤剂的原因是 。
III.组成测定:精确称取5.350g晶体A,配成溶液后,分为两等份;向一份溶液中加入足量氢氧化钠溶液,加热,所放出的气体能与60mL 1mol/L的盐酸恰好完全反应。向另一份溶液中加入足量硝酸银溶液,生成4.305g白色沉淀;
(7)A的分子式为 。
参考答案:
1.D
2.B
3.D
4.B
5.A
6.C
7.A
8.A
9.C
10.D
11.(1)温度过低,反应速率慢;温度过高,Ca(OH)2溶解度小,沉淀率下降
(2) 2+3H3AsO3+8H+=2Fe3++3H3AsO4+5H2O pH过低,酸性增强,K2FeO4氧化H3AsO3,本身被还原为Fe3+,生成絮凝剂Fe(OH)3胶体较少,此时As(V)主要以H3AsO4分子形式存在,被Fe(OH)3胶体吸附的量少,As的去除率下降。pH过高,K2FeO4氧化性减弱,还原产物Fe3+的量减少,产生 Fe(OH)3胶体的量少;碱性增强,还原产物Fe3+直接生成Fe(OH)3沉淀;As(V)主要以或形式存在,絮凝剂表面所带负电荷增多,静电斥力增加,As的去除率下降。
(3)根据离子交换原理:1个OH-可以交换1个,与交换需要2个OH-,与交换需要3个OH-,不能与H3AsO4交换。pH=4.5时,As(V)主要以形式存在; pH<4.5时,pH越小,H3AsO4比例越高,去除率越低;pH>4.5时,pH越大,和比例越高,去除率越低。
12. A 2.2×10-10mol·L-1
13. c(Na+)+c(H+)=2c(C2O)+c(OH-)+c(HC2O) c(Na+)=2c(C2O)+2c(HC2O)+2c(H2C2O4) c(H+)+ c(HC2O)+2c(H2C2O4)= c(OH-) c(Na+)+c(H+)=2c(CO)+c(OH-)+c(HCO) c(Na+)=2c(CO)+2c(HCO)+2c(H2CO3) c(H+)+ c(HCO)+2c(H2CO3)= c(OH-) DACB
14.(1) 相等 饱和溶液
(2) 本身的性质 沉淀溶解的方向 沉淀溶解的方向 生成沉淀的方向 沉淀溶解的方向
15. Al3++3H2OAl(OH)3(胶体)+3H+ < ③>①>④>② ×10-7 ③<②<①<④ 3c(HCO)+3c(CO)+3c(H2CO3)
16. c、d HCO3-H++CO32- HCO3-+H2OH2CO3+OH- ②>①>③ ①=②>③ Ksp=c(Ag+)·c(Cl-)
17. ②③⑥⑧ ⑥ ①④⑤⑨⑩ ⑤⑨ ③④⑨⑩ ⑤⑥⑨ ①②③④⑧⑩ ⑦⑩
18.(1)
(2)O
19. 氧化产物脱离反应体系,不引入新的杂质,不污染空气 、、
20. A、C A、D I 0.1mol·L-1醋酸溶液 < c(CH3COO-)> c (Na+)> c (H+)> c (OH-)
或[CH3COO-]> [Na+]>[ H+]> [OH-] 1.0×10﹣8 (NH4)2Fe(SO4)2 Fe2+水解显酸性,对NH的水解有抑制作用 ②①③
21. +3 酸式 溶液由无色变为淡紫色,且半分钟不褪色 ab 67% ,多喝水沉淀溶解平衡正向移动,有利于结石的消融
22. 碱石灰(或固体氢氧化钠或生石灰) 平衡气压,使NaOH溶液顺利滴下 排出装置内的空气,防止生成的ZnS2O4被氧化 Cu+2H2SO4(浓)CuSO4+SO2+2H2O 水浴加热 利用同离子小于,减小Na2S2O4的溶解度 使产品快速干燥 2[Fe(CN)6]3-+S2O+4OH-=2[Fe(CN)6]4-+2SO+2H2O
23. 分液漏斗上口的瓶塞没有打开或瓶塞的凹槽没有对准颈部的小孔 受热均匀,易控制温度 Co(OH)3 减少A的损失 活性炭 防止生成Co(OH)3,同时有利于形成A晶体 通过抽气,使锥形瓶中的压强减小,形成压力差,从而达到加快过滤的目的 减少A的溶解 Co (NH3)6Cl3
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
