人教版(2019) 高中化学选择性必修1 3.4.2沉淀溶解平衡的应用提升练(含答案)
文档属性
| 名称 | 人教版(2019) 高中化学选择性必修1 3.4.2沉淀溶解平衡的应用提升练(含答案) |
|
|
| 格式 | doc | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-22 00:00:00 | ||
图片预览





文档简介
中小学教育资源及组卷应用平台
3.4.2沉淀溶解平衡的应用提升练-人教版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
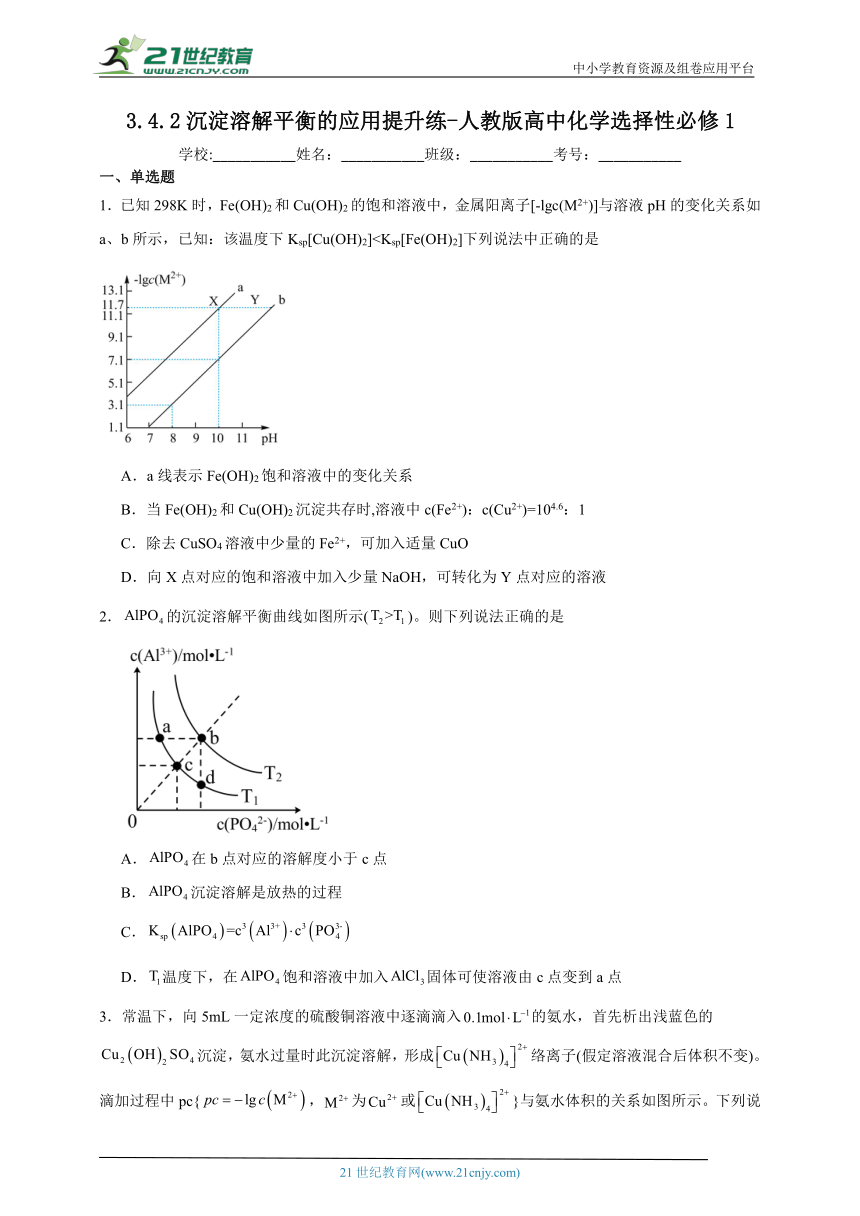
1.已知298K时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子[-lgc(M2+)]与溶液pH的变化关系如a、b所示,已知:该温度下Ksp[Cu(OH)2]
A.a线表示Fe(OH)2饱和溶液中的变化关系
B.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6:1
C.除去CuSO4溶液中少量的Fe2+,可加入适量CuO
D.向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
2.的沉淀溶解平衡曲线如图所示()。则下列说法正确的是
A.在b点对应的溶解度小于c点
B.沉淀溶解是放热的过程
C.
D.温度下,在饱和溶液中加入固体可使溶液由c点变到a点
3.常温下,向5mL一定浓度的硫酸铜溶液中逐滴滴入的氨水,首先析出浅蓝色的沉淀,氨水过量时此沉淀溶解,形成络离子(假定溶液混合后体积不变)。滴加过程中pc{,为或}与氨水体积的关系如图所示。下列说法错误的是
A.硫酸铜溶液的浓度为
B.常温下,b点溶液中水的电离程度低于纯水的
C.c点溶液中存在
D.常温下,忽略的影响,可得
4.下列实验设计、操作、现象及得出的结论完全正确的是
实验操作、现象 得出的结论
A 向一未知溶液的样品中,加入盐酸酸化的氯化钡溶液,生成大量白色沉淀 该溶液中一定含有-
B 向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1AgNO3溶液,振荡,沉淀呈黄色 Ksp:AgCl>AgI
C 取少量蔗糖溶液,加入3~5滴稀硫酸,水浴加热后再加入少量新制的Cu(OH)2悬浊液,加热3~5分钟,无砖红色沉淀生成 蔗糖没有水解
D 向两支装有2mL0.1mol·L-1草酸溶液的试管中,分别滴入4mL0.01mol·L-1的高锰酸钾溶液、4mL0.02mol·L-1的高锰酸钾溶液,发现加4mL0.02mol·L-1的高锰酸钾溶液的试管先褪色 浓度越大,反应速率越快
A.A B.B C.C D.D
5.实验:①将0.1 mol·L-1的AgNO3溶液和0.1 mol·L-1的NaCl溶液等体积混合,得到浊液a,过滤,得到滤液b和白色沉淀c;
②取一部分沉淀c,向其中滴加0.1 mol·L-1的 KI溶液,沉淀变为黄色(AgI);
③往剩余的沉淀c中滴加0.1 mol·L-1的KBr溶液,沉淀变为淡黄色(AgBr)。
通过以上实验进行分析,下列有关结论不正确的是
A.滤液b中:c(Na+)=c(NO)
B.实验②中反应达到平衡时,平衡常数表达式为K=
C.实验③中发生反应的化学方程式为AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)
D.根据实验②③可得出:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI)
6.是一种二元弱酸,由于与空气中的某种成分作用而保持浓度不变,已知,,某水体中(X为、、、)与pH的关系如图所示。下列叙述正确的是
A.曲线②代表
B.Q点
C.随pH升高,先增大后减小
D.R点时,
7.利用湿法炼锌产生的铜镉渣(主要含有、、、、等单质)生产金属镉的流程及相关离子生成氢氧化物沉淀的如下:
氢氧化物
开始沉淀的 1.5 6.5 7.2 8.2
沉淀完全的 3.3 9.9 9.5 10.6
下列说法不正确的是
A.为了提高铜镉渣没出的速率,可以采取升温、搅拌、适当增加硫酸浓度等措施
B.除铁过程中加入发生的反应为
C.加入控制反应液的范围应该为3.3~7.2
D.可以用溶液检验除铁过程中是否加入足量
8.还原沉淀法是处理含铬(含Cr2O和CrO)工业废水的常用方法,过程如下,下列说法错误的是(已知:常温下,Ksp[Cr(OH)3]=1×10-32)
A.反应①,增大c(H+),的转化率增大
B.反应①2v正(CrO)=v逆(Cr2O)时,反应处于平衡状态
C.反应②转移0.6mole-,则有0.1molCr2O被还原
D.常温下,要使处理后废水中的c()降至1×10-5mol·L-1,反应③应调溶液pH=5
9.某温度下,将足量的BaSO4固体溶于一定量的水中达到溶解平衡,加入Na2CO3使c()增大过程中,溶液中c(Ba2+)和c()的变化曲线如图所示(忽略溶液体积的变化)。下列说不正确的是
A.当c()大于2.5×10-4mol L-1时开始有BaCO3沉淀生成
B.“MN”代表沉淀转化过程中c(Ba2+)变化的曲线
C.该温度下,BaCO3比BaSO4更难溶于水
D.该温度下,BaSO4转换为BaCO3的平衡常数K=0.04
10.化学在生产和日常生活中有着重要的应用。下列说法正确的是
A.工业上可利用电解饱和食盐水的方法冶炼金属钠
B.含的草木灰与铵态氮肥混合施用,能增强肥效
C.除去锅炉水垢中的,可依次用碳酸钠溶液、盐酸处理
D.合成氨工业中可使用高效催化剂来提高原材料的平衡转化率
二、填空题
11.氢氰酸()有剧毒,易挥发。金矿提金时,用溶液浸取金生成,再用锌置换出金,产生的含氰废水需处理后排放。
(1)①存在着两步电离平衡,其第一步电离方程式为 。
②可用于制备,浊液中加入溶液可发生反应:
,该反应的平衡常数 。
[已知,]。
(2)可催化氧化废水中的。其他条件相同时,总氯化物(、等)去除率随溶液初始变化如图所示。
①在酸性条件下,也能氧化,但实际处理废水时却不在酸性条件下进行的原因是 。
②当溶液初始时,总氰化物去除率下降的原因可能是 。
(3)通过电激发产生和处理废水中的,可能的反应机理如图所示。虚线方框内的过程可描述为 。
12.沉淀溶解和生成判断
(1)Q Ksp,溶液过饱和,有 析出,直至溶液 ,达到新的平衡。
(2)Q Ksp,溶液饱和,沉淀与溶解处于 状态。
(3)Q Ksp,溶液未饱和,无 析出,若加入过量难溶电解质,难溶电解质 直至溶液 。
13.草酸()存在于菠菜等蔬菜中,是一种二元弱酸。常温下,向某浓度的草酸溶液中逐滴滴入一定浓度的NaOH溶液,所得溶液中、、三种微粒的物质的量分数(δ)与溶液pH的关系如图1所示。
回答下列问题:
(1)用离子方程式说明溶液显碱性的原因: 。
(2)常温下,若向N点溶液加蒸馏水稀释,在稀释该溶液过程中,下列物理量始终增大的是 (填标号)。
a. b.
c. d.
(3)p点,溶液中 。
(4)下列说法正确的是 (填标号)。
a.E、F、Q三点,水的电离程度最大的是Q点
b.E点存在:
c.F点存在:
(5)常温下,的溶液的物质的量浓度为,水电离出的为;的溶液的物质的量浓度为,水电离出的为。则 (填“>”“<”或“=”,下同); 。
(6)已知。将0.03 mol L 1的溶液与0.01 mol L 1的溶液等体积混合,混合溶液中的浓度约为 mol L 1。(用含a的代数式表示,混合后溶液体积变化忽略不计)。
14.(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“>”或“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)常温下,Ksp(PbI2)=8.5×10-9。取适量黄色PbI2粉末溶于水中,充分搅拌后得到浊液,过滤。在滤液中加入少量KI,测得c(I-)=1.0×10-2mol·L-1。则c(Pb2+)= 。
15.在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。
(1)在25℃时,反应CaSO4(s)+CO (aq) CaCO3(s)+SO (aq)的平衡常数K=
(2)在某含Ca2+废水中加入Na2CO3,当Ca2+沉淀完全时,水体中Ca2+浓度为 mol·L-1;
16.高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示,回答下列问题:
相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如图:
金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+
开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2 6.9
沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9
(1)“氧化”中添加适量的MnO2的作用是 。
(2)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是 。
17.水溶液存在离子平衡,回答下列问题:
(1)水的电离平衡曲线如图所示。若以A点表示25℃时水在电离平衡时的离子浓度。当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积为 ,该温度时0.1 mol·L-1NaOH溶液pH为 。
(2)一定温度下,向1 L0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向 (填“正”或“逆”)反应方向移动;水的电离程度将 (填“增大”、“减小”或“不变”)。
(3)常温下,在0.1mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液,充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH为8时,c(Cu2+)= 。(已知常温时Cu(OH)的Ksp=2.2×10-20)
(4)常温下,向20.00 mL 0.100 mol/LHX(一元酸)溶液中滴加0.100 mol/L NaOH过程中pH变化如图所示。
①A点溶液中水电离出的氢离子浓度为 。
② HX的电离常数为 。
③ C点溶液中c(X-) c(Na+)(填“>”、“<”或“=”,下同)
④D点时二者恰好完全反应,此时溶液的pH 7(填“>”、“<”或“=” ),原因是 (用离子方程式表示)。该溶液中离子浓度大小关系
18.连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为 。
(2)常温下,用0.01mol L-1的NaOH溶液滴定10mL 0.01mol·L-1的H2N2O2溶液,测得溶液的pH与NaOH溶液体积的关系如图所示。
①写出H2N2O2在水溶液中的电离方程式: 。
②b点时溶液中c(H2N2O2) c(N2O22-) 。(填“>”“ <”或“=”下同)
③a点时溶液中c(Na+) c(HN2O2-)+c(N2O22-)。
(3)向10mL 0.1mol/L的硝酸银溶液中滴加等浓度的连二次硝酸钠溶液,要使Ag完全沉淀[c(Ag+)小于10-5 mol/L],至少需要连二次硝酸钠溶液 mL。[已知Ksp(Ag2N2O2)=4.0×10-12]
19.溶度积常数()的相关计算
悬浊液中间的关系
。
(1)与溶解度(S)之间的计算关系
对于型物质,其。
如时溴酸银的溶解度为,则约等于 。
(2)与沉淀转化平衡常数K的计算关系
建立与K的关系,一般是在K的表达式分子分母中同乘以某个离子的浓度,将分子分母转化为不同物质的。
如在溶液中溶解,列式计算,溶液的最初浓度不得低于 [忽略溶液体积变化,已知:、]。
(3)与电离常数的计算关系
根据电离常数计算出各离子浓度,进而计算。
如汽车尾气中的可用石灰水吸收,生成亚硫酸钙浊液。常温下,测得与水形成的浊液为9,忽略的第二步水解,则 (结果保留3位有效数字)。[已知:,]
20.Ⅰ.25℃时在25 mL氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示.下列说法正确的是
A.滴定终点时俯视读数则测定的氢氧化钠浓度偏高
B.B、C、D三点的溶液中水的电离程度为B>C>D
C.D点,c(CH3COO-)+ c(CH3COOH)>2c(Na+)
D.B点为滴定终点
E.B点时c(CH3COO-)=c(Na+)
F. 若由体积相等的氢氧化钠和醋酸溶液混合而且恰好呈中性,则混合前c(NaOH)< c(CH3COOH)
G.滴定前的氢氧化钠溶液的浓度为0.1mol/L
Ⅱ.(1)为了检验某残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,写出滴定过程中反应的离子方程式: KMnO4应装在 滴定管中(填“酸式”或“碱式”)滴定前是否要滴加指示剂? (填“是”或“否”),滴定终点的判断方法:
(2)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入 调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。[Fe(OH)3的Ksp=2.6×10-39]
三、实验题
21.As2S3是国民经济发展中不可缺少的资源,是剧毒物质。某小组拟在实验室模拟对As2S3矿渣进行回收处理,湿法制取As2O3.实验装置及步骤如下。
步骤1:向C装置的反应瓶中,加入61.5gAs2S3粉料与200mL足量的CuSO4溶液形成料浆,关闭开关B,控制温度80℃左右,持续搅拌反应1小时。
步骤2:待C装置反应瓶中的反应溶液冷却至室温,料浆中主要含CuS和As2O3.打开B,通入过量氧气使微溶的As2O3氧化成易溶的As2O5,过滤。
步骤3:向步骤2的滤液中通入二氧化硫,使As2O5还原,经冷却析出As2O3晶体19.8g。
(1)A装置中仪器X的名称是 ;实验中的加热方式为 。
(2)C装置反应瓶中发生反应的化学方程式为 。步骤2中,若过滤后的溶液中Cu2+浓度为0.5mol·L-1,已知CuS的Ksp=6.3×10-36.则滤液中S2-浓度为 mol·L-1。
(3)步骤3中,通入二氧化硫使As2O5还原的离子方程式为 。
(4)本实验中As2O3的产率最接近于___________(填标号)。
A.40% B.50% C.60% D.70%
(5)将分离出As2O3晶体后的母液收集、循环使用,其实际工业生产的意义是 。
22.亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,其熔点为-64.5℃,沸点为-5.5℃,遇水易水解。它是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。
实验1:利用下图所示装置制备NO和Cl2。
(1)利用图1制备Cl2,烧瓶中反应的化学方程式为 。
(2)利用图2制备NO,检验图2装置气密性的具体操作为 。
实验2:利用图3装置制备NOCl。
(3)实验开始,需先打开 ,当 时,再打开 ,当烧瓶中有一定量液体生成时,停止实验。
(4)图3中发生反应的化学方程式为 。A中装有碱石灰,其作用是 。
实验3:测定NOCl的纯度。
已知下列物质在常温下的颜色及Ksp
化学式 AgCl AgBr Ag2S Ag2CrO4
颜色 白色 浅黄色 黑色 砖红色
Ksp 1.56×10-10 5.4×10-13 2.0×10-48 1×10-12
(5)取所得液体mg溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用cmol·L-1的AgNO3标准溶液滴定至终点,应加入的指示剂是 (填序号)。
A.KBr B.KI C. K2S D.K2CrO4
消耗标准溶液的体积为20. 00 mL,滴定终点的现象是 ,亚硝酰氯(NOCl)的质量分数为 。
23.草酸(H2C2O4)及草酸盐是常用试剂,广泛用于金属除锈和制药等领域。
(1)为了探究影响化学反应速率的因素,某化学兴趣小组用 0.1mol·L-1 H2C2O4溶液与20%硫酸酸化的 0.01mol·L-1 KMnO4溶液进行实验,反应的离子方程式为2+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;他们设计实验如下表,按如图1实验装置进行了实验I、II、III。回答下列问题:
实验序号 A溶液体积(mL) B溶液体积(mL) 温度
V(H2C2O4) V(蒸馏水) V(KMnO4) V(H2SO4)
I 10.0 10.0 15.0 5.0 20 oC
II 20.0 0.0 15.0 5.0 20 oC
III 10.0 x 15.0 5.0 30 oC
①上表中实验I和II是探究 对化学反应速率的影响,实验 和 (填实验序号)是探究温度对化学反应速率的影响;实验III中x= 。
②除通过测定相同时间内CO2的体积来比较化学反应速率,本实验还可通过测定 来比较化学反应速率。
③在相同时间内,测得实验I中收集CO2的体积比实验II小,由此得出影响化学反应速率的结论是 。
④小组同学发现实验I的反应速率如图2,其中t1~t2时间内速率变快的原因可能是 。
(2)室温下,Ksp(CaC2O4)=4.0×10-8,Ksp(CaCO3)=3.6×10-9,某悬浊液中含CaC2O4和CaCO3,则浊液中c()与c()之比为 。
(3)小组同学设计实验IV和V并进行实验,验证了Ksp(CaCO3)小于Ksp(CaC2O4)。
实验序号 实验步骤 实验现象
IV 取等体积等物质的量浓度的碳酸钠和草酸钠溶液于试管中混合均匀,再向试管中加入① 有白色沉淀生成
V ② ③
参考答案:
1.B
2.D
3.B
4.B
5.D
6.B
7.B
8.B
9.C
10.C
11. 为AuCN+CN- 1.225×109; 在酸性条件下,溶液中的氰化物转变为HCN逸出,造成污染 随着pH升高,c(OH-)增大,铜离子转化为氢氧化铜,催化效率降低 氧气在阴极表面得电子被还原成 , 结合氢离子生成 O2H, O2H分解生成氧气和双氧水
12. > 沉淀 不再出现沉淀 = 平衡 < 沉淀 继续溶解 饱和
13.(1)
(2)bd
(3)
(4)ac
(5) > =
(6)100a
14. 碱性 > 酸性 < 中性 > 8.5×10-5mol/L
15. 3250 5.3×10-5
16.(1)将Fe2+氧化为Fe3+
(2)NiS和ZnS
17.(1) 1×10-12 11
(2) 逆 增大
(3)2.2×10-8 mol·L-1
(4) 1×10-11 1×10-5 = > X +H2OHX+OH c(Na+)>c(X-)>c(OH-)>c(H+)
18. +1 H2N2O2H++HN2O2-,HN2O2- H++ N2O22- > > 15
19.(1)
(2)0.46
(3)1.05×10-6
20. B E F G 5Fe2++8H++MnO4-=5Fe3++Mn2++4H2O 酸式 否 滴最后一滴酸性高锰酸钾溶液紫色不褪去,且30 s不变色 CuO (或Cu(OH)2或CuCO3或 Cu2(OH)2CO3) 2.6×10-9mol/L
21.(1) 恒压滴液漏斗 水浴加热
(2) 3CuSO4+As2S3+3H2O3CuS+As2O3+3H2SO4 1.26×10-35
(3)As2O5+2SO2+2H2O=As2O3↓+2SO+4H+
(4)A
(5)提高CuSO4的利用率,减少成本
22. 2KMnO4 + 16HCl(浓)=2KCl+ 2MnCl2 +5Cl2↑+8H2O或KClO3 +6HCl(浓)= KCl+3Cl2 ↑+3H2O 将导气管右端接胶管并用止水夹夹紧,向U形管左管加水至左管液面高于右管,静置片刻,若液面差不变,则气密性良好 K2、K3 A 中充有黄绿色气体 K1 2NO+Cl2= 2NOCl 除去多余的氯气并防止空气中的水蒸气进入装置中 D 滴入最后一滴标准溶液,生成砖红色沉淀,且半分钟内无变化 %
23.(1) 浓度 I III 10.0 产生相同体积气体所需的时间(或测定KMnO4溶液完全褪色所需时间) 反应物浓度越大,化学反应速率越大 Mn2+是该反应的催化剂(或该反应是放热反应,温度升高,反应速率加快)
(2)100:9
(3) 少量CaCl2溶液(或少量Ca(NO3)2溶液) 过滤,向沉淀滴加稀盐酸 有气泡产生
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
3.4.2沉淀溶解平衡的应用提升练-人教版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.已知298K时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子[-lgc(M2+)]与溶液pH的变化关系如a、b所示,已知:该温度下Ksp[Cu(OH)2]
A.a线表示Fe(OH)2饱和溶液中的变化关系
B.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6:1
C.除去CuSO4溶液中少量的Fe2+,可加入适量CuO
D.向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
2.的沉淀溶解平衡曲线如图所示()。则下列说法正确的是
A.在b点对应的溶解度小于c点
B.沉淀溶解是放热的过程
C.
D.温度下,在饱和溶液中加入固体可使溶液由c点变到a点
3.常温下,向5mL一定浓度的硫酸铜溶液中逐滴滴入的氨水,首先析出浅蓝色的沉淀,氨水过量时此沉淀溶解,形成络离子(假定溶液混合后体积不变)。滴加过程中pc{,为或}与氨水体积的关系如图所示。下列说法错误的是
A.硫酸铜溶液的浓度为
B.常温下,b点溶液中水的电离程度低于纯水的
C.c点溶液中存在
D.常温下,忽略的影响,可得
4.下列实验设计、操作、现象及得出的结论完全正确的是
实验操作、现象 得出的结论
A 向一未知溶液的样品中,加入盐酸酸化的氯化钡溶液,生成大量白色沉淀 该溶液中一定含有-
B 向2.0mL浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1AgNO3溶液,振荡,沉淀呈黄色 Ksp:AgCl>AgI
C 取少量蔗糖溶液,加入3~5滴稀硫酸,水浴加热后再加入少量新制的Cu(OH)2悬浊液,加热3~5分钟,无砖红色沉淀生成 蔗糖没有水解
D 向两支装有2mL0.1mol·L-1草酸溶液的试管中,分别滴入4mL0.01mol·L-1的高锰酸钾溶液、4mL0.02mol·L-1的高锰酸钾溶液,发现加4mL0.02mol·L-1的高锰酸钾溶液的试管先褪色 浓度越大,反应速率越快
A.A B.B C.C D.D
5.实验:①将0.1 mol·L-1的AgNO3溶液和0.1 mol·L-1的NaCl溶液等体积混合,得到浊液a,过滤,得到滤液b和白色沉淀c;
②取一部分沉淀c,向其中滴加0.1 mol·L-1的 KI溶液,沉淀变为黄色(AgI);
③往剩余的沉淀c中滴加0.1 mol·L-1的KBr溶液,沉淀变为淡黄色(AgBr)。
通过以上实验进行分析,下列有关结论不正确的是
A.滤液b中:c(Na+)=c(NO)
B.实验②中反应达到平衡时,平衡常数表达式为K=
C.实验③中发生反应的化学方程式为AgCl(s)+Br-(aq)AgBr(s)+Cl-(aq)
D.根据实验②③可得出:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI)
6.是一种二元弱酸,由于与空气中的某种成分作用而保持浓度不变,已知,,某水体中(X为、、、)与pH的关系如图所示。下列叙述正确的是
A.曲线②代表
B.Q点
C.随pH升高,先增大后减小
D.R点时,
7.利用湿法炼锌产生的铜镉渣(主要含有、、、、等单质)生产金属镉的流程及相关离子生成氢氧化物沉淀的如下:
氢氧化物
开始沉淀的 1.5 6.5 7.2 8.2
沉淀完全的 3.3 9.9 9.5 10.6
下列说法不正确的是
A.为了提高铜镉渣没出的速率,可以采取升温、搅拌、适当增加硫酸浓度等措施
B.除铁过程中加入发生的反应为
C.加入控制反应液的范围应该为3.3~7.2
D.可以用溶液检验除铁过程中是否加入足量
8.还原沉淀法是处理含铬(含Cr2O和CrO)工业废水的常用方法,过程如下,下列说法错误的是(已知:常温下,Ksp[Cr(OH)3]=1×10-32)
A.反应①,增大c(H+),的转化率增大
B.反应①2v正(CrO)=v逆(Cr2O)时,反应处于平衡状态
C.反应②转移0.6mole-,则有0.1molCr2O被还原
D.常温下,要使处理后废水中的c()降至1×10-5mol·L-1,反应③应调溶液pH=5
9.某温度下,将足量的BaSO4固体溶于一定量的水中达到溶解平衡,加入Na2CO3使c()增大过程中,溶液中c(Ba2+)和c()的变化曲线如图所示(忽略溶液体积的变化)。下列说不正确的是
A.当c()大于2.5×10-4mol L-1时开始有BaCO3沉淀生成
B.“MN”代表沉淀转化过程中c(Ba2+)变化的曲线
C.该温度下,BaCO3比BaSO4更难溶于水
D.该温度下,BaSO4转换为BaCO3的平衡常数K=0.04
10.化学在生产和日常生活中有着重要的应用。下列说法正确的是
A.工业上可利用电解饱和食盐水的方法冶炼金属钠
B.含的草木灰与铵态氮肥混合施用,能增强肥效
C.除去锅炉水垢中的,可依次用碳酸钠溶液、盐酸处理
D.合成氨工业中可使用高效催化剂来提高原材料的平衡转化率
二、填空题
11.氢氰酸()有剧毒,易挥发。金矿提金时,用溶液浸取金生成,再用锌置换出金,产生的含氰废水需处理后排放。
(1)①存在着两步电离平衡,其第一步电离方程式为 。
②可用于制备,浊液中加入溶液可发生反应:
,该反应的平衡常数 。
[已知,]。
(2)可催化氧化废水中的。其他条件相同时,总氯化物(、等)去除率随溶液初始变化如图所示。
①在酸性条件下,也能氧化,但实际处理废水时却不在酸性条件下进行的原因是 。
②当溶液初始时,总氰化物去除率下降的原因可能是 。
(3)通过电激发产生和处理废水中的,可能的反应机理如图所示。虚线方框内的过程可描述为 。
12.沉淀溶解和生成判断
(1)Q Ksp,溶液过饱和,有 析出,直至溶液 ,达到新的平衡。
(2)Q Ksp,溶液饱和,沉淀与溶解处于 状态。
(3)Q Ksp,溶液未饱和,无 析出,若加入过量难溶电解质,难溶电解质 直至溶液 。
13.草酸()存在于菠菜等蔬菜中,是一种二元弱酸。常温下,向某浓度的草酸溶液中逐滴滴入一定浓度的NaOH溶液,所得溶液中、、三种微粒的物质的量分数(δ)与溶液pH的关系如图1所示。
回答下列问题:
(1)用离子方程式说明溶液显碱性的原因: 。
(2)常温下,若向N点溶液加蒸馏水稀释,在稀释该溶液过程中,下列物理量始终增大的是 (填标号)。
a. b.
c. d.
(3)p点,溶液中 。
(4)下列说法正确的是 (填标号)。
a.E、F、Q三点,水的电离程度最大的是Q点
b.E点存在:
c.F点存在:
(5)常温下,的溶液的物质的量浓度为,水电离出的为;的溶液的物质的量浓度为,水电离出的为。则 (填“>”“<”或“=”,下同); 。
(6)已知。将0.03 mol L 1的溶液与0.01 mol L 1的溶液等体积混合,混合溶液中的浓度约为 mol L 1。(用含a的代数式表示,混合后溶液体积变化忽略不计)。
14.(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“>”或“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(4)常温下,Ksp(PbI2)=8.5×10-9。取适量黄色PbI2粉末溶于水中,充分搅拌后得到浊液,过滤。在滤液中加入少量KI,测得c(I-)=1.0×10-2mol·L-1。则c(Pb2+)= 。
15.在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。
(1)在25℃时,反应CaSO4(s)+CO (aq) CaCO3(s)+SO (aq)的平衡常数K=
(2)在某含Ca2+废水中加入Na2CO3,当Ca2+沉淀完全时,水体中Ca2+浓度为 mol·L-1;
16.高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示,回答下列问题:
相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如图:
金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+ Ni2+
开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2 6.9
沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2 8.9
(1)“氧化”中添加适量的MnO2的作用是 。
(2)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是 。
17.水溶液存在离子平衡,回答下列问题:
(1)水的电离平衡曲线如图所示。若以A点表示25℃时水在电离平衡时的离子浓度。当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积为 ,该温度时0.1 mol·L-1NaOH溶液pH为 。
(2)一定温度下,向1 L0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向 (填“正”或“逆”)反应方向移动;水的电离程度将 (填“增大”、“减小”或“不变”)。
(3)常温下,在0.1mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液,充分搅拌有浅蓝色氢氧化铜沉淀生成,当溶液的pH为8时,c(Cu2+)= 。(已知常温时Cu(OH)的Ksp=2.2×10-20)
(4)常温下,向20.00 mL 0.100 mol/LHX(一元酸)溶液中滴加0.100 mol/L NaOH过程中pH变化如图所示。
①A点溶液中水电离出的氢离子浓度为 。
② HX的电离常数为 。
③ C点溶液中c(X-) c(Na+)(填“>”、“<”或“=”,下同)
④D点时二者恰好完全反应,此时溶液的pH 7(填“>”、“<”或“=” ),原因是 (用离子方程式表示)。该溶液中离子浓度大小关系
18.连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为 。
(2)常温下,用0.01mol L-1的NaOH溶液滴定10mL 0.01mol·L-1的H2N2O2溶液,测得溶液的pH与NaOH溶液体积的关系如图所示。
①写出H2N2O2在水溶液中的电离方程式: 。
②b点时溶液中c(H2N2O2) c(N2O22-) 。(填“>”“ <”或“=”下同)
③a点时溶液中c(Na+) c(HN2O2-)+c(N2O22-)。
(3)向10mL 0.1mol/L的硝酸银溶液中滴加等浓度的连二次硝酸钠溶液,要使Ag完全沉淀[c(Ag+)小于10-5 mol/L],至少需要连二次硝酸钠溶液 mL。[已知Ksp(Ag2N2O2)=4.0×10-12]
19.溶度积常数()的相关计算
悬浊液中间的关系
。
(1)与溶解度(S)之间的计算关系
对于型物质,其。
如时溴酸银的溶解度为,则约等于 。
(2)与沉淀转化平衡常数K的计算关系
建立与K的关系,一般是在K的表达式分子分母中同乘以某个离子的浓度,将分子分母转化为不同物质的。
如在溶液中溶解,列式计算,溶液的最初浓度不得低于 [忽略溶液体积变化,已知:、]。
(3)与电离常数的计算关系
根据电离常数计算出各离子浓度,进而计算。
如汽车尾气中的可用石灰水吸收,生成亚硫酸钙浊液。常温下,测得与水形成的浊液为9,忽略的第二步水解,则 (结果保留3位有效数字)。[已知:,]
20.Ⅰ.25℃时在25 mL氢氧化钠溶液中逐滴加入0.2 mol/L醋酸溶液,滴定曲线如下图所示.下列说法正确的是
A.滴定终点时俯视读数则测定的氢氧化钠浓度偏高
B.B、C、D三点的溶液中水的电离程度为B>C>D
C.D点,c(CH3COO-)+ c(CH3COOH)>2c(Na+)
D.B点为滴定终点
E.B点时c(CH3COO-)=c(Na+)
F. 若由体积相等的氢氧化钠和醋酸溶液混合而且恰好呈中性,则混合前c(NaOH)< c(CH3COOH)
G.滴定前的氢氧化钠溶液的浓度为0.1mol/L
Ⅱ.(1)为了检验某残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,写出滴定过程中反应的离子方程式: KMnO4应装在 滴定管中(填“酸式”或“碱式”)滴定前是否要滴加指示剂? (填“是”或“否”),滴定终点的判断方法:
(2)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入 调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。[Fe(OH)3的Ksp=2.6×10-39]
三、实验题
21.As2S3是国民经济发展中不可缺少的资源,是剧毒物质。某小组拟在实验室模拟对As2S3矿渣进行回收处理,湿法制取As2O3.实验装置及步骤如下。
步骤1:向C装置的反应瓶中,加入61.5gAs2S3粉料与200mL足量的CuSO4溶液形成料浆,关闭开关B,控制温度80℃左右,持续搅拌反应1小时。
步骤2:待C装置反应瓶中的反应溶液冷却至室温,料浆中主要含CuS和As2O3.打开B,通入过量氧气使微溶的As2O3氧化成易溶的As2O5,过滤。
步骤3:向步骤2的滤液中通入二氧化硫,使As2O5还原,经冷却析出As2O3晶体19.8g。
(1)A装置中仪器X的名称是 ;实验中的加热方式为 。
(2)C装置反应瓶中发生反应的化学方程式为 。步骤2中,若过滤后的溶液中Cu2+浓度为0.5mol·L-1,已知CuS的Ksp=6.3×10-36.则滤液中S2-浓度为 mol·L-1。
(3)步骤3中,通入二氧化硫使As2O5还原的离子方程式为 。
(4)本实验中As2O3的产率最接近于___________(填标号)。
A.40% B.50% C.60% D.70%
(5)将分离出As2O3晶体后的母液收集、循环使用,其实际工业生产的意义是 。
22.亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,其熔点为-64.5℃,沸点为-5.5℃,遇水易水解。它是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。
实验1:利用下图所示装置制备NO和Cl2。
(1)利用图1制备Cl2,烧瓶中反应的化学方程式为 。
(2)利用图2制备NO,检验图2装置气密性的具体操作为 。
实验2:利用图3装置制备NOCl。
(3)实验开始,需先打开 ,当 时,再打开 ,当烧瓶中有一定量液体生成时,停止实验。
(4)图3中发生反应的化学方程式为 。A中装有碱石灰,其作用是 。
实验3:测定NOCl的纯度。
已知下列物质在常温下的颜色及Ksp
化学式 AgCl AgBr Ag2S Ag2CrO4
颜色 白色 浅黄色 黑色 砖红色
Ksp 1.56×10-10 5.4×10-13 2.0×10-48 1×10-12
(5)取所得液体mg溶于水,配制成250mL溶液;取出25.00mL样品溶于锥形瓶中,用cmol·L-1的AgNO3标准溶液滴定至终点,应加入的指示剂是 (填序号)。
A.KBr B.KI C. K2S D.K2CrO4
消耗标准溶液的体积为20. 00 mL,滴定终点的现象是 ,亚硝酰氯(NOCl)的质量分数为 。
23.草酸(H2C2O4)及草酸盐是常用试剂,广泛用于金属除锈和制药等领域。
(1)为了探究影响化学反应速率的因素,某化学兴趣小组用 0.1mol·L-1 H2C2O4溶液与20%硫酸酸化的 0.01mol·L-1 KMnO4溶液进行实验,反应的离子方程式为2+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;他们设计实验如下表,按如图1实验装置进行了实验I、II、III。回答下列问题:
实验序号 A溶液体积(mL) B溶液体积(mL) 温度
V(H2C2O4) V(蒸馏水) V(KMnO4) V(H2SO4)
I 10.0 10.0 15.0 5.0 20 oC
II 20.0 0.0 15.0 5.0 20 oC
III 10.0 x 15.0 5.0 30 oC
①上表中实验I和II是探究 对化学反应速率的影响,实验 和 (填实验序号)是探究温度对化学反应速率的影响;实验III中x= 。
②除通过测定相同时间内CO2的体积来比较化学反应速率,本实验还可通过测定 来比较化学反应速率。
③在相同时间内,测得实验I中收集CO2的体积比实验II小,由此得出影响化学反应速率的结论是 。
④小组同学发现实验I的反应速率如图2,其中t1~t2时间内速率变快的原因可能是 。
(2)室温下,Ksp(CaC2O4)=4.0×10-8,Ksp(CaCO3)=3.6×10-9,某悬浊液中含CaC2O4和CaCO3,则浊液中c()与c()之比为 。
(3)小组同学设计实验IV和V并进行实验,验证了Ksp(CaCO3)小于Ksp(CaC2O4)。
实验序号 实验步骤 实验现象
IV 取等体积等物质的量浓度的碳酸钠和草酸钠溶液于试管中混合均匀,再向试管中加入① 有白色沉淀生成
V ② ③
参考答案:
1.B
2.D
3.B
4.B
5.D
6.B
7.B
8.B
9.C
10.C
11. 为AuCN+CN- 1.225×109; 在酸性条件下,溶液中的氰化物转变为HCN逸出,造成污染 随着pH升高,c(OH-)增大,铜离子转化为氢氧化铜,催化效率降低 氧气在阴极表面得电子被还原成 , 结合氢离子生成 O2H, O2H分解生成氧气和双氧水
12. > 沉淀 不再出现沉淀 = 平衡 < 沉淀 继续溶解 饱和
13.(1)
(2)bd
(3)
(4)ac
(5) > =
(6)100a
14. 碱性 > 酸性 < 中性 > 8.5×10-5mol/L
15. 3250 5.3×10-5
16.(1)将Fe2+氧化为Fe3+
(2)NiS和ZnS
17.(1) 1×10-12 11
(2) 逆 增大
(3)2.2×10-8 mol·L-1
(4) 1×10-11 1×10-5 = > X +H2OHX+OH c(Na+)>c(X-)>c(OH-)>c(H+)
18. +1 H2N2O2H++HN2O2-,HN2O2- H++ N2O22- > > 15
19.(1)
(2)0.46
(3)1.05×10-6
20. B E F G 5Fe2++8H++MnO4-=5Fe3++Mn2++4H2O 酸式 否 滴最后一滴酸性高锰酸钾溶液紫色不褪去,且30 s不变色 CuO (或Cu(OH)2或CuCO3或 Cu2(OH)2CO3) 2.6×10-9mol/L
21.(1) 恒压滴液漏斗 水浴加热
(2) 3CuSO4+As2S3+3H2O3CuS+As2O3+3H2SO4 1.26×10-35
(3)As2O5+2SO2+2H2O=As2O3↓+2SO+4H+
(4)A
(5)提高CuSO4的利用率,减少成本
22. 2KMnO4 + 16HCl(浓)=2KCl+ 2MnCl2 +5Cl2↑+8H2O或KClO3 +6HCl(浓)= KCl+3Cl2 ↑+3H2O 将导气管右端接胶管并用止水夹夹紧,向U形管左管加水至左管液面高于右管,静置片刻,若液面差不变,则气密性良好 K2、K3 A 中充有黄绿色气体 K1 2NO+Cl2= 2NOCl 除去多余的氯气并防止空气中的水蒸气进入装置中 D 滴入最后一滴标准溶液,生成砖红色沉淀,且半分钟内无变化 %
23.(1) 浓度 I III 10.0 产生相同体积气体所需的时间(或测定KMnO4溶液完全褪色所需时间) 反应物浓度越大,化学反应速率越大 Mn2+是该反应的催化剂(或该反应是放热反应,温度升高,反应速率加快)
(2)100:9
(3) 少量CaCl2溶液(或少量Ca(NO3)2溶液) 过滤,向沉淀滴加稀盐酸 有气泡产生
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
