化学人教版(2019)必修第二册6.2.2探究影响化学反应速率的因素(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.2.2探究影响化学反应速率的因素(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 33.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-23 08:55:35 | ||
图片预览








文档简介
(共26张PPT)
第二节 化学反应速率与限度
第2课时 影响化学反应速率的因素
第二节 化学反应速率与限度
对于下列反应,你是希望其反应速率越快越好还是越慢越好?
■钢铁腐蚀 ■ 食物腐坏 ■ 炼钢 ■ 合成氨
【思考与讨论】
调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。
有哪些因素能够影响化学反应速率呢?
为什么其它条件都相同时,钙、镁、锌、铁与稀盐酸的反应剧烈程度不同?
第二节 化学反应速率与限度
反应物本身的性质
钙、镁、锌、铁与稀盐酸反应
第二节 化学反应速率与限度
为什么苹果和香蕉密封在一起能加快香蕉成熟?
催化剂
第二节 化学反应速率与限度
盐水鸭保质期:
0℃以下180天
25℃以下90天
为什么冰箱能够延长食品保质期?
温度
第二节 化学反应速率与限度
反应物浓度
为什么铁在空气中和在纯氧中反应的剧烈程度不同?
第二节 化学反应速率与限度
N2 + 3 H2 2NH3
高温高压
催化剂
为什么工业上合成氨时,需要高压条件?
压强
第二节 化学反应速率与限度
第二节 化学反应速率与限度
变量控制
科学研究中,对于多因素(多变量)的问
题,常常采用只改变其中的某一个因素,控制
其他因素不变的研究方法,使多因素的问题变
成几个单因素的问题分别加以研究,最后再将
几个单因素问题的研究结果加以综合。这种变
量控制的方法是科学探究中常用的方法。
方法介绍
方法实践
方法应用
第二节 化学反应速率与限度
第二节 化学反应速率与限度
影响化学反应速率的因素
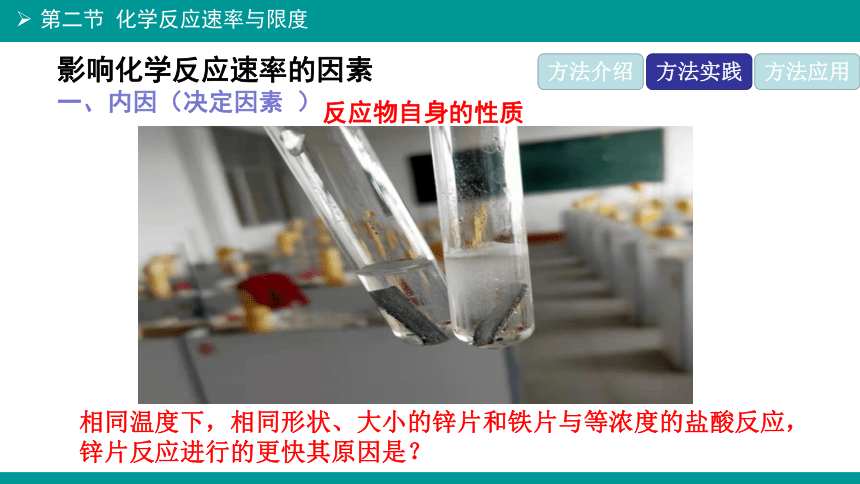
一、内因(决定因素 )
反应物自身的性质
相同温度下,相同形状、大小的锌片和铁片与等浓度的盐酸反应,锌片反应进行的更快其原因是?
方法介绍
方法实践
方法应用
第二节 化学反应速率与限度
第二节 化学反应速率与限度
影响化学反应速率的因素
【实验探究】 影响化学反应速率的因素
【问题】
我们已经知道催化剂可以影响化学反应速率,此外,还有哪些反应条件会影响化学反应的速率?
【假设】
影响化学反应速率的因素可能有反应温度、反应物浓度等。
【用品】
5% H2O2 溶液、1 mol/L FeCl3 溶液、0.1 mol/L 盐酸、1 mol/L 盐酸、大理石碎块、大理石粉末、冷水、热水、试管、试管夹、烧杯。
方法介绍
方法实践
方法应用
第二节 化学反应速率与限度
第二节 化学反应速率与限度
第二节 化学反应速率与限度
实验现象:
①有少量气泡出现
②能产生大量气泡
③能产生大量气泡
实验结论:其他条件不变时,加入催化剂,反应速率越快
影响化学反应速率的因素 二、外因
方法介绍
方法实践
方法应用
第二节 化学反应速率与限度
第二节 化学反应速率与限度
其他条件不变时,温度越高,化学反应速率越快
影响化学反应速率的因素 二、外因
①
②
A同学在小烧杯中倒入80ml冷水,B同学在另一个小烧杯中倒入80ml热水。
1. AB两同学分别在两个在小试管中加入2ml H2O2溶液
2.AB两同学同时滴入2滴FeCl3溶液
3.AB两同学同时将试管分别放入冷热水中
4.所有同学观察实验现象(比较两试管气泡产生速率)
量筒量取
方法介绍
方法实践
方法应用
第二节 化学反应速率与限度
第二节 化学反应速率与限度
实验结论:其他条件不变时,反应物浓度越大,化学反应速率越快。
影响化学反应速率的因素 二、外因
1.AB两同学分别取两支已装好少量粉末大理石的试管
2.A量取2ml 1mol/L盐酸,B量取2ml 0.1mol/L盐酸
3.AB两同学同时将已量取的盐酸倒入装有大理石粉末的试管中
4.所有同学观察现象(比较气泡产生速率)
方法介绍
方法实践
方法应用
第二节 化学反应速率与限度
把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示。下列因素中,影响该反应速率的是 ( )
①盐酸的浓度 ②镁条的表面积
③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.①③ D.②③
C
【课堂练习】
第二节 化学反应速率与限度
第二节 化学反应速率与限度
第二节 化学反应速率与限度
影响化学反应速率的因素 二、外因
第二节 化学反应速率与限度
宏观辨识——压强对速率的影响
N2(g)+3H2(g) 2NH3(g)
1mol N2(g)+
3mol H2(g)
2mol N2(g)+
6mol H2(g)
1mol N2(g)+
3mol H2(g)
压强增大, 加快反应速率。
恒容充入反应物
压缩体积
第二节 化学反应速率与限度
第二节 化学反应速率与限度
N2(g)+3H2(g) 2NH3(g)
1mol N2(g)+
3mol H2(g)
虽然总的压强增大,但反应物浓度不发生变化,故化学反应速率不变。
1mol N2(g)+
3mol H2(g)+
Ar(g)
宏观辨识——压强对速率的影响
体积不变,充入不参与反应的气体。
恒温恒容:充入不参加反应的气体,反应速率不变
第二节 化学反应速率与限度
第二节 化学反应速率与限度
N2(g)+3H2(g) 2NH3(g)
1mol N2(g)+
3mol H2(g)
虽然压强不变,但容器体积增大,反应物浓度减小,故化学反应速率减小。
1mol N2(g)+
3mol H2(g)+
Ar(g)
宏观辨识——压强对速率的影响
体积可变的恒压容器,充入不参与反应的气体。
恒温恒压:充入不参加反应的气体,反应速率减小
第二节 化学反应速率与限度
第二节 化学反应速率与限度
第二节 化学反应速率与限度
影响化学反应速率的因素 二、外因
第二节 化学反应速率与限度
接触面积
为什么煤块中有很多小孔?
第二节 化学反应速率与限度
3在A、B两支试管中分别加入相同质量的锌粒和相同体积的1mol/L 稀硫酸,再向B试管中滴入了2滴CuSO4溶液,冒气泡的速率明显加快。
1.在相同条件下,等质量的大理石块和大理石粉与相同盐酸反应,大理石粉反应更快。
2.将浓硝酸分别放在冷暗处和强光照射下,发现强光照射下很快出现大量红棕色气体。
固体表面积
光照
形成原电池
影响化学反应速率的因素 二、外因
第二节 化学反应速率与限度
两只敞口烧杯中分别发生如下反应:一只烧杯中反应为A+B===C+D,反应温度为T1;另一只烧杯中反应为M+N===P+Q,反应温度为T2,T1>T2,则两只烧杯中反应速率快慢为( )
A.前者快 B.后者快
C.一样快 D.无法确定
【答案】D
【解析】化学反应速率的决定因素是反应物自身的性质,两只烧杯中反应物不同,所以无法判断反应速率的快慢。
第二节 化学反应速率与限度
第二节 化学反应速率与限度
第二节 化学反应速率与限度
一定能使化学反应速率加快的因素是( )
①扩大容器容积 ②使用正催化剂 ③增大反应物的物质的量 ④升高温度 ⑤缩小容器容积 ⑥增大压强
A. ②③ B. ②③④⑥
C. ②③④⑤ D. ②④
D
【解析】①扩大容器容积,对无气体参加的反应没有影响,错误;②使用正催化剂,一定能使化学反应速率加快,正确;③若反应物是固体或纯液体物质,则增大反应物的物质的量,化学反应速率不变,错误;④升高温度一定能使化学反应速率加快,正确;⑤缩小容器容积,对无气体参加的反应没有影响,错误;⑥若反应无气体参加,则增大压强,化学反应速率不变,错误。综上所述,符合题意的为②④,D正确。
第二节 化学反应速率与限度
对于吸热反应:C(s)+CO2(g)===2CO(g),不能增大化学反应速率的是 ( )
A.将块状炭进行粉碎 B.升高反应的温度
C.增加炭的量 D.V不变,通入少量CO2气体
错因分析:A中块状炭变成炭粉,可增大接触面积,从而增大化学反应速率;B中升高温度,化学反应速率加快;C中增加炭的量,不能改变其浓度,化学反应速率不变;D中通入少量CO2气体,c(CO2)增大,化学反应速率增大。
第二节 化学反应速率与限度
C
第二节 化学反应速率与限度
第二节 化学反应速率与限度
影响化学反应速率的因素
(1)内因
化学反应速率的大小主要取决于反应物本身的性质。
(2)外因
在其他条件相同时。
催化剂
温度
反应物浓度
固体表面积
光照
形成原电池
压强
第二节 化学反应速率与限度
第二节 化学反应速率与限度
神奇的催化剂
催化剂是现代化学中关键而神奇的物质之一。剧统计,有80%以上的化工生产过程使用了催化剂,目的是增大反应速率,提高生产效率。在资源利用、能源开发、医药制造、环境保护等领域,催化剂有着广泛的应用。
催化剂十分神奇,它能极大地提高化学反应速率,而自身的组成、化学性质和质量在反应前后不发生变化;它和一些反应体系的关系就像钥匙与锁的关系,具有一定的选择性。
催化剂神奇面纱至今尚未完全解开,对催化剂的研究是当代化学一个极具魅力和应用前景的重要课题。
第二节 化学反应速率与限度
第2课时 影响化学反应速率的因素
第二节 化学反应速率与限度
对于下列反应,你是希望其反应速率越快越好还是越慢越好?
■钢铁腐蚀 ■ 食物腐坏 ■ 炼钢 ■ 合成氨
【思考与讨论】
调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。
有哪些因素能够影响化学反应速率呢?
为什么其它条件都相同时,钙、镁、锌、铁与稀盐酸的反应剧烈程度不同?
第二节 化学反应速率与限度
反应物本身的性质
钙、镁、锌、铁与稀盐酸反应
第二节 化学反应速率与限度
为什么苹果和香蕉密封在一起能加快香蕉成熟?
催化剂
第二节 化学反应速率与限度
盐水鸭保质期:
0℃以下180天
25℃以下90天
为什么冰箱能够延长食品保质期?
温度
第二节 化学反应速率与限度
反应物浓度
为什么铁在空气中和在纯氧中反应的剧烈程度不同?
第二节 化学反应速率与限度
N2 + 3 H2 2NH3
高温高压
催化剂
为什么工业上合成氨时,需要高压条件?
压强
第二节 化学反应速率与限度
第二节 化学反应速率与限度
变量控制
科学研究中,对于多因素(多变量)的问
题,常常采用只改变其中的某一个因素,控制
其他因素不变的研究方法,使多因素的问题变
成几个单因素的问题分别加以研究,最后再将
几个单因素问题的研究结果加以综合。这种变
量控制的方法是科学探究中常用的方法。
方法介绍
方法实践
方法应用
第二节 化学反应速率与限度
第二节 化学反应速率与限度
影响化学反应速率的因素
一、内因(决定因素 )
反应物自身的性质
相同温度下,相同形状、大小的锌片和铁片与等浓度的盐酸反应,锌片反应进行的更快其原因是?
方法介绍
方法实践
方法应用
第二节 化学反应速率与限度
第二节 化学反应速率与限度
影响化学反应速率的因素
【实验探究】 影响化学反应速率的因素
【问题】
我们已经知道催化剂可以影响化学反应速率,此外,还有哪些反应条件会影响化学反应的速率?
【假设】
影响化学反应速率的因素可能有反应温度、反应物浓度等。
【用品】
5% H2O2 溶液、1 mol/L FeCl3 溶液、0.1 mol/L 盐酸、1 mol/L 盐酸、大理石碎块、大理石粉末、冷水、热水、试管、试管夹、烧杯。
方法介绍
方法实践
方法应用
第二节 化学反应速率与限度
第二节 化学反应速率与限度
第二节 化学反应速率与限度
实验现象:
①有少量气泡出现
②能产生大量气泡
③能产生大量气泡
实验结论:其他条件不变时,加入催化剂,反应速率越快
影响化学反应速率的因素 二、外因
方法介绍
方法实践
方法应用
第二节 化学反应速率与限度
第二节 化学反应速率与限度
其他条件不变时,温度越高,化学反应速率越快
影响化学反应速率的因素 二、外因
①
②
A同学在小烧杯中倒入80ml冷水,B同学在另一个小烧杯中倒入80ml热水。
1. AB两同学分别在两个在小试管中加入2ml H2O2溶液
2.AB两同学同时滴入2滴FeCl3溶液
3.AB两同学同时将试管分别放入冷热水中
4.所有同学观察实验现象(比较两试管气泡产生速率)
量筒量取
方法介绍
方法实践
方法应用
第二节 化学反应速率与限度
第二节 化学反应速率与限度
实验结论:其他条件不变时,反应物浓度越大,化学反应速率越快。
影响化学反应速率的因素 二、外因
1.AB两同学分别取两支已装好少量粉末大理石的试管
2.A量取2ml 1mol/L盐酸,B量取2ml 0.1mol/L盐酸
3.AB两同学同时将已量取的盐酸倒入装有大理石粉末的试管中
4.所有同学观察现象(比较气泡产生速率)
方法介绍
方法实践
方法应用
第二节 化学反应速率与限度
把镁条投入盛有盐酸的敞口容器中,产生氢气的速率变化曲线如图所示。下列因素中,影响该反应速率的是 ( )
①盐酸的浓度 ②镁条的表面积
③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.①③ D.②③
C
【课堂练习】
第二节 化学反应速率与限度
第二节 化学反应速率与限度
第二节 化学反应速率与限度
影响化学反应速率的因素 二、外因
第二节 化学反应速率与限度
宏观辨识——压强对速率的影响
N2(g)+3H2(g) 2NH3(g)
1mol N2(g)+
3mol H2(g)
2mol N2(g)+
6mol H2(g)
1mol N2(g)+
3mol H2(g)
压强增大, 加快反应速率。
恒容充入反应物
压缩体积
第二节 化学反应速率与限度
第二节 化学反应速率与限度
N2(g)+3H2(g) 2NH3(g)
1mol N2(g)+
3mol H2(g)
虽然总的压强增大,但反应物浓度不发生变化,故化学反应速率不变。
1mol N2(g)+
3mol H2(g)+
Ar(g)
宏观辨识——压强对速率的影响
体积不变,充入不参与反应的气体。
恒温恒容:充入不参加反应的气体,反应速率不变
第二节 化学反应速率与限度
第二节 化学反应速率与限度
N2(g)+3H2(g) 2NH3(g)
1mol N2(g)+
3mol H2(g)
虽然压强不变,但容器体积增大,反应物浓度减小,故化学反应速率减小。
1mol N2(g)+
3mol H2(g)+
Ar(g)
宏观辨识——压强对速率的影响
体积可变的恒压容器,充入不参与反应的气体。
恒温恒压:充入不参加反应的气体,反应速率减小
第二节 化学反应速率与限度
第二节 化学反应速率与限度
第二节 化学反应速率与限度
影响化学反应速率的因素 二、外因
第二节 化学反应速率与限度
接触面积
为什么煤块中有很多小孔?
第二节 化学反应速率与限度
3在A、B两支试管中分别加入相同质量的锌粒和相同体积的1mol/L 稀硫酸,再向B试管中滴入了2滴CuSO4溶液,冒气泡的速率明显加快。
1.在相同条件下,等质量的大理石块和大理石粉与相同盐酸反应,大理石粉反应更快。
2.将浓硝酸分别放在冷暗处和强光照射下,发现强光照射下很快出现大量红棕色气体。
固体表面积
光照
形成原电池
影响化学反应速率的因素 二、外因
第二节 化学反应速率与限度
两只敞口烧杯中分别发生如下反应:一只烧杯中反应为A+B===C+D,反应温度为T1;另一只烧杯中反应为M+N===P+Q,反应温度为T2,T1>T2,则两只烧杯中反应速率快慢为( )
A.前者快 B.后者快
C.一样快 D.无法确定
【答案】D
【解析】化学反应速率的决定因素是反应物自身的性质,两只烧杯中反应物不同,所以无法判断反应速率的快慢。
第二节 化学反应速率与限度
第二节 化学反应速率与限度
第二节 化学反应速率与限度
一定能使化学反应速率加快的因素是( )
①扩大容器容积 ②使用正催化剂 ③增大反应物的物质的量 ④升高温度 ⑤缩小容器容积 ⑥增大压强
A. ②③ B. ②③④⑥
C. ②③④⑤ D. ②④
D
【解析】①扩大容器容积,对无气体参加的反应没有影响,错误;②使用正催化剂,一定能使化学反应速率加快,正确;③若反应物是固体或纯液体物质,则增大反应物的物质的量,化学反应速率不变,错误;④升高温度一定能使化学反应速率加快,正确;⑤缩小容器容积,对无气体参加的反应没有影响,错误;⑥若反应无气体参加,则增大压强,化学反应速率不变,错误。综上所述,符合题意的为②④,D正确。
第二节 化学反应速率与限度
对于吸热反应:C(s)+CO2(g)===2CO(g),不能增大化学反应速率的是 ( )
A.将块状炭进行粉碎 B.升高反应的温度
C.增加炭的量 D.V不变,通入少量CO2气体
错因分析:A中块状炭变成炭粉,可增大接触面积,从而增大化学反应速率;B中升高温度,化学反应速率加快;C中增加炭的量,不能改变其浓度,化学反应速率不变;D中通入少量CO2气体,c(CO2)增大,化学反应速率增大。
第二节 化学反应速率与限度
C
第二节 化学反应速率与限度
第二节 化学反应速率与限度
影响化学反应速率的因素
(1)内因
化学反应速率的大小主要取决于反应物本身的性质。
(2)外因
在其他条件相同时。
催化剂
温度
反应物浓度
固体表面积
光照
形成原电池
压强
第二节 化学反应速率与限度
第二节 化学反应速率与限度
神奇的催化剂
催化剂是现代化学中关键而神奇的物质之一。剧统计,有80%以上的化工生产过程使用了催化剂,目的是增大反应速率,提高生产效率。在资源利用、能源开发、医药制造、环境保护等领域,催化剂有着广泛的应用。
催化剂十分神奇,它能极大地提高化学反应速率,而自身的组成、化学性质和质量在反应前后不发生变化;它和一些反应体系的关系就像钥匙与锁的关系,具有一定的选择性。
催化剂神奇面纱至今尚未完全解开,对催化剂的研究是当代化学一个极具魅力和应用前景的重要课题。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
