化学人教版(2019)必修第一册2.1.2钠的几种重要化合物(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.1.2钠的几种重要化合物(共28张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 72.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-23 08:57:27 | ||
图片预览






文档简介
(共28张PPT)
§1.2 钠的几种重要化合物
钠与氧气的化学方程式,并说出其产物的颜色、状态。
条件不同
产物不同
-2
-1
(白 色)
(淡黄色)
4Na + O2 = 2Na2O
2Na + O2 Na2O2
加热:
常温:
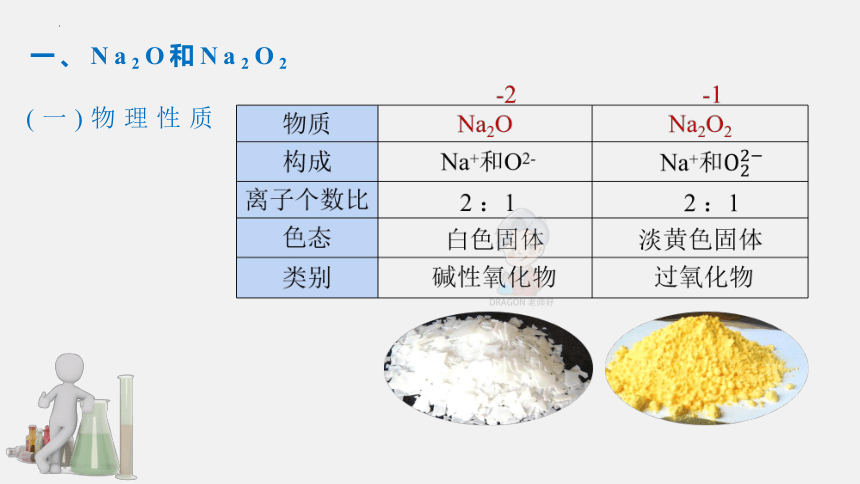
一、Na2O和Na2O2
(一)物理性质
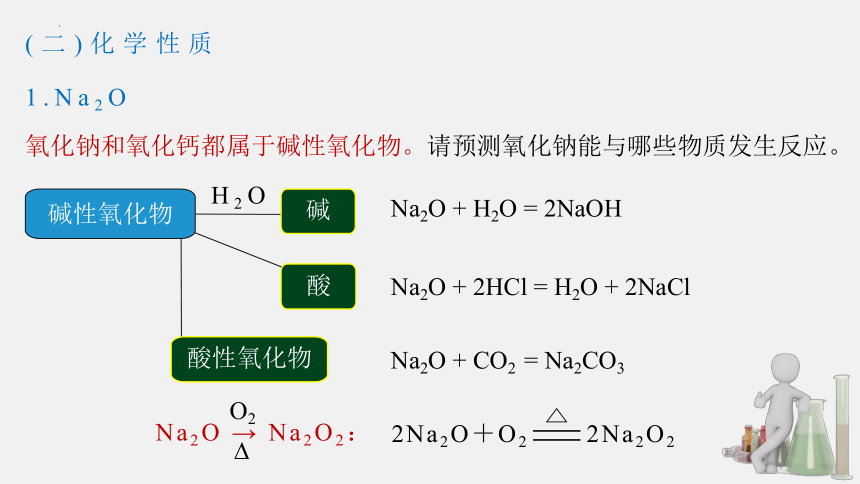
1.Na2O
氧化钠和氧化钙都属于碱性氧化物。请预测氧化钠能与哪些物质发生反应。
Na2O + H2O = 2NaOH
H2O
碱
Na2O + CO2 = Na2CO3
酸性氧化物
Na2O + 2HCl = H2O + 2NaCl
酸
2Na2O+O2 2Na2O2
Na2O → Na2O2:
O2
碱性氧化物
(二)化学性质
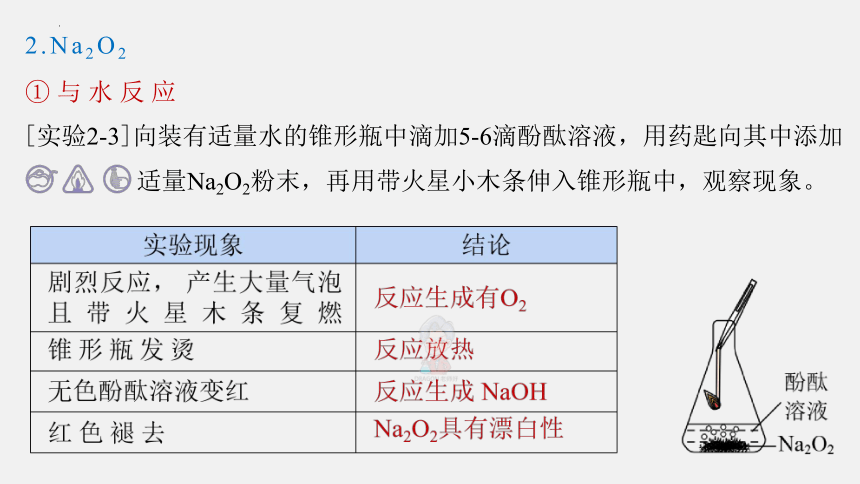
[实验2-3]向装有适量水的锥形瓶中滴加5-6滴酚酞溶液,用药匙向其中添加
适量Na2O2粉末,再用带火星小木条伸入锥形瓶中,观察现象。
2.Na2O2
①与水反应
2 Na2O2 + 2H2O = 4NaOH + O2↑
[达标检测2]用双线桥表示电子转移方向及数目,并指出氧化剂、
还原剂,氧化产物、还原产物。
[实验结论]
[达标检测1]将化学方程式改写成离子方程式。
②强氧化性
a.漂白性
Na2O2可用来漂白织物、麦杆、羽毛等。
-1价的氧元素具有强氧化性-永久褪色。
b.与还原性物质反应
如:Na2O2+Na2SO3+H2O = Na2SO4+2NaOH
③与酸性氧化物反应
2Na2O2+2CO2=2Na2CO3+O2
④与酸反应
[疑问]Na2O2属于氧化物,那是不是碱性氧化物?为什么?
2Na2O2+4HCl=4NaCl+2H2O+O2↑
(三)物质用途
[小 结]氧化钠和过氧化钠对比
物 质 N a 2 O N a 2 O 2
色 态 白色固体 淡黄色固体
类 别 碱性氧化物 过氧化物
氧的价态 -2 -1
生成条件 常温下缓慢氧化 加热或点燃
热稳定性 不稳定 较稳定
[小 结]氧化钠和过氧化钠对比
二、Na2CO3和NaHCO3
NaHCO3—小苏打
Na2CO3—纯碱、苏打
(一)名称对比
Na2CO3
(二)用途对比
NaHCO3
[实验2-4]
Na2CO3+xH2O = Na2CO3·xH2O(密封保存)
(三)物理性质对比
1.酸碱性
Na2CO3水溶液和NaHCO3水溶液都呈碱性,都能使酚酞溶液变红,紫色石蕊变蓝,变色程度不一样。
碱性:Na2CO3水溶液>NaHCO3水溶液
[疑问]它们都属于盐,但其水溶液都呈碱性,说明什么?
(三)化学性质对比
2.热稳定性
[实验2-5]
加热Na2CO3或NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
[加热NaHCO3]澄清石灰水变浑浊
[加热Na2CO3]无现象
热稳定性:Na2CO3 >NaHCO3
[疑问]小苏打发酵后的糕点松软,为什么?
2NaHCO3=Na2CO3+H2O+CO2 ↑
[实验拓展]向等质量NaHCO3和Na2CO3中逐滴滴加等同的稀盐酸,观察现象。
3.与酸反应
Na2CO3+HCl(少)=NaCl+NaHCO3
NaHCO3+HCl=NaCl+H2O+CO2 ↑
Na2CO3+2HCl(过)=2NaCl+H2O+CO2 ↑
[Na2CO3]过一小段时间才产生气泡
[NaHCO3]立即产生气泡
为何不用碳酸钠来治疗胃酸过多,而是采用碳酸氢钠?
Na2CO3碱性较强,反应速率较慢,不适宜做胃药。
NaHCO3碱性较弱,反应速率快,可用于治疗胃酸过多。
[温馨提示]
胃痛类型很多,胃溃疡不能吃含有小苏打的药物进行治疗,反而会加重病情!
4.与碱反应
①Na2CO3
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3 + NaOH不反应(不符合复分解反应的条件)
②NaHCO3
[拓展实验]向盛有碳酸氢钠溶液的试管里滴入澄清石灰水,观察现象,并写出方程式。
现象:产生白色沉淀
过量Ca(OH)2:Ca(OH)2+NaHCO3=CaCO3↓+H2O+NaOH
少量Ca(OH)2: Ca(OH)2+2NaHCO3=Na2CO3+CaCO3 ↓+2H2O
5.与盐反应
①Na2CO3
Na2CO3+CaCl2=CaCO3↓+2NaCl
Na2CO3+BaCl2=BaCO3↓+2NaCl
②NaHCO3不与CaCl2、BaCl2反应
[知识拓展]为什么长时间CO2通入澄清的石灰水,先变浑浊然后又变清?
[类比推理]若将澄清石灰水换成饱和碳酸钠,会有什么现象呢?
CaCO3+CO2+H2O =Ca(HCO3)2
Ca(OH)2+CO2=CaCO3↓+H2O
Na2CO3+CO2+H2O=2NaHCO3↓
NaHCO3溶解度比Na2CO3小,所以会析出碳酸氢钠晶体。
[课堂小结]
Na2CO3
NaHCO3
①CO2 + H2O
②NaOH
②HCl(少量)
①△
①Na2CO3和NaHCO3相互转化
②Na2CO3和NaHCO3的鉴别
热稳定性
CaCl2(BaCl2)
与盐酸反应
溶液酸碱性
③Na2CO3和NaHCO3的除杂
[课堂小结]
【研究与实践】了解纯碱的生产历史
路布兰制碱法
索尔维制碱法
侯氏制碱法
三、焰色试验
很多金属或他们的化合物在灼烧时都会使火焰呈现出特征颜色,根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把试样的定性分析操作称为焰色试验。
[实验2-6]
[实验方法]
①洗烧:盐酸洗净铂丝,将铂丝在酒精灯火焰上灼烧至与酒精灯颜色一致
②蘸烧:蘸取试样,火焰上灼烧 ,观察火焰颜色(钾元素—蓝色钴玻璃)
③洗烧:盐酸洗净铂丝,将铂丝在酒精灯火焰上灼烧至与酒精灯颜色一致
钠黄钾紫铜绿色
1.焰色试验是物理变化,是元素的一种性质;
2.铂丝或光洁无锈的铁丝:焰色为无颜色,且熔点较高;
3.只能用稀盐酸:①与氧化物反应生成氯化物而除去;
②盐酸及其盐易挥发,不会对实验造成干扰;
4.焰色试验只能判断是某种元素,不能确定是单质还是化合物,是离子、原子还是分子或原子团。
5.钾元素—蓝色的钴玻璃:滤去钠元素产生的黄色的光,避免干扰。
[温馨提示]
§1.2 钠的几种重要化合物
钠与氧气的化学方程式,并说出其产物的颜色、状态。
条件不同
产物不同
-2
-1
(白 色)
(淡黄色)
4Na + O2 = 2Na2O
2Na + O2 Na2O2
加热:
常温:
一、Na2O和Na2O2
(一)物理性质
1.Na2O
氧化钠和氧化钙都属于碱性氧化物。请预测氧化钠能与哪些物质发生反应。
Na2O + H2O = 2NaOH
H2O
碱
Na2O + CO2 = Na2CO3
酸性氧化物
Na2O + 2HCl = H2O + 2NaCl
酸
2Na2O+O2 2Na2O2
Na2O → Na2O2:
O2
碱性氧化物
(二)化学性质
[实验2-3]向装有适量水的锥形瓶中滴加5-6滴酚酞溶液,用药匙向其中添加
适量Na2O2粉末,再用带火星小木条伸入锥形瓶中,观察现象。
2.Na2O2
①与水反应
2 Na2O2 + 2H2O = 4NaOH + O2↑
[达标检测2]用双线桥表示电子转移方向及数目,并指出氧化剂、
还原剂,氧化产物、还原产物。
[实验结论]
[达标检测1]将化学方程式改写成离子方程式。
②强氧化性
a.漂白性
Na2O2可用来漂白织物、麦杆、羽毛等。
-1价的氧元素具有强氧化性-永久褪色。
b.与还原性物质反应
如:Na2O2+Na2SO3+H2O = Na2SO4+2NaOH
③与酸性氧化物反应
2Na2O2+2CO2=2Na2CO3+O2
④与酸反应
[疑问]Na2O2属于氧化物,那是不是碱性氧化物?为什么?
2Na2O2+4HCl=4NaCl+2H2O+O2↑
(三)物质用途
[小 结]氧化钠和过氧化钠对比
物 质 N a 2 O N a 2 O 2
色 态 白色固体 淡黄色固体
类 别 碱性氧化物 过氧化物
氧的价态 -2 -1
生成条件 常温下缓慢氧化 加热或点燃
热稳定性 不稳定 较稳定
[小 结]氧化钠和过氧化钠对比
二、Na2CO3和NaHCO3
NaHCO3—小苏打
Na2CO3—纯碱、苏打
(一)名称对比
Na2CO3
(二)用途对比
NaHCO3
[实验2-4]
Na2CO3+xH2O = Na2CO3·xH2O(密封保存)
(三)物理性质对比
1.酸碱性
Na2CO3水溶液和NaHCO3水溶液都呈碱性,都能使酚酞溶液变红,紫色石蕊变蓝,变色程度不一样。
碱性:Na2CO3水溶液>NaHCO3水溶液
[疑问]它们都属于盐,但其水溶液都呈碱性,说明什么?
(三)化学性质对比
2.热稳定性
[实验2-5]
加热Na2CO3或NaHCO3,观察现象,比较Na2CO3和NaHCO3的热稳定性。
[加热NaHCO3]澄清石灰水变浑浊
[加热Na2CO3]无现象
热稳定性:Na2CO3 >NaHCO3
[疑问]小苏打发酵后的糕点松软,为什么?
2NaHCO3=Na2CO3+H2O+CO2 ↑
[实验拓展]向等质量NaHCO3和Na2CO3中逐滴滴加等同的稀盐酸,观察现象。
3.与酸反应
Na2CO3+HCl(少)=NaCl+NaHCO3
NaHCO3+HCl=NaCl+H2O+CO2 ↑
Na2CO3+2HCl(过)=2NaCl+H2O+CO2 ↑
[Na2CO3]过一小段时间才产生气泡
[NaHCO3]立即产生气泡
为何不用碳酸钠来治疗胃酸过多,而是采用碳酸氢钠?
Na2CO3碱性较强,反应速率较慢,不适宜做胃药。
NaHCO3碱性较弱,反应速率快,可用于治疗胃酸过多。
[温馨提示]
胃痛类型很多,胃溃疡不能吃含有小苏打的药物进行治疗,反而会加重病情!
4.与碱反应
①Na2CO3
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3 + NaOH不反应(不符合复分解反应的条件)
②NaHCO3
[拓展实验]向盛有碳酸氢钠溶液的试管里滴入澄清石灰水,观察现象,并写出方程式。
现象:产生白色沉淀
过量Ca(OH)2:Ca(OH)2+NaHCO3=CaCO3↓+H2O+NaOH
少量Ca(OH)2: Ca(OH)2+2NaHCO3=Na2CO3+CaCO3 ↓+2H2O
5.与盐反应
①Na2CO3
Na2CO3+CaCl2=CaCO3↓+2NaCl
Na2CO3+BaCl2=BaCO3↓+2NaCl
②NaHCO3不与CaCl2、BaCl2反应
[知识拓展]为什么长时间CO2通入澄清的石灰水,先变浑浊然后又变清?
[类比推理]若将澄清石灰水换成饱和碳酸钠,会有什么现象呢?
CaCO3+CO2+H2O =Ca(HCO3)2
Ca(OH)2+CO2=CaCO3↓+H2O
Na2CO3+CO2+H2O=2NaHCO3↓
NaHCO3溶解度比Na2CO3小,所以会析出碳酸氢钠晶体。
[课堂小结]
Na2CO3
NaHCO3
①CO2 + H2O
②NaOH
②HCl(少量)
①△
①Na2CO3和NaHCO3相互转化
②Na2CO3和NaHCO3的鉴别
热稳定性
CaCl2(BaCl2)
与盐酸反应
溶液酸碱性
③Na2CO3和NaHCO3的除杂
[课堂小结]
【研究与实践】了解纯碱的生产历史
路布兰制碱法
索尔维制碱法
侯氏制碱法
三、焰色试验
很多金属或他们的化合物在灼烧时都会使火焰呈现出特征颜色,根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把试样的定性分析操作称为焰色试验。
[实验2-6]
[实验方法]
①洗烧:盐酸洗净铂丝,将铂丝在酒精灯火焰上灼烧至与酒精灯颜色一致
②蘸烧:蘸取试样,火焰上灼烧 ,观察火焰颜色(钾元素—蓝色钴玻璃)
③洗烧:盐酸洗净铂丝,将铂丝在酒精灯火焰上灼烧至与酒精灯颜色一致
钠黄钾紫铜绿色
1.焰色试验是物理变化,是元素的一种性质;
2.铂丝或光洁无锈的铁丝:焰色为无颜色,且熔点较高;
3.只能用稀盐酸:①与氧化物反应生成氯化物而除去;
②盐酸及其盐易挥发,不会对实验造成干扰;
4.焰色试验只能判断是某种元素,不能确定是单质还是化合物,是离子、原子还是分子或原子团。
5.钾元素—蓝色的钴玻璃:滤去钠元素产生的黄色的光,避免干扰。
[温馨提示]
