化学人教版(2019)必修第一册1.2.2离子反应(共22张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.2离子反应(共22张ppt) | 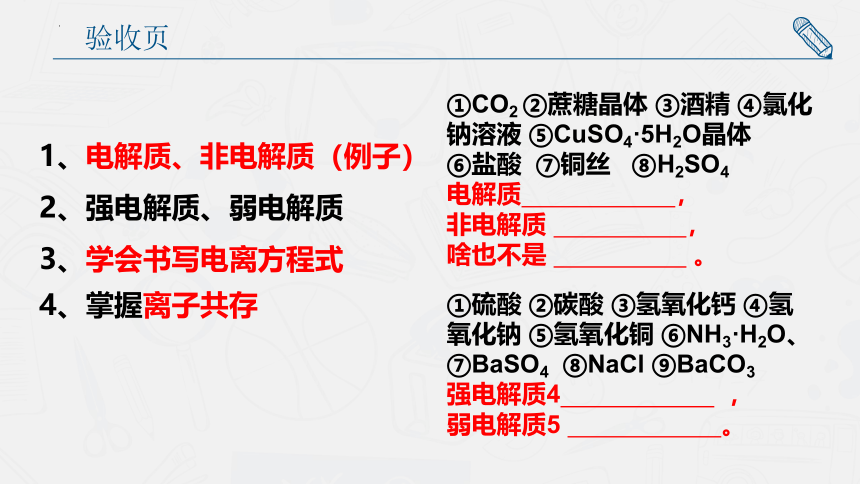 | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-23 16:03:48 | ||
图片预览








文档简介
(共22张PPT)
验收页
1、电解质、非电解质(例子)
2、强电解质、弱电解质
3、学会书写电离方程式
4、掌握离子共存
①CO2 ②蔗糖晶体 ③酒精 ④氯化钠溶液 ⑤CuSO4·5H2O晶体
⑥盐酸 ⑦铜丝 ⑧H2SO4
电解质 ,
非电解质 ,
啥也不是 。
①硫酸 ②碳酸 ③氢氧化钙 ④氢氧化钠 ⑤氢氧化铜 ⑥NH3·H2O、⑦BaSO4 ⑧NaCl ⑨BaCO3
强电解质4 ,
弱电解质5 。
错题本规范
CaCO3与NaOH反应( )
1.2.2离子反应
01 离子共存
02 离子方程式
CONTENTS
目录
一、离子共存
离子共存
(1)离子反应:有离子参加或生成的反应
(2)发生地点:一般在溶液中
(3)实质:离子之间结合成新物质,使反应物离子浓度降低
(4)复分解型离子反应发生条件:沉淀、气体、弱电解质
【实验1-3】 现象:产生白色沉淀
离子共存
2、离子共存(不发生反应)
(1)发生复分解反应而不能共存
①离子之间生成难溶性物质,不能大量共存(组在一起是沉淀)
SO42-:
CO32-:
OH-:
Ag+:
微溶
Ba2+、Pb2+
Ba2+、Ca2+、Ag+
Cu2+、Fe3+、Mg2+、Al3+、Zn2+
Cl-、Br-、I-
离子共存
②离子之间生成气体,不能大量共存
H+:CO32-、HCO3-、SO32-、HSO3-、S2-、HS-
OH-:NH4+
离子共存
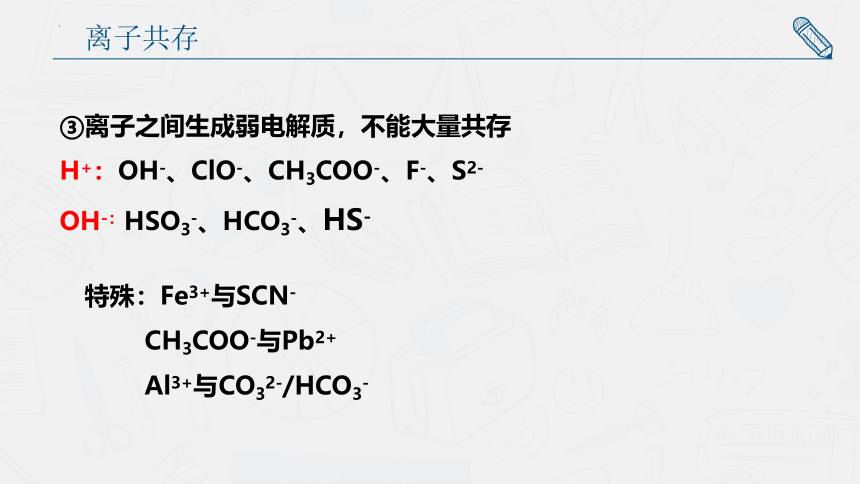
③离子之间生成弱电解质,不能大量共存
H+:OH-、ClO-、CH3COO-、F-、S2-
OH-:HSO3-、HCO3-、HS-
特殊:Fe3+与SCN-
CH3COO-与Pb2+
Al3+与CO32-/HCO3-
练习
例1、下列各组离子能在同一溶液中大量共存的是( )
A.Fe2+、H+、Cl-、OH- B.Ba2+、H+、SO42-、NO3-
C.K+、NH4+、OH-、SO42- D.Na+、Ca2+、HCO3-、NO3-
D
例2、下列各组离子能在同一溶液中大量共存的是( )
A.K+、H+、Cl-、ClO- B.Na+、Ca2+、SO42-、NO3-
C.Ba2+、H+、Cl-、SO42- D.Na+、Cu2+、Cl-、NO3-
D
离子共存
(2)判断离子共存的隐含条件
①溶液无色透明——有颜色的不能存在
(蓝)Cu2+、(棕黄)Fe3+、(浅绿)Fe2+、(绿)Cr3+、
(紫红)MnO4-、
②强酸性溶液/紫色石蕊变红/PH<7/甲基橙变红/PH试纸红——H+
③强碱性溶液/紫色石蕊变蓝、无色酚酞变红/PH>7/PH试纸蓝色——OH-
练习
例3
B
例4
A
练习
例5
B
二、离子方程式
离子方程式
1、定义:用实际参加反应的离子符号来表示反应的式子叫
离子方程式
2、原则:①遵循客观事实规律
②遵循原子守恒
③遵循电荷守恒
④遵循得失电子守恒
离子方程式
3.步骤
一写:写化学方程式
二拆:易溶于水易电离的物质
不拆:
强酸
强碱
大多数可溶盐
单质、氧化物
沉淀、气体、弱电解质(弱酸、弱碱、H2O)
浓硫酸
离子方程式
注意:①微溶物(MgCO3、CaSO4、Ag2SO4、Ca(OH)2)
②氨水
Ca(OH)2
反应物
澄清石灰水
石灰乳
生成物
拆
不拆
反应物
生成物
稀溶液且不△
浓溶液/△
不拆
拆
离子方程式
3.步骤
三删:删去不参加反应(形式相同的),并化简
四查:查守恒和符号
4、离子方程式意义:
揭示反应的本质:
表示一类反应
表示具体反应
P19思考与讨论
练习
①锌与稀硫酸:
②
③二氧化碳与氢氧化钠
④氢氧化钡和稀硫酸
⑤硫酸氢钠和氢氧化钡
⑥氢氧化钾与稀硫酸
⑦氢氧化铜和稀盐酸
Zn+2H+=Zn2++H2
OH-+H+=H2O
CO2+2OH-=CO32-+H2O
HCO3-+H+=CO2 +H2O
Cu(OH)2+2H+=Cu2++2H2O
Ba2++2OH-+2H++SO42-=BaSO4 +2H2O
Ba2++OH- +H++SO42-=BaSO4 +H2O
碳酸氢钠和稀盐酸
离子方程式
5、判断离子方程式正误
①符合客观事实
②化学式拆分是否正确
③符合原子守恒和电荷守恒
④是否漏写离子反应
⑤是否符合题设条件
练习
1.能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与稀硝酸反应:
B.澄清的石灰水与稀盐酸反应:
C.醋酸与氢氧化钠溶液反应:
D.碳酸钡溶于稀盐酸中:
E.铜与硝酸银反应:
Cu+Ag+=Cu2++Ag
A
下课
验收页
1、电解质、非电解质(例子)
2、强电解质、弱电解质
3、学会书写电离方程式
4、掌握离子共存
①CO2 ②蔗糖晶体 ③酒精 ④氯化钠溶液 ⑤CuSO4·5H2O晶体
⑥盐酸 ⑦铜丝 ⑧H2SO4
电解质 ,
非电解质 ,
啥也不是 。
①硫酸 ②碳酸 ③氢氧化钙 ④氢氧化钠 ⑤氢氧化铜 ⑥NH3·H2O、⑦BaSO4 ⑧NaCl ⑨BaCO3
强电解质4 ,
弱电解质5 。
错题本规范
CaCO3与NaOH反应( )
1.2.2离子反应
01 离子共存
02 离子方程式
CONTENTS
目录
一、离子共存
离子共存
(1)离子反应:有离子参加或生成的反应
(2)发生地点:一般在溶液中
(3)实质:离子之间结合成新物质,使反应物离子浓度降低
(4)复分解型离子反应发生条件:沉淀、气体、弱电解质
【实验1-3】 现象:产生白色沉淀
离子共存
2、离子共存(不发生反应)
(1)发生复分解反应而不能共存
①离子之间生成难溶性物质,不能大量共存(组在一起是沉淀)
SO42-:
CO32-:
OH-:
Ag+:
微溶
Ba2+、Pb2+
Ba2+、Ca2+、Ag+
Cu2+、Fe3+、Mg2+、Al3+、Zn2+
Cl-、Br-、I-
离子共存
②离子之间生成气体,不能大量共存
H+:CO32-、HCO3-、SO32-、HSO3-、S2-、HS-
OH-:NH4+
离子共存
③离子之间生成弱电解质,不能大量共存
H+:OH-、ClO-、CH3COO-、F-、S2-
OH-:HSO3-、HCO3-、HS-
特殊:Fe3+与SCN-
CH3COO-与Pb2+
Al3+与CO32-/HCO3-
练习
例1、下列各组离子能在同一溶液中大量共存的是( )
A.Fe2+、H+、Cl-、OH- B.Ba2+、H+、SO42-、NO3-
C.K+、NH4+、OH-、SO42- D.Na+、Ca2+、HCO3-、NO3-
D
例2、下列各组离子能在同一溶液中大量共存的是( )
A.K+、H+、Cl-、ClO- B.Na+、Ca2+、SO42-、NO3-
C.Ba2+、H+、Cl-、SO42- D.Na+、Cu2+、Cl-、NO3-
D
离子共存
(2)判断离子共存的隐含条件
①溶液无色透明——有颜色的不能存在
(蓝)Cu2+、(棕黄)Fe3+、(浅绿)Fe2+、(绿)Cr3+、
(紫红)MnO4-、
②强酸性溶液/紫色石蕊变红/PH<7/甲基橙变红/PH试纸红——H+
③强碱性溶液/紫色石蕊变蓝、无色酚酞变红/PH>7/PH试纸蓝色——OH-
练习
例3
B
例4
A
练习
例5
B
二、离子方程式
离子方程式
1、定义:用实际参加反应的离子符号来表示反应的式子叫
离子方程式
2、原则:①遵循客观事实规律
②遵循原子守恒
③遵循电荷守恒
④遵循得失电子守恒
离子方程式
3.步骤
一写:写化学方程式
二拆:易溶于水易电离的物质
不拆:
强酸
强碱
大多数可溶盐
单质、氧化物
沉淀、气体、弱电解质(弱酸、弱碱、H2O)
浓硫酸
离子方程式
注意:①微溶物(MgCO3、CaSO4、Ag2SO4、Ca(OH)2)
②氨水
Ca(OH)2
反应物
澄清石灰水
石灰乳
生成物
拆
不拆
反应物
生成物
稀溶液且不△
浓溶液/△
不拆
拆
离子方程式
3.步骤
三删:删去不参加反应(形式相同的),并化简
四查:查守恒和符号
4、离子方程式意义:
揭示反应的本质:
表示一类反应
表示具体反应
P19思考与讨论
练习
①锌与稀硫酸:
②
③二氧化碳与氢氧化钠
④氢氧化钡和稀硫酸
⑤硫酸氢钠和氢氧化钡
⑥氢氧化钾与稀硫酸
⑦氢氧化铜和稀盐酸
Zn+2H+=Zn2++H2
OH-+H+=H2O
CO2+2OH-=CO32-+H2O
HCO3-+H+=CO2 +H2O
Cu(OH)2+2H+=Cu2++2H2O
Ba2++2OH-+2H++SO42-=BaSO4 +2H2O
Ba2++OH- +H++SO42-=BaSO4 +H2O
碳酸氢钠和稀盐酸
离子方程式
5、判断离子方程式正误
①符合客观事实
②化学式拆分是否正确
③符合原子守恒和电荷守恒
④是否漏写离子反应
⑤是否符合题设条件
练习
1.能正确表示下列化学反应的离子方程式的是( )
A.氢氧化钡溶液与稀硝酸反应:
B.澄清的石灰水与稀盐酸反应:
C.醋酸与氢氧化钠溶液反应:
D.碳酸钡溶于稀盐酸中:
E.铜与硝酸银反应:
Cu+Ag+=Cu2++Ag
A
下课
