化学人教版(2019)必修第一册1.2.2离子反应以及离子共存 课件(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.2.2离子反应以及离子共存 课件(共20张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 32.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-23 00:00:00 | ||
图片预览








文档简介
(共20张PPT)
第一章 物质的分类及其转化
第二节 离子反应
第二课时 离子反应以及离子共存
离子反应
KCl固体
NaNO3固体
KCl和NaNO3混合溶液
氯化钾与硝酸钠不发生化学反应,所以将混合溶液蒸干应该得到氯化钾和硝酸钠的固体?
氯化钠、氯化钾、硝酸钠、硝酸钾四种盐混合固体
离子反应
用如图装置及试剂进行【实验1-3】,并参考下表进行分析。
(a溶液是硫酸钠溶液)
现象 分析 相应物质的电离方程式 混合前两溶液中的离子 混合后溶液中的离子
白色沉淀
BaCl2 + Na2SO4=
BaSO4 ↓+2NaCl
Na+、SO42-Ba2+、Cl—
Na+、Cl—
氯化钡和硫酸钠反应实验
离子反应
向盛有2mL Na2SO4稀溶液的试管中加入2mL BaCl2稀溶液
Na2SO4溶液
BaCl2溶液
Ba2+、
Cl-2+、Cl-
Na+、SO42-2+、Cl-
BaSO4
Na+、Cl-
混合氯化钡和硫酸钠溶液,实际上是将四种离子(Na+、SO42-、Ba2+、Cl-)混合,SO42-和Ba2+结合为BaSO4沉淀析出,Na+和Cl-并未参与反应,只是剩余在溶液中。
Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
SO42- + Ba2+ = BaSO4↓
宏观
微观
电解质在溶液中实际是以离子形式发生反应
网
氯化钡和硫酸钠反应实验
离子反应
实验中产生了白色沉淀,说明Ba2+ 和SO42- 发生反应,生成了BaSO4沉淀。这种离子间的反应,叫做离子反应。
离子反应:
电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
离子方程式:
用实际参加反应的离子符号来表示反应的式子叫做离子方程式。
SO42- + Ba2+ = BaSO4↓
Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
离子反应、离子反应方程式
离子反应
离子方程式的书写步骤:
(1)写出化学方程式:Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4↓ + 2Na+ + 2Cl-
(3)删去方程式两边不参加反应的离子,并将方程式化成最简:
SO42- + Ba2+ = BaSO4↓
(4)检查离子方程式两边各元素的原子个数和电荷总数是否相等:
SO42- + Ba2+ = BaSO4↓
2- + 2+ = 0
0
电荷守恒
学
(2)将易溶于水且易电离的物质拆写成离子形式,难溶的物质、气体和水等仍用化学式表示。
离子反应方程式的书写
离子反应
电解质的拆分是离子方程式书写的关键,在拆分时一定要注意以下问题:
①能够进行拆分的只有易溶易电离的物质(强酸、强碱和大多数可溶盐)。
②拆分时应该按照电离方程式的形式进行拆分,注意方程式中的系数。
③其余不能拆分的物质不变,注意反应条件和沉淀、气体符号都不能改变。
离子方程式的书写步骤:
离子反应方程式的书写步骤
离子反应
离子方程式中的“拆”与“不拆”
(1)能拆写成离子的物质
拆:强酸、强碱、可溶性盐
强酸:HNO3、H2SO4、HCl、HBr、HI、HClO4
强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2
离子反应方程式的书写难点
离子反应
(2)不能拆写成离子的物质
不拆
离子反应方程式的书写难点
离子反应
微溶物处理方式有三种情况
①出现在生成物中写化学式;
②是反应物处于溶液状态写离子符号;
③是反应物处于浊液(石灰乳)或固态时写化学式。
不能拆分的物质包括单质、氧化物、弱电解质、难溶电解质、气体。
①产物NH3·H2O的处理,不加热或稀溶液中,写成NH3·H2O。加热或浓溶液中,写成NH3和H2O。
②浓盐酸、浓HNO3在离子方程式中拆开,浓H2SO4保留化学式。
③HCO3—、HS—、HSO3—等弱酸的酸式酸根离子不能拆开写。
离子反应方程式的书写难点
离子反应
判断下列离子方程式是否正确并说明理由:
(1)铁与稀盐酸反应:2Fe + 6H+ = 2Fe3++ 3H2↑
(2)铝与稀盐酸反应:Al + 3H+ = Al3+ + H2↑
(3)FeCl3与Fe反应:Fe3+ + Fe = 2Fe2+
(4)硫酸和Ba(OH)2溶液反应:
Ba2+ + OH- + H+ + SO42- = BaSO4↓ + H2O
(5)碳酸钡和稀硝酸反应:CO32-+2H+ = H2O + CO2↑
不符合客观事实
Fe + 2H+ = Fe2++ H2↑
原子不守恒
2Al + 6H+ = 2Al3++ 3H2↑
电荷不守恒
2Fe3+ + Fe = 3Fe2+
物质比例不符合客观事实
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓ + 2H2O
物质拆分不正确
BaCO3+2H+ = Ba2++ H2O + CO2↑
离子反应方程式的判断
离子反应
观察下面的方程式,化学方程式和离子方程式的意义有何不同?
反应物 化学方程式 离子方程式
⑥HCl + NaOH HCl + NaOH = NaCl + H2O H+ + OH- = H2O
⑦HCl + KOH HCl + KOH = KCl + H2O H+ + OH- = H2O
⑧H2SO4 + NaOH H2SO4 + 2NaOH = Na2SO4 + 2H2O H+ + OH- = H2O
⑨H2SO4 + KOH H2SO4 + 2KOH = K2SO4 + 2H2O H+ + OH- = H2O
四个不同的强酸强碱之间的中和反应,化学方程式不同
不同
相同
化学方程式表示的是一个具体的反应,
离子方程式除表示具体反应外,还可以表示一类反应。
实质都是溶液中的H+和OH-的反应,离子方程式相同
离子反应的特点
离子反应
复分解型离子反应
氧化还原反应型离子反应
溶液中有离子参加的氧化还原反应,如活泼金属与酸、活泼金属与盐的反应等。
例:Zn与稀H2SO4反应的离子方程式
Zn+2H+===Zn2++H2↑
大部分难溶盐不会和盐溶液反应,也不会和碱溶液反应。
离子反应的类型
离子反应
1.离子共存的本质
几种离子在同一溶液中能大量共存,就是指离子间 ;若离子之间能 ,则不能大量共存。
2.判断离子能否大量共存的“四个要点”
判断多种离子能否大量共存于同一溶液中,归纳起来就是:一色、二性、三特殊、四反应。
(1)一色——溶液颜色
几种常见离子的颜色:
离子 Cu2+ Fe3+ Fe2+ MnO4—
溶液颜色 蓝色 棕黄色 浅绿色 紫红色
不发生任何反应
发生反应
离子共存
离子反应
(2)二性——溶液的酸碱性
(3)三特殊——三种特殊情况:
离子共存
离子反应
(4)四反应——四种反应类型
四反应是指离子间通常能发生的四种类型的反应,能相互反应的离子显然不能大量共存。
原则:能反应生成沉淀、气体、难电离物质的不能共存。
离子共存
离子反应
离子共存
离子反应
(1)审清题干要求的关键词语,如“一定大量共存”“可能大量共存”或“不能大量共存”等。
(2)规避颜色陷阱,如“无色溶液”“透明溶液”等。
(3)注意离子共存的条件,如酸性、碱性及特殊离子存在。
离子共存
离子反应
离子反应在水处理中起着重要作用,能够使水中的杂质与离子结合形成沉淀。离子反应广泛用于化学研究、化工生产、医疗诊断和环境保护等各个领域,化学实验中也常用相关的离子反应定性地检验某溶液中是否含有某离子。如用稀HNO3和AgNO3溶液检验溶液中的Cl-的离子方程式:
Ag+
+Cl-===AgCl↓
离子反应的应用
离子反应
离子反应、复分解反应、置换反应之间可用集合关系来表示,其中正确的是
解析 置换反应与复分解反应没有相交的关系,离子反应与置换反应和复分解反应分别有相交的关系。
√
离子反应的特点
第一章 物质的分类及其转化
第二节 离子反应
第二课时 离子反应以及离子共存
离子反应
KCl固体
NaNO3固体
KCl和NaNO3混合溶液
氯化钾与硝酸钠不发生化学反应,所以将混合溶液蒸干应该得到氯化钾和硝酸钠的固体?
氯化钠、氯化钾、硝酸钠、硝酸钾四种盐混合固体
离子反应
用如图装置及试剂进行【实验1-3】,并参考下表进行分析。
(a溶液是硫酸钠溶液)
现象 分析 相应物质的电离方程式 混合前两溶液中的离子 混合后溶液中的离子
白色沉淀
BaCl2 + Na2SO4=
BaSO4 ↓+2NaCl
Na+、SO42-Ba2+、Cl—
Na+、Cl—
氯化钡和硫酸钠反应实验
离子反应
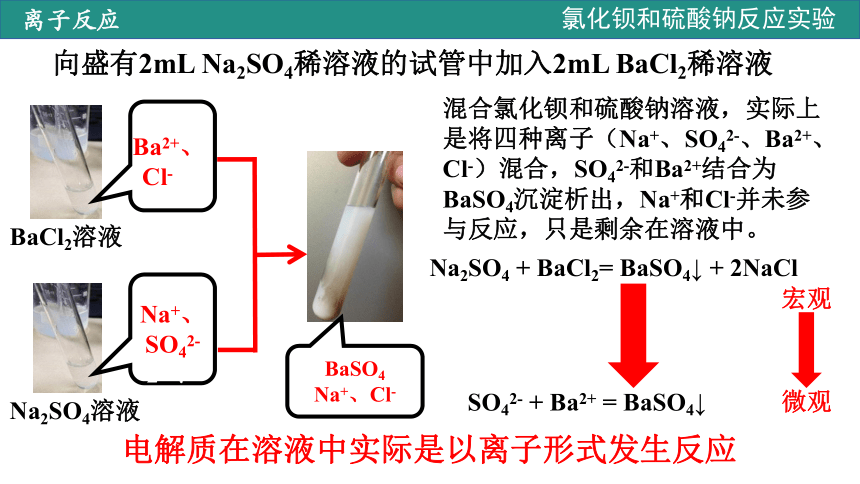
向盛有2mL Na2SO4稀溶液的试管中加入2mL BaCl2稀溶液
Na2SO4溶液
BaCl2溶液
Ba2+、
Cl-2+、Cl-
Na+、SO42-2+、Cl-
BaSO4
Na+、Cl-
混合氯化钡和硫酸钠溶液,实际上是将四种离子(Na+、SO42-、Ba2+、Cl-)混合,SO42-和Ba2+结合为BaSO4沉淀析出,Na+和Cl-并未参与反应,只是剩余在溶液中。
Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
SO42- + Ba2+ = BaSO4↓
宏观
微观
电解质在溶液中实际是以离子形式发生反应
网
氯化钡和硫酸钠反应实验
离子反应
实验中产生了白色沉淀,说明Ba2+ 和SO42- 发生反应,生成了BaSO4沉淀。这种离子间的反应,叫做离子反应。
离子反应:
电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
离子方程式:
用实际参加反应的离子符号来表示反应的式子叫做离子方程式。
SO42- + Ba2+ = BaSO4↓
Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
离子反应、离子反应方程式
离子反应
离子方程式的书写步骤:
(1)写出化学方程式:Na2SO4 + BaCl2= BaSO4↓ + 2NaCl
2Na+ + SO42- + Ba2+ + 2Cl- = BaSO4↓ + 2Na+ + 2Cl-
(3)删去方程式两边不参加反应的离子,并将方程式化成最简:
SO42- + Ba2+ = BaSO4↓
(4)检查离子方程式两边各元素的原子个数和电荷总数是否相等:
SO42- + Ba2+ = BaSO4↓
2- + 2+ = 0
0
电荷守恒
学
(2)将易溶于水且易电离的物质拆写成离子形式,难溶的物质、气体和水等仍用化学式表示。
离子反应方程式的书写
离子反应
电解质的拆分是离子方程式书写的关键,在拆分时一定要注意以下问题:
①能够进行拆分的只有易溶易电离的物质(强酸、强碱和大多数可溶盐)。
②拆分时应该按照电离方程式的形式进行拆分,注意方程式中的系数。
③其余不能拆分的物质不变,注意反应条件和沉淀、气体符号都不能改变。
离子方程式的书写步骤:
离子反应方程式的书写步骤
离子反应
离子方程式中的“拆”与“不拆”
(1)能拆写成离子的物质
拆:强酸、强碱、可溶性盐
强酸:HNO3、H2SO4、HCl、HBr、HI、HClO4
强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2
离子反应方程式的书写难点
离子反应
(2)不能拆写成离子的物质
不拆
离子反应方程式的书写难点
离子反应
微溶物处理方式有三种情况
①出现在生成物中写化学式;
②是反应物处于溶液状态写离子符号;
③是反应物处于浊液(石灰乳)或固态时写化学式。
不能拆分的物质包括单质、氧化物、弱电解质、难溶电解质、气体。
①产物NH3·H2O的处理,不加热或稀溶液中,写成NH3·H2O。加热或浓溶液中,写成NH3和H2O。
②浓盐酸、浓HNO3在离子方程式中拆开,浓H2SO4保留化学式。
③HCO3—、HS—、HSO3—等弱酸的酸式酸根离子不能拆开写。
离子反应方程式的书写难点
离子反应
判断下列离子方程式是否正确并说明理由:
(1)铁与稀盐酸反应:2Fe + 6H+ = 2Fe3++ 3H2↑
(2)铝与稀盐酸反应:Al + 3H+ = Al3+ + H2↑
(3)FeCl3与Fe反应:Fe3+ + Fe = 2Fe2+
(4)硫酸和Ba(OH)2溶液反应:
Ba2+ + OH- + H+ + SO42- = BaSO4↓ + H2O
(5)碳酸钡和稀硝酸反应:CO32-+2H+ = H2O + CO2↑
不符合客观事实
Fe + 2H+ = Fe2++ H2↑
原子不守恒
2Al + 6H+ = 2Al3++ 3H2↑
电荷不守恒
2Fe3+ + Fe = 3Fe2+
物质比例不符合客观事实
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓ + 2H2O
物质拆分不正确
BaCO3+2H+ = Ba2++ H2O + CO2↑
离子反应方程式的判断
离子反应
观察下面的方程式,化学方程式和离子方程式的意义有何不同?
反应物 化学方程式 离子方程式
⑥HCl + NaOH HCl + NaOH = NaCl + H2O H+ + OH- = H2O
⑦HCl + KOH HCl + KOH = KCl + H2O H+ + OH- = H2O
⑧H2SO4 + NaOH H2SO4 + 2NaOH = Na2SO4 + 2H2O H+ + OH- = H2O
⑨H2SO4 + KOH H2SO4 + 2KOH = K2SO4 + 2H2O H+ + OH- = H2O
四个不同的强酸强碱之间的中和反应,化学方程式不同
不同
相同
化学方程式表示的是一个具体的反应,
离子方程式除表示具体反应外,还可以表示一类反应。
实质都是溶液中的H+和OH-的反应,离子方程式相同
离子反应的特点
离子反应
复分解型离子反应
氧化还原反应型离子反应
溶液中有离子参加的氧化还原反应,如活泼金属与酸、活泼金属与盐的反应等。
例:Zn与稀H2SO4反应的离子方程式
Zn+2H+===Zn2++H2↑
大部分难溶盐不会和盐溶液反应,也不会和碱溶液反应。
离子反应的类型
离子反应
1.离子共存的本质
几种离子在同一溶液中能大量共存,就是指离子间 ;若离子之间能 ,则不能大量共存。
2.判断离子能否大量共存的“四个要点”
判断多种离子能否大量共存于同一溶液中,归纳起来就是:一色、二性、三特殊、四反应。
(1)一色——溶液颜色
几种常见离子的颜色:
离子 Cu2+ Fe3+ Fe2+ MnO4—
溶液颜色 蓝色 棕黄色 浅绿色 紫红色
不发生任何反应
发生反应
离子共存
离子反应
(2)二性——溶液的酸碱性
(3)三特殊——三种特殊情况:
离子共存
离子反应
(4)四反应——四种反应类型
四反应是指离子间通常能发生的四种类型的反应,能相互反应的离子显然不能大量共存。
原则:能反应生成沉淀、气体、难电离物质的不能共存。
离子共存
离子反应
离子共存
离子反应
(1)审清题干要求的关键词语,如“一定大量共存”“可能大量共存”或“不能大量共存”等。
(2)规避颜色陷阱,如“无色溶液”“透明溶液”等。
(3)注意离子共存的条件,如酸性、碱性及特殊离子存在。
离子共存
离子反应
离子反应在水处理中起着重要作用,能够使水中的杂质与离子结合形成沉淀。离子反应广泛用于化学研究、化工生产、医疗诊断和环境保护等各个领域,化学实验中也常用相关的离子反应定性地检验某溶液中是否含有某离子。如用稀HNO3和AgNO3溶液检验溶液中的Cl-的离子方程式:
Ag+
+Cl-===AgCl↓
离子反应的应用
离子反应
离子反应、复分解反应、置换反应之间可用集合关系来表示,其中正确的是
解析 置换反应与复分解反应没有相交的关系,离子反应与置换反应和复分解反应分别有相交的关系。
√
离子反应的特点
