1.2.1 离子反应 课件(共20张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.2.1 离子反应 课件(共20张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 38.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-23 19:37:02 | ||
图片预览





文档简介
(共20张PPT)
第一章物质及其变化
第二节 离子反应
第一课时 电解质的电离
离子反应
电解质
湿手不能触碰插座
离子反应
[实验1-2](视频)在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图1-9所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
取上述烧杯中的NaCl固体、KNO3,固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图1-9所示,将石墨电极依次放入NaC1溶液、KNO3溶液中,分别接通电源,观察并记录现象。
物质的导电性实验
离子反应
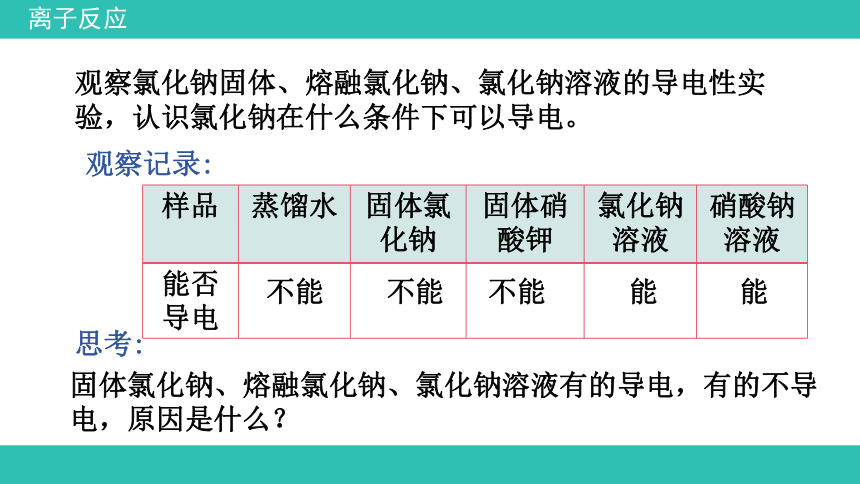
样品 蒸馏水 固体氯化钠 固体硝酸钾 氯化钠溶液 硝酸钠溶液
能否导电
观察氯化钠固体、熔融氯化钠、氯化钠溶液的导电性实验,认识氯化钠在什么条件下可以导电。
观察记录:
思考:
固体氯化钠、熔融氯化钠、氯化钠溶液有的导电,有的不导电,原因是什么?
不能
不能
能
不能
能
离子反应
离子反应
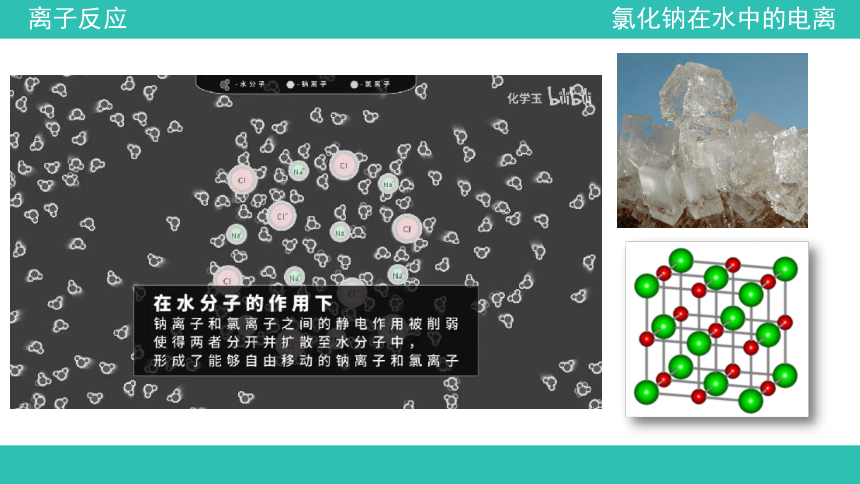
氯化钠在水中的电离
离子反应
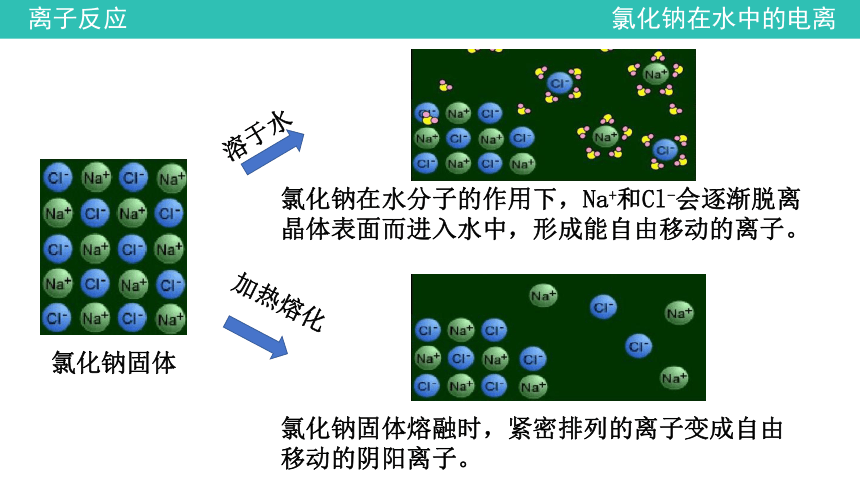
溶于水
加热熔化
氯化钠固体
氯化钠在水分子的作用下,Na+和Cl-会逐渐脱离晶体表面而进入水中,形成能自由移动的离子。
氯化钠固体熔融时,紧密排列的离子变成自由移动的阴阳离子。
氯化钠在水中的电离
离子反应
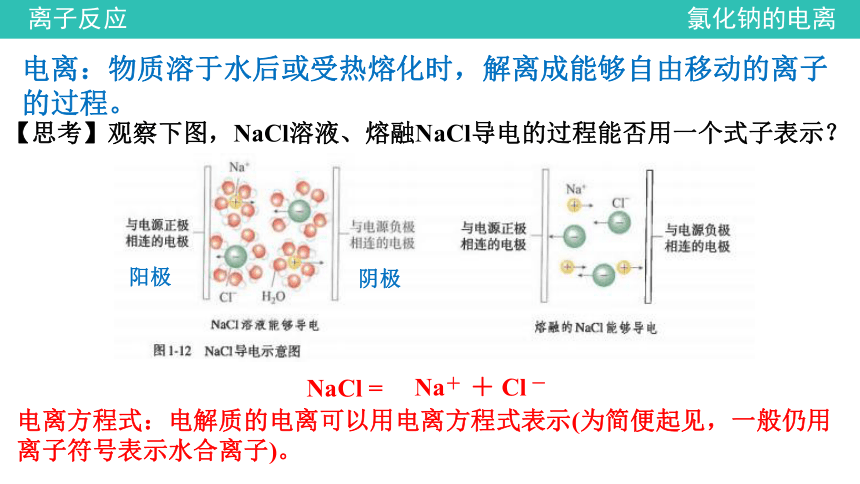
电离:物质溶于水后或受热熔化时,解离成能够自由移动的离子的过程。
【思考】观察下图,NaCl溶液、熔融NaCl导电的过程能否用一个式子表示?
NaCl =
Na+ + Cl -
电离方程式:电解质的电离可以用电离方程式表示(为简便起见,一般仍用离子符号表示水合离子)。
阳极
阴极
氯化钠的电离
离子反应
一、电解质的电离:
注意:1、电离的条件是:溶于水或加热熔融
2、电离不需要通电
3、本质是在水或熔融状态下自身解离产生自由移动的离子,和通电无关。
4、电解是化学变化,需要通电。
1、电离:
溶于水或熔融状态(受热融化)时解离成能够自由移动的离子的过程。(物理变化)
电离的概念
离子反应
导
电
实
验
【知识支持】熔融的NaCl和熔融的NaOH都导电,熔融的蔗糖不导电。
物质的导电实验
酸在熔融状态下不会导电。
离子反应
1.请根据化合物的导电性实验说出“电解质”、“非电解质”的概念。
2.请依据物质的组成和性质对上述5种化合物进行分类,并指出哪些类别的物质属于电解质?哪些属于非电解质?
NaCl NaOH 酒精 蔗糖 硫酸
电解质:
非电解质:
在水溶液中或熔融状态下能够导电的化合物。
在水溶液里和熔融状态下都不导电的化合物。
电解质和非电解质的概念
离子反应
1.水导电吗?
2.什么化学物质是导电的,什么化学物质又是不导电的呢?
生活常识:铜、石墨是导电的。
电流是由带电荷的粒子按一定方向移动而形成的。因此,能导电的物质必须具有能自由移动的、带电荷的粒子。
电解质溶液导电能力主要取决于离子浓度大小和离子所带的电荷的多少。
初中电解水的实验中,水中是加入了硫酸钠或氢氧化钠来增强导电性的,实际纯水在一般条件下是很难测出导电性的。
物质导电性解析
离子反应
物质
混合物
纯净 物
化合物
单质
电解质
非电解质
既不是电解质
也不是非电解质
酸、碱、盐、水、
活泼金属氧化物
活泼金属氢化物
大多数有机物(酒精、蔗糖)
非金属氧化物(CO2、SO2、NH3)
利用分类方法,将电解质和非电解质归纳入物质中,并用图示表示出来。
既不是电解质也不是非电解质
离子反应酸碱部分盐水活泼金属氧化物活泼金属氢化物如HCl、H2SO4、H2CO3、CH3COOH等如NaOH、NH3H2O、Ba(OH)2等如KCl、Na2SO4、BaSO4、AgCl等如MgO、Na2O等非金属氧化物部分非金属氢化物大部分有机物如CO2、CO、SO3等如蔗糖、葡萄糖、酒精等;电解质非电解质化合物如NH3、CH4等;电解质和非电解质的举例H2O难溶于水的物质不一定是非电解质。部分非电解质的水溶液导电,是因为和水反应生成了导电的物质。如NaH、NaH等
离子反应
HCl HBr HI HNO3 H2SO4 HClO4
H2CO3 H2S CH3COOH等
KOH NaOH Ca(OH)2 Ba(OH)2
NH3·H2O(电离OH—) Fe(OH)3 等
(CH3COO)2Pb
强电解质:水溶液中完全电离的电解质
强酸
强碱
绝大多数的盐:
弱电解质:水溶液中只能部分电离的电解质
弱酸
弱碱
水
极少数盐
常见的强电解质和弱电解质
KCl Na2CO3 Ca2CO3 NaHCO3 BaSO4
与水溶液的电离情况有关
强弱电解质
离子反应
HCl 溶于水时完全电离
CH3COOH 溶于水时部分电离
HCl = H+ + Cl-
CH3COOH H+ + CH3COO-
溶液中只存在H+和Cl-,不存在HCl分子
溶液中既存在H+和CH3COO- ,也存在CH3COOH分子
弱电解质的电离
离子反应
已知NaHSO4水溶液中能电离出 H+,请写出其电离方程式。
并判断它属于酸、碱、盐的哪一种?
NaHSO4 = Na+ +H+ + SO42- 盐 溶液中电离
NaHCO3 = Na+ +HCO3- 溶液中的电离(受热易分解,无熔融状态)
NaHSO4 = Na+ +HSO4- 熔融状态下的电离
强酸及其酸式盐在水溶液中完全电离。
弱酸在水溶液中不能完全电离,弱酸的酸式盐在水溶液中电离生成酸式酸根离子和阳离子。
电离方程式
离子反应
(3)能导电的有:
①Cu ②盐酸 ③KNO3固体 ④KNO3溶液 ⑤葡萄糖 ⑥CuSO4
⑦熔融的KNO3 ⑧H2SO4 ⑨NH3 ⑩液态HCl
按要求对下列物质进行分类:
(1)属于是电解质:
(2)属于非电解质:
①②④⑦
③⑥⑦⑧⑩
⑤⑨
注意:1、单质和混合物既不是电解质也不是非电解质
2、电解质导电必须是化合物本身电离出自由移动的离子
3、电解质不一定能导电,能导电的物质不一定是电解质。
练习
离子反应
电解质溶液导电性
离子反应
电解质与细胞活动
第一章物质及其变化
第二节 离子反应
第一课时 电解质的电离
离子反应
电解质
湿手不能触碰插座
离子反应
[实验1-2](视频)在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图1-9所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
取上述烧杯中的NaCl固体、KNO3,固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图1-9所示,将石墨电极依次放入NaC1溶液、KNO3溶液中,分别接通电源,观察并记录现象。
物质的导电性实验
离子反应
样品 蒸馏水 固体氯化钠 固体硝酸钾 氯化钠溶液 硝酸钠溶液
能否导电
观察氯化钠固体、熔融氯化钠、氯化钠溶液的导电性实验,认识氯化钠在什么条件下可以导电。
观察记录:
思考:
固体氯化钠、熔融氯化钠、氯化钠溶液有的导电,有的不导电,原因是什么?
不能
不能
能
不能
能
离子反应
离子反应
氯化钠在水中的电离
离子反应
溶于水
加热熔化
氯化钠固体
氯化钠在水分子的作用下,Na+和Cl-会逐渐脱离晶体表面而进入水中,形成能自由移动的离子。
氯化钠固体熔融时,紧密排列的离子变成自由移动的阴阳离子。
氯化钠在水中的电离
离子反应
电离:物质溶于水后或受热熔化时,解离成能够自由移动的离子的过程。
【思考】观察下图,NaCl溶液、熔融NaCl导电的过程能否用一个式子表示?
NaCl =
Na+ + Cl -
电离方程式:电解质的电离可以用电离方程式表示(为简便起见,一般仍用离子符号表示水合离子)。
阳极
阴极
氯化钠的电离
离子反应
一、电解质的电离:
注意:1、电离的条件是:溶于水或加热熔融
2、电离不需要通电
3、本质是在水或熔融状态下自身解离产生自由移动的离子,和通电无关。
4、电解是化学变化,需要通电。
1、电离:
溶于水或熔融状态(受热融化)时解离成能够自由移动的离子的过程。(物理变化)
电离的概念
离子反应
导
电
实
验
【知识支持】熔融的NaCl和熔融的NaOH都导电,熔融的蔗糖不导电。
物质的导电实验
酸在熔融状态下不会导电。
离子反应
1.请根据化合物的导电性实验说出“电解质”、“非电解质”的概念。
2.请依据物质的组成和性质对上述5种化合物进行分类,并指出哪些类别的物质属于电解质?哪些属于非电解质?
NaCl NaOH 酒精 蔗糖 硫酸
电解质:
非电解质:
在水溶液中或熔融状态下能够导电的化合物。
在水溶液里和熔融状态下都不导电的化合物。
电解质和非电解质的概念
离子反应
1.水导电吗?
2.什么化学物质是导电的,什么化学物质又是不导电的呢?
生活常识:铜、石墨是导电的。
电流是由带电荷的粒子按一定方向移动而形成的。因此,能导电的物质必须具有能自由移动的、带电荷的粒子。
电解质溶液导电能力主要取决于离子浓度大小和离子所带的电荷的多少。
初中电解水的实验中,水中是加入了硫酸钠或氢氧化钠来增强导电性的,实际纯水在一般条件下是很难测出导电性的。
物质导电性解析
离子反应
物质
混合物
纯净 物
化合物
单质
电解质
非电解质
既不是电解质
也不是非电解质
酸、碱、盐、水、
活泼金属氧化物
活泼金属氢化物
大多数有机物(酒精、蔗糖)
非金属氧化物(CO2、SO2、NH3)
利用分类方法,将电解质和非电解质归纳入物质中,并用图示表示出来。
既不是电解质也不是非电解质
离子反应酸碱部分盐水活泼金属氧化物活泼金属氢化物如HCl、H2SO4、H2CO3、CH3COOH等如NaOH、NH3H2O、Ba(OH)2等如KCl、Na2SO4、BaSO4、AgCl等如MgO、Na2O等非金属氧化物部分非金属氢化物大部分有机物如CO2、CO、SO3等如蔗糖、葡萄糖、酒精等;电解质非电解质化合物如NH3、CH4等;电解质和非电解质的举例H2O难溶于水的物质不一定是非电解质。部分非电解质的水溶液导电,是因为和水反应生成了导电的物质。如NaH、NaH等
离子反应
HCl HBr HI HNO3 H2SO4 HClO4
H2CO3 H2S CH3COOH等
KOH NaOH Ca(OH)2 Ba(OH)2
NH3·H2O(电离OH—) Fe(OH)3 等
(CH3COO)2Pb
强电解质:水溶液中完全电离的电解质
强酸
强碱
绝大多数的盐:
弱电解质:水溶液中只能部分电离的电解质
弱酸
弱碱
水
极少数盐
常见的强电解质和弱电解质
KCl Na2CO3 Ca2CO3 NaHCO3 BaSO4
与水溶液的电离情况有关
强弱电解质
离子反应
HCl 溶于水时完全电离
CH3COOH 溶于水时部分电离
HCl = H+ + Cl-
CH3COOH H+ + CH3COO-
溶液中只存在H+和Cl-,不存在HCl分子
溶液中既存在H+和CH3COO- ,也存在CH3COOH分子
弱电解质的电离
离子反应
已知NaHSO4水溶液中能电离出 H+,请写出其电离方程式。
并判断它属于酸、碱、盐的哪一种?
NaHSO4 = Na+ +H+ + SO42- 盐 溶液中电离
NaHCO3 = Na+ +HCO3- 溶液中的电离(受热易分解,无熔融状态)
NaHSO4 = Na+ +HSO4- 熔融状态下的电离
强酸及其酸式盐在水溶液中完全电离。
弱酸在水溶液中不能完全电离,弱酸的酸式盐在水溶液中电离生成酸式酸根离子和阳离子。
电离方程式
离子反应
(3)能导电的有:
①Cu ②盐酸 ③KNO3固体 ④KNO3溶液 ⑤葡萄糖 ⑥CuSO4
⑦熔融的KNO3 ⑧H2SO4 ⑨NH3 ⑩液态HCl
按要求对下列物质进行分类:
(1)属于是电解质:
(2)属于非电解质:
①②④⑦
③⑥⑦⑧⑩
⑤⑨
注意:1、单质和混合物既不是电解质也不是非电解质
2、电解质导电必须是化合物本身电离出自由移动的离子
3、电解质不一定能导电,能导电的物质不一定是电解质。
练习
离子反应
电解质溶液导电性
离子反应
电解质与细胞活动
