化学人教版(2019)选择性必修1 3.1.1强弱电解质(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.1.1强弱电解质(共25张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 99.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-24 16:38:00 | ||
图片预览








文档简介
(共25张PPT)
第一节 电离平衡
第1课时
第三章
水溶液中的离子反应与平衡
1. 通过预习回顾能复述电解质、非电解质的概念,并以此对常见物质进行分类
学习目标
2.通过实验探究、合作交流归纳出强弱电解质的概念
3.会书写常见电解质的电离方程式
知识回顾
1.铜丝、盐酸能导电,它们是电解质还是非电解质?
2.BaSO4、AgCl、CaCO3均难溶于水,它们是电解质吗?
既不是电解质也不是非电解质
是
难溶盐在熔融状态时可导电
什么叫电解质?
什么叫非电解质?
现有下列物质:
①石墨 ②BaSO4 ③稀盐酸 ④CO2 ⑤CaO ⑥NaCl ⑦NH3·H2O
⑧熔融KCl ⑨乙醇 ⑩ CH3COOH ⑾ NaCl溶液
以上指定物质中,属于电解质的是__________________________
属于非电解质的是_________________________________________
②⑤⑥⑦⑧⑩
④⑨
(酸、碱 、盐,活泼金属氧化物、H2O)
(一些非金属氧化物、大多数有机物及NH3)
电解质的导电
条件:
本质 :
自由离子的定向移动
离子浓度、离子所带电荷
导电能力:
溶于水或熔融状态
疑点突破:
电解质、非电解质的前提必须为化合物,故单质、混合物既不是电解质也不是非电解质
电解质必须是化合物本身能电离出离子,否则不属于电解质。例:NH3、SO2、CO2 。
电解质的导电:导电的条件是溶于水或熔融状态
导电的本质是自由离子的定向移动
导电能力与离子浓度和离子所带电荷有关
盐酸和醋酸是生活中经常用到的酸。盐酸常用于卫生洁具的清洁。
有效成分是盐酸
醋酸的腐蚀性比盐酸的小,比较安全,为什么不用醋酸代替盐酸呢?
有哪些方法能判断醋酸和盐酸的酸性不同?
取相同体积,0.1mol/L的盐酸和醋酸,比较它们pH的大小,试验其导电能力,并分别与等量镁条反应,观察、比较并记录现象。
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
pH
导电能力
与镁条反应
探究实验3-1, 课本P56
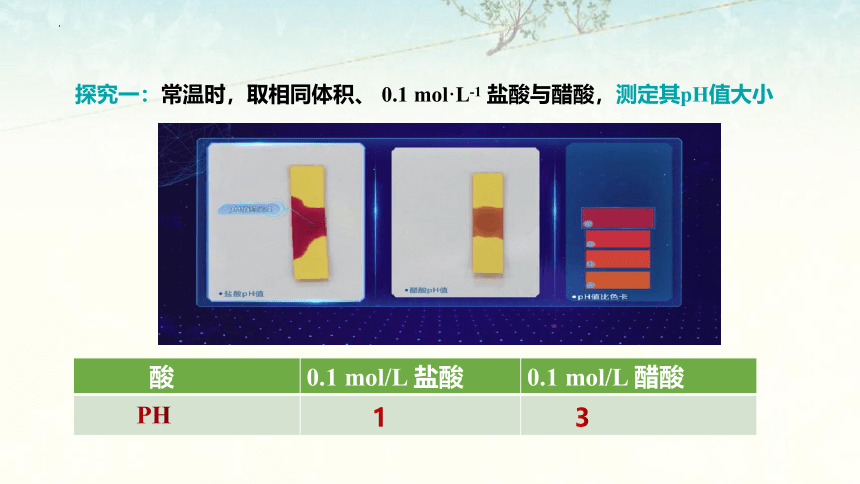
探究一:常温时,取相同体积、 0.1 mol·L-1 盐酸与醋酸,测定其pH值大小
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
PH
1
3
资料卡片:PH= - lgC(H+)
PH=1 C(H+) =0.1mol/L
PH=2.8 C(H+) =0.00168mol/L
0.1 mol/L 盐酸 pH=1
c(H+)=0.1 mol/L
0.1 mol/L 醋酸 pH=3
c(H+)=0.001 mol/L
pH不同,说明: 盐酸和醋酸中的H+浓度不同,
即 HCl和CH3COOH的电离程度不同。
探究二:用水质检测笔检测0.1 mol/L 盐酸、0.1 mol/L 醋酸、蒸馏水的导电性。
(已知:相同温度下,水质检测笔读数越大,溶液的导电性越强)
数据分析:
读数:7180
读数:187
读数:2
导电性:
0.1 mol/L 盐酸 > 0.1 mol/L 醋酸
探究三:观察等体积、等浓度0.1 mol·L-1 的盐酸、醋酸溶液和相同大小镁条反应的实验,进行预测,观察现象并尝试解释原因
镁条
1 mol·L-1 HCl
1 mol·L-1 CH3COOH
实验分析
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
pH
导电能力
实验现象
化学方 程式
Mg + 2HCl
MgCl2 + H2↑
Mg + 2CH3COOH
(CH3COO)2Mg + H2↑
1.0
3.0
镁条表面产生气泡较快
镁条表面产生气泡较慢
导电能力强
导电能力弱
数据分析
图1 HCl在水中的电离示意图
图2 CH3COOH在水中的电离示意图
H3O+
Cl-
H3O+
CH3COOH
CH3COO-
结论:
HCl分子在水中完全电离
醋酸分子在水中部分电离,且非常微弱
为何相同浓度的盐酸和醋酸氢离子与等体积镁条反应有如此差异?
——依据电解质电离程度的差异对电解质进行分类
强电解质和弱电解质
分类依据
强电解质:全部电离的电解质。
溶液中只有阴阳离子,没有溶质分子。
弱电解质:不完全电离的电解质。
溶液中既有阴阳离子,又有未电离的溶质分子。
完全电离,只有离子,无分子,不可逆,电离方程式用“=”连接
不完全电离,既有分子又有离子,可逆,存在电离平衡,电离方程式用“ ”连接
(1)常见的强电解质
强酸:HCl、H2SO4、HNO3、HBr、HI、HClO4
强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2
大部分盐(包括难溶盐)NaCl、NH4Cl、Fe(NO3)3、BaSO4等
活泼金属氧化物:Na2O、 CaO等
弱酸HF、HClO、H2S、H2SO3、H3PO4、H2CO3、 CH3COOH等
弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等
少数盐:醋酸铅、HgCl2等
H2O是极弱电解质。
(2)常见的弱电解质
电解质的强弱与其溶解性有何关系?
强电解质
弱电解质
能否根据溶液导电能力判断电解质的相对强弱?
无关
不能
难溶:BaSO4 Fe(OH)3
易溶:HCl CH3COOH
结论:电解质的强弱与其溶解性和导电能力无必然联系。
电解质的强弱与溶液的导电性:
溶液的导电性的影响因素:
①水溶液中自由移动的离子总浓度
②离子总浓度相同时,看离子所带的电荷数
③与温度也有关
电离方程式的书写
强电解质
NaCl Na+ + Cl-
NaOH Na+ + OH-
强电解质在溶液中完全电离,用“ ”
电解质溶于水或熔融状态下,解离成自由移动的离子的式子
原子团不能拆
H2SO4 = 2H+ + SO42-
BaSO4
①虽难溶,但溶解的部分完全电离
②BaSO4是离子化合物,熔化时完全电离
= Ba2+ + SO42-
NaHCO3
NaHSO4
NaHCO3== Na+ + HCO3-
水
受热易分解
弱酸酸式酸根离子---不拆
NaHSO4===
水
NaHSO4===
熔化
Na+ + HSO4-
Na+ + H + + SO42-
强酸酸式酸根离子水溶液中---拆
Na2O
(熔化时完全电离)
= 2Na+ + O2-
注意:共价化合物液态时不电离,全部为分子状态
4.活波金属氧化物
注意:
弱电解质
部分电离,符号选用“ ”
(主要)
(次要、微弱)
一定不可以合并
H2CO3
H++HCO32-
H++HCO32-
CH3COOH :____________________________
NH3·H2O :______________________________
Fe(OH)3 :_______________________________
CH3COOH CH3COO + H+
NH3·H2O NH + OH
+
4
Fe(OH)3
Fe3+ + 3OH-
多元弱酸分步电离,以第一步为主
强电解质和弱电解质
强电解质:“ ”、弱电解质:“ ”
多元弱酸分步电离,分步书写
多元弱碱分步电离,一步书写
强等号、弱可逆、多元弱酸分步写,多元弱碱写一步
①先判断强、弱电解质,决定符号。
③弱酸的酸式酸根阴离子只微弱电离,要保留;强酸的酸式酸根在水中完全电离,要拆开。
②多元弱酸分步电离,分步写;多元弱碱分步电离,写一步。
电离方程式的书写要点
小结:
强电解质 弱电解质
相同点 不同点 化合物类型
物质类别
溶质微粒
电离程度
表示方法
实例
电离方程式
都是电解质,在水溶液中都能电离,与溶解度无关
离子化合物,共价化合物
共价化合物
强酸、强碱、大多数盐
弱酸、弱碱、水
离子
分子(多)、离子
完全电离(不可逆)
部分电离(可逆)
电离方程式用“ = ”
电离方程式用“ ”
强酸、强碱、盐
弱酸、弱碱、水
NaCl=Na++Cl-
HF H++F-
谢谢大家
第一节 电离平衡
第1课时
第三章
水溶液中的离子反应与平衡
1. 通过预习回顾能复述电解质、非电解质的概念,并以此对常见物质进行分类
学习目标
2.通过实验探究、合作交流归纳出强弱电解质的概念
3.会书写常见电解质的电离方程式
知识回顾
1.铜丝、盐酸能导电,它们是电解质还是非电解质?
2.BaSO4、AgCl、CaCO3均难溶于水,它们是电解质吗?
既不是电解质也不是非电解质
是
难溶盐在熔融状态时可导电
什么叫电解质?
什么叫非电解质?
现有下列物质:
①石墨 ②BaSO4 ③稀盐酸 ④CO2 ⑤CaO ⑥NaCl ⑦NH3·H2O
⑧熔融KCl ⑨乙醇 ⑩ CH3COOH ⑾ NaCl溶液
以上指定物质中,属于电解质的是__________________________
属于非电解质的是_________________________________________
②⑤⑥⑦⑧⑩
④⑨
(酸、碱 、盐,活泼金属氧化物、H2O)
(一些非金属氧化物、大多数有机物及NH3)
电解质的导电
条件:
本质 :
自由离子的定向移动
离子浓度、离子所带电荷
导电能力:
溶于水或熔融状态
疑点突破:
电解质、非电解质的前提必须为化合物,故单质、混合物既不是电解质也不是非电解质
电解质必须是化合物本身能电离出离子,否则不属于电解质。例:NH3、SO2、CO2 。
电解质的导电:导电的条件是溶于水或熔融状态
导电的本质是自由离子的定向移动
导电能力与离子浓度和离子所带电荷有关
盐酸和醋酸是生活中经常用到的酸。盐酸常用于卫生洁具的清洁。
有效成分是盐酸
醋酸的腐蚀性比盐酸的小,比较安全,为什么不用醋酸代替盐酸呢?
有哪些方法能判断醋酸和盐酸的酸性不同?
取相同体积,0.1mol/L的盐酸和醋酸,比较它们pH的大小,试验其导电能力,并分别与等量镁条反应,观察、比较并记录现象。
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
pH
导电能力
与镁条反应
探究实验3-1, 课本P56
探究一:常温时,取相同体积、 0.1 mol·L-1 盐酸与醋酸,测定其pH值大小
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
PH
1
3
资料卡片:PH= - lgC(H+)
PH=1 C(H+) =0.1mol/L
PH=2.8 C(H+) =0.00168mol/L
0.1 mol/L 盐酸 pH=1
c(H+)=0.1 mol/L
0.1 mol/L 醋酸 pH=3
c(H+)=0.001 mol/L
pH不同,说明: 盐酸和醋酸中的H+浓度不同,
即 HCl和CH3COOH的电离程度不同。
探究二:用水质检测笔检测0.1 mol/L 盐酸、0.1 mol/L 醋酸、蒸馏水的导电性。
(已知:相同温度下,水质检测笔读数越大,溶液的导电性越强)
数据分析:
读数:7180
读数:187
读数:2
导电性:
0.1 mol/L 盐酸 > 0.1 mol/L 醋酸
探究三:观察等体积、等浓度0.1 mol·L-1 的盐酸、醋酸溶液和相同大小镁条反应的实验,进行预测,观察现象并尝试解释原因
镁条
1 mol·L-1 HCl
1 mol·L-1 CH3COOH
实验分析
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
pH
导电能力
实验现象
化学方 程式
Mg + 2HCl
MgCl2 + H2↑
Mg + 2CH3COOH
(CH3COO)2Mg + H2↑
1.0
3.0
镁条表面产生气泡较快
镁条表面产生气泡较慢
导电能力强
导电能力弱
数据分析
图1 HCl在水中的电离示意图
图2 CH3COOH在水中的电离示意图
H3O+
Cl-
H3O+
CH3COOH
CH3COO-
结论:
HCl分子在水中完全电离
醋酸分子在水中部分电离,且非常微弱
为何相同浓度的盐酸和醋酸氢离子与等体积镁条反应有如此差异?
——依据电解质电离程度的差异对电解质进行分类
强电解质和弱电解质
分类依据
强电解质:全部电离的电解质。
溶液中只有阴阳离子,没有溶质分子。
弱电解质:不完全电离的电解质。
溶液中既有阴阳离子,又有未电离的溶质分子。
完全电离,只有离子,无分子,不可逆,电离方程式用“=”连接
不完全电离,既有分子又有离子,可逆,存在电离平衡,电离方程式用“ ”连接
(1)常见的强电解质
强酸:HCl、H2SO4、HNO3、HBr、HI、HClO4
强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2
大部分盐(包括难溶盐)NaCl、NH4Cl、Fe(NO3)3、BaSO4等
活泼金属氧化物:Na2O、 CaO等
弱酸HF、HClO、H2S、H2SO3、H3PO4、H2CO3、 CH3COOH等
弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等
少数盐:醋酸铅、HgCl2等
H2O是极弱电解质。
(2)常见的弱电解质
电解质的强弱与其溶解性有何关系?
强电解质
弱电解质
能否根据溶液导电能力判断电解质的相对强弱?
无关
不能
难溶:BaSO4 Fe(OH)3
易溶:HCl CH3COOH
结论:电解质的强弱与其溶解性和导电能力无必然联系。
电解质的强弱与溶液的导电性:
溶液的导电性的影响因素:
①水溶液中自由移动的离子总浓度
②离子总浓度相同时,看离子所带的电荷数
③与温度也有关
电离方程式的书写
强电解质
NaCl Na+ + Cl-
NaOH Na+ + OH-
强电解质在溶液中完全电离,用“ ”
电解质溶于水或熔融状态下,解离成自由移动的离子的式子
原子团不能拆
H2SO4 = 2H+ + SO42-
BaSO4
①虽难溶,但溶解的部分完全电离
②BaSO4是离子化合物,熔化时完全电离
= Ba2+ + SO42-
NaHCO3
NaHSO4
NaHCO3== Na+ + HCO3-
水
受热易分解
弱酸酸式酸根离子---不拆
NaHSO4===
水
NaHSO4===
熔化
Na+ + HSO4-
Na+ + H + + SO42-
强酸酸式酸根离子水溶液中---拆
Na2O
(熔化时完全电离)
= 2Na+ + O2-
注意:共价化合物液态时不电离,全部为分子状态
4.活波金属氧化物
注意:
弱电解质
部分电离,符号选用“ ”
(主要)
(次要、微弱)
一定不可以合并
H2CO3
H++HCO32-
H++HCO32-
CH3COOH :____________________________
NH3·H2O :______________________________
Fe(OH)3 :_______________________________
CH3COOH CH3COO + H+
NH3·H2O NH + OH
+
4
Fe(OH)3
Fe3+ + 3OH-
多元弱酸分步电离,以第一步为主
强电解质和弱电解质
强电解质:“ ”、弱电解质:“ ”
多元弱酸分步电离,分步书写
多元弱碱分步电离,一步书写
强等号、弱可逆、多元弱酸分步写,多元弱碱写一步
①先判断强、弱电解质,决定符号。
③弱酸的酸式酸根阴离子只微弱电离,要保留;强酸的酸式酸根在水中完全电离,要拆开。
②多元弱酸分步电离,分步写;多元弱碱分步电离,写一步。
电离方程式的书写要点
小结:
强电解质 弱电解质
相同点 不同点 化合物类型
物质类别
溶质微粒
电离程度
表示方法
实例
电离方程式
都是电解质,在水溶液中都能电离,与溶解度无关
离子化合物,共价化合物
共价化合物
强酸、强碱、大多数盐
弱酸、弱碱、水
离子
分子(多)、离子
完全电离(不可逆)
部分电离(可逆)
电离方程式用“ = ”
电离方程式用“ ”
强酸、强碱、盐
弱酸、弱碱、水
NaCl=Na++Cl-
HF H++F-
谢谢大家
