化学人教版(2019)选择性必修1 3.4.1难溶电解质的沉淀溶解平衡(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 3.4.1难溶电解质的沉淀溶解平衡(共18张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-25 08:51:04 | ||
图片预览




文档简介
(共18张PPT)
第1课时 难溶电解质的沉淀溶解平衡
第四节 沉淀溶解平衡
第三章 水溶液中的离子反应与平衡
1.溶解性
2.固体物质的溶解度
(1) 在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
(2) 注意
①条件:一定温度 ②标准:100 g溶剂
③状态:饱和状态 ④单位:g
⑤在一定条件下某物质的溶解量一般是有限的
一、溶解度
一种物质溶解在另一种物质中的能力
溶解度(S)与溶解性的关系
化学式 溶解度/g 化学式 溶解度/g
AgNO3 211 Ba(OH)2 3.89
AgCl 1.5×10-4 Ag2SO4 0.786
AgBr 8.4×10-6 Ca(OH)2 0.160
Ag2S 1.3×10-16 CaSO4 0.202
一、溶解度
S
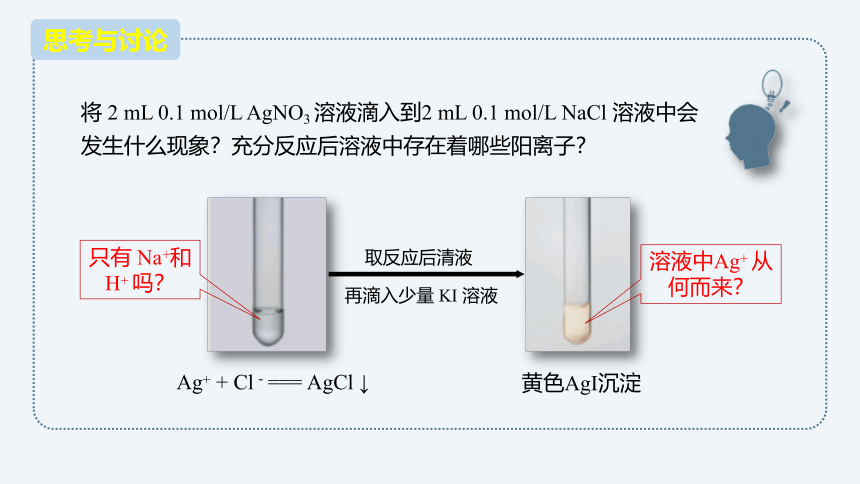
将 2 mL 0.1 mol/L AgNO3 溶液滴入到2 mL 0.1 mol/L NaCl 溶液中会发生什么现象?充分反应后溶液中存在着哪些阳离子?
Ag+ + Cl-=== AgCl ↓
只有 Na+和 H+ 吗?
溶液中Ag+ 从何而来?
再滴入少量 KI 溶液
取反应后清液
黄色AgI沉淀
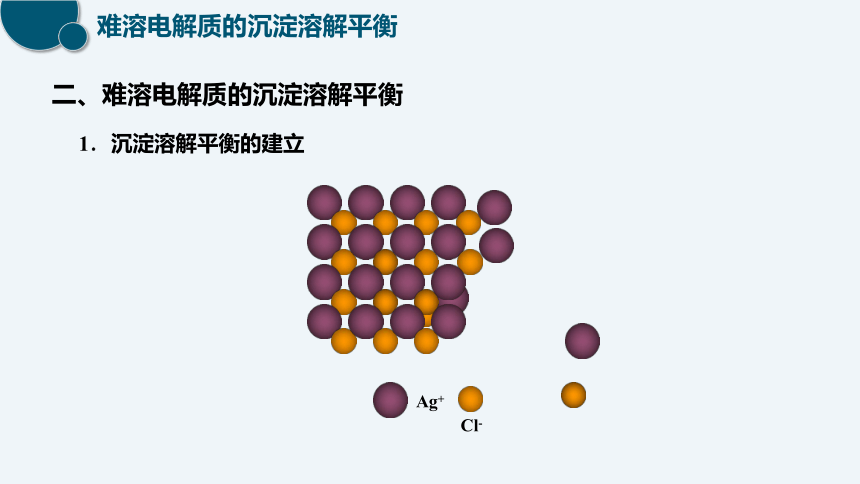
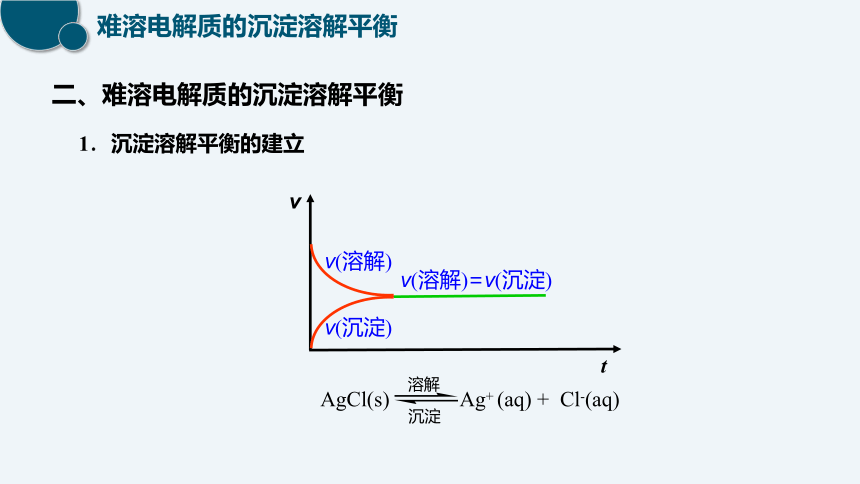
1.沉淀溶解平衡的建立
Ag+
Cl-
二、难溶电解质的沉淀溶解平衡
v(溶解)=v(沉淀)
v
v(溶解)
v(沉淀)
t
AgCl(s) Ag+ (aq) + Cl-(aq)
沉淀
溶解
1.沉淀溶解平衡的建立
二、难溶电解质的沉淀溶解平衡
动:动态平衡,溶解和沉淀仍在进行
定:溶液中各离子浓度保持不变
变:当条件改变时,溶解平衡将发生移动
逆:溶解和沉淀互为可逆过程
等:
v(溶解)=v(沉淀)
沉淀溶解平衡和化学平衡、电离平衡一样,符合平衡的基本特征、满足平衡的变化基本规律
逆等动定变
2.沉淀溶解平衡的特征
二、难溶电解质的沉淀溶解平衡
1.定义
溶度积
符号:Ksp
难溶电解质的沉淀溶解平衡的平衡常数,称为溶度积常数,简称溶度积
2.表达式
MmNn (s) mMn+(aq) + nNm- (aq)
AgCl (s) Ag+(aq) + Cl- (aq)
Ksp=
Fe(OH)3(s) Fe3+(aq)+3OH-(aq)
Ksp=
类型 化学式 溶度积Ksp 溶解度/g
AB AgBr 5.0×10-13 8.4×10-6
AB AgCl 1.8×10-10 1.5×10-4
A2B Ag2CrO4 1.1×10-12 2.2×10-3
A2B Ag2S 6.3×10-50 1.3×10-16
结论:相同类型的难溶电解质的Ksp越小,溶解度越小
一定条件下:
一定的温度下,相同类型的难溶电解质的Ksp越小,溶解度越小
Ksp反映了难溶电解质在水中的溶解能力
Ksp(AgCl)=1.8×10-10
Ksp(AgBr)=5.0×10-13
S(AgCl)>S(AgBr)
Ksp(AgCl)=1.8×10-10
Ksp(Ag2CrO4)=1.1×10-12
不能直接比较S(AgCl)与 S(Ag2CrO4)大小
3.意义
溶度积
溶度积Ksp值的大小只与难溶电解质本身的性质和温度有关:
4.影响因素
T↑,Ksp↑
少数难溶电解质如Ca(OH)2的溶解是放热过程,升高温度,平衡向生成沉淀的方向移动,Ksp减小。
溶度积
当Q=Ksp:饱和溶液 ,沉淀与溶解处于平衡状态
Q=cm(An+)·cn(Bm-)
5.溶度积Ksp与离子积Q的关系——溶度积规则
AmBn(s) mAn+(aq)+nBm-(aq)
当Q>Ksp:过饱和溶液 ,溶液中有沉淀析出
当QQ与Ksp
溶度积
(1)内因:难溶电解质本身的性质
3.影响沉淀溶解平衡的因素
二、难溶电解质的沉淀溶解平衡
(2)外界条件对溶解平衡的影响
①温度升高,大多数溶解平衡向溶解的方向移动。
但如Ca(OH)2,温度越高,溶解度越小。
②加水稀释,浓度减小,溶解平衡向溶解的方向移动。
③加入与难溶电解质构成粒子相同的物质,溶解平衡向生成沉淀的方向移动,称同离子效应。
④加入与难溶电解质溶解所得的离子反应的物质,溶解平衡向溶解的方向移动。
3.影响沉淀溶解平衡的因素
二、难溶电解质的沉淀溶解平衡
在AgCl饱和溶液中分别改变下列条件,将如何变化?
改变条件 平衡移动方向 c(Ag+ ) c(Cl-)
升 温
加 水
加AgCl(s)
加NaCl(s)
加AgNO3(s)
→ ↑ ↑
→ 不变 不变
不移动 不变 不变
← ↓ ↑
← ↑ ↓
(2021·江苏昆山·高二月考)不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量。下列说法正确的是
A.T1>T2
B.加入BaCl2固体,可使溶液由a点变到c点
C.c点时,在T1、T2两个温度下均没有固体析出
D.图中c点对应的是T1时硫酸钡的过饱和溶液
D
题型四:沉淀溶解平衡图像
(2021·全国·高三专题练习)溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
利用上述表格数据,计算Ni(OH)2的Ksp=___________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L-1,则“调pH”应控制的pH范围是___________。
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时(c=0.01 mol·L-1)的pH 7.2 3.7 2.2 7.5
沉淀完全时(c=1.0×10-5 mol·L-1)的pH 8.7 4.7 3.2 9.0
题型三:溶度积 Ksp
【答案】0.01×(107.2-14)2[或10-5×(108.7-14)2] 3.2~6.2
知识整合
沉淀溶解平衡
溶度积常数
建
立
表达式
特
征
影响因素
定
义
影响因素
Ksp的意义
Ksp的应用
第1课时 难溶电解质的沉淀溶解平衡
第四节 沉淀溶解平衡
第三章 水溶液中的离子反应与平衡
1.溶解性
2.固体物质的溶解度
(1) 在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
(2) 注意
①条件:一定温度 ②标准:100 g溶剂
③状态:饱和状态 ④单位:g
⑤在一定条件下某物质的溶解量一般是有限的
一、溶解度
一种物质溶解在另一种物质中的能力
溶解度(S)与溶解性的关系
化学式 溶解度/g 化学式 溶解度/g
AgNO3 211 Ba(OH)2 3.89
AgCl 1.5×10-4 Ag2SO4 0.786
AgBr 8.4×10-6 Ca(OH)2 0.160
Ag2S 1.3×10-16 CaSO4 0.202
一、溶解度
S
将 2 mL 0.1 mol/L AgNO3 溶液滴入到2 mL 0.1 mol/L NaCl 溶液中会发生什么现象?充分反应后溶液中存在着哪些阳离子?
Ag+ + Cl-=== AgCl ↓
只有 Na+和 H+ 吗?
溶液中Ag+ 从何而来?
再滴入少量 KI 溶液
取反应后清液
黄色AgI沉淀
1.沉淀溶解平衡的建立
Ag+
Cl-
二、难溶电解质的沉淀溶解平衡
v(溶解)=v(沉淀)
v
v(溶解)
v(沉淀)
t
AgCl(s) Ag+ (aq) + Cl-(aq)
沉淀
溶解
1.沉淀溶解平衡的建立
二、难溶电解质的沉淀溶解平衡
动:动态平衡,溶解和沉淀仍在进行
定:溶液中各离子浓度保持不变
变:当条件改变时,溶解平衡将发生移动
逆:溶解和沉淀互为可逆过程
等:
v(溶解)=v(沉淀)
沉淀溶解平衡和化学平衡、电离平衡一样,符合平衡的基本特征、满足平衡的变化基本规律
逆等动定变
2.沉淀溶解平衡的特征
二、难溶电解质的沉淀溶解平衡
1.定义
溶度积
符号:Ksp
难溶电解质的沉淀溶解平衡的平衡常数,称为溶度积常数,简称溶度积
2.表达式
MmNn (s) mMn+(aq) + nNm- (aq)
AgCl (s) Ag+(aq) + Cl- (aq)
Ksp=
Fe(OH)3(s) Fe3+(aq)+3OH-(aq)
Ksp=
类型 化学式 溶度积Ksp 溶解度/g
AB AgBr 5.0×10-13 8.4×10-6
AB AgCl 1.8×10-10 1.5×10-4
A2B Ag2CrO4 1.1×10-12 2.2×10-3
A2B Ag2S 6.3×10-50 1.3×10-16
结论:相同类型的难溶电解质的Ksp越小,溶解度越小
一定条件下:
一定的温度下,相同类型的难溶电解质的Ksp越小,溶解度越小
Ksp反映了难溶电解质在水中的溶解能力
Ksp(AgCl)=1.8×10-10
Ksp(AgBr)=5.0×10-13
S(AgCl)>S(AgBr)
Ksp(AgCl)=1.8×10-10
Ksp(Ag2CrO4)=1.1×10-12
不能直接比较S(AgCl)与 S(Ag2CrO4)大小
3.意义
溶度积
溶度积Ksp值的大小只与难溶电解质本身的性质和温度有关:
4.影响因素
T↑,Ksp↑
少数难溶电解质如Ca(OH)2的溶解是放热过程,升高温度,平衡向生成沉淀的方向移动,Ksp减小。
溶度积
当Q=Ksp:饱和溶液 ,沉淀与溶解处于平衡状态
Q=cm(An+)·cn(Bm-)
5.溶度积Ksp与离子积Q的关系——溶度积规则
AmBn(s) mAn+(aq)+nBm-(aq)
当Q>Ksp:过饱和溶液 ,溶液中有沉淀析出
当Q
溶度积
(1)内因:难溶电解质本身的性质
3.影响沉淀溶解平衡的因素
二、难溶电解质的沉淀溶解平衡
(2)外界条件对溶解平衡的影响
①温度升高,大多数溶解平衡向溶解的方向移动。
但如Ca(OH)2,温度越高,溶解度越小。
②加水稀释,浓度减小,溶解平衡向溶解的方向移动。
③加入与难溶电解质构成粒子相同的物质,溶解平衡向生成沉淀的方向移动,称同离子效应。
④加入与难溶电解质溶解所得的离子反应的物质,溶解平衡向溶解的方向移动。
3.影响沉淀溶解平衡的因素
二、难溶电解质的沉淀溶解平衡
在AgCl饱和溶液中分别改变下列条件,将如何变化?
改变条件 平衡移动方向 c(Ag+ ) c(Cl-)
升 温
加 水
加AgCl(s)
加NaCl(s)
加AgNO3(s)
→ ↑ ↑
→ 不变 不变
不移动 不变 不变
← ↓ ↑
← ↑ ↓
(2021·江苏昆山·高二月考)不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量。下列说法正确的是
A.T1>T2
B.加入BaCl2固体,可使溶液由a点变到c点
C.c点时,在T1、T2两个温度下均没有固体析出
D.图中c点对应的是T1时硫酸钡的过饱和溶液
D
题型四:沉淀溶解平衡图像
(2021·全国·高三专题练习)溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
利用上述表格数据,计算Ni(OH)2的Ksp=___________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L-1,则“调pH”应控制的pH范围是___________。
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时(c=0.01 mol·L-1)的pH 7.2 3.7 2.2 7.5
沉淀完全时(c=1.0×10-5 mol·L-1)的pH 8.7 4.7 3.2 9.0
题型三:溶度积 Ksp
【答案】0.01×(107.2-14)2[或10-5×(108.7-14)2] 3.2~6.2
知识整合
沉淀溶解平衡
溶度积常数
建
立
表达式
特
征
影响因素
定
义
影响因素
Ksp的意义
Ksp的应用
