3.4.1难溶电解质溶解平衡 课件(共25张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.4.1难溶电解质溶解平衡 课件(共25张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-25 10:01:13 | ||
图片预览








文档简介
(共25张PPT)
难溶电解质的溶解平衡
人教版2019
第三章 水溶液中的离子平衡
1 . 举例说明学过的“平衡”,它们有哪些特征?
化学平衡 2NO2 N2O4
电离平衡 H2O H+ +OH-
Kw = c(H+ ).c(OH-)
K
水解平衡 FeCl3+3H2O Fe(OH)3+3HCl
2.特征:“逆、等、动、定、变”
3.平衡移动原理——勒夏特列原理
如果改变影响平衡的一个条件(如浓度、温度、
或压强等),平衡就向能够减弱这种改变的方
向移动。
复习
固体物质的溶解度
定义:在一定温度下,某固态物质在100克溶剂
里达到饱和状态时所溶解的质量。叫做这
种物质在这种溶剂里的溶解度。
注意:
条件:一定温度 标准:100克溶剂
状态:饱和状态 单位:克
任何物质的溶解是有条件的,在一定的条 件下某物质的溶解量一般是有限的。
在初中化学中,我们曾根据物质溶解度的大小,将物质分为易溶物、可溶物、微溶物和难溶物。例如,AgCl、BaSO4、Fe(OH)3等都属于难溶物。根据表格信息回答下列问题。
【思考与讨论】
(1)通常我们所说的难溶物在水中是否完全不能溶解?
(2)生成AgCl沉淀的离子反应完成后,溶液中是否还有Ag+和Cl-?
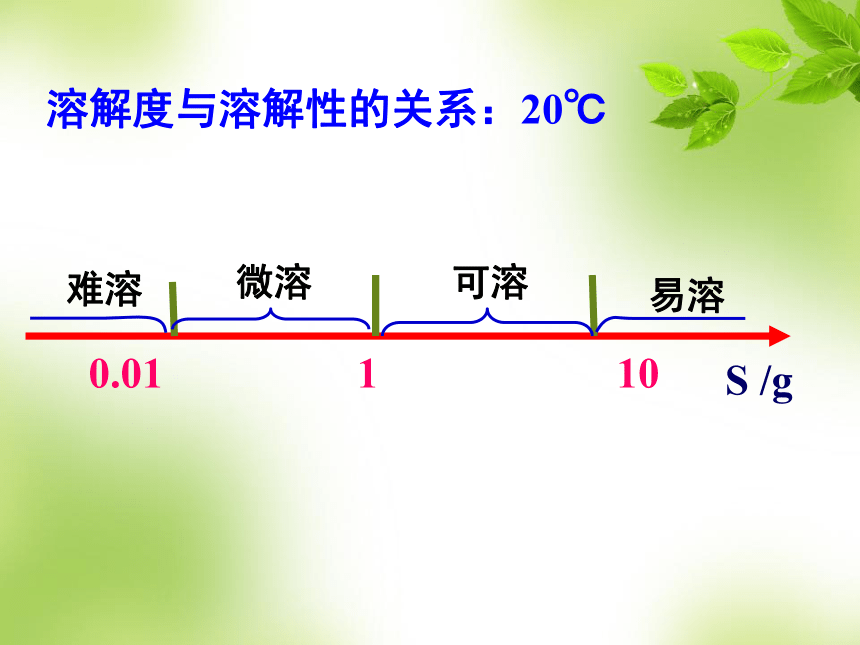
溶解度与溶解性的关系:20℃
10
易溶
可溶
1
微溶
0.01
难溶
S /g
思考:得到什么启示?
不规则 规则
v(溶解) = v(结晶)
悬挂在饱和CuSO4溶液中
溶解平衡:
在某饱和溶液中,溶质溶解速率等于结晶速率,溶液中溶质不再变化的状态。
固体质量没有改变
一昼夜后
Ag+和Cl-的反应能进行到底吗?
【实验】向盛有2 mL 0.1mol/LAgNO3溶液的试管中加入2 mL 0.1 mol/L NaCl溶液。
1、问题讨论:
有黄色沉淀生成,说明溶液中依然有Ag+、 Cl-存在,即Ag+和Cl-的反应不能进行到底。
(1)、恰好反应没有?
(2)、溶液中还含有Ag+和Cl-?
【继续试验】取上层清液,滴加KI溶液,有何现象?说明了什么?
资料:化学上通常认为残留在溶液中的离子浓度小于10-5 mol/L时,沉淀达到完全。
沉淀是难溶物,但不是绝对不溶,只不过溶解 度很小,难溶物在水中存在溶解平衡。
结论:在电解质的溶液中,不管是易溶的,微溶的,难溶的电解质都存在着溶解平衡。
(1)生成沉淀的离子反应能发生的原因
生成物的溶解度很小
2、难溶电解质的溶解平衡
化学上通常认为残留在溶液中的离子浓度小于10-5mol/L时,沉淀达到完全。
(2)AgCl溶解平衡的建立
当v(溶解)= v(沉淀)时,
得到饱和AgCl溶液,建立溶解平衡
水合Ag+
水合Cl-
溶解
AgCl(s) Ag+(aq) + Cl-(aq)
沉淀
注意写法
在一定条件下,难溶电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。(也叫沉淀溶解平衡)
(4)溶解平衡的特征:
逆、等、动、定、变
(3)沉淀溶解平衡的概念:
平衡的共性
几点说明:
溶解平衡的存在,决定了生成难溶电解质的反应不能进行到底。
习惯上将生成难溶电解质的反应,认为反应完全了,因对于常量的反应来说,0.01 g是很小的。当溶液中残留的离子浓度< 1 ×10-5 mol/L时,沉淀就达到完全。
难溶电解质的溶解度尽管很小,但不会等于0。如Ag2S的溶解度为1.3×10-16 g。
溶解平衡与化学平衡一样,受外界条件的影响而发生移动。
(5)影响难溶电解质溶解平衡的因素:
a、绝对不溶的电解质是没有的。
b、同是难溶电解质,溶解度差别也很大。
c、易溶电解质做溶质时只要是饱和溶液也可 存在溶解平衡。
①内因:电解质本身的性质
②外因:
a、浓度:加水,平衡向溶解方向移动。
b、温度:升温,多数平衡向溶解方向移动。
特例:
Ca(OH)2
特例: 随温度升高反而降低:Ca(OH)2
c、同离子效应——向平衡体系中加入难溶物相应
的离子,平衡向 生成沉淀的方向移动
表达式
难溶电解质用“s”标明状态,溶液中的离子用“ ”标明状态,并用“ ”连接。
aq
当堂练习
请写出BaSO4、CaCO3、Ag2S的沉淀溶解平衡表达式。
2. 溶度积常数
(1)难溶电解质的沉淀溶解平衡也存在平衡常数,称为难溶电解质的溶度积常数,简称溶度积。
(2)难溶电解质的溶度积常数用Ksp表示。
通式:
AnBm(s) nAm+(aq) + mBn-(aq)
则Ksp, AnBm= C(Am+)n . C(Bn-)m
练习:BaSO4、Ag2CrO4、Mg(OH)2、Fe(OH)3的溶度积
AmBn (S)
mAn+(aq)+nBm-(aq)
Ksp ( AmBn ) =
C( An+)m · C(Bm-)n
注意:
当难溶物确定时,
Ksp只与温度有关,与浓度无关。
沉淀溶解平衡常数——溶度积 Ksp
例3: 在1L含1.0×10-3mol L-1 的SO42-溶液中,注入0.01mol BaCl2溶液(假设溶液体积不变)能否有效除去SO42- 已知:Ksp(BaSO4)= 1.1×10-10 mol2 L-2
解:c(Ba2+)=0.01mol/L,c(SO42-)=0.001mol/L,生成BaSO4沉
淀后,Ba2+过量,剩余的即[Ba2+]=0.01-0.001=0.009mol/L.
[SO42-]=Ksp/[Ba2+]= 1.1×10-10/9.0×10-3=1.2×10-8(mol/L)
因为,剩余的即[SO42-]=1.2×10-8mol/L<1.0×10-5mol/L
所以, SO42-已沉淀完全,即有效除去了SO42-。
注意:当剩余离子即平衡离子浓度﹤10-5mol/L时,认为离子已沉淀完全或离子已有效除去。
例4:若某溶液中Fe3+和Mg2+的浓度均为0.10 mol/L,
使Fe3+完全沉淀而使Mg2+不沉淀的pH条件是什么
( Ksp (Fe(OH)3)= 4×10-39Ksp (Mg(OH)2)= 1.8×10-11)
pOH = 10.8 , pH = 3.2
解: Fe(OH)3 Fe3+ + 3OH-
Fe3+ 沉淀完全时的[OH-]为:
Mg2+开始沉淀的pH值为:
pOH = 4.9, pH =9.1
因此, 只要控制pH值在3.2 ~ 9.1之间即可使Fe3+定量沉淀而使Mg2+不沉淀。
Ksp (Mg(OH)2)= 1.8×10-11
(3)溶度积与溶解度之间的关系
例1、已知Ksp,AgCl= 1.56 10-10, Ksp,Ag2CrO4= 9.0 10-12,试求AgCl和Ag2CrO4的溶解度(用g/L表示)
(2)设Ag2CrO4的浓度为S2(mol/dm3),则:
Ag2CrO4(s) 2Ag+(aq) + CrO42-(aq)
平 2S2 S2
在水中:AgCl溶解度小于Ag2CrO4的溶解度
(1)
= 9.0 10-12
332g/mol
例2:已知25℃时,AgCl的溶解度是1.92×10-3g/L,求它的溶度积。已知AgCl的摩尔质量为143.5g/mol。
解 :依题意可知25℃时AgCl饱和溶液中
c(Ag+)=c(Cl-)=0.00192/143.5mol/L
=1.34×10-5mol/L
则KSP,AgCl=c(Ag+).c(Cl-)
=(1.34×10-5)2
=1.8×10-10
(4)溶度积规则
①离子积
AnBm(s) nAm+(aq) + mBn-(aq)
(1)Q >Ksp 时,沉淀从溶液中析出(溶液过饱和),
体系中不断析出沉淀,直至达到平衡(此时Q =Ksp )
(2) Q =Ksp 时,沉淀与饱和溶液的平衡
(3)Q则沉淀会溶解直至达到平衡(此时Q =Ksp )
Q = C(Am+)n·C(Bn-)m
Q 称为离子积,其表达式中离子浓度是任意的,为此瞬间溶液中的实际浓度,所以其数值不定,但对一难溶电解质,在一定温度下,Ksp 为一定值。
②溶度积规则
例1:在100mL 0.01mol/LKCl 溶液中,
加入 1mL 0.01mol/L AgNO3溶液,下列
说法正确的是(AgCl Ksp=1.8×10-10) ( )
A.有AgCl沉淀析出 B.无AgCl沉淀
C.无法确定 D.有沉淀但不是AgCl
A
c(Cl-)=(0.01×0.1) ÷0.101=9.9×10-3mol/L
c(Ag+)=(0.01×0.001) ÷0.101=9.9×10-5mol/L
QC =9.9×10-3×9.9×10-5=9.8×10-7>KSP
例2. 现将足量的AgCl分别加入下列物质中, AgCl在下列溶液中的溶解度由大到小的排列顺序是 ( )
① 20 ml 0.01mol·L-1KCl溶液
② 30 ml 0.02mol·L-1CaCl2溶液
③ 40 ml 0.03mol·L-1HCl溶液
④ 10 ml 蒸馏水
⑤ 50 ml 0.05mol·L-1AgNO3溶液
A.① > ② > ③ > ④ > ⑤
B.④ > ① > ③ > ② > ⑤
C.⑤ > ④ > ② > ① > ③
D.④ > ③ > ⑤ > ② > ①
B
解析:由于[Ag+] · [Cl-]=KSP , Ag+或Cl-的浓度越大,越能抑制AgCl的溶解, AgCl的溶解度就越小。
①[Cl-]=0.01mol·L-1 ②[Cl-]=0.04mol·L-1
③[Cl-]=0.03mol·L-1 ④[Cl-] =0mol·L-1
⑤[Ag+] =0.05mol·L-1
Ag+或Cl-浓度由小到大的顺序为④ < ① < ③ < ② < ⑤ ,故
AgCl的溶解度由 大到小的顺序为④ > ① > ③ > ② > ⑤ 。
答案:B
难溶电解质的溶解平衡
人教版2019
第三章 水溶液中的离子平衡
1 . 举例说明学过的“平衡”,它们有哪些特征?
化学平衡 2NO2 N2O4
电离平衡 H2O H+ +OH-
Kw = c(H+ ).c(OH-)
K
水解平衡 FeCl3+3H2O Fe(OH)3+3HCl
2.特征:“逆、等、动、定、变”
3.平衡移动原理——勒夏特列原理
如果改变影响平衡的一个条件(如浓度、温度、
或压强等),平衡就向能够减弱这种改变的方
向移动。
复习
固体物质的溶解度
定义:在一定温度下,某固态物质在100克溶剂
里达到饱和状态时所溶解的质量。叫做这
种物质在这种溶剂里的溶解度。
注意:
条件:一定温度 标准:100克溶剂
状态:饱和状态 单位:克
任何物质的溶解是有条件的,在一定的条 件下某物质的溶解量一般是有限的。
在初中化学中,我们曾根据物质溶解度的大小,将物质分为易溶物、可溶物、微溶物和难溶物。例如,AgCl、BaSO4、Fe(OH)3等都属于难溶物。根据表格信息回答下列问题。
【思考与讨论】
(1)通常我们所说的难溶物在水中是否完全不能溶解?
(2)生成AgCl沉淀的离子反应完成后,溶液中是否还有Ag+和Cl-?
溶解度与溶解性的关系:20℃
10
易溶
可溶
1
微溶
0.01
难溶
S /g
思考:得到什么启示?
不规则 规则
v(溶解) = v(结晶)
悬挂在饱和CuSO4溶液中
溶解平衡:
在某饱和溶液中,溶质溶解速率等于结晶速率,溶液中溶质不再变化的状态。
固体质量没有改变
一昼夜后
Ag+和Cl-的反应能进行到底吗?
【实验】向盛有2 mL 0.1mol/LAgNO3溶液的试管中加入2 mL 0.1 mol/L NaCl溶液。
1、问题讨论:
有黄色沉淀生成,说明溶液中依然有Ag+、 Cl-存在,即Ag+和Cl-的反应不能进行到底。
(1)、恰好反应没有?
(2)、溶液中还含有Ag+和Cl-?
【继续试验】取上层清液,滴加KI溶液,有何现象?说明了什么?
资料:化学上通常认为残留在溶液中的离子浓度小于10-5 mol/L时,沉淀达到完全。
沉淀是难溶物,但不是绝对不溶,只不过溶解 度很小,难溶物在水中存在溶解平衡。
结论:在电解质的溶液中,不管是易溶的,微溶的,难溶的电解质都存在着溶解平衡。
(1)生成沉淀的离子反应能发生的原因
生成物的溶解度很小
2、难溶电解质的溶解平衡
化学上通常认为残留在溶液中的离子浓度小于10-5mol/L时,沉淀达到完全。
(2)AgCl溶解平衡的建立
当v(溶解)= v(沉淀)时,
得到饱和AgCl溶液,建立溶解平衡
水合Ag+
水合Cl-
溶解
AgCl(s) Ag+(aq) + Cl-(aq)
沉淀
注意写法
在一定条件下,难溶电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。(也叫沉淀溶解平衡)
(4)溶解平衡的特征:
逆、等、动、定、变
(3)沉淀溶解平衡的概念:
平衡的共性
几点说明:
溶解平衡的存在,决定了生成难溶电解质的反应不能进行到底。
习惯上将生成难溶电解质的反应,认为反应完全了,因对于常量的反应来说,0.01 g是很小的。当溶液中残留的离子浓度< 1 ×10-5 mol/L时,沉淀就达到完全。
难溶电解质的溶解度尽管很小,但不会等于0。如Ag2S的溶解度为1.3×10-16 g。
溶解平衡与化学平衡一样,受外界条件的影响而发生移动。
(5)影响难溶电解质溶解平衡的因素:
a、绝对不溶的电解质是没有的。
b、同是难溶电解质,溶解度差别也很大。
c、易溶电解质做溶质时只要是饱和溶液也可 存在溶解平衡。
①内因:电解质本身的性质
②外因:
a、浓度:加水,平衡向溶解方向移动。
b、温度:升温,多数平衡向溶解方向移动。
特例:
Ca(OH)2
特例: 随温度升高反而降低:Ca(OH)2
c、同离子效应——向平衡体系中加入难溶物相应
的离子,平衡向 生成沉淀的方向移动
表达式
难溶电解质用“s”标明状态,溶液中的离子用“ ”标明状态,并用“ ”连接。
aq
当堂练习
请写出BaSO4、CaCO3、Ag2S的沉淀溶解平衡表达式。
2. 溶度积常数
(1)难溶电解质的沉淀溶解平衡也存在平衡常数,称为难溶电解质的溶度积常数,简称溶度积。
(2)难溶电解质的溶度积常数用Ksp表示。
通式:
AnBm(s) nAm+(aq) + mBn-(aq)
则Ksp, AnBm= C(Am+)n . C(Bn-)m
练习:BaSO4、Ag2CrO4、Mg(OH)2、Fe(OH)3的溶度积
AmBn (S)
mAn+(aq)+nBm-(aq)
Ksp ( AmBn ) =
C( An+)m · C(Bm-)n
注意:
当难溶物确定时,
Ksp只与温度有关,与浓度无关。
沉淀溶解平衡常数——溶度积 Ksp
例3: 在1L含1.0×10-3mol L-1 的SO42-溶液中,注入0.01mol BaCl2溶液(假设溶液体积不变)能否有效除去SO42- 已知:Ksp(BaSO4)= 1.1×10-10 mol2 L-2
解:c(Ba2+)=0.01mol/L,c(SO42-)=0.001mol/L,生成BaSO4沉
淀后,Ba2+过量,剩余的即[Ba2+]=0.01-0.001=0.009mol/L.
[SO42-]=Ksp/[Ba2+]= 1.1×10-10/9.0×10-3=1.2×10-8(mol/L)
因为,剩余的即[SO42-]=1.2×10-8mol/L<1.0×10-5mol/L
所以, SO42-已沉淀完全,即有效除去了SO42-。
注意:当剩余离子即平衡离子浓度﹤10-5mol/L时,认为离子已沉淀完全或离子已有效除去。
例4:若某溶液中Fe3+和Mg2+的浓度均为0.10 mol/L,
使Fe3+完全沉淀而使Mg2+不沉淀的pH条件是什么
( Ksp (Fe(OH)3)= 4×10-39Ksp (Mg(OH)2)= 1.8×10-11)
pOH = 10.8 , pH = 3.2
解: Fe(OH)3 Fe3+ + 3OH-
Fe3+ 沉淀完全时的[OH-]为:
Mg2+开始沉淀的pH值为:
pOH = 4.9, pH =9.1
因此, 只要控制pH值在3.2 ~ 9.1之间即可使Fe3+定量沉淀而使Mg2+不沉淀。
Ksp (Mg(OH)2)= 1.8×10-11
(3)溶度积与溶解度之间的关系
例1、已知Ksp,AgCl= 1.56 10-10, Ksp,Ag2CrO4= 9.0 10-12,试求AgCl和Ag2CrO4的溶解度(用g/L表示)
(2)设Ag2CrO4的浓度为S2(mol/dm3),则:
Ag2CrO4(s) 2Ag+(aq) + CrO42-(aq)
平 2S2 S2
在水中:AgCl溶解度小于Ag2CrO4的溶解度
(1)
= 9.0 10-12
332g/mol
例2:已知25℃时,AgCl的溶解度是1.92×10-3g/L,求它的溶度积。已知AgCl的摩尔质量为143.5g/mol。
解 :依题意可知25℃时AgCl饱和溶液中
c(Ag+)=c(Cl-)=0.00192/143.5mol/L
=1.34×10-5mol/L
则KSP,AgCl=c(Ag+).c(Cl-)
=(1.34×10-5)2
=1.8×10-10
(4)溶度积规则
①离子积
AnBm(s) nAm+(aq) + mBn-(aq)
(1)Q >Ksp 时,沉淀从溶液中析出(溶液过饱和),
体系中不断析出沉淀,直至达到平衡(此时Q =Ksp )
(2) Q =Ksp 时,沉淀与饱和溶液的平衡
(3)Q
Q = C(Am+)n·C(Bn-)m
Q 称为离子积,其表达式中离子浓度是任意的,为此瞬间溶液中的实际浓度,所以其数值不定,但对一难溶电解质,在一定温度下,Ksp 为一定值。
②溶度积规则
例1:在100mL 0.01mol/LKCl 溶液中,
加入 1mL 0.01mol/L AgNO3溶液,下列
说法正确的是(AgCl Ksp=1.8×10-10) ( )
A.有AgCl沉淀析出 B.无AgCl沉淀
C.无法确定 D.有沉淀但不是AgCl
A
c(Cl-)=(0.01×0.1) ÷0.101=9.9×10-3mol/L
c(Ag+)=(0.01×0.001) ÷0.101=9.9×10-5mol/L
QC =9.9×10-3×9.9×10-5=9.8×10-7>KSP
例2. 现将足量的AgCl分别加入下列物质中, AgCl在下列溶液中的溶解度由大到小的排列顺序是 ( )
① 20 ml 0.01mol·L-1KCl溶液
② 30 ml 0.02mol·L-1CaCl2溶液
③ 40 ml 0.03mol·L-1HCl溶液
④ 10 ml 蒸馏水
⑤ 50 ml 0.05mol·L-1AgNO3溶液
A.① > ② > ③ > ④ > ⑤
B.④ > ① > ③ > ② > ⑤
C.⑤ > ④ > ② > ① > ③
D.④ > ③ > ⑤ > ② > ①
B
解析:由于[Ag+] · [Cl-]=KSP , Ag+或Cl-的浓度越大,越能抑制AgCl的溶解, AgCl的溶解度就越小。
①[Cl-]=0.01mol·L-1 ②[Cl-]=0.04mol·L-1
③[Cl-]=0.03mol·L-1 ④[Cl-] =0mol·L-1
⑤[Ag+] =0.05mol·L-1
Ag+或Cl-浓度由小到大的顺序为④ < ① < ③ < ② < ⑤ ,故
AgCl的溶解度由 大到小的顺序为④ > ① > ③ > ② > ⑤ 。
答案:B
