化学人教版(2019)必修第二册8.1.自然资源的开发利用 课件(共48张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册8.1.自然资源的开发利用 课件(共48张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 27.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-25 10:02:17 | ||
图片预览









文档简介
(共48张PPT)
第一节 自然资源的开发利用
第八章 化学与可持续发展
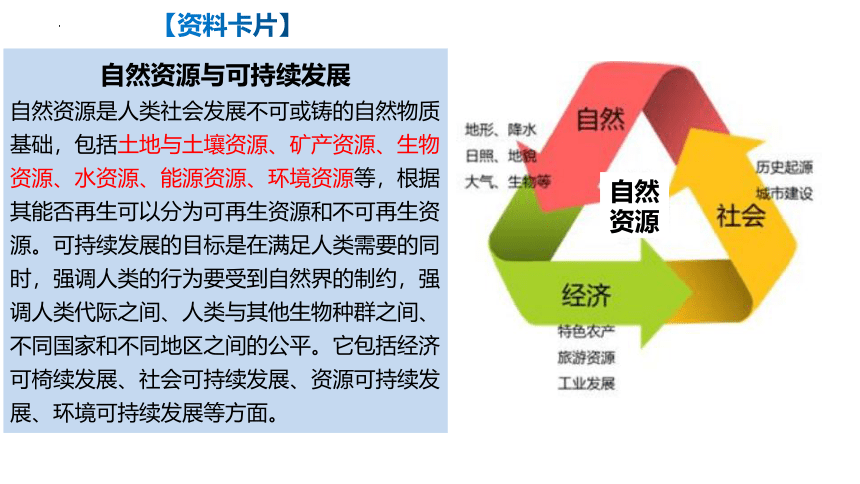
【资料卡片】
自然资源与可持续发展
自然资源是人类社会发展不可或铸的自然物质基础,包括土地与土壤资源、矿产资源、生物资源、水资源、能源资源、环境资源等,根据其能否再生可以分为可再生资源和不可再生资源。可持续发展的目标是在满足人类需要的同时,强调人类的行为要受到自然界的制约,强调人类代际之间、人类与其他生物种群之间、不同国家和不同地区之间的公平。它包括经济可椅续发展、社会可持续发展、资源可持续发展、环境可持续发展等方面。
自然资源
黄铜矿
赤铁矿
铝矿
锰矿
钨矿
金
银
铜
铁
极少数的不活泼金属(金、铂等)以游离态的形式存在。
绝大多数金属以化合物的形式存在。
在地壳中,含量最高的金属元素是铝,其次是铁。
1、金属的冶炼实质
冶炼金属的实质是用还原的方法使金属化合物中的金属离子得到电子变成金属单质。
(化合态)M n+
得电子
M(游离态)
(被还原)
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性逐渐减弱
金属活动性不同,还原方法一样吗?金属活动顺序与金属冶炼有关系吗?
一、金属矿物的开发利用
《浪淘沙》
刘禹锡
千淘万漉虽辛苦,
吹尽狂沙始到金。
美人首饰侯王印,
尽是沙中浪底来。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
①富集法(物理方法)
2、金属的冶炼方法
淘金原理:_________________
淘去粗沙后的砂金
湿法黄金提练法(王水溶解)
金的密度比沙大
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
②热分解法
古代炼丹术家葛洪,曾经在他的著作《抱朴子》中记载有“丹砂烧之成水银”。
HgS Hg + S
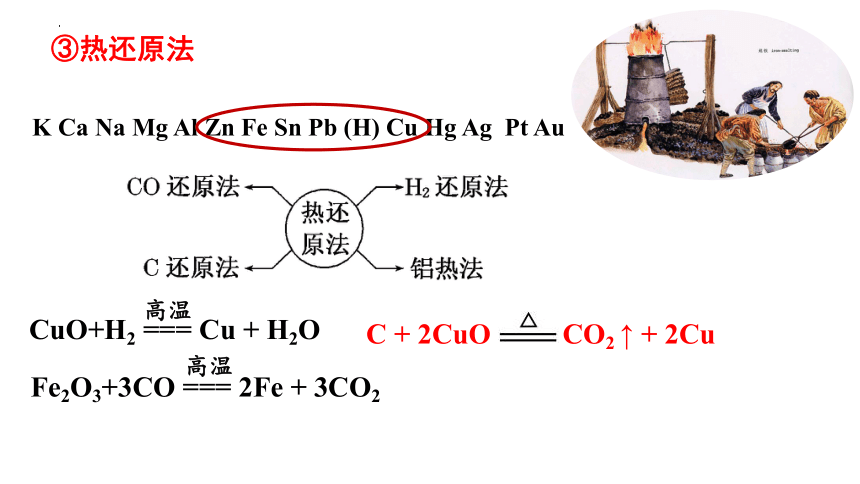
③热还原法
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
CuO+H2 === Cu + H2O
高温
Fe2O3+3CO === 2Fe + 3CO2
高温
C + 2CuO CO2 ↑ + 2Cu
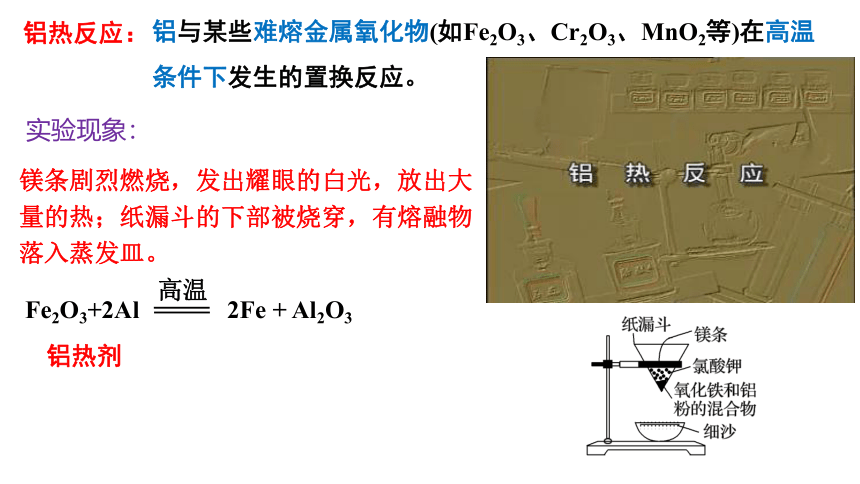
镁条剧烈燃烧,发出耀眼的白光,放出大量的热;纸漏斗的下部被烧穿,有熔融物落入蒸发皿。
实验现象:
Fe2O3+2Al 2Fe + Al2O3
高温
铝热剂
铝热反应:
铝与某些难熔金属氧化物(如Fe2O3、Cr2O3、MnO2等)在高温条件下发生的置换反应。
【思考与交流】
1、铝热反应需要高温条件,是否还需要持续加热?
铝热反应为放热反应,放出的热可以维持反应继续进行,因此不需要持续加热。
2、实验中,镁条、氯酸钾的作用是什么?引发反应的操作是什么?
镁条是引燃剂,氯酸钾为助燃剂,点燃镁条,促使氯酸钾分解,释放出氧气,使镁条更剧烈燃烧,单位时间内放出更多热量,从而引发Al和Fe2O3发生反应。
3、蒸发皿中铺少量细沙的作用是什么?
一是防止蒸发皿炸裂,二是防止生成的熔融物溅出。
铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等等高熔点金属。
3MnO2+4Al 2Al2O3+3Mn。
高温
====
Cr2O3 + 2Al == 2Cr + Al2O3
高温
Fe + CuSO4 = Cu + FeSO4
Cu2S +O2 === 2Cu + SO2
高温
信州铅山县有苦泉,流以为涧。其水熬之,则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之异化为铜。
——沈括《梦溪笔谈》
用矿(硫化矿,主要成分为Cu2S)二百五十箩……入大旋风炉,连烹(灼烧) 三日三夜,方见成铜。
——明·陆容《菽园杂记》
湿法炼铜
火法炼铜
【资料卡片】
④电解法
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
制Mg:______________________。
制Al:_______________________。
制Na:_______________________。
注:
①“熔融”不是水溶液。
②必须是离子化合物,
共价化合物熔融不导电。
【思考与交流】
结合表中数据分析为什么冶炼镁时电解MgCl2而不是MgO,冶炼铝时电解Al2O3而不是AlCl3?
工业上采用电解法冶炼铝的材料是Al2O3,而不是AlCl3,这是因为AlCl3是共价化合物,熔融时无法电离出自由移动的离子,不能导电;工业上采用电解法冶炼镁的材料是MgCl2,而不是MgO,这是因为MgO虽是离子化合物,但其熔点太高,熔融时会消耗大量热能,成本较高。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
活泼
(氧化物、氯化物)
中等活泼
(C、CO、H2、Al等)
不活泼
(氧化物)
【总结金属的冶炼方法】
电解法
物理法
热分解法
热还原法
【思考】金属的发现与使用、冶炼难度、活泼性三者的关系?
Au
Ag
Cu
Fe
Al
······
公元前
一万年
公元前
八千年
公元前
七千年
十九世纪
初期
十三世纪初期
【结论】金属越活泼,冶炼难度越_____,发现得通常越______。
大
晚
金属越不活泼,冶炼的方法越简单,人们使用的时间越早,所以有青铜、铁器等时代的发展历程。
【思考与讨论】
计算表明,生产1 mol 铝消耗的电能至少为1.8 ×106J,回收铝质饮料罐得到铝与从铝土矿制铝相比,前者的能耗仅为后者的3%~5%。通过对上述数据的分析和对比,你想到了什么?请将你的想法和同学交流。
铝土矿
萤石
氧化铝
冰晶石
铝锭
碳素电极
液态铝
石油焦和
沥青焦
电解
图8-1 铝的生产原理示意图
启示1:从铝土矿制铝消耗的能量要远远高于回收铝制饮料罐得到铝消耗的能量,因而在实际生产过程中要考虑成本。
启示2:加强废旧金属的回收和再利用是合理开发和利用金属资源的重要途径。在日常生活中要大力倡导金属垃圾的分类回收和再利用。
启示3:实际生产中,从金属矿物到纯净金属的冶炼过程是一个复杂的过程,在得到所需产品的同时也会产生废弃物,因此必须考虑废弃物的处理对环境的影响,形成绿色化学观念和可持续发展的意识。
①_________________________;
②开发环保高效的金属冶炼方法;
③________________________;
④___________________________;
⑤使用其他材料代替金属材料。
提高金属矿物的利用率
防止金属的腐蚀
加强废旧金属的回收和再利用
①资源有限且分布不均
②金属的冶炼消耗许多能量
③金属冶炼造成环境污染
④金属腐蚀造成大量损失
1)原因:
2)措施:
3、合理开发和利用金属资源的原因及途径
二、海水资源的开发利用
分散性
多样性
1、海水淡化
目的:
从海水中提取淡水
海水蒸馏原理示意图
原理:加热到水的沸点,液态水变为水蒸汽与海水中的盐分离,水蒸汽冷凝得到淡水
1)蒸馏法
优点:历史最久,技术和工艺比较成熟;
缺点:成本较高
①原理:利用各成分的沸点不同,分离互溶液态混合物的物理分离方法。
②装置及仪器名称
拓展链接——蒸馏
酒精灯
蒸馏烧瓶
温度计
冷凝管(直型)
牛角管或尾接管
锥形瓶
或沸石
2)电渗析法
+
-
【原理】离子交换膜,通电后海水中的阳离子和阴离子在电场的作用下渗出膜外
3)离子交换法
阳离子交换树脂:HR+Na+=NaR+H+
阳离子和海水中的钠离子交换
阴离子能和海水中的氯离子交换
阴离子交换树脂:ROH+Cl-=RCl+OH-
目前正迅速发展,但需要不断更新离子交换树脂
浓缩海水
结晶池
蒸发池
粗盐
母液
这里的“母液”也叫“苦卤”,含有高浓度的K+、Mg2+、Br-和SO42-等,可从中提取多种化工原料。
盐田法
(太阳能蒸发法)
日晒风吹蒸发水分
蒸发结晶
继续日晒风吹成为过
饱和溶液,析出晶体
海水日晒制盐
2、海水制盐
①定义:在一定条件下,溶液中的溶质以晶体的形式从溶液中析出的过程
不饱和溶液→饱和溶液→过饱和溶液→晶体析出
蒸发结晶(蒸发溶剂)
降温结晶(冷却热饱和溶液)
②方法
拓展链接——结晶
A溶液:NaCl(含少量KNO3);提纯NaCl 的方法是 。
B溶液:KNO3(含少量NaCI);提纯KNO3的方法是 。
蒸发结晶、趁热过滤
冷却结晶
3、海水提溴——吹出法
【思考与讨论】根据教材中海水提溴的工艺流程图,思考和讨论每一环节的作用,写出氧化和吸收环节主要反应的离子方程式。
2023年9月25日星期一
新人教版2019
“吹出法”海水提溴
环节 作用 化学方程式(或离子方程式)
氧化
吹出
吸收
蒸馏
用氯气氧化海水中的溴离子
用空气将生成的溴 吹出
用SO2作还原剂使溴转化为氢溴酸,以使其与空气分离
再用氯气将氢溴酸氧化为溴
后蒸馏分离
冷凝
将气态溴转化为液态溴
2Br-+Cl2=2Cl-+Br2
Br2+SO2+2H2O=H2SO4+2HBr
Br2+SO2+2H2O=4H++SO42-+2Br-
2Br-+Cl2=2Cl-+Br2
2HBr+Cl2=2HCl+Br2
海水
富集
(浓缩)
氧化室
吹出塔
吸收塔
蒸馏塔
冷凝器
Br2
酸和Cl2
空气
SO2和H2O
Cl2和H2O
目标产品
物质转化、分离提纯
工业原料
富集
【思考与讨论】请绘制出运用“吹出法”从海水中制备溴的工业流程图?
请总结由工业原料到具体产品的一般思路和方法流程和思维方法
建立方法模型 ——自然界提取物质的一般工业流程和思维方法
工业原料
中间产物1
中间产物2
目标产品
富集
转化
①酸碱性
②氧化性
①除去杂质②提纯产物
分离提纯
任 务
核心问题
原料
产品
如何分离出产品?
物料是否能够循环使用?
原料预处理
物质转化
产品分离
如何选取原料?
如何处理原料?
1、从资源、成本角度考虑;
2、从反应速率、提高效率角度。
1、从元素价态的角度分析是否需要选取氧化剂或还原剂?
2、从成本、环保的角度选取最合适的试剂。
根据目标产物的性质及含量,选取合适的分离提纯方法。
如何控制反应条件?
如何选取氧化剂?还原剂?
知识、方法
石灰乳
溶液
Mg(OH)2
沉淀
盐酸
MgCl2溶液
Mg
无水MgCl2
熔融 电解
海水
(含Mg2+)
过滤
MgCl2+Ca(OH)2 == Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl == MgCl2+2H2O
MgCl2(熔融) == Mg+Cl2↑
电解
CaO+H2O == Ca(OH)2
△
CaCO3 == CaO+CO2↑
4、海水提镁
海带
灼烧
海带灰
残渣
含I 的溶液
H2O2
稀硫酸
①
含I2的溶液
萃 取
含I2的有机溶液
溶解
过滤
NaOH
溶液
②
上/下层
硫酸
溶液
③
I2+水溶液
过滤
粗碘
H2O2+2H++2I =I2+2H2O
3I2+6OH =5I +IO3 +3H2O
5I +IO3 +6H+=3I2+3H2O
5、海水提碘
三、煤、石油和天然气的开发利用
迄今为止,煤、石油和天然气仍然是人类使用的主要能源,也是三种重要的化工原料。
形成:
古代动植物遗体经过上一亿万年的复杂变化形成的
缺点: 不可再生、污染环境
∴要实现化石燃料的综合利用, 减少化石燃料燃烧所造成的环境污染!
工业的粮食
工业的血液
1、煤的组成与综合利用:干馏、气化、液化
(1)煤的组成
(2)煤的干馏
均为化学变化
煤是由 和少量 组成的复杂 物,
主要含有 元素,还含有少量 、 、 、 等元素。
有机物
无机物
C
H O N S
混合
把煤隔绝空气加强热使它分解的过程,叫做煤的干馏
表8-1煤干馏的主要产品和用途
干 馏 产 品 主 要 成 分 主 要 用 途
出炉 煤气 (气) 焦炉气 氢气、甲烷、乙烯、 一氧化碳 气体燃料、化工原料
粗氨水 氨、铵盐 氮肥
粗苯 苯、甲苯、二甲苯 炸药、染料、医药、农药、合成材料
煤 焦 油 (液) 苯、甲苯、二甲苯
酚类、萘 染料、医药、农药、合成材料
沥青 筑路材料、制碳素电极
焦 炭(固) 碳 冶金、合成氨造气、电石、燃料
(3)煤的气化
定义:将煤转化为 的过程
主要反应:
可燃性气体
C(s)+H2O(g)==== CO(g)+H2(g)
高温
水煤气
(4)煤的液化
直接液化:使煤与氢气作用生成 。
间接液化:煤 等。
液体燃料
CO和H2
甲醇
CO + 2H2 CH3OH(甲醇)
催化剂
煤的用途
沥青
苯酚
煤是“工业的粮食”
2、天然气的组成和综合利用
CH4
化石燃料
氨
甲醇
清洁燃料:燃烧时能产生高热值且不污染环境的燃料
3、石油的组成和综合利用
(1)石油的组成
多种碳氢化合物(烷烃、环烷烃和芳香烃)组成的混合物,
物性:黑色或深棕色粘稠液体,比水稍轻,不溶于水,有特殊气味,无固定沸点。
(2)石油的综合利用途径
分馏
裂化
裂解
催化重整
(不含烯烃)
①石油的分馏
利用石油中各组分沸点的不同,通过加热和冷凝,把石油(复杂的混合物)分成不同沸点范围的产物(较简单的混合物)的过程。
常压蒸馏:在常压下进行的蒸馏。
减压蒸馏:在减压下进行的蒸馏。
减压可降低碳氢化合物的沸点,以防高级烃在高温下发生分解结焦。
裂化:在一定的条件下,将相对分子质量较大、沸点较高的烃断裂为相对分子质量较小、沸点较低的烃的过程。在催化剂作用下进行的裂化叫做催化裂化。
裂解:就是深度裂化。以比裂化更高的温度,使石油分馏产物(包括石油气) 中的长链烃断裂成乙烯、丙烯等短链烃的过程。
裂化
裂解
目的:提高轻质油的产量,特别是汽油的产量
目的:获得乙烯、丙烯、甲烷等重要的基本化工原料
裂化汽油(含烯烃)
②石油的裂化和裂解
石油在加热和催化剂的作用下,可以通过结构的重新调整,使链状烃转化为环状烃,以获得苯、甲苯等芳香烃,这个过程叫石油的催化重整。
催化重整的目的:
获得苯、甲苯等
重要的化工原料
③石油的催化重整
原油 脱盐脱水 石油 常压蒸馏
石油气(C4以下)
汽油(C5~C11)
煤油(C11~C16)
柴油(C15~C18)
重油
C20
以上
25%
75%
减压蒸馏
沥青
润滑油
石蜡
燃料油
柴油
直馏汽油
(不含烯烃)
图8-6 石油的分馏和裂化及产品用途示意图
图8-7 石油化工产品的应用及投入产出示意图
煤、石油、天然气为原料生产合成材料
三大合成材料: 、 、 。
塑料 合成橡胶 合成纤维
【科学·技术·社会】
生物质资源的利用
人类对生物质资源的开发利用具有悠久的历史。古代人类在长期实践中学会了种植农作物、用薪柴生火、酿酒、造醋、制作饴糖、植物药用,等等。现代科技的发展为开发利用生物质资源奠定了更加坚实的基础。人们利用物理、化学和生物方法将生物质资源转化为材料(如木材、纸张)、燃料(如生物乙醇、生物柴油),以及基本化工原料(如木炭、乙醇、甲醇、甲烷)等。目前,我国可供开发利用的生物质资源主要有农业、林业产品的废弃物(如农作物秸秆、林木加工余料),生产和生活的废弃物(如厨余垃圾、畜禽粪便)等。随着科技和社会的发展,以来自生物质的纤维素、淀粉和油脂等为原料的化工生产路线,替代以煤、石油和天然气为原料的路线,将是一条绿色的可持续发展途径。
化学“三馏”的比较
干馏 蒸馏 分馏
原理
产物
反应类型
隔绝空气、高温下使物质分解
根据液态混合物中各组分沸点不同进行分离
与蒸馏原理相同
产物为混合物
产物为单一组分的纯净物
产物为沸点相近的各组分组成的混合物
化学变化
物理变化
物理变化
六气 高炉 煤气 水煤气 天然气 液化石油气 焦炉气 裂解气
主要成分
CO、CO2
H2、CO
CH4
C3H8、C4H10
H2、CH4、C2H4、CO
C2H4、C3H6、C4H8、CH4
化学“六气”的主要成分
第一节 自然资源的开发利用
第八章 化学与可持续发展
【资料卡片】
自然资源与可持续发展
自然资源是人类社会发展不可或铸的自然物质基础,包括土地与土壤资源、矿产资源、生物资源、水资源、能源资源、环境资源等,根据其能否再生可以分为可再生资源和不可再生资源。可持续发展的目标是在满足人类需要的同时,强调人类的行为要受到自然界的制约,强调人类代际之间、人类与其他生物种群之间、不同国家和不同地区之间的公平。它包括经济可椅续发展、社会可持续发展、资源可持续发展、环境可持续发展等方面。
自然资源
黄铜矿
赤铁矿
铝矿
锰矿
钨矿
金
银
铜
铁
极少数的不活泼金属(金、铂等)以游离态的形式存在。
绝大多数金属以化合物的形式存在。
在地壳中,含量最高的金属元素是铝,其次是铁。
1、金属的冶炼实质
冶炼金属的实质是用还原的方法使金属化合物中的金属离子得到电子变成金属单质。
(化合态)M n+
得电子
M(游离态)
(被还原)
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
金属活动性逐渐减弱
金属活动性不同,还原方法一样吗?金属活动顺序与金属冶炼有关系吗?
一、金属矿物的开发利用
《浪淘沙》
刘禹锡
千淘万漉虽辛苦,
吹尽狂沙始到金。
美人首饰侯王印,
尽是沙中浪底来。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
①富集法(物理方法)
2、金属的冶炼方法
淘金原理:_________________
淘去粗沙后的砂金
湿法黄金提练法(王水溶解)
金的密度比沙大
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
②热分解法
古代炼丹术家葛洪,曾经在他的著作《抱朴子》中记载有“丹砂烧之成水银”。
HgS Hg + S
③热还原法
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
CuO+H2 === Cu + H2O
高温
Fe2O3+3CO === 2Fe + 3CO2
高温
C + 2CuO CO2 ↑ + 2Cu
镁条剧烈燃烧,发出耀眼的白光,放出大量的热;纸漏斗的下部被烧穿,有熔融物落入蒸发皿。
实验现象:
Fe2O3+2Al 2Fe + Al2O3
高温
铝热剂
铝热反应:
铝与某些难熔金属氧化物(如Fe2O3、Cr2O3、MnO2等)在高温条件下发生的置换反应。
【思考与交流】
1、铝热反应需要高温条件,是否还需要持续加热?
铝热反应为放热反应,放出的热可以维持反应继续进行,因此不需要持续加热。
2、实验中,镁条、氯酸钾的作用是什么?引发反应的操作是什么?
镁条是引燃剂,氯酸钾为助燃剂,点燃镁条,促使氯酸钾分解,释放出氧气,使镁条更剧烈燃烧,单位时间内放出更多热量,从而引发Al和Fe2O3发生反应。
3、蒸发皿中铺少量细沙的作用是什么?
一是防止蒸发皿炸裂,二是防止生成的熔融物溅出。
铝热反应的原理可以应用在生产上,如用于焊接钢轨等。在冶金工业上也常用这一反应原理,使铝与金属氧化物反应,冶炼钒、铬、锰等等高熔点金属。
3MnO2+4Al 2Al2O3+3Mn。
高温
====
Cr2O3 + 2Al == 2Cr + Al2O3
高温
Fe + CuSO4 = Cu + FeSO4
Cu2S +O2 === 2Cu + SO2
高温
信州铅山县有苦泉,流以为涧。其水熬之,则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之异化为铜。
——沈括《梦溪笔谈》
用矿(硫化矿,主要成分为Cu2S)二百五十箩……入大旋风炉,连烹(灼烧) 三日三夜,方见成铜。
——明·陆容《菽园杂记》
湿法炼铜
火法炼铜
【资料卡片】
④电解法
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
制Mg:______________________。
制Al:_______________________。
制Na:_______________________。
注:
①“熔融”不是水溶液。
②必须是离子化合物,
共价化合物熔融不导电。
【思考与交流】
结合表中数据分析为什么冶炼镁时电解MgCl2而不是MgO,冶炼铝时电解Al2O3而不是AlCl3?
工业上采用电解法冶炼铝的材料是Al2O3,而不是AlCl3,这是因为AlCl3是共价化合物,熔融时无法电离出自由移动的离子,不能导电;工业上采用电解法冶炼镁的材料是MgCl2,而不是MgO,这是因为MgO虽是离子化合物,但其熔点太高,熔融时会消耗大量热能,成本较高。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
活泼
(氧化物、氯化物)
中等活泼
(C、CO、H2、Al等)
不活泼
(氧化物)
【总结金属的冶炼方法】
电解法
物理法
热分解法
热还原法
【思考】金属的发现与使用、冶炼难度、活泼性三者的关系?
Au
Ag
Cu
Fe
Al
······
公元前
一万年
公元前
八千年
公元前
七千年
十九世纪
初期
十三世纪初期
【结论】金属越活泼,冶炼难度越_____,发现得通常越______。
大
晚
金属越不活泼,冶炼的方法越简单,人们使用的时间越早,所以有青铜、铁器等时代的发展历程。
【思考与讨论】
计算表明,生产1 mol 铝消耗的电能至少为1.8 ×106J,回收铝质饮料罐得到铝与从铝土矿制铝相比,前者的能耗仅为后者的3%~5%。通过对上述数据的分析和对比,你想到了什么?请将你的想法和同学交流。
铝土矿
萤石
氧化铝
冰晶石
铝锭
碳素电极
液态铝
石油焦和
沥青焦
电解
图8-1 铝的生产原理示意图
启示1:从铝土矿制铝消耗的能量要远远高于回收铝制饮料罐得到铝消耗的能量,因而在实际生产过程中要考虑成本。
启示2:加强废旧金属的回收和再利用是合理开发和利用金属资源的重要途径。在日常生活中要大力倡导金属垃圾的分类回收和再利用。
启示3:实际生产中,从金属矿物到纯净金属的冶炼过程是一个复杂的过程,在得到所需产品的同时也会产生废弃物,因此必须考虑废弃物的处理对环境的影响,形成绿色化学观念和可持续发展的意识。
①_________________________;
②开发环保高效的金属冶炼方法;
③________________________;
④___________________________;
⑤使用其他材料代替金属材料。
提高金属矿物的利用率
防止金属的腐蚀
加强废旧金属的回收和再利用
①资源有限且分布不均
②金属的冶炼消耗许多能量
③金属冶炼造成环境污染
④金属腐蚀造成大量损失
1)原因:
2)措施:
3、合理开发和利用金属资源的原因及途径
二、海水资源的开发利用
分散性
多样性
1、海水淡化
目的:
从海水中提取淡水
海水蒸馏原理示意图
原理:加热到水的沸点,液态水变为水蒸汽与海水中的盐分离,水蒸汽冷凝得到淡水
1)蒸馏法
优点:历史最久,技术和工艺比较成熟;
缺点:成本较高
①原理:利用各成分的沸点不同,分离互溶液态混合物的物理分离方法。
②装置及仪器名称
拓展链接——蒸馏
酒精灯
蒸馏烧瓶
温度计
冷凝管(直型)
牛角管或尾接管
锥形瓶
或沸石
2)电渗析法
+
-
【原理】离子交换膜,通电后海水中的阳离子和阴离子在电场的作用下渗出膜外
3)离子交换法
阳离子交换树脂:HR+Na+=NaR+H+
阳离子和海水中的钠离子交换
阴离子能和海水中的氯离子交换
阴离子交换树脂:ROH+Cl-=RCl+OH-
目前正迅速发展,但需要不断更新离子交换树脂
浓缩海水
结晶池
蒸发池
粗盐
母液
这里的“母液”也叫“苦卤”,含有高浓度的K+、Mg2+、Br-和SO42-等,可从中提取多种化工原料。
盐田法
(太阳能蒸发法)
日晒风吹蒸发水分
蒸发结晶
继续日晒风吹成为过
饱和溶液,析出晶体
海水日晒制盐
2、海水制盐
①定义:在一定条件下,溶液中的溶质以晶体的形式从溶液中析出的过程
不饱和溶液→饱和溶液→过饱和溶液→晶体析出
蒸发结晶(蒸发溶剂)
降温结晶(冷却热饱和溶液)
②方法
拓展链接——结晶
A溶液:NaCl(含少量KNO3);提纯NaCl 的方法是 。
B溶液:KNO3(含少量NaCI);提纯KNO3的方法是 。
蒸发结晶、趁热过滤
冷却结晶
3、海水提溴——吹出法
【思考与讨论】根据教材中海水提溴的工艺流程图,思考和讨论每一环节的作用,写出氧化和吸收环节主要反应的离子方程式。
2023年9月25日星期一
新人教版2019
“吹出法”海水提溴
环节 作用 化学方程式(或离子方程式)
氧化
吹出
吸收
蒸馏
用氯气氧化海水中的溴离子
用空气将生成的溴 吹出
用SO2作还原剂使溴转化为氢溴酸,以使其与空气分离
再用氯气将氢溴酸氧化为溴
后蒸馏分离
冷凝
将气态溴转化为液态溴
2Br-+Cl2=2Cl-+Br2
Br2+SO2+2H2O=H2SO4+2HBr
Br2+SO2+2H2O=4H++SO42-+2Br-
2Br-+Cl2=2Cl-+Br2
2HBr+Cl2=2HCl+Br2
海水
富集
(浓缩)
氧化室
吹出塔
吸收塔
蒸馏塔
冷凝器
Br2
酸和Cl2
空气
SO2和H2O
Cl2和H2O
目标产品
物质转化、分离提纯
工业原料
富集
【思考与讨论】请绘制出运用“吹出法”从海水中制备溴的工业流程图?
请总结由工业原料到具体产品的一般思路和方法流程和思维方法
建立方法模型 ——自然界提取物质的一般工业流程和思维方法
工业原料
中间产物1
中间产物2
目标产品
富集
转化
①酸碱性
②氧化性
①除去杂质②提纯产物
分离提纯
任 务
核心问题
原料
产品
如何分离出产品?
物料是否能够循环使用?
原料预处理
物质转化
产品分离
如何选取原料?
如何处理原料?
1、从资源、成本角度考虑;
2、从反应速率、提高效率角度。
1、从元素价态的角度分析是否需要选取氧化剂或还原剂?
2、从成本、环保的角度选取最合适的试剂。
根据目标产物的性质及含量,选取合适的分离提纯方法。
如何控制反应条件?
如何选取氧化剂?还原剂?
知识、方法
石灰乳
溶液
Mg(OH)2
沉淀
盐酸
MgCl2溶液
Mg
无水MgCl2
熔融 电解
海水
(含Mg2+)
过滤
MgCl2+Ca(OH)2 == Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl == MgCl2+2H2O
MgCl2(熔融) == Mg+Cl2↑
电解
CaO+H2O == Ca(OH)2
△
CaCO3 == CaO+CO2↑
4、海水提镁
海带
灼烧
海带灰
残渣
含I 的溶液
H2O2
稀硫酸
①
含I2的溶液
萃 取
含I2的有机溶液
溶解
过滤
NaOH
溶液
②
上/下层
硫酸
溶液
③
I2+水溶液
过滤
粗碘
H2O2+2H++2I =I2+2H2O
3I2+6OH =5I +IO3 +3H2O
5I +IO3 +6H+=3I2+3H2O
5、海水提碘
三、煤、石油和天然气的开发利用
迄今为止,煤、石油和天然气仍然是人类使用的主要能源,也是三种重要的化工原料。
形成:
古代动植物遗体经过上一亿万年的复杂变化形成的
缺点: 不可再生、污染环境
∴要实现化石燃料的综合利用, 减少化石燃料燃烧所造成的环境污染!
工业的粮食
工业的血液
1、煤的组成与综合利用:干馏、气化、液化
(1)煤的组成
(2)煤的干馏
均为化学变化
煤是由 和少量 组成的复杂 物,
主要含有 元素,还含有少量 、 、 、 等元素。
有机物
无机物
C
H O N S
混合
把煤隔绝空气加强热使它分解的过程,叫做煤的干馏
表8-1煤干馏的主要产品和用途
干 馏 产 品 主 要 成 分 主 要 用 途
出炉 煤气 (气) 焦炉气 氢气、甲烷、乙烯、 一氧化碳 气体燃料、化工原料
粗氨水 氨、铵盐 氮肥
粗苯 苯、甲苯、二甲苯 炸药、染料、医药、农药、合成材料
煤 焦 油 (液) 苯、甲苯、二甲苯
酚类、萘 染料、医药、农药、合成材料
沥青 筑路材料、制碳素电极
焦 炭(固) 碳 冶金、合成氨造气、电石、燃料
(3)煤的气化
定义:将煤转化为 的过程
主要反应:
可燃性气体
C(s)+H2O(g)==== CO(g)+H2(g)
高温
水煤气
(4)煤的液化
直接液化:使煤与氢气作用生成 。
间接液化:煤 等。
液体燃料
CO和H2
甲醇
CO + 2H2 CH3OH(甲醇)
催化剂
煤的用途
沥青
苯酚
煤是“工业的粮食”
2、天然气的组成和综合利用
CH4
化石燃料
氨
甲醇
清洁燃料:燃烧时能产生高热值且不污染环境的燃料
3、石油的组成和综合利用
(1)石油的组成
多种碳氢化合物(烷烃、环烷烃和芳香烃)组成的混合物,
物性:黑色或深棕色粘稠液体,比水稍轻,不溶于水,有特殊气味,无固定沸点。
(2)石油的综合利用途径
分馏
裂化
裂解
催化重整
(不含烯烃)
①石油的分馏
利用石油中各组分沸点的不同,通过加热和冷凝,把石油(复杂的混合物)分成不同沸点范围的产物(较简单的混合物)的过程。
常压蒸馏:在常压下进行的蒸馏。
减压蒸馏:在减压下进行的蒸馏。
减压可降低碳氢化合物的沸点,以防高级烃在高温下发生分解结焦。
裂化:在一定的条件下,将相对分子质量较大、沸点较高的烃断裂为相对分子质量较小、沸点较低的烃的过程。在催化剂作用下进行的裂化叫做催化裂化。
裂解:就是深度裂化。以比裂化更高的温度,使石油分馏产物(包括石油气) 中的长链烃断裂成乙烯、丙烯等短链烃的过程。
裂化
裂解
目的:提高轻质油的产量,特别是汽油的产量
目的:获得乙烯、丙烯、甲烷等重要的基本化工原料
裂化汽油(含烯烃)
②石油的裂化和裂解
石油在加热和催化剂的作用下,可以通过结构的重新调整,使链状烃转化为环状烃,以获得苯、甲苯等芳香烃,这个过程叫石油的催化重整。
催化重整的目的:
获得苯、甲苯等
重要的化工原料
③石油的催化重整
原油 脱盐脱水 石油 常压蒸馏
石油气(C4以下)
汽油(C5~C11)
煤油(C11~C16)
柴油(C15~C18)
重油
C20
以上
25%
75%
减压蒸馏
沥青
润滑油
石蜡
燃料油
柴油
直馏汽油
(不含烯烃)
图8-6 石油的分馏和裂化及产品用途示意图
图8-7 石油化工产品的应用及投入产出示意图
煤、石油、天然气为原料生产合成材料
三大合成材料: 、 、 。
塑料 合成橡胶 合成纤维
【科学·技术·社会】
生物质资源的利用
人类对生物质资源的开发利用具有悠久的历史。古代人类在长期实践中学会了种植农作物、用薪柴生火、酿酒、造醋、制作饴糖、植物药用,等等。现代科技的发展为开发利用生物质资源奠定了更加坚实的基础。人们利用物理、化学和生物方法将生物质资源转化为材料(如木材、纸张)、燃料(如生物乙醇、生物柴油),以及基本化工原料(如木炭、乙醇、甲醇、甲烷)等。目前,我国可供开发利用的生物质资源主要有农业、林业产品的废弃物(如农作物秸秆、林木加工余料),生产和生活的废弃物(如厨余垃圾、畜禽粪便)等。随着科技和社会的发展,以来自生物质的纤维素、淀粉和油脂等为原料的化工生产路线,替代以煤、石油和天然气为原料的路线,将是一条绿色的可持续发展途径。
化学“三馏”的比较
干馏 蒸馏 分馏
原理
产物
反应类型
隔绝空气、高温下使物质分解
根据液态混合物中各组分沸点不同进行分离
与蒸馏原理相同
产物为混合物
产物为单一组分的纯净物
产物为沸点相近的各组分组成的混合物
化学变化
物理变化
物理变化
六气 高炉 煤气 水煤气 天然气 液化石油气 焦炉气 裂解气
主要成分
CO、CO2
H2、CO
CH4
C3H8、C4H10
H2、CH4、C2H4、CO
C2H4、C3H6、C4H8、CH4
化学“六气”的主要成分
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
