3.1.2电离平衡及影响电离平衡的因素 课件(共19张PPT)2023—2024学年上学期高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.1.2电离平衡及影响电离平衡的因素 课件(共19张PPT)2023—2024学年上学期高二化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-25 10:49:57 | ||
图片预览




文档简介
(共19张PPT)
第三章 水溶液中的离子平衡
第一节 电离平衡
第2课时
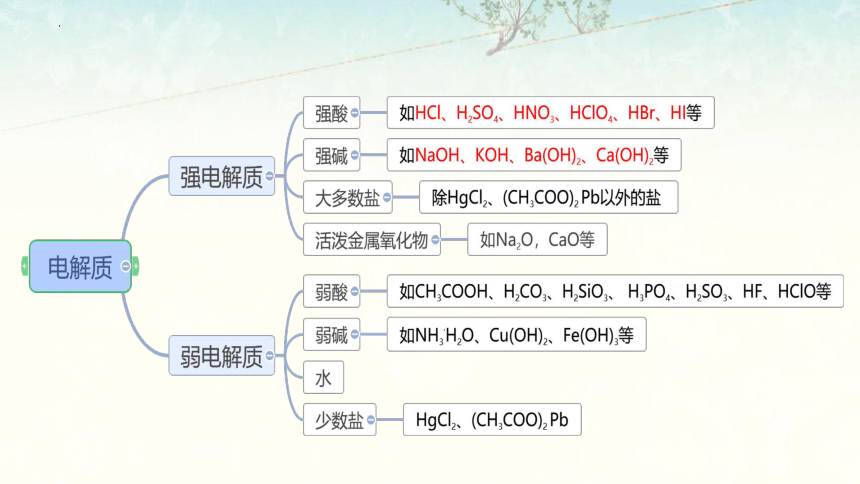
1.结合真实情境中的应用实例,认识电解质在水溶液中存在电离平衡
2.掌握弱电解质的电离平衡,了解其影响因素
3.认识电离平衡常数,知道其定义及意义
学习目标
电离平衡常数表达式的书写
本节重点
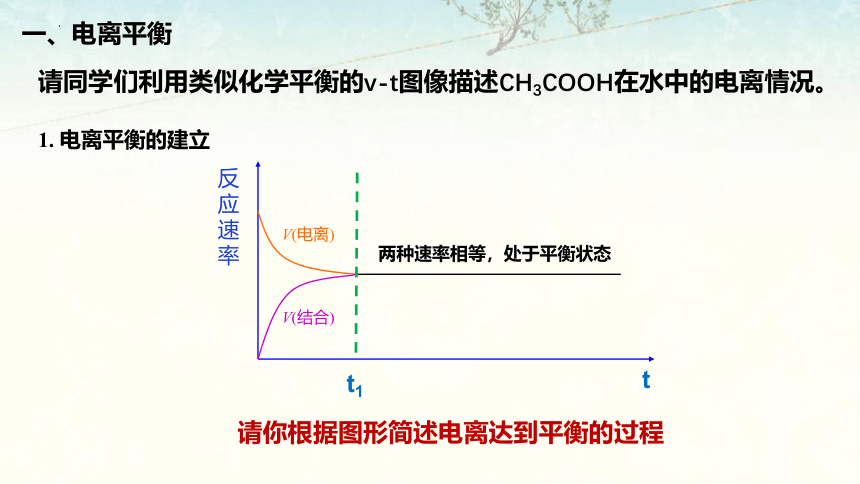
以CH3COOH CH3COO-+H+为例,分析电离过程以及溶液中分子与离子浓度的变化
请同学们利用类似化学平衡的v-t图像描述CH3COOH在水中的电离情况。
反应速率
V(电离)
V(结合)
t
t1
两种速率相等,处于平衡状态
请你根据图形简述电离达到平衡的过程
一、电离平衡
1. 电离平衡的建立
反应速率
时间
V(电离)
V(结合)
V(电离) = V(结合) 电离平衡状态
逆,等,动,定,变
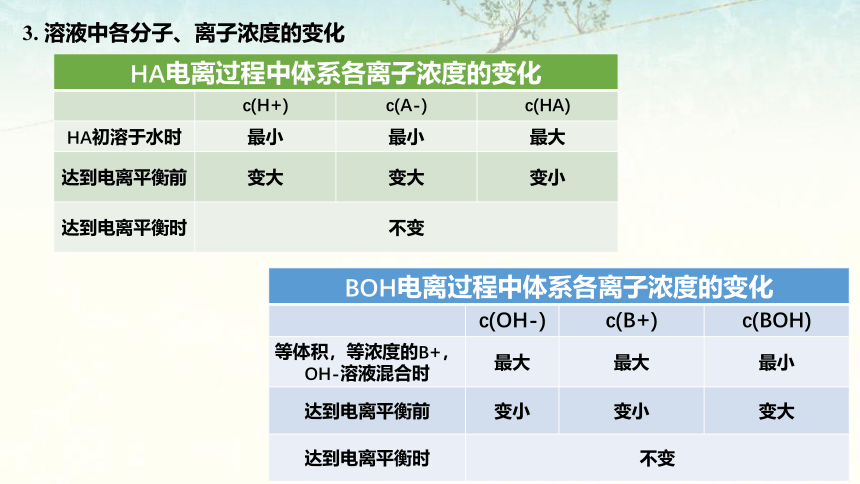
2. 电离平衡的特征
HA电离过程中体系各离子浓度的变化
c(H+) c(A-) c(HA)
HA初溶于水时 最小 最小 最大
达到电离平衡前 变大 变大 变小
达到电离平衡时 不变
BOH电离过程中体系各离子浓度的变化
c(OH-) c(B+) c(BOH)
等体积,等浓度的B+,OH-溶液混合时 最大 最大 最小
达到电离平衡前 变小 变小 变大
达到电离平衡时 不变
3. 溶液中各分子、离子浓度的变化
在醋酸溶液中存在怎样的电离平衡?改变条件对平衡有什么影响?
CH3COOH CH3COO-+H+
平衡移动的方向 n(H+) C(H+) 导电性 电离程度
加水稀释 右移 增大 减小 减弱 增大
加冰醋酸 右移 增大 增大 增强 减小
升温 右移 增大 增大 增强 增大
加CH3COONa固体 右移 减小 减小 增强 减小
加NaOH固体 右移 减小 减小 增强 增大
加Na2CO3固体 右移 减小 减小 增强 增大
加金属镁 右移 减小 减小 增强 增大
4. 影响电离平衡的因素
内因:
外因:
加电解质的组成离子,左移,抑制电离,电离程度减小
加能与电解质离子反应的物质,右移,电离程度增大
电解质本身的性质,电解质越弱,电离程度越小
温度:
向电离方向移动,电离程度增大 (电离过程是吸热过程)
浓度:
浓度越大,电离程度越小
同离子效应:
化学反应:
稀释,右移,电离程度增大
1. 向等体积,等物质的量浓度的盐酸和醋酸溶液中加入质量、颗粒大小均相同且足量的Zn
(1)起始时产生H2的速率大小:
(2)_______先反应完。
(3)反应结束时二者产生的H2体积大小________。
相等
盐酸
v盐酸 > v醋酸
练一练
二、电离平衡常数的概念与表达式
1. 概念
对一元弱酸或者一元弱碱来说,在一定条件下,弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是个常数,这个常数称为电离平衡常数,简称电离常数。
2. 表达式
练习:请书写CH3COOH、NH3.H2O电离平衡常数表达式
Ka、 Kb 分别表示弱酸、弱碱的电离平衡常数
多元弱酸的电离是分步进行的,所以酸的元数是多少,就有几个电离常数。多元弱酸电离常数依次称为Ka1、Ka2……
2:H2CO3是二元弱酸,其电离方程式和电离常数分别为:
=4.5×10-7
c(H+)·c(HCO3-)
c(H2CO3)
Ka1=
H2CO3 H++HCO3-
=4.7×10-11
c(H+)·c(CO32-)
c(HCO3-)
Ka2=
HCO3- H++CO32-
Ka1 Ka2,因此计算多元弱酸溶液的c(H+)时,通常只考虑第一步电离
二、电离平衡常数的概念与表达式
名称 化学式 电离常数(K) 名称 化学式 电离常数(K)
醋酸 CH3COOH Ka=1.75×10-5 亚硝酸 HNO2 Ka=5.60×10-4
氢氰酸 HCN Ka=6.20×10-10 氢氟酸 HF Ka=6.30×10-4
次氯酸 HClO Ka=4.00×10-8 甲酸 HCOOH Ka=1.80×10-4
相同温度下(25℃)一元弱酸的电离常数,有什么发现?
相同温度下,电离常数由弱电解质自身的性质决定
CH3COOH H2CO3 H2S
K=1.8×10-5 K1=4.3×10-7 K2=5.6×10-11 K1=9.1×10-8
K2=1.1×10-12
酸性:CH3COOH>H2CO3>H2S>HCO3->HS
结论:一定温度下,K值越大,弱电解质的电离程度越大,酸性(或碱性)越强
比较多元弱酸酸性的相对强弱时,通常只考虑第一步电离
三、电离平衡常数的影响因素
1. 内因:弱电解质本身的性质。
2. 外因:电离平衡常数只跟温度有关,温度升高,电离平衡常数增大。
对于同一弱电解质,温度越高,电离常数越大;温度越低,电离常数越小。但由于电离过程中热效应较小,因此温度改变对电离常数影响不大,其数量级一般不变,故室温范围内可忽略温度对电离常数的影响
四、电离平衡常数的计算
在某温度时,溶质的物质的量浓度为0.2mol·L-1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10-3 mol·L-1,试计算该温度下NH3·H2O的电离常数(Kb)。
NH3·H2O NH4+ + OH-
起始浓度
变化浓度
平衡浓度
0.2
0
0
1.7×10-3
1.7×10-3
1.7×10-3
1.7×10-3
1.7×10-3
0.2-1.7×10-3
c(NH3·H2O)
=(0.2-1.7×10-3)mol·L-1
≈0.2mol·L-1
Kb=
c(NH4+)·c(OH-)
c(NH3·H2O)
=
(1.7×10-3)·(1.7×10-3)
0.2
≈1.4×10-5
【随堂检测】
1. 一元弱酸HA(aq)中存在下列电离平衡:HA H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )
C
【随堂检测】
2. 在100 mL 0.1 mol·L-1的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用的方法是( )
A.加热 B.加入100 mL 0.1 mol·L-1的醋酸溶液 C.加入少量的0.5 mol·L-1的硫酸
D.加入少量的1 mol·L-1的NaOH溶液
D
谢谢大家
第三章 水溶液中的离子平衡
第一节 电离平衡
第2课时
1.结合真实情境中的应用实例,认识电解质在水溶液中存在电离平衡
2.掌握弱电解质的电离平衡,了解其影响因素
3.认识电离平衡常数,知道其定义及意义
学习目标
电离平衡常数表达式的书写
本节重点
以CH3COOH CH3COO-+H+为例,分析电离过程以及溶液中分子与离子浓度的变化
请同学们利用类似化学平衡的v-t图像描述CH3COOH在水中的电离情况。
反应速率
V(电离)
V(结合)
t
t1
两种速率相等,处于平衡状态
请你根据图形简述电离达到平衡的过程
一、电离平衡
1. 电离平衡的建立
反应速率
时间
V(电离)
V(结合)
V(电离) = V(结合) 电离平衡状态
逆,等,动,定,变
2. 电离平衡的特征
HA电离过程中体系各离子浓度的变化
c(H+) c(A-) c(HA)
HA初溶于水时 最小 最小 最大
达到电离平衡前 变大 变大 变小
达到电离平衡时 不变
BOH电离过程中体系各离子浓度的变化
c(OH-) c(B+) c(BOH)
等体积,等浓度的B+,OH-溶液混合时 最大 最大 最小
达到电离平衡前 变小 变小 变大
达到电离平衡时 不变
3. 溶液中各分子、离子浓度的变化
在醋酸溶液中存在怎样的电离平衡?改变条件对平衡有什么影响?
CH3COOH CH3COO-+H+
平衡移动的方向 n(H+) C(H+) 导电性 电离程度
加水稀释 右移 增大 减小 减弱 增大
加冰醋酸 右移 增大 增大 增强 减小
升温 右移 增大 增大 增强 增大
加CH3COONa固体 右移 减小 减小 增强 减小
加NaOH固体 右移 减小 减小 增强 增大
加Na2CO3固体 右移 减小 减小 增强 增大
加金属镁 右移 减小 减小 增强 增大
4. 影响电离平衡的因素
内因:
外因:
加电解质的组成离子,左移,抑制电离,电离程度减小
加能与电解质离子反应的物质,右移,电离程度增大
电解质本身的性质,电解质越弱,电离程度越小
温度:
向电离方向移动,电离程度增大 (电离过程是吸热过程)
浓度:
浓度越大,电离程度越小
同离子效应:
化学反应:
稀释,右移,电离程度增大
1. 向等体积,等物质的量浓度的盐酸和醋酸溶液中加入质量、颗粒大小均相同且足量的Zn
(1)起始时产生H2的速率大小:
(2)_______先反应完。
(3)反应结束时二者产生的H2体积大小________。
相等
盐酸
v盐酸 > v醋酸
练一练
二、电离平衡常数的概念与表达式
1. 概念
对一元弱酸或者一元弱碱来说,在一定条件下,弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是个常数,这个常数称为电离平衡常数,简称电离常数。
2. 表达式
练习:请书写CH3COOH、NH3.H2O电离平衡常数表达式
Ka、 Kb 分别表示弱酸、弱碱的电离平衡常数
多元弱酸的电离是分步进行的,所以酸的元数是多少,就有几个电离常数。多元弱酸电离常数依次称为Ka1、Ka2……
2:H2CO3是二元弱酸,其电离方程式和电离常数分别为:
=4.5×10-7
c(H+)·c(HCO3-)
c(H2CO3)
Ka1=
H2CO3 H++HCO3-
=4.7×10-11
c(H+)·c(CO32-)
c(HCO3-)
Ka2=
HCO3- H++CO32-
Ka1 Ka2,因此计算多元弱酸溶液的c(H+)时,通常只考虑第一步电离
二、电离平衡常数的概念与表达式
名称 化学式 电离常数(K) 名称 化学式 电离常数(K)
醋酸 CH3COOH Ka=1.75×10-5 亚硝酸 HNO2 Ka=5.60×10-4
氢氰酸 HCN Ka=6.20×10-10 氢氟酸 HF Ka=6.30×10-4
次氯酸 HClO Ka=4.00×10-8 甲酸 HCOOH Ka=1.80×10-4
相同温度下(25℃)一元弱酸的电离常数,有什么发现?
相同温度下,电离常数由弱电解质自身的性质决定
CH3COOH H2CO3 H2S
K=1.8×10-5 K1=4.3×10-7 K2=5.6×10-11 K1=9.1×10-8
K2=1.1×10-12
酸性:CH3COOH>H2CO3>H2S>HCO3->HS
结论:一定温度下,K值越大,弱电解质的电离程度越大,酸性(或碱性)越强
比较多元弱酸酸性的相对强弱时,通常只考虑第一步电离
三、电离平衡常数的影响因素
1. 内因:弱电解质本身的性质。
2. 外因:电离平衡常数只跟温度有关,温度升高,电离平衡常数增大。
对于同一弱电解质,温度越高,电离常数越大;温度越低,电离常数越小。但由于电离过程中热效应较小,因此温度改变对电离常数影响不大,其数量级一般不变,故室温范围内可忽略温度对电离常数的影响
四、电离平衡常数的计算
在某温度时,溶质的物质的量浓度为0.2mol·L-1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10-3 mol·L-1,试计算该温度下NH3·H2O的电离常数(Kb)。
NH3·H2O NH4+ + OH-
起始浓度
变化浓度
平衡浓度
0.2
0
0
1.7×10-3
1.7×10-3
1.7×10-3
1.7×10-3
1.7×10-3
0.2-1.7×10-3
c(NH3·H2O)
=(0.2-1.7×10-3)mol·L-1
≈0.2mol·L-1
Kb=
c(NH4+)·c(OH-)
c(NH3·H2O)
=
(1.7×10-3)·(1.7×10-3)
0.2
≈1.4×10-5
【随堂检测】
1. 一元弱酸HA(aq)中存在下列电离平衡:HA H++A-,如图将1.0 mol HA分子加入1.0 L水中,溶液中HA、H+、A-的物质的量浓度随时间而变化的曲线正确的是( )
C
【随堂检测】
2. 在100 mL 0.1 mol·L-1的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用的方法是( )
A.加热 B.加入100 mL 0.1 mol·L-1的醋酸溶液 C.加入少量的0.5 mol·L-1的硫酸
D.加入少量的1 mol·L-1的NaOH溶液
D
谢谢大家
