1.2.2化学电池 课件(共18张PPT)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.2.2化学电池 课件(共18张PPT)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-25 14:58:33 | ||
图片预览




文档简介
(共18张PPT)
第1章 化学反应与能量转化
第2节 化学能转化为电能—电池
第2课时 化学电源
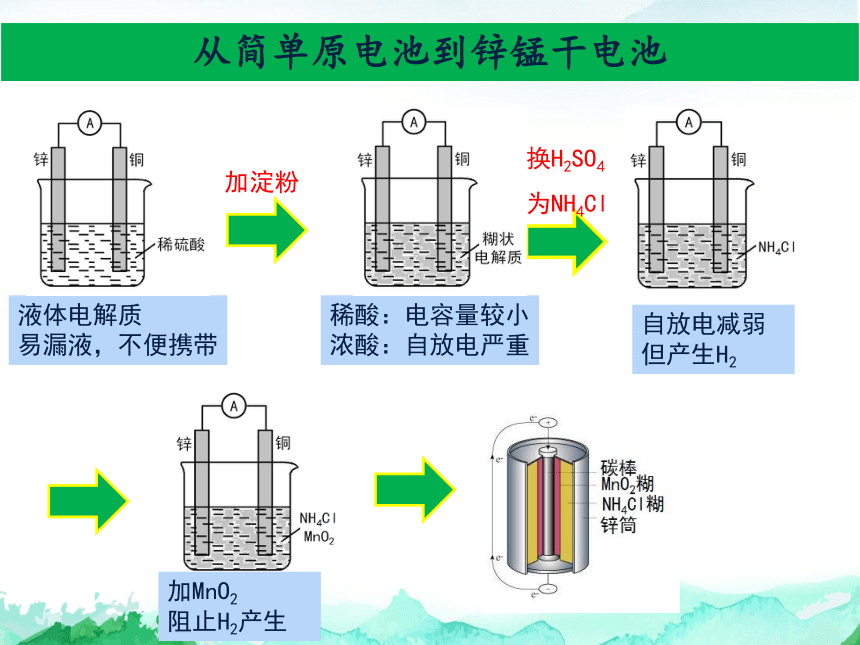
从简单原电池到锌锰干电池
液体电解质
易漏液,不便携带
加淀粉
稀酸:电容量较小
浓酸:自放电严重
换H2SO4
为NH4Cl
自放电减弱
但产生H2
加MnO2
阻止H2产生
日常生活中形形色色的电池
知识点 一:化学电源的分类
化学电源
一次电池:如普通锌锰干电池、碱性锌锰电池等
二次电池:铅蓄电池、锂离子电池
燃料电池:氢氧燃料电池
新型化学电源:微生物电池
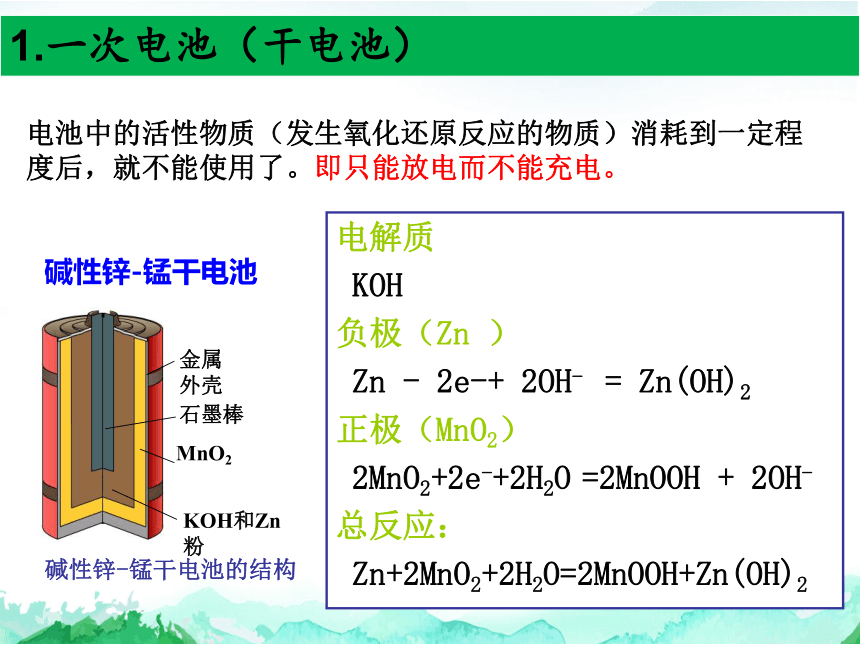
1.一次电池(干电池)
碱性锌-锰干电池
电池中的活性物质(发生氧化还原反应的物质)消耗到一定程度后,就不能使用了。即只能放电而不能充电。
金属外壳
石墨棒
KOH和Zn粉
碱性锌-锰干电池的结构
MnO2
电解质
KOH
负极(Zn )
Zn - 2e-+ 2OH- = Zn(OH)2
正极(MnO2)
2MnO2+2e-+2H2O =2MnOOH + 2OH-
总反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
方法解读:
①标明变价,判断正负极
②判断出反应物和产物,标明得失电子
③写电极反应式,注意原子、电荷、转移电子守恒,考虑离子反应。
(若一个较“难”写,可用“总”减“易”)
④写总式:两电极相加(得失电子数相等)
注意:碱性溶液不能出现H+;酸性溶液不能出现OH-
练习:银锌电池-纽扣电池
Zn +Ag2O + H2O = 2Ag + Zn(OH)2
总反应:
电解质:KOH
负极:Zn
正极:Ag2O
Zn - 2e- + 2OH- = Zn(OH)2
Ag2O +2e- + H2O=2Ag + 2OH-
0
0
+1
+2
2.二次电池(可充电电池)
又称充电电池或蓄电池。放电后经充电可使电池中的活性物质获得再生,恢复工作能力,可多次重复使用。
总反应:Pb+PbO2+2H2SO4 2PbSO4 +2H2O
负极材料:
正极材料:
电解质溶液:
Pb
PbO2
H2SO4
负极:Pb-2e-+SO42-=PbSO4
正极:PbO2+2e- +SO42-+4H+=PbSO4+ 2H2O
放电过程
(原电池)
镍-镉(Ni-Cd)电池--使用寿命比铅蓄电池长,可充电500次以上.
镍-镉( Ni-Cd)电池发生如下反应:
Cd+NiO(OH)2+H2O Cd(OH)2+Ni(OH)2,
0
+4
+2
+2
负极
正极
(探讨) 对于镍-镉( Ni-Cd)电池,下列判断正确的是( )
A NiO(OH)2是电池的负极
B 放电时Cd是电池的负极
C 充电时Ni(OH)2发生氧化反应
D 正极反应为 Ni(OH)2 - 2e-+ 2OH-= NiO(OH)2+ H2O
BC
书写两电极方程式:
3.燃料电池
一种连续将燃料和氧化剂的化学能直接转换成电能的化学电池。电池的电极本身不包含活性物质,只是一个催化转化元件。
(氢气、烃、甲醇、肼、氨、煤气燃料电池……)
氢氧燃料电池
总反应:2H2+O2 = 2H2O
负极:燃料(如H2、CH4)
正极:氧化剂(如O2)
中性条件下
负极: 2H2-4e- = 4H+
正极:O2+4e-+2H2O = 4OH-
酸性条件下
碱性条件下
负极: 2H2-4e- = 4H+
正极:O2+4e-+4H+ = 2H2O
总反应: 2H2+O2 = 2H2O
酸
性
负极:2H2+4OH--4e- = 4H2O
正极:O2+4e- +2H2O= 4OH-
总反应:2H2+O2 = 2H2O
碱
性
注意:涉及到两个电极方程式书写时,需要得失电子守恒
甲烷燃料电池
1.燃料电池总反应:CH4+2O2 = CO2+2H2O
2.正极: 2O2+8e- +8H+= 4H2O
3.负极:CH4-8e-+2H2O = CO2+8H+
1.燃料电池总反应:CH4+2OH-+2O2 = CO32-+3H2O
2.正极: 2O2+8e- +4H2O= 8OH-
3.负极:CH4-8e-+10OH- = CO32-+7H2O
电解质溶液:稀硫酸
电解质溶液:氢氧化钾溶液
方法解读:
②标化合价,得失电子
①注明反应物、产物
③添其他
酸性离子 用H+ H2O
若有碳元素参加反应生成 CO2
碱性离子 用OH- H2O
若有碳元素参加反应生成CO32-
正极:O2在酸性条件下生成H2O ,碱性条件下生成OH-
负极:C元素在酸性条件下生成CO2 ,碱性条件下生成CO32-
常见元素或物质 H C O Al
碱性 H2O CO32- OH- AlO2-
酸性 H+ CO2 H2O Al3+
熔融 金属氧化物 H2O CO2 O2-
Al3+
熔融 碳酸盐 H2O CO2 CO32-
H→H+, O2→O2-, C→CO2, Al→Al3+
【练习】
CH3OH燃料电池、电解质为KOH溶液,电池总
反应为
书写正负极电极反应。
2CH3OH+ 3O2 + 4KOH = 2K2CO3 + 6 H2O
正极:
负极:
2CH3OH-12e-+ 16OH -= 2CO32- + 12H2O
3O2+12e-+6H2O = 12OH -
4.微生物电池
微生物燃料电池是一种利用微生物将有机物中的化学能转化为电能的装置。
工作时温度不能太高
B
4. 共存原则:原电池的两极反应若均在一定介质中进行,
在酸性介质中,不可能出现OH-,
在碱性介质中,不可能出现H+ CO2
3. 必须遵循得失电子守恒、电荷守恒、原子守恒。
2. 正、负极反应具有加和性:
化学反应方程式=正极反应方程式+负极反应方程式。
1. 两极判断:先分析电池反应中有关物质元素化合价的变化,确定原电池的正极和负极。
规律总结:
第1章 化学反应与能量转化
第2节 化学能转化为电能—电池
第2课时 化学电源
从简单原电池到锌锰干电池
液体电解质
易漏液,不便携带
加淀粉
稀酸:电容量较小
浓酸:自放电严重
换H2SO4
为NH4Cl
自放电减弱
但产生H2
加MnO2
阻止H2产生
日常生活中形形色色的电池
知识点 一:化学电源的分类
化学电源
一次电池:如普通锌锰干电池、碱性锌锰电池等
二次电池:铅蓄电池、锂离子电池
燃料电池:氢氧燃料电池
新型化学电源:微生物电池
1.一次电池(干电池)
碱性锌-锰干电池
电池中的活性物质(发生氧化还原反应的物质)消耗到一定程度后,就不能使用了。即只能放电而不能充电。
金属外壳
石墨棒
KOH和Zn粉
碱性锌-锰干电池的结构
MnO2
电解质
KOH
负极(Zn )
Zn - 2e-+ 2OH- = Zn(OH)2
正极(MnO2)
2MnO2+2e-+2H2O =2MnOOH + 2OH-
总反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
方法解读:
①标明变价,判断正负极
②判断出反应物和产物,标明得失电子
③写电极反应式,注意原子、电荷、转移电子守恒,考虑离子反应。
(若一个较“难”写,可用“总”减“易”)
④写总式:两电极相加(得失电子数相等)
注意:碱性溶液不能出现H+;酸性溶液不能出现OH-
练习:银锌电池-纽扣电池
Zn +Ag2O + H2O = 2Ag + Zn(OH)2
总反应:
电解质:KOH
负极:Zn
正极:Ag2O
Zn - 2e- + 2OH- = Zn(OH)2
Ag2O +2e- + H2O=2Ag + 2OH-
0
0
+1
+2
2.二次电池(可充电电池)
又称充电电池或蓄电池。放电后经充电可使电池中的活性物质获得再生,恢复工作能力,可多次重复使用。
总反应:Pb+PbO2+2H2SO4 2PbSO4 +2H2O
负极材料:
正极材料:
电解质溶液:
Pb
PbO2
H2SO4
负极:Pb-2e-+SO42-=PbSO4
正极:PbO2+2e- +SO42-+4H+=PbSO4+ 2H2O
放电过程
(原电池)
镍-镉(Ni-Cd)电池--使用寿命比铅蓄电池长,可充电500次以上.
镍-镉( Ni-Cd)电池发生如下反应:
Cd+NiO(OH)2+H2O Cd(OH)2+Ni(OH)2,
0
+4
+2
+2
负极
正极
(探讨) 对于镍-镉( Ni-Cd)电池,下列判断正确的是( )
A NiO(OH)2是电池的负极
B 放电时Cd是电池的负极
C 充电时Ni(OH)2发生氧化反应
D 正极反应为 Ni(OH)2 - 2e-+ 2OH-= NiO(OH)2+ H2O
BC
书写两电极方程式:
3.燃料电池
一种连续将燃料和氧化剂的化学能直接转换成电能的化学电池。电池的电极本身不包含活性物质,只是一个催化转化元件。
(氢气、烃、甲醇、肼、氨、煤气燃料电池……)
氢氧燃料电池
总反应:2H2+O2 = 2H2O
负极:燃料(如H2、CH4)
正极:氧化剂(如O2)
中性条件下
负极: 2H2-4e- = 4H+
正极:O2+4e-+2H2O = 4OH-
酸性条件下
碱性条件下
负极: 2H2-4e- = 4H+
正极:O2+4e-+4H+ = 2H2O
总反应: 2H2+O2 = 2H2O
酸
性
负极:2H2+4OH--4e- = 4H2O
正极:O2+4e- +2H2O= 4OH-
总反应:2H2+O2 = 2H2O
碱
性
注意:涉及到两个电极方程式书写时,需要得失电子守恒
甲烷燃料电池
1.燃料电池总反应:CH4+2O2 = CO2+2H2O
2.正极: 2O2+8e- +8H+= 4H2O
3.负极:CH4-8e-+2H2O = CO2+8H+
1.燃料电池总反应:CH4+2OH-+2O2 = CO32-+3H2O
2.正极: 2O2+8e- +4H2O= 8OH-
3.负极:CH4-8e-+10OH- = CO32-+7H2O
电解质溶液:稀硫酸
电解质溶液:氢氧化钾溶液
方法解读:
②标化合价,得失电子
①注明反应物、产物
③添其他
酸性离子 用H+ H2O
若有碳元素参加反应生成 CO2
碱性离子 用OH- H2O
若有碳元素参加反应生成CO32-
正极:O2在酸性条件下生成H2O ,碱性条件下生成OH-
负极:C元素在酸性条件下生成CO2 ,碱性条件下生成CO32-
常见元素或物质 H C O Al
碱性 H2O CO32- OH- AlO2-
酸性 H+ CO2 H2O Al3+
熔融 金属氧化物 H2O CO2 O2-
Al3+
熔融 碳酸盐 H2O CO2 CO32-
H→H+, O2→O2-, C→CO2, Al→Al3+
【练习】
CH3OH燃料电池、电解质为KOH溶液,电池总
反应为
书写正负极电极反应。
2CH3OH+ 3O2 + 4KOH = 2K2CO3 + 6 H2O
正极:
负极:
2CH3OH-12e-+ 16OH -= 2CO32- + 12H2O
3O2+12e-+6H2O = 12OH -
4.微生物电池
微生物燃料电池是一种利用微生物将有机物中的化学能转化为电能的装置。
工作时温度不能太高
B
4. 共存原则:原电池的两极反应若均在一定介质中进行,
在酸性介质中,不可能出现OH-,
在碱性介质中,不可能出现H+ CO2
3. 必须遵循得失电子守恒、电荷守恒、原子守恒。
2. 正、负极反应具有加和性:
化学反应方程式=正极反应方程式+负极反应方程式。
1. 两极判断:先分析电池反应中有关物质元素化合价的变化,确定原电池的正极和负极。
规律总结:
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
