3.1电离平衡 课件(共41张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.1电离平衡 课件(共41张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 43.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-25 14:59:39 | ||
图片预览










文档简介
(共41张PPT)
第一节 电离平衡
第三章 水溶液中的离子反应与平衡
【情境创设】
盐酸主要用于卫生清洁,如洁厕剂的主要成分是盐酸(HCl),为什么不用醋酸(CH3COOH)?
为什么除水垢用醋酸(CH3COOH)、而不用盐酸(HCl)?
【知识回顾】
电解质、非电解质
①电解质: 在水溶液里或熔化状态下能够(自身电离)导电的化合物。
②非电解质: 在水溶液里和熔化状态下都不能导电的化合物。
如: 酸、碱、盐、部分金属氧化物、水等
如: 大多数有机物、非金属氧化物、氨气等
③电解质的导电能力:
离子浓度、离子所带电荷
【实验3-1】探究盐酸和醋酸的电离程度
取等体积、0.1 mol/L的盐酸和醋酸溶液,比较其pH值的大小,试验其导电能力,并分别与等量镁条反应。观察比较并记录现象。
0.1 mol/L HCl
0.1mol/L CH3COOH
pH
导电能力
与镁条反应
【实验探究】
0.1 mol/L HCl
0.1mol/L CH3COOH
pH
导电能力
与镁条反应
pH=1
pH≈3
强
弱
产生气泡速度较快
产生气泡速度较慢
结论:相同体积、相同浓度的盐酸和醋酸的电离程度不一样
0.1mol/L HCl(aq)
c(H+) =
10-1
=0.1 mol/L
0.1mol/L CH3COOH(aq)
c(H+) ≈
0.001 mol/L
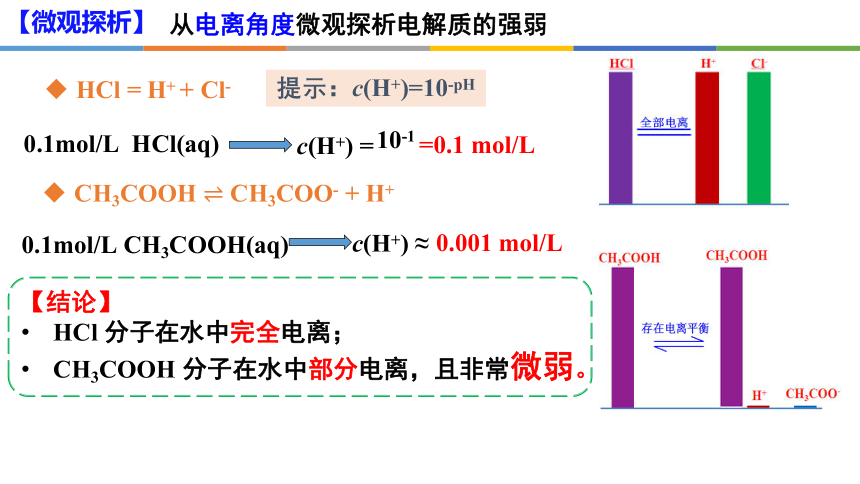
【结论】
HCl 分子在水中完全电离;
CH3COOH 分子在水中部分电离,且非常微弱。
从电离角度微观探析电解质的强弱
HCl = H+ + Cl-
CH3COOH CH3COO- + H+
提示:c(H+)=10-pH
【微观探析】
溶质在溶液中只以离子形式存在,没有分子。
在水溶液中能够全部电离的电解质称为强电解质
强
电解质
Cl- H3O+
H3O+ CH3COO- CH3COOH
在水溶液中只能部分电离的电解质称为弱电解质
溶质在溶液中大部分以分子形式存在,仅一少部分发生电离。
弱
电解质
一、强电解质和弱电解质
强电解质
①强酸(六大强酸)
HCl、HBr、HI、H SO 、HNO 、HClO
②强碱(四大强碱)
如KOH、Ba(OH) 、NaOH、Ca(OH)
③大部分盐:如NaCl、BaSO4 (包括难溶性盐)
④活泼金属氧化物:如Na O
【类别】
弱电解质
【类别】
弱酸: CH3COOH、HF、H S、HClO、H SO 、H PO 等
弱碱: NH3·H2O、Al(OH)3、Cu(OH) 、Fe(OH) 等
水
醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
CaCO3是卫生洁具常见的污染物之一。
去污原理如下:
CaCO3 + 2H+ = CO2↑ + H2O + Ca2+
相同浓度盐酸比醋酸能够提供更大的c(H+),可以增大去污反应的速率。
实际产品兼顾安全性与去除效果,确定产品有效成分及浓度。
学以致用
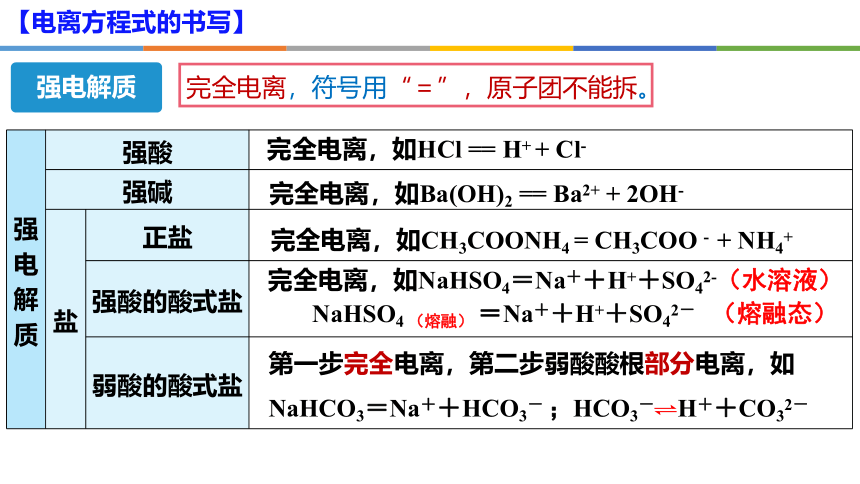
强电解质
完全电离,符号用“=”,原子团不能拆。
强电解质 强酸
强碱
盐 正盐
强酸的酸式盐
弱酸的酸式盐
完全电离,如HCl == H+ + Cl-
完全电离,如Ba(OH)2 == Ba2+ + 2OH-
完全电离,如CH3COONH4 = CH3COO - + NH4+
完全电离,如NaHSO4=Na++H++SO42-(水溶液)
第一步完全电离,第二步弱酸酸根部分电离,如
NaHCO3=Na++HCO3- ;HCO3- H++CO32-
NaHSO4 (熔融) =Na++H++SO42- (熔融态)
【电离方程式的书写】
部分电离,符号选用“ ”
弱电解质
弱电解质 一元弱酸
一元弱碱
H2O
多元弱酸
多元弱碱
碱式
酸式
两性氢氧化物双向电离
部分电离,CH3COOH H+ + CH3COO-
部分电离,NH3·H2O NH4+ + OH -
部分电离,H2O H+ + OH -
H2CO3 H+ +HCO3
;HCO3 H+ + CO32
Cu(OH)2 Cu2+ + 2OH
分步电离,一步写出
分步电离,分步写出
甲酸(HCOOH)又称蚁酸,酸性很强,有腐蚀性,能刺激皮肤出现红肿。甲酸存在手某些蚁类和毛虫的分泌物中。
从电离平衡的角度分析皮肤被蚂蚁、毛虫叮咬后出现红胂的原因。
已知人体血液中存在如下平衡:
H2O + CO2 H2CO3 H+ + HCO3-
【情境创设】
二、弱电解质的电离平衡
我们将冰醋酸加入水中,冰醋酸会发生如何的变化?
水
冰醋酸
c(CH3COOH) c(H+) c(CH3COO-) v(电离) v(结合)
开始时
接着
最后
0
0
最大
最大
0
增大
增大
减小
减小
增大
不变
不变
不变
不变
不变
CH3COOH CH3COO - + H+
电离
结合
反应速率
时间
v(电离成离子)
v(结合成分子)
v(电离) = v(结合)
电离平衡状态
1、弱电解质电离平衡状态的建立
弱电解质电离过程中,分子电离成离子的速率和离子结合成分子的速率随时间的变化
动:电离平衡是一种动态平衡
变:条件改变时,电离平衡发生移动
等:V电离 = V结合≠0
逆:弱电解质的电离是可逆过程
定:平衡时分子、离子的浓度不再变化
弱:研究对象是弱电解质
—勒夏特列原理
3、电离平衡的特征
在一定条件下,当弱电解质分子电离成离子的速率和离子重新结合生
成分子的速率相等时,电离过程就达到了电离平衡状态。
2、电离平衡的定义
(1)电离过程是吸热的。
(2)弱电解质的电离属于可逆过程,分子、离子共存,这完全不同于强电解质。
(3)弱电解质在溶液中的电离都是微弱的。一般来说,电离的分子极少,绝大多数以分子形式存在,离子和分子之间存在电离平衡。如0.1 mol·L-1的CH3COOH溶液中,c(H+)在1×10-3 mol·L-1左右。 电离方向是微粒数增多的过程.
4、弱电解质电离的特点
通常电解质越弱电离程度越小。
内因:
①温度
②浓度
③其他因素
外因:
电离平衡是动态平衡,遵循勒夏特列原理
特别说明:电离程度相当于化学反应中反应物的转化率
5、影响弱电解质电离平衡的因素
已电离弱电解质分子数
原弱电解质分子数
×100%
电离度 =
已电离的溶质浓度
溶质的初始浓度
= ————————×100%
①温度
【结论】由于电离过程吸热,升高温度,电离平衡向电离的方向移动,电离程度增大; 降低温度,电离平衡逆向移动,电离程度减小。
CH3COOH CH3COO- + H+
【思考】c(CH3COO-)和c(H+)怎样变化?
增大
△H>0
“越热越电离”
【特别注意】易挥发或易分解的弱电解质的电离平衡,温度过高,使分子浓度减小,平衡向逆向移动。
“越稀越电离”
a.加水稀释向电离的方向移动,电离程度增大,但离子浓度减小
b.增加弱电解质浓度,向电离的方向移动,但电离程度减小
c.加入同浓度的弱电解质溶液→平衡不移动→各微粒浓度不变、电离程度不变
②浓度
CH3COOH CH3COO- + H+
电离平衡逆向移动。
●加少量CH3COONa固体:
【总结】同离子效应:
在弱电解质溶液中,加入与弱电解质含有相同离子的易溶强电解质,抑制弱电解质电离,电离程度减小。
③其他因素
CH3COOH CH3COO- + H+
“同抑反促”
电离平衡正向移动。
●加少量镁粉或NaOH:
【总结】 加入能与弱电解质电离产生的某种离子反应的物质时,减少了该离子的浓度,促进了弱电解质的电离,使电离平衡向电离方向移动,电离程度增大。
请画出用水稀释冰醋酸时氢离子浓度随加水量的变化曲线,并分析变化的原因。
影响因素:
① CH3COOH电离程度②溶液体积
图中最高点之前, CH3COOH电离程度的增大是主要影响因素,溶液中离子总浓度增大,导电能力增强;最高点之后,溶液体积的增大是主要影响因素,溶液中离子总浓度减小,导电能力减弱。
【拓展延伸】
(P60-4)在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示:
(3)a、b、c三点对应的溶液中CH3COOH电离程度最大的是______。
(4)若使b点对应的溶液中c(CH3COO-)增大,c(H+)减小,可采用的方法是______(填序号)
① 加入H2O ②加入NaOH固体
③加入浓硫酸 ④ 加入Na2CO3固体
b>a>c
(1)“O”点不能导电的理由 。
(2)a、b、c三点溶液c(H+)由大到小的顺序为 。
没有自由移动的离子
C
②④
【练习】
CO2、H2CO3?
【思考】小孩大哭过后,容易出现抽抽搭搭,停不下来、喘不上气,或者手脚僵硬的情况。
已知人体血液中存在如下平衡:
H2O + CO2 H2CO3 H+ + HCO
3
人体血液的pH需维持在7.35~7.45。
当pH<7.35会导致酸中毒,pH大于7.45会导致碱中毒。
小孩大哭后出现的生理症状,与上述平衡相关,是随着哭泣,呼出大量CO2,平衡状态改变后,发生了轻微碱中毒。
学以致用
分析问题的化学本质
直接吸入大量CO2合理吗?
H2O + CO2 H2CO3 H+ + HCO
3
需要控制条件,使上述平衡正向移动
【思考】出现轻微碱中毒后,如何缓解中毒症状呢?
可用纸袋,罩于鼻、口上再呼吸,增加动脉血CO2浓度
严重时需及时就医
会窒息
三、电离平衡常数
【学习任务一】定量描述弱电解质的电离程度
1、含义:在一定温度下,当弱电解质达到电离平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数。这个常数叫做电离平衡常数,简称电离常数,用K表示。
通常用Ka、Kb分别表示弱酸、弱碱的电离平衡常数。
c(A -)、 c(B十)、 c(HA)和c(BOH) 均为达到电离平衡后各粒子在溶液中的浓度值
(1)一元弱酸HA的电离常数:根据HA H++A-,
可表示为
(2)一元弱碱BOH的电离常数:根据BOH B++OH-,
可表示为
Ka=
c ( H+) .c( A-)
c(HA)
Kb=
c ( B+).c( OH- )
c(BOH)
2、表示方法
(3)多元弱酸的电离是分步进行的,每一步各有电离常数。
通常用K1 、K2 、K3等来分别表示
=4.3×10-7
=5.6×10-11
注意事项:比较多元弱酸的各步电离常数可以发现,Ka1 >Ka2 >Ka3 ……当Ka1 Ka2 时,计算多元弱酸中的c (H+),或比较多元弱酸酸性的相对强弱时,通常只考虑第一步电离。 (口诀:分步进行,一步定性)。
H2CO3 H+ +
H+ + CO32-
H2CO3
Ka1=
Ka2=
(4)多元弱碱的电离一步写完。
Cu(OH)2 Cu2+ + 2OH-
K=
由于多元弱碱为难溶碱,所以一般不用电离平衡常数,而用第四节要学到的难溶物的溶度积常数。
3、影响电离平衡常数K的因素
【思考】对比如下数据,电离平衡常数受哪些因素的影响?
表1:25℃ 几种弱酸的 Ka
表2:不同温度下CH3COOH的 Ka
温度 Ka
0℃ 1.66×10-5
10℃ 1.73×10-5
25℃ 1.75×10-5
弱电解质 Ka
HF 6.3×10-4
CH3COOH 1.75×10-5
HCN 6.2×10-10
相同温度下,Ka 越大,弱酸越易电离,电离程度越大,酸性越强。
(2)外因:温度;升高温度,电离常数 K 增大。
(1)内因:弱酸的自身性质决定。
1、判断弱电解质的相对强弱
【学习任务二】电离平衡常数的应用
实验操作 向盛有2 mL 1mol/L 醋酸的试管中滴加1 mol/L Na2CO3溶液,观察现象。你能否由此推测Ka(CH3COOH)与Kal(H2CO3) 的大小?
实验现象
原理
结论
有气泡产生
反应生成了CO2,化学方程式为:
2CH3COOH + Na2CO3=2CH3COONa + H2O +CO2↑
CH3COOH的酸性比H2CO3的强,Ka(CH3COOH) > Ka1(H2CO3)
TP59
【实验3-2】
弱酸的Ka越大,电离程度越大,越容易电离出H+,酸性越强。
弱碱的Kb越大,电离程度越大,越容易电离出OH-,碱性越强。
2、判断复分解反应能否发生,以及确定产物
酸性:HCOOH > HCN
HCOOH+NaCN===HCN+HCOONa
【例题】 已知:Ka(HCOOH)=1.77×10-4 mol·L-1
Ka(HCN)=4.9×10-10 mol·L-1
HCOONa 与 HCN不反应
问下列反应是否能发生,若能发生请写出化学方程式:
(1)HCOOH与NaCN溶液:
(2)HCOONa 与 HCN溶液:
强酸制弱酸——弱酸与盐溶液的反应规律
3、比较溶液中离子浓度的大小
【例题】已知:磷酸存在的三步电离,这三步的电离常数大小进行比较,
第一步K1 > 第二步K2 > 第三步K3
C(H+) c(H2PO4-) c(HPO42-) c(PO43- ) c(OH-)
离子浓度:
>
>
>
>
一般弱酸的电离常数越小,酸性越弱,弱酸根离子结合氢离子的能力就越强。
酸性 :
CH3COOH>H2CO3>
CH3COO- _____ HCO3- _____ CO32-
<
<
结合H+能力:
4、判断离子结合质子的能力
【例】CH3COOH溶液加水稀释,
c(H+)减小,Ka不变,则 增大。
5、
判断浓度比
(1)K值的求算
【例题】在某温度时,溶质的物质的量浓度为 0.2 mol·L 1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10 3 mol·L 1,试计算该温度下NH3·H2O的电离常数Kb。
起始浓度/(mol·L 1)
变化浓度/(mol·L 1)
平衡浓度/(mol·L 1)
0.2
0
0
1.7×10 3
0.2 1.7×10 3
1.7×10 3
1.7×10 3
1.7×10 3
1.7×10 3
NH3·H2O NH4+ + OH
c(NH3·H2O)
Kb=
c(NH4+ )· c(OH )
=
(1.7×10 3)·(1.7×10 3)
(0.2 1.7×10 3)
0.2
≈
(1.7×10 3)·(1.7×10 3)
≈1.4×10 5
【学习任务三】电离平衡常数K的相关计算
【模型构建】
(1)列出“三段式”计算
(2)由于弱电解质的电离程度比较小,平衡时弱电解质的浓度(a-x) mol·L-1,一般近似为a mol·L-1。(即忽略弱电解质电离的部分)
CH3COOH CH3COO-+H+
起始浓度/(mol·L-1) a 0 0
变化浓度/(mol·L-1) x x x
平衡浓度/(mol·L-1) a-x x x
Ka=
C(酸根离子)
C(H+)
C(酸)
=
C(酸)
C2(H+)
(2)利用平衡常数求离子浓度
=
x·x
0.2
≈
1.75×10 5
变化浓度/(mol·L 1)
x
x
x
平衡浓度/(mol·L 1)
x
0.2 x
x
c(CH3COOH)=(0.2 x) mol·L 1 ≈ 0.2 mol·L 1
c(H+)= x = 0.00187 mol/L
【例题】已知25 ℃时,CH3COOH的Ka=1.75×10 5,计算0.2mol·L 1的CH3COOH达到电离平衡时c(H+)的浓度。
0
起始浓度/(mol·L 1)
0.2
0
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
(3)电离度的计算
【例】在某温度,溶质的物质的量浓度为 0.2 mol·L 1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10 3 mol·L 1,试计算NH3·H2O的电离度?
电离度:实际上是一种平衡转化率,表示弱电解质在水中的电离程度。
电离度=
1.7×10 3×V(溶液)
0.2×V(溶液)
×100%
=
0.85%
已电离弱电解质分子数
原弱电解质分子数
×100%
电离度 =
已电离的溶质浓度
溶质的初始浓度
= ————————×100%
四、一元强酸与一元弱酸的比较——规律总结
压强/kPa
时间/s
0
100
200
300
120
140
160
镁与盐酸、醋酸反应时气体压强随时间的变化示意图
2 mol/L盐酸
2 mol/L醋酸
【思考与讨论】向两个锥形瓶中各加入0.05 g镁条,盖紧橡胶塞,然后用注射器分别注入2 mL 2 mol·L-1盐酸、2 mL 2 mol·L-1醋酸,测得锥形瓶内气体的压强随时间的变化如图所示。请回答下列问题 :
(1)两个反应的反应速率及其变化有什么特点?
(2)反应结束时,两个锥形瓶内气体的压强基本相等,由此你能得出什么结论?
n(Mg) = 0.0021 mol
n(酸) = 0.004 mol
【结 论】
①等质量的镁分别与同体积同浓度的盐酸和醋酸反应时,与盐酸反应的速率大,与醋酸反应的速率小。
②过量的镁分别与同体积同浓度的盐酸和醋酸反应时,生成氢气的体积相同。
1、相同体积、相同物质的量浓度(c)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较 项目 酸 c(H+) 酸性 中和碱的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸 大 强 相同 相同 大
一元弱酸 小 弱 小
2、相同体积、相同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较项目 酸 c(H+) 酸性 中和碱的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸 相同 相同 小 少 相同
一元弱酸 大 多
3、一元强酸(HCl)与一元弱酸(CH3COOH)稀释图像比较
(1)相同体积、相同浓度的盐酸、醋酸
加水稀释相同的倍数,醋酸的pH大
加水稀释到相同pH,盐酸用水多
(2)相同体积、相同pH的盐酸、醋酸
加水稀释到相同的pH,醋酸加入的水多
加水稀释相同的倍数,盐酸的pH大
第一节 电离平衡
第三章 水溶液中的离子反应与平衡
【情境创设】
盐酸主要用于卫生清洁,如洁厕剂的主要成分是盐酸(HCl),为什么不用醋酸(CH3COOH)?
为什么除水垢用醋酸(CH3COOH)、而不用盐酸(HCl)?
【知识回顾】
电解质、非电解质
①电解质: 在水溶液里或熔化状态下能够(自身电离)导电的化合物。
②非电解质: 在水溶液里和熔化状态下都不能导电的化合物。
如: 酸、碱、盐、部分金属氧化物、水等
如: 大多数有机物、非金属氧化物、氨气等
③电解质的导电能力:
离子浓度、离子所带电荷
【实验3-1】探究盐酸和醋酸的电离程度
取等体积、0.1 mol/L的盐酸和醋酸溶液,比较其pH值的大小,试验其导电能力,并分别与等量镁条反应。观察比较并记录现象。
0.1 mol/L HCl
0.1mol/L CH3COOH
pH
导电能力
与镁条反应
【实验探究】
0.1 mol/L HCl
0.1mol/L CH3COOH
pH
导电能力
与镁条反应
pH=1
pH≈3
强
弱
产生气泡速度较快
产生气泡速度较慢
结论:相同体积、相同浓度的盐酸和醋酸的电离程度不一样
0.1mol/L HCl(aq)
c(H+) =
10-1
=0.1 mol/L
0.1mol/L CH3COOH(aq)
c(H+) ≈
0.001 mol/L
【结论】
HCl 分子在水中完全电离;
CH3COOH 分子在水中部分电离,且非常微弱。
从电离角度微观探析电解质的强弱
HCl = H+ + Cl-
CH3COOH CH3COO- + H+
提示:c(H+)=10-pH
【微观探析】
溶质在溶液中只以离子形式存在,没有分子。
在水溶液中能够全部电离的电解质称为强电解质
强
电解质
Cl- H3O+
H3O+ CH3COO- CH3COOH
在水溶液中只能部分电离的电解质称为弱电解质
溶质在溶液中大部分以分子形式存在,仅一少部分发生电离。
弱
电解质
一、强电解质和弱电解质
强电解质
①强酸(六大强酸)
HCl、HBr、HI、H SO 、HNO 、HClO
②强碱(四大强碱)
如KOH、Ba(OH) 、NaOH、Ca(OH)
③大部分盐:如NaCl、BaSO4 (包括难溶性盐)
④活泼金属氧化物:如Na O
【类别】
弱电解质
【类别】
弱酸: CH3COOH、HF、H S、HClO、H SO 、H PO 等
弱碱: NH3·H2O、Al(OH)3、Cu(OH) 、Fe(OH) 等
水
醋酸的腐蚀性比盐酸的小,为什么不用醋酸代替盐酸呢?
CaCO3是卫生洁具常见的污染物之一。
去污原理如下:
CaCO3 + 2H+ = CO2↑ + H2O + Ca2+
相同浓度盐酸比醋酸能够提供更大的c(H+),可以增大去污反应的速率。
实际产品兼顾安全性与去除效果,确定产品有效成分及浓度。
学以致用
强电解质
完全电离,符号用“=”,原子团不能拆。
强电解质 强酸
强碱
盐 正盐
强酸的酸式盐
弱酸的酸式盐
完全电离,如HCl == H+ + Cl-
完全电离,如Ba(OH)2 == Ba2+ + 2OH-
完全电离,如CH3COONH4 = CH3COO - + NH4+
完全电离,如NaHSO4=Na++H++SO42-(水溶液)
第一步完全电离,第二步弱酸酸根部分电离,如
NaHCO3=Na++HCO3- ;HCO3- H++CO32-
NaHSO4 (熔融) =Na++H++SO42- (熔融态)
【电离方程式的书写】
部分电离,符号选用“ ”
弱电解质
弱电解质 一元弱酸
一元弱碱
H2O
多元弱酸
多元弱碱
碱式
酸式
两性氢氧化物双向电离
部分电离,CH3COOH H+ + CH3COO-
部分电离,NH3·H2O NH4+ + OH -
部分电离,H2O H+ + OH -
H2CO3 H+ +HCO3
;HCO3 H+ + CO32
Cu(OH)2 Cu2+ + 2OH
分步电离,一步写出
分步电离,分步写出
甲酸(HCOOH)又称蚁酸,酸性很强,有腐蚀性,能刺激皮肤出现红肿。甲酸存在手某些蚁类和毛虫的分泌物中。
从电离平衡的角度分析皮肤被蚂蚁、毛虫叮咬后出现红胂的原因。
已知人体血液中存在如下平衡:
H2O + CO2 H2CO3 H+ + HCO3-
【情境创设】
二、弱电解质的电离平衡
我们将冰醋酸加入水中,冰醋酸会发生如何的变化?
水
冰醋酸
c(CH3COOH) c(H+) c(CH3COO-) v(电离) v(结合)
开始时
接着
最后
0
0
最大
最大
0
增大
增大
减小
减小
增大
不变
不变
不变
不变
不变
CH3COOH CH3COO - + H+
电离
结合
反应速率
时间
v(电离成离子)
v(结合成分子)
v(电离) = v(结合)
电离平衡状态
1、弱电解质电离平衡状态的建立
弱电解质电离过程中,分子电离成离子的速率和离子结合成分子的速率随时间的变化
动:电离平衡是一种动态平衡
变:条件改变时,电离平衡发生移动
等:V电离 = V结合≠0
逆:弱电解质的电离是可逆过程
定:平衡时分子、离子的浓度不再变化
弱:研究对象是弱电解质
—勒夏特列原理
3、电离平衡的特征
在一定条件下,当弱电解质分子电离成离子的速率和离子重新结合生
成分子的速率相等时,电离过程就达到了电离平衡状态。
2、电离平衡的定义
(1)电离过程是吸热的。
(2)弱电解质的电离属于可逆过程,分子、离子共存,这完全不同于强电解质。
(3)弱电解质在溶液中的电离都是微弱的。一般来说,电离的分子极少,绝大多数以分子形式存在,离子和分子之间存在电离平衡。如0.1 mol·L-1的CH3COOH溶液中,c(H+)在1×10-3 mol·L-1左右。 电离方向是微粒数增多的过程.
4、弱电解质电离的特点
通常电解质越弱电离程度越小。
内因:
①温度
②浓度
③其他因素
外因:
电离平衡是动态平衡,遵循勒夏特列原理
特别说明:电离程度相当于化学反应中反应物的转化率
5、影响弱电解质电离平衡的因素
已电离弱电解质分子数
原弱电解质分子数
×100%
电离度 =
已电离的溶质浓度
溶质的初始浓度
= ————————×100%
①温度
【结论】由于电离过程吸热,升高温度,电离平衡向电离的方向移动,电离程度增大; 降低温度,电离平衡逆向移动,电离程度减小。
CH3COOH CH3COO- + H+
【思考】c(CH3COO-)和c(H+)怎样变化?
增大
△H>0
“越热越电离”
【特别注意】易挥发或易分解的弱电解质的电离平衡,温度过高,使分子浓度减小,平衡向逆向移动。
“越稀越电离”
a.加水稀释向电离的方向移动,电离程度增大,但离子浓度减小
b.增加弱电解质浓度,向电离的方向移动,但电离程度减小
c.加入同浓度的弱电解质溶液→平衡不移动→各微粒浓度不变、电离程度不变
②浓度
CH3COOH CH3COO- + H+
电离平衡逆向移动。
●加少量CH3COONa固体:
【总结】同离子效应:
在弱电解质溶液中,加入与弱电解质含有相同离子的易溶强电解质,抑制弱电解质电离,电离程度减小。
③其他因素
CH3COOH CH3COO- + H+
“同抑反促”
电离平衡正向移动。
●加少量镁粉或NaOH:
【总结】 加入能与弱电解质电离产生的某种离子反应的物质时,减少了该离子的浓度,促进了弱电解质的电离,使电离平衡向电离方向移动,电离程度增大。
请画出用水稀释冰醋酸时氢离子浓度随加水量的变化曲线,并分析变化的原因。
影响因素:
① CH3COOH电离程度②溶液体积
图中最高点之前, CH3COOH电离程度的增大是主要影响因素,溶液中离子总浓度增大,导电能力增强;最高点之后,溶液体积的增大是主要影响因素,溶液中离子总浓度减小,导电能力减弱。
【拓展延伸】
(P60-4)在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示:
(3)a、b、c三点对应的溶液中CH3COOH电离程度最大的是______。
(4)若使b点对应的溶液中c(CH3COO-)增大,c(H+)减小,可采用的方法是______(填序号)
① 加入H2O ②加入NaOH固体
③加入浓硫酸 ④ 加入Na2CO3固体
b>a>c
(1)“O”点不能导电的理由 。
(2)a、b、c三点溶液c(H+)由大到小的顺序为 。
没有自由移动的离子
C
②④
【练习】
CO2、H2CO3?
【思考】小孩大哭过后,容易出现抽抽搭搭,停不下来、喘不上气,或者手脚僵硬的情况。
已知人体血液中存在如下平衡:
H2O + CO2 H2CO3 H+ + HCO
3
人体血液的pH需维持在7.35~7.45。
当pH<7.35会导致酸中毒,pH大于7.45会导致碱中毒。
小孩大哭后出现的生理症状,与上述平衡相关,是随着哭泣,呼出大量CO2,平衡状态改变后,发生了轻微碱中毒。
学以致用
分析问题的化学本质
直接吸入大量CO2合理吗?
H2O + CO2 H2CO3 H+ + HCO
3
需要控制条件,使上述平衡正向移动
【思考】出现轻微碱中毒后,如何缓解中毒症状呢?
可用纸袋,罩于鼻、口上再呼吸,增加动脉血CO2浓度
严重时需及时就医
会窒息
三、电离平衡常数
【学习任务一】定量描述弱电解质的电离程度
1、含义:在一定温度下,当弱电解质达到电离平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数。这个常数叫做电离平衡常数,简称电离常数,用K表示。
通常用Ka、Kb分别表示弱酸、弱碱的电离平衡常数。
c(A -)、 c(B十)、 c(HA)和c(BOH) 均为达到电离平衡后各粒子在溶液中的浓度值
(1)一元弱酸HA的电离常数:根据HA H++A-,
可表示为
(2)一元弱碱BOH的电离常数:根据BOH B++OH-,
可表示为
Ka=
c ( H+) .c( A-)
c(HA)
Kb=
c ( B+).c( OH- )
c(BOH)
2、表示方法
(3)多元弱酸的电离是分步进行的,每一步各有电离常数。
通常用K1 、K2 、K3等来分别表示
=4.3×10-7
=5.6×10-11
注意事项:比较多元弱酸的各步电离常数可以发现,Ka1 >Ka2 >Ka3 ……当Ka1 Ka2 时,计算多元弱酸中的c (H+),或比较多元弱酸酸性的相对强弱时,通常只考虑第一步电离。 (口诀:分步进行,一步定性)。
H2CO3 H+ +
H+ + CO32-
H2CO3
Ka1=
Ka2=
(4)多元弱碱的电离一步写完。
Cu(OH)2 Cu2+ + 2OH-
K=
由于多元弱碱为难溶碱,所以一般不用电离平衡常数,而用第四节要学到的难溶物的溶度积常数。
3、影响电离平衡常数K的因素
【思考】对比如下数据,电离平衡常数受哪些因素的影响?
表1:25℃ 几种弱酸的 Ka
表2:不同温度下CH3COOH的 Ka
温度 Ka
0℃ 1.66×10-5
10℃ 1.73×10-5
25℃ 1.75×10-5
弱电解质 Ka
HF 6.3×10-4
CH3COOH 1.75×10-5
HCN 6.2×10-10
相同温度下,Ka 越大,弱酸越易电离,电离程度越大,酸性越强。
(2)外因:温度;升高温度,电离常数 K 增大。
(1)内因:弱酸的自身性质决定。
1、判断弱电解质的相对强弱
【学习任务二】电离平衡常数的应用
实验操作 向盛有2 mL 1mol/L 醋酸的试管中滴加1 mol/L Na2CO3溶液,观察现象。你能否由此推测Ka(CH3COOH)与Kal(H2CO3) 的大小?
实验现象
原理
结论
有气泡产生
反应生成了CO2,化学方程式为:
2CH3COOH + Na2CO3=2CH3COONa + H2O +CO2↑
CH3COOH的酸性比H2CO3的强,Ka(CH3COOH) > Ka1(H2CO3)
TP59
【实验3-2】
弱酸的Ka越大,电离程度越大,越容易电离出H+,酸性越强。
弱碱的Kb越大,电离程度越大,越容易电离出OH-,碱性越强。
2、判断复分解反应能否发生,以及确定产物
酸性:HCOOH > HCN
HCOOH+NaCN===HCN+HCOONa
【例题】 已知:Ka(HCOOH)=1.77×10-4 mol·L-1
Ka(HCN)=4.9×10-10 mol·L-1
HCOONa 与 HCN不反应
问下列反应是否能发生,若能发生请写出化学方程式:
(1)HCOOH与NaCN溶液:
(2)HCOONa 与 HCN溶液:
强酸制弱酸——弱酸与盐溶液的反应规律
3、比较溶液中离子浓度的大小
【例题】已知:磷酸存在的三步电离,这三步的电离常数大小进行比较,
第一步K1 > 第二步K2 > 第三步K3
C(H+) c(H2PO4-) c(HPO42-) c(PO43- ) c(OH-)
离子浓度:
>
>
>
>
一般弱酸的电离常数越小,酸性越弱,弱酸根离子结合氢离子的能力就越强。
酸性 :
CH3COOH>H2CO3>
CH3COO- _____ HCO3- _____ CO32-
<
<
结合H+能力:
4、判断离子结合质子的能力
【例】CH3COOH溶液加水稀释,
c(H+)减小,Ka不变,则 增大。
5、
判断浓度比
(1)K值的求算
【例题】在某温度时,溶质的物质的量浓度为 0.2 mol·L 1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10 3 mol·L 1,试计算该温度下NH3·H2O的电离常数Kb。
起始浓度/(mol·L 1)
变化浓度/(mol·L 1)
平衡浓度/(mol·L 1)
0.2
0
0
1.7×10 3
0.2 1.7×10 3
1.7×10 3
1.7×10 3
1.7×10 3
1.7×10 3
NH3·H2O NH4+ + OH
c(NH3·H2O)
Kb=
c(NH4+ )· c(OH )
=
(1.7×10 3)·(1.7×10 3)
(0.2 1.7×10 3)
0.2
≈
(1.7×10 3)·(1.7×10 3)
≈1.4×10 5
【学习任务三】电离平衡常数K的相关计算
【模型构建】
(1)列出“三段式”计算
(2)由于弱电解质的电离程度比较小,平衡时弱电解质的浓度(a-x) mol·L-1,一般近似为a mol·L-1。(即忽略弱电解质电离的部分)
CH3COOH CH3COO-+H+
起始浓度/(mol·L-1) a 0 0
变化浓度/(mol·L-1) x x x
平衡浓度/(mol·L-1) a-x x x
Ka=
C(酸根离子)
C(H+)
C(酸)
=
C(酸)
C2(H+)
(2)利用平衡常数求离子浓度
=
x·x
0.2
≈
1.75×10 5
变化浓度/(mol·L 1)
x
x
x
平衡浓度/(mol·L 1)
x
0.2 x
x
c(CH3COOH)=(0.2 x) mol·L 1 ≈ 0.2 mol·L 1
c(H+)= x = 0.00187 mol/L
【例题】已知25 ℃时,CH3COOH的Ka=1.75×10 5,计算0.2mol·L 1的CH3COOH达到电离平衡时c(H+)的浓度。
0
起始浓度/(mol·L 1)
0.2
0
Ka=
c(CH3COO )·c(H+)
c(CH3COOH)
(3)电离度的计算
【例】在某温度,溶质的物质的量浓度为 0.2 mol·L 1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10 3 mol·L 1,试计算NH3·H2O的电离度?
电离度:实际上是一种平衡转化率,表示弱电解质在水中的电离程度。
电离度=
1.7×10 3×V(溶液)
0.2×V(溶液)
×100%
=
0.85%
已电离弱电解质分子数
原弱电解质分子数
×100%
电离度 =
已电离的溶质浓度
溶质的初始浓度
= ————————×100%
四、一元强酸与一元弱酸的比较——规律总结
压强/kPa
时间/s
0
100
200
300
120
140
160
镁与盐酸、醋酸反应时气体压强随时间的变化示意图
2 mol/L盐酸
2 mol/L醋酸
【思考与讨论】向两个锥形瓶中各加入0.05 g镁条,盖紧橡胶塞,然后用注射器分别注入2 mL 2 mol·L-1盐酸、2 mL 2 mol·L-1醋酸,测得锥形瓶内气体的压强随时间的变化如图所示。请回答下列问题 :
(1)两个反应的反应速率及其变化有什么特点?
(2)反应结束时,两个锥形瓶内气体的压强基本相等,由此你能得出什么结论?
n(Mg) = 0.0021 mol
n(酸) = 0.004 mol
【结 论】
①等质量的镁分别与同体积同浓度的盐酸和醋酸反应时,与盐酸反应的速率大,与醋酸反应的速率小。
②过量的镁分别与同体积同浓度的盐酸和醋酸反应时,生成氢气的体积相同。
1、相同体积、相同物质的量浓度(c)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较 项目 酸 c(H+) 酸性 中和碱的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸 大 强 相同 相同 大
一元弱酸 小 弱 小
2、相同体积、相同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较项目 酸 c(H+) 酸性 中和碱的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸 相同 相同 小 少 相同
一元弱酸 大 多
3、一元强酸(HCl)与一元弱酸(CH3COOH)稀释图像比较
(1)相同体积、相同浓度的盐酸、醋酸
加水稀释相同的倍数,醋酸的pH大
加水稀释到相同pH,盐酸用水多
(2)相同体积、相同pH的盐酸、醋酸
加水稀释到相同的pH,醋酸加入的水多
加水稀释相同的倍数,盐酸的pH大
