2024人教版新教材高中化学必修第一册同步练习--第1课时 元素性质的周期性变化规律(含解析)
文档属性
| 名称 | 2024人教版新教材高中化学必修第一册同步练习--第1课时 元素性质的周期性变化规律(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 454.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-26 09:29:50 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2024人教版新教材高中化学必修第一册
第二节 元素周期律
第1课时 元素性质的周期性变化规律
基础过关练
题组一 元素周期律
1.(2020福建厦门期中)下列关于元素性质递变规律的说法正确的是( )
A.第二周期元素从左到右,最高正价从+1递增到+7
B.第三周期非金属元素从左到右,非金属性逐渐减弱
C.第ⅠA族金属元素从上到下,金属性逐渐增强
D.第ⅦA族元素从上到下,简单氢化物稳定性逐渐增强
2.(2022河北唐山期末)下列有关比较中,不正确的是( )
A.气态氢化物的热稳定性:NH3>CH4
B.酸性:HClO>H2SO4
C.碱性:NaOHD.原子半径:S3.(2021北京顺义期末)下列事实不能用元素周期律知识解释的是( )
A.非金属性:Cl>S
B.热稳定性:HBr>HI
C.酸性:HClO4>H2SO3
D.碱性:NaOH>Mg(OH)2
题组二 微粒半径的大小比较
4.下列粒子半径大小比较正确的是( )
A.原子半径:F>Cl
B.原子半径:钠>硫>氯
C.离子半径:S2-D.第三周期元素的阳离子半径从左到右逐渐增大
5.(2022辽宁辽阳期末)X、Y、Z均为元素周期表中前三周期元素,Xn+、Yn-、Z(n+1)-三种简单离子的电子层结构相同,下列说法正确的是( )
A.原子序数:Z>X
B.原子半径:Y>Z
C.气态氢化物的稳定性:H(n+1)Z>HnY
D.离子半径:Yn->Xn+
题组三 元素金属性与非金属性的比较
6.下列叙述中金属M的活泼性肯定比金属N的活泼性强的是( )
A.M原子的最外层电子数比N原子的最外层电子数少
B.常温时,M能从水中置换出氢,而N不能
C.1 mol M从酸中置换H+生成的H2比1 mol N从酸中置换H+生成的H2多
D.M的氧化物对应水化物的碱性比N的氧化物对应水化物的碱性强
7.(2022黑龙江哈尔滨期末)X、Y分别代表两种非金属元素,下列不能说明非金属性X比Y强的是( )
A.X的氧化物对应水化物的酸性比Y的氧化物对应水化物的酸性强
B.Y-的还原性强于X-
C.X的单质X2能将Y的阴离子Y-氧化为Y2
D.X、Y的单质分别与H2化合,产物中前者的稳定性比后者强
能力提升练
题组一 利用元素周期律推测陌生元素或物质的性质
1.(2021天津六校期末)运用元素周期律分析下面的推断,其中不正确的是( )
A.锂与水反应比钠与水反应剧烈
B.砹为有色固体,AgAt难溶于水也不溶于稀硝酸
C.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂
D.HBrO4的酸性比HIO4的酸性强
2.(2021山西太原期末)硒是人体所需的一种微量元素,它与氧、硫位于同一主族。下列有关硒的推测错误的是( )
A.常温下单质为固体
B.单质的密度大于硫
C.元素有非金属性
D.化合价只有+4价、+6价
3.(2022黑龙江铁人中学期末)几种短周期元素的原子半径及常见化合价见下表:
元素代号 常见化合价 原子半径/nm
A -1 0.071
B -2 0.074
D +4、-4 0.077
E -1 0.099
G +5、-3 0.110
H +3 0.143
I +2 0.160
J +1 0.186
分析判断下列说法正确的是( )
A.D、H、J的氧化物分别为酸性氧化物、两性氧化物、碱性氧化物
B.A、H、J的离子半径由大到小的顺序是A>J>H
C.G元素的单质不存在同素异形体
D.I在DB2中燃烧生成两种化合物
4.科学家预测第114号元素具有良好的力学、光学、电学性质,将它命名为“类铅”。以下对“类铅”的叙述错误的是( )
A.位于第七周期第ⅣA族,是金属元素
B.主要化合价为+2、+4价
C.最高价氧化物有较强氧化性
D.“类铅”的原子半径小于同主族其他元素
5.迄今为止我国相关部门已经发布了113号Nh、115号Mc、116号Lv、117号Ts、118号Og等元素的中文名称,分别是:、、、、。下列有关推断正确的是( )
A.这五种元素均为主族元素
B.Nh的最高价氧化物是一种典型的两性氧化物
C.Ts的简单阴离子比该族上一周期简单阴离子的还原性弱
D.Og在通常状况下呈气态,其余四种为固态
题组二 元素周期律的综合应用
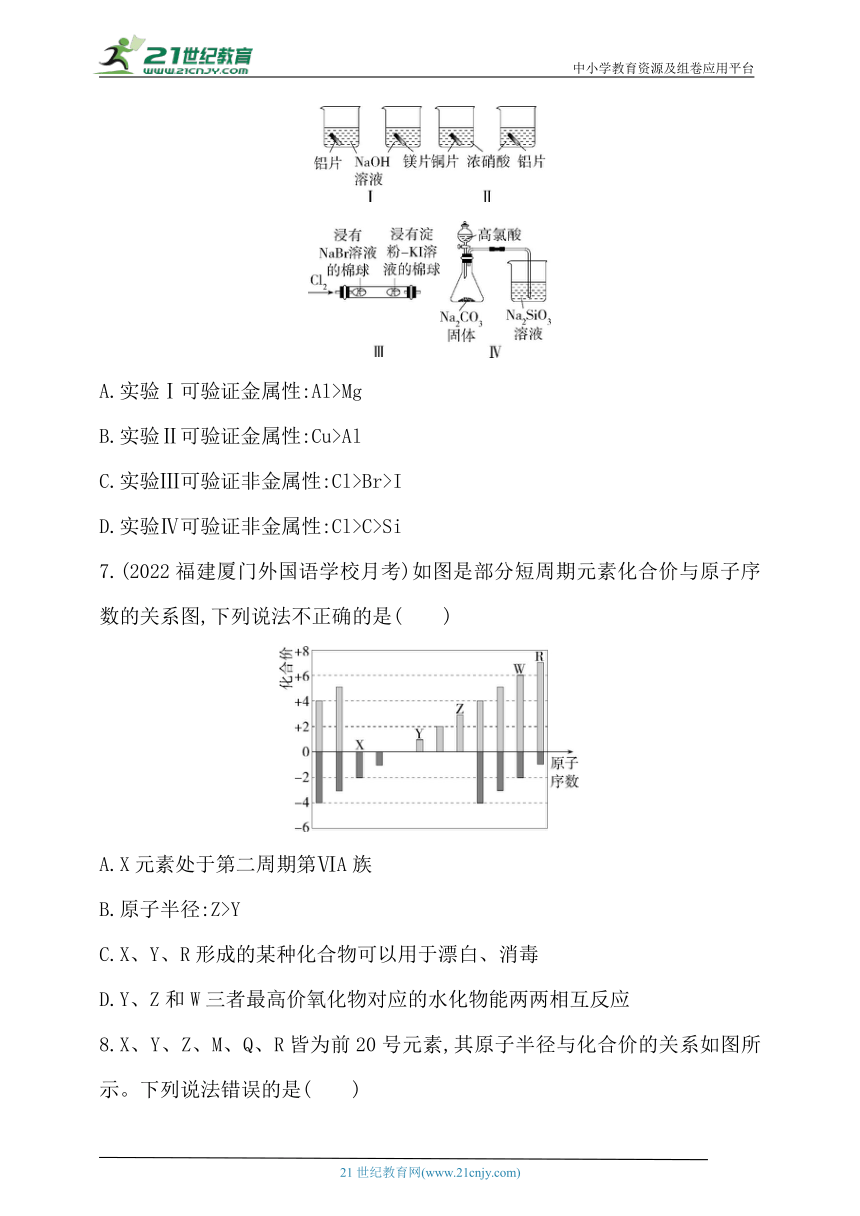
6.下列实验或事实能证明相应结论的是( )
A.实验Ⅰ可验证金属性:Al>Mg
B.实验Ⅱ可验证金属性:Cu>Al
C.实验Ⅲ可验证非金属性:Cl>Br>I
D.实验Ⅳ可验证非金属性:Cl>C>Si
7.(2022福建厦门外国语学校月考)如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
A.X元素处于第二周期第ⅥA族
B.原子半径:Z>Y
C.X、Y、R形成的某种化合物可以用于漂白、消毒
D.Y、Z和W三者最高价氧化物对应的水化物能两两相互反应
8.X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是( )
A.Q位于第三周期第ⅠA族
B.X、Y、Z三种元素组成的化合物可能是盐或碱
C.简单离子半径:M->Q+>R2+
D.Z与M的最高价氧化物对应的水化物均为强酸
9.(2022湘赣粤名校联考)元素周期表与元素周期律在学习、研究中有很重要的作用。下表所示为某5种元素的相关信息,已知W、X都位于第三周期。
元素 信息
Q 地壳中含量最高的元素
W 最高化合价为+7价
X 最高价氧化物对应的水化物在本周期中碱性最强
Y 焰色试验(透过蓝色钴玻璃)的火焰呈紫色
Z 原子结构示意图为
回答下列问题:
(1)W在元素周期表中的位置为 ,X的最高价氧化物对应的水化物的化学式为 。
(2)Y的单质与水反应的离子方程式是 。
(3)金属性:Y (填“>”或“<”)X,用原子结构解释原因:
。
(4)下列对于Z及其化合物的推断中正确的是 (填字母)。
A.Z的化合价中有-1和+7
B.Z的最高价氧化物对应水化物的酸性弱于W的最高价氧化物对应水化物的酸性
C.Z元素单质的氧化性强于W元素单质的氧化性
(5)将X元素的单质在Q元素的单质中点燃生成M,预测将M投入硫酸亚铁溶液中,主要的反应现象是 。
答案全解全析
基础过关练
1.C 2.B 3.C 4.B 5.D 6.B 7.A
1.C 第二周期中O无最高正价、F无正价,A错误;同周期主族元素从左到右非金属性依次增强,B错误;同主族元素从上到下原子半径依次增大,金属性依次增强,C正确;通常情况下,非金属性越强,氢化物越稳定,第ⅦA族元素从上到下非金属性依次减弱,则简单氢化物稳定性逐渐减弱,D错误。
2.B 根据非金属性:N>C,可知气态氢化物的热稳定性:NH3>CH4,A正确;根据非金属性:Cl>S,可知酸性:HClO4>H2SO4,HClO是弱酸,B错误;根据金属性:Na3.C 同一周期的主族元素,从左到右金属性逐渐减弱,非金属性逐渐增强,A能用元素周期律知识解释;同一主族元素,从上到下非金属性逐渐减弱,金属性逐渐增强,非金属元素的简单氢化物的热稳定性逐渐减弱,B能用元素周期律知识解释;同一周期的元素,从左到右最高价氧化物对应水化物的碱性逐渐减弱,酸性逐渐增强,而H2SO3不是S元素最高价氧化物对应的水化物,C不能用元素周期律知识解释;同一周期的元素,从左到右最高价氧化物对应水化物的碱性逐渐减弱,碱性:NaOH>Mg(OH)2,D能用元素周期律知识解释。
4.B F与Cl的最外层电子数相同,随着电子层数的递增原子半径逐渐增大,所以Cl的原子半径大于F,A错误;钠、硫、氯原子的电子层数相同,随着原子序数的递增,原子半径逐渐减小,B正确;电子层结构相同的离子,核电荷数越大,半径越小,C错误;第三周期元素的阳离子半径从左到右逐渐减小,D错误。
方法技巧
影响微粒半径大小的因素有:①电子层数的多少;②原子核对核外电子的吸引力的大小;③核外电子数的多少。
5.D 根据Xn+、Yn-、Z(n+1)-三种简单离子的电子层结构相同,可知X在Y、Z的下一周期,由所带电荷数目可知Z、Y左右相邻。三种元素在周期表中的大致位置为
…… Z Y
X ……
则原子序数:ZXn+,D正确。
6.B 最外层电子数的多少以及从酸中置换出H2的多少与金属元素的金属性的强弱无关,A、C项错误;金属的活泼性越强,越易与水反应,常温时,M能从水中置换出氢,而N不能,说明金属的活泼性M比N强,B项正确;由元素的最高价氧化物对应的水化物的碱性强弱来判断金属性的强弱,而不是氧化物对应的水化物,D项错误。
7.A 元素非金属性强弱可由最高价氧化物对应水化物的酸性强弱来判断,选项中没有指明是否是最高价氧化物,无法判断非金属性强弱,A符合题意;元素非金属性越弱,其离子的还原性越强,B不符合题意;单质X2能与Y-发生置换反应生成Y2,说明非金属性:X>Y,C不符合题意;单质与H2化合,根据产物的稳定性可知非金属性:X>Y,D不符合题意。
能力提升练
1.A 2.D 3.B 4.D 5.D 6.D 7.B 8.C
1.A 锂与钠是同主族元素,从上到下,金属性逐渐增强,所以钠与水反应比锂与水反应更剧烈,A项错误;砹为卤族元素,从上到下,单质颜色变深,根据氯化银的性质推断AgAt难溶于水也不溶于稀硝酸,B项正确;铷为碱金属元素,碱金属元素从上到下,在氧气中燃烧的产物越来越复杂,则铷(Rb)的燃烧产物比钠的燃烧产物更复杂,C项正确;卤族元素从上到下,最高价氧化物对应水化物的酸性逐渐减弱,则HBrO4的酸性比HIO4的酸性强,D项正确。
2.D 同一主族从上到下,非金属单质的沸点逐渐升高,常温下S的单质呈固态,因此常温下,硒单质为固体,A正确;同主族元素从上到下,单质的密度呈增大趋势,硒的密度大于硫,B正确;硒元素属于非金属元素,具有非金属性,C正确;同一主族元素具有相似的化学性质,硒在形成化合物时,与硫元素有相似之处,化合物中硒的化合价可显-2价、+4价、+6价,D错误。
3.B 本题是结合原子半径和主要化合价数据的元素推断题,解答本题需从-2价找突破口,确定B为O元素,再结合化合价相同的元素确定元素所在的主族,根据原子半径大小确定元素所在的周期,据此可逐一完成各元素的推断。根据B元素常见化合价为-2价及其原子半径可确定B为O元素,结合A的原子半径比B小可确定A为F元素,由D的化合价可知其为第ⅣA族元素,原子半径与O元素接近,即D为第二周期的C元素;结合A、E均为-1价,E应为Cl元素;根据G元素的化合价可知其位于第ⅤA族,其半径比C元素大,即G为第三周期P元素,再结合H、I、J的化合价可确定分别为Al、Mg、Na元素。CO不是酸性氧化物,Al2O3是两性氧化物,Na2O2不是碱性氧化物,A错误;根据电子层结构相同的离子,核电荷数越多离子半径越小,可判断离子半径:F->Na+>Al3+,B正确;磷元素的单质有红磷和白磷,二者互为同素异形体,C错误;Mg在CO2中燃烧生成MgO和C,D错误。
反思升华
解答关于元素的推断题,关键是根据题中原子半径和主要化合价等信息快速找到解题的突破口,尤其注意特殊化合价、化合价代数和等,快速完成推断。具体到本题的解答还需注意,C元素有CO、CO2两种氧化物,分别为不成盐氧化物和酸性氧化物,而Na与O2反应可生成Na2O、Na2O2两种物质,Na2O是碱性氧化物,Na2O2不是碱性氧化物。
4.D 第七周期稀有气体元素的原子序数为118,可知114号元素位于第七周期第ⅣA族,该元素为金属元素,A正确;第ⅣA族元素的主要化合价为+2、+4价,B正确;最高价氧化物易得到电子,有较强氧化性,C正确;“类铅”是第ⅣA族中电子层数最多的原子,原子半径最大,D错误。
5.D Og为0族元素,不是主族元素,故A错误;113号Nh位于周期表中第七周期第ⅢA族,同一主族从上到下,金属性逐渐增强,则Nh的最高价氧化物为碱性氧化物,故B错误;Ts的非金属性比上一周期同主族元素的非金属性弱,所以Ts的简单阴离子比该族上一周期简单阴离子的还原性强,故C错误;118号元素为稀有气体元素,为0族元素,在通常状况下呈气态,113号、115号、116号、117号分别为第ⅢA、ⅤA、ⅥA、ⅦA族元素,根据主族元素的单质的状态变化规律可知它们为固体,故D正确。
6.D 验证元素的金属性的强弱,可由金属单质与酸反应置换出氢气的难易程度来判断,而不是与NaOH溶液反应,A项错误;Al的金属性强于Cu,B项错误;Cl2与NaBr溶液反应,使左侧棉球变为橙色,未反应的Cl2继续与KI溶液反应置换出I2,使右侧棉球变为蓝色,能证明非金属性:Cl>Br、Cl>I,但不能证明非金属性:Br>I,C项错误;实验Ⅳ可证明酸性HClO4>H2CO3>H2SiO3,这三种酸为Cl、C、Si的最高价氧化物对应的水化物,故能验证非金属性:Cl>C>Si,D项正确。
归纳总结
元素金属性、非金属性的比较方法
①金属性比较:
a.金属单质与水或酸反应生成氢气的难易程度;
b.最高价氧化物对应水化物的碱性强弱。
②非金属性比较:
a.非金属单质与氢气反应生成气态氢化物的难易程度以及氢化物的稳定性;
b.最高价氧化物对应水化物的酸性强弱。
7.B 结合图像中的信息可知X为O元素,Y为Na元素,Z为Al元素,W为S元素,R为Cl元素。X(O)元素核外有2个电子层,且最外层有6个电子,即X元素位于第二周期第ⅥA族,A正确;同周期主族元素随核电荷数递增原子半径递减,即原子半径:Y>Z,B错误;O、Na、Cl元素形成的化合物NaClO可以用于漂白、消毒,C正确;Na、Al、S最高价氧化物对应的水化物分别为NaOH、Al(OH)3、H2SO4,Al(OH)3为两性氢氧化物,三种物质能两两相互反应,D正确。
8.C 由Y的化合价只有-2价推断Y为氧元素,X的半径比氧原子的半径小且有+1价,则X为氢元素,M的最高正价为+7价,最低负价为-1价,则M为氯元素,Z的半径小于Cl,且最低负价为-3价,最高价为+5价,则Z为氮元素,Q只有+1价,且Q的半径大于氯原子半径,但小于只有+2价的R,故Q为钠元素,R为钙元素。Na位于第三周期第ⅠA族,A正确;X、Y、Z三种元素分别代表H、O、N,可以形成硝酸、硝酸铵和一水合氨,故B正确;M-、Q+、R2+的半径大小应该为Cl->Ca2+>Na+,故C错误;Z、M的最高价氧化物对应的水化物为HNO3和HClO4,都是强酸,故D正确。
9.答案 (1)第三周期第ⅦA族 NaOH
(2)2K+2H2O 2K++2OH-+H2↑
(3)> K和Na位于同一主族,电子层数K大于Na,原子半径K大于Na,原子核对核外电子的吸引力K小于Na,失电子能力K大于Na,则金属性K强于Na
(4)AB
(5)有气泡产生,并生成红褐色沉淀
解析 根据Q是地壳中含量最高的元素,可知Q为O元素;根据W最高化合价为+7价且是第三周期元素,可知W为Cl元素;由第三周期X的最高价氧化物对应的水化物在本周期中碱性最强,可知X为Na元素;结合Y的焰色试验可知Y为K元素;由Z的原子结构示意图可知Z为Br元素。(1)Cl元素在周期表中位于第三周期第ⅦA族;Na元素最高价氧化物的水化物为NaOH。(2)K与H2O反应生成KOH和H2,其离子方程式为2K+2H2O 2K++2OH-+H2↑。(3)金属性:K>Na;K、Na均为第ⅠA族元素,电子层数K>Na,原子半径K>Na,原子核对核外电子的吸引力KNa,故金属性K>Na。(4)Br原子最外层有7个电子,其最高正价为+7价,最低负价为-1价,A正确;由于非金属性:BrBr,非金属性越强,其单质的氧化性越强,即单质的氧化性:Cl2>Br2,C错误。(5)Na在O2中点燃生成Na2O2,将Na2O2投入FeSO4溶液中,由于Na2O2具有强氧化性,Fe2+具有还原性,发生氧化还原反应生成Fe(OH)3沉淀和O2,故主要的反应现象是有气泡产生,并生成红褐色沉淀。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024人教版新教材高中化学必修第一册
第二节 元素周期律
第1课时 元素性质的周期性变化规律
基础过关练
题组一 元素周期律
1.(2020福建厦门期中)下列关于元素性质递变规律的说法正确的是( )
A.第二周期元素从左到右,最高正价从+1递增到+7
B.第三周期非金属元素从左到右,非金属性逐渐减弱
C.第ⅠA族金属元素从上到下,金属性逐渐增强
D.第ⅦA族元素从上到下,简单氢化物稳定性逐渐增强
2.(2022河北唐山期末)下列有关比较中,不正确的是( )
A.气态氢化物的热稳定性:NH3>CH4
B.酸性:HClO>H2SO4
C.碱性:NaOH
A.非金属性:Cl>S
B.热稳定性:HBr>HI
C.酸性:HClO4>H2SO3
D.碱性:NaOH>Mg(OH)2
题组二 微粒半径的大小比较
4.下列粒子半径大小比较正确的是( )
A.原子半径:F>Cl
B.原子半径:钠>硫>氯
C.离子半径:S2-
5.(2022辽宁辽阳期末)X、Y、Z均为元素周期表中前三周期元素,Xn+、Yn-、Z(n+1)-三种简单离子的电子层结构相同,下列说法正确的是( )
A.原子序数:Z>X
B.原子半径:Y>Z
C.气态氢化物的稳定性:H(n+1)Z>HnY
D.离子半径:Yn->Xn+
题组三 元素金属性与非金属性的比较
6.下列叙述中金属M的活泼性肯定比金属N的活泼性强的是( )
A.M原子的最外层电子数比N原子的最外层电子数少
B.常温时,M能从水中置换出氢,而N不能
C.1 mol M从酸中置换H+生成的H2比1 mol N从酸中置换H+生成的H2多
D.M的氧化物对应水化物的碱性比N的氧化物对应水化物的碱性强
7.(2022黑龙江哈尔滨期末)X、Y分别代表两种非金属元素,下列不能说明非金属性X比Y强的是( )
A.X的氧化物对应水化物的酸性比Y的氧化物对应水化物的酸性强
B.Y-的还原性强于X-
C.X的单质X2能将Y的阴离子Y-氧化为Y2
D.X、Y的单质分别与H2化合,产物中前者的稳定性比后者强
能力提升练
题组一 利用元素周期律推测陌生元素或物质的性质
1.(2021天津六校期末)运用元素周期律分析下面的推断,其中不正确的是( )
A.锂与水反应比钠与水反应剧烈
B.砹为有色固体,AgAt难溶于水也不溶于稀硝酸
C.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂
D.HBrO4的酸性比HIO4的酸性强
2.(2021山西太原期末)硒是人体所需的一种微量元素,它与氧、硫位于同一主族。下列有关硒的推测错误的是( )
A.常温下单质为固体
B.单质的密度大于硫
C.元素有非金属性
D.化合价只有+4价、+6价
3.(2022黑龙江铁人中学期末)几种短周期元素的原子半径及常见化合价见下表:
元素代号 常见化合价 原子半径/nm
A -1 0.071
B -2 0.074
D +4、-4 0.077
E -1 0.099
G +5、-3 0.110
H +3 0.143
I +2 0.160
J +1 0.186
分析判断下列说法正确的是( )
A.D、H、J的氧化物分别为酸性氧化物、两性氧化物、碱性氧化物
B.A、H、J的离子半径由大到小的顺序是A>J>H
C.G元素的单质不存在同素异形体
D.I在DB2中燃烧生成两种化合物
4.科学家预测第114号元素具有良好的力学、光学、电学性质,将它命名为“类铅”。以下对“类铅”的叙述错误的是( )
A.位于第七周期第ⅣA族,是金属元素
B.主要化合价为+2、+4价
C.最高价氧化物有较强氧化性
D.“类铅”的原子半径小于同主族其他元素
5.迄今为止我国相关部门已经发布了113号Nh、115号Mc、116号Lv、117号Ts、118号Og等元素的中文名称,分别是:、、、、。下列有关推断正确的是( )
A.这五种元素均为主族元素
B.Nh的最高价氧化物是一种典型的两性氧化物
C.Ts的简单阴离子比该族上一周期简单阴离子的还原性弱
D.Og在通常状况下呈气态,其余四种为固态
题组二 元素周期律的综合应用
6.下列实验或事实能证明相应结论的是( )
A.实验Ⅰ可验证金属性:Al>Mg
B.实验Ⅱ可验证金属性:Cu>Al
C.实验Ⅲ可验证非金属性:Cl>Br>I
D.实验Ⅳ可验证非金属性:Cl>C>Si
7.(2022福建厦门外国语学校月考)如图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
A.X元素处于第二周期第ⅥA族
B.原子半径:Z>Y
C.X、Y、R形成的某种化合物可以用于漂白、消毒
D.Y、Z和W三者最高价氧化物对应的水化物能两两相互反应
8.X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是( )
A.Q位于第三周期第ⅠA族
B.X、Y、Z三种元素组成的化合物可能是盐或碱
C.简单离子半径:M->Q+>R2+
D.Z与M的最高价氧化物对应的水化物均为强酸
9.(2022湘赣粤名校联考)元素周期表与元素周期律在学习、研究中有很重要的作用。下表所示为某5种元素的相关信息,已知W、X都位于第三周期。
元素 信息
Q 地壳中含量最高的元素
W 最高化合价为+7价
X 最高价氧化物对应的水化物在本周期中碱性最强
Y 焰色试验(透过蓝色钴玻璃)的火焰呈紫色
Z 原子结构示意图为
回答下列问题:
(1)W在元素周期表中的位置为 ,X的最高价氧化物对应的水化物的化学式为 。
(2)Y的单质与水反应的离子方程式是 。
(3)金属性:Y (填“>”或“<”)X,用原子结构解释原因:
。
(4)下列对于Z及其化合物的推断中正确的是 (填字母)。
A.Z的化合价中有-1和+7
B.Z的最高价氧化物对应水化物的酸性弱于W的最高价氧化物对应水化物的酸性
C.Z元素单质的氧化性强于W元素单质的氧化性
(5)将X元素的单质在Q元素的单质中点燃生成M,预测将M投入硫酸亚铁溶液中,主要的反应现象是 。
答案全解全析
基础过关练
1.C 2.B 3.C 4.B 5.D 6.B 7.A
1.C 第二周期中O无最高正价、F无正价,A错误;同周期主族元素从左到右非金属性依次增强,B错误;同主族元素从上到下原子半径依次增大,金属性依次增强,C正确;通常情况下,非金属性越强,氢化物越稳定,第ⅦA族元素从上到下非金属性依次减弱,则简单氢化物稳定性逐渐减弱,D错误。
2.B 根据非金属性:N>C,可知气态氢化物的热稳定性:NH3>CH4,A正确;根据非金属性:Cl>S,可知酸性:HClO4>H2SO4,HClO是弱酸,B错误;根据金属性:Na
4.B F与Cl的最外层电子数相同,随着电子层数的递增原子半径逐渐增大,所以Cl的原子半径大于F,A错误;钠、硫、氯原子的电子层数相同,随着原子序数的递增,原子半径逐渐减小,B正确;电子层结构相同的离子,核电荷数越大,半径越小,C错误;第三周期元素的阳离子半径从左到右逐渐减小,D错误。
方法技巧
影响微粒半径大小的因素有:①电子层数的多少;②原子核对核外电子的吸引力的大小;③核外电子数的多少。
5.D 根据Xn+、Yn-、Z(n+1)-三种简单离子的电子层结构相同,可知X在Y、Z的下一周期,由所带电荷数目可知Z、Y左右相邻。三种元素在周期表中的大致位置为
…… Z Y
X ……
则原子序数:Z
6.B 最外层电子数的多少以及从酸中置换出H2的多少与金属元素的金属性的强弱无关,A、C项错误;金属的活泼性越强,越易与水反应,常温时,M能从水中置换出氢,而N不能,说明金属的活泼性M比N强,B项正确;由元素的最高价氧化物对应的水化物的碱性强弱来判断金属性的强弱,而不是氧化物对应的水化物,D项错误。
7.A 元素非金属性强弱可由最高价氧化物对应水化物的酸性强弱来判断,选项中没有指明是否是最高价氧化物,无法判断非金属性强弱,A符合题意;元素非金属性越弱,其离子的还原性越强,B不符合题意;单质X2能与Y-发生置换反应生成Y2,说明非金属性:X>Y,C不符合题意;单质与H2化合,根据产物的稳定性可知非金属性:X>Y,D不符合题意。
能力提升练
1.A 2.D 3.B 4.D 5.D 6.D 7.B 8.C
1.A 锂与钠是同主族元素,从上到下,金属性逐渐增强,所以钠与水反应比锂与水反应更剧烈,A项错误;砹为卤族元素,从上到下,单质颜色变深,根据氯化银的性质推断AgAt难溶于水也不溶于稀硝酸,B项正确;铷为碱金属元素,碱金属元素从上到下,在氧气中燃烧的产物越来越复杂,则铷(Rb)的燃烧产物比钠的燃烧产物更复杂,C项正确;卤族元素从上到下,最高价氧化物对应水化物的酸性逐渐减弱,则HBrO4的酸性比HIO4的酸性强,D项正确。
2.D 同一主族从上到下,非金属单质的沸点逐渐升高,常温下S的单质呈固态,因此常温下,硒单质为固体,A正确;同主族元素从上到下,单质的密度呈增大趋势,硒的密度大于硫,B正确;硒元素属于非金属元素,具有非金属性,C正确;同一主族元素具有相似的化学性质,硒在形成化合物时,与硫元素有相似之处,化合物中硒的化合价可显-2价、+4价、+6价,D错误。
3.B 本题是结合原子半径和主要化合价数据的元素推断题,解答本题需从-2价找突破口,确定B为O元素,再结合化合价相同的元素确定元素所在的主族,根据原子半径大小确定元素所在的周期,据此可逐一完成各元素的推断。根据B元素常见化合价为-2价及其原子半径可确定B为O元素,结合A的原子半径比B小可确定A为F元素,由D的化合价可知其为第ⅣA族元素,原子半径与O元素接近,即D为第二周期的C元素;结合A、E均为-1价,E应为Cl元素;根据G元素的化合价可知其位于第ⅤA族,其半径比C元素大,即G为第三周期P元素,再结合H、I、J的化合价可确定分别为Al、Mg、Na元素。CO不是酸性氧化物,Al2O3是两性氧化物,Na2O2不是碱性氧化物,A错误;根据电子层结构相同的离子,核电荷数越多离子半径越小,可判断离子半径:F->Na+>Al3+,B正确;磷元素的单质有红磷和白磷,二者互为同素异形体,C错误;Mg在CO2中燃烧生成MgO和C,D错误。
反思升华
解答关于元素的推断题,关键是根据题中原子半径和主要化合价等信息快速找到解题的突破口,尤其注意特殊化合价、化合价代数和等,快速完成推断。具体到本题的解答还需注意,C元素有CO、CO2两种氧化物,分别为不成盐氧化物和酸性氧化物,而Na与O2反应可生成Na2O、Na2O2两种物质,Na2O是碱性氧化物,Na2O2不是碱性氧化物。
4.D 第七周期稀有气体元素的原子序数为118,可知114号元素位于第七周期第ⅣA族,该元素为金属元素,A正确;第ⅣA族元素的主要化合价为+2、+4价,B正确;最高价氧化物易得到电子,有较强氧化性,C正确;“类铅”是第ⅣA族中电子层数最多的原子,原子半径最大,D错误。
5.D Og为0族元素,不是主族元素,故A错误;113号Nh位于周期表中第七周期第ⅢA族,同一主族从上到下,金属性逐渐增强,则Nh的最高价氧化物为碱性氧化物,故B错误;Ts的非金属性比上一周期同主族元素的非金属性弱,所以Ts的简单阴离子比该族上一周期简单阴离子的还原性强,故C错误;118号元素为稀有气体元素,为0族元素,在通常状况下呈气态,113号、115号、116号、117号分别为第ⅢA、ⅤA、ⅥA、ⅦA族元素,根据主族元素的单质的状态变化规律可知它们为固体,故D正确。
6.D 验证元素的金属性的强弱,可由金属单质与酸反应置换出氢气的难易程度来判断,而不是与NaOH溶液反应,A项错误;Al的金属性强于Cu,B项错误;Cl2与NaBr溶液反应,使左侧棉球变为橙色,未反应的Cl2继续与KI溶液反应置换出I2,使右侧棉球变为蓝色,能证明非金属性:Cl>Br、Cl>I,但不能证明非金属性:Br>I,C项错误;实验Ⅳ可证明酸性HClO4>H2CO3>H2SiO3,这三种酸为Cl、C、Si的最高价氧化物对应的水化物,故能验证非金属性:Cl>C>Si,D项正确。
归纳总结
元素金属性、非金属性的比较方法
①金属性比较:
a.金属单质与水或酸反应生成氢气的难易程度;
b.最高价氧化物对应水化物的碱性强弱。
②非金属性比较:
a.非金属单质与氢气反应生成气态氢化物的难易程度以及氢化物的稳定性;
b.最高价氧化物对应水化物的酸性强弱。
7.B 结合图像中的信息可知X为O元素,Y为Na元素,Z为Al元素,W为S元素,R为Cl元素。X(O)元素核外有2个电子层,且最外层有6个电子,即X元素位于第二周期第ⅥA族,A正确;同周期主族元素随核电荷数递增原子半径递减,即原子半径:Y>Z,B错误;O、Na、Cl元素形成的化合物NaClO可以用于漂白、消毒,C正确;Na、Al、S最高价氧化物对应的水化物分别为NaOH、Al(OH)3、H2SO4,Al(OH)3为两性氢氧化物,三种物质能两两相互反应,D正确。
8.C 由Y的化合价只有-2价推断Y为氧元素,X的半径比氧原子的半径小且有+1价,则X为氢元素,M的最高正价为+7价,最低负价为-1价,则M为氯元素,Z的半径小于Cl,且最低负价为-3价,最高价为+5价,则Z为氮元素,Q只有+1价,且Q的半径大于氯原子半径,但小于只有+2价的R,故Q为钠元素,R为钙元素。Na位于第三周期第ⅠA族,A正确;X、Y、Z三种元素分别代表H、O、N,可以形成硝酸、硝酸铵和一水合氨,故B正确;M-、Q+、R2+的半径大小应该为Cl->Ca2+>Na+,故C错误;Z、M的最高价氧化物对应的水化物为HNO3和HClO4,都是强酸,故D正确。
9.答案 (1)第三周期第ⅦA族 NaOH
(2)2K+2H2O 2K++2OH-+H2↑
(3)> K和Na位于同一主族,电子层数K大于Na,原子半径K大于Na,原子核对核外电子的吸引力K小于Na,失电子能力K大于Na,则金属性K强于Na
(4)AB
(5)有气泡产生,并生成红褐色沉淀
解析 根据Q是地壳中含量最高的元素,可知Q为O元素;根据W最高化合价为+7价且是第三周期元素,可知W为Cl元素;由第三周期X的最高价氧化物对应的水化物在本周期中碱性最强,可知X为Na元素;结合Y的焰色试验可知Y为K元素;由Z的原子结构示意图可知Z为Br元素。(1)Cl元素在周期表中位于第三周期第ⅦA族;Na元素最高价氧化物的水化物为NaOH。(2)K与H2O反应生成KOH和H2,其离子方程式为2K+2H2O 2K++2OH-+H2↑。(3)金属性:K>Na;K、Na均为第ⅠA族元素,电子层数K>Na,原子半径K>Na,原子核对核外电子的吸引力K
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
