2024人教版新教材高中化学选择性必修1同步练习--第2课时 电解原理的应用(含解析)
文档属性
| 名称 | 2024人教版新教材高中化学选择性必修1同步练习--第2课时 电解原理的应用(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 885.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-26 09:58:18 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024人教版新教材高中化学选择性必修1
第2课时 电解原理的应用
基础过关练
题组一 氯碱工业
1.(2022河南新郑期中)如图是氯碱工业中的电解装置,下列说法不正确的是( )
A.电解总反应式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑
B.阳极反应式:2Cl--2e- Cl2↑
C.离子交换膜应为阳离子交换膜
D.每生成1 mol Cl2,此装置理论上共转移电子4 mol
2.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置,c、d都为石墨电极。回答下列问题:
(1)a为电源的 (填“正”或“负”)极,c为电解池的 极(填“阴”或“阳”)。
(2)d电极上的电极反应式为 ,电解产生消毒液的总反应式为 。
题组二 电解精炼与电镀
3.(2020福建泉州期末)下列关于电解精炼铜的说法不正确的是( )
A.粗铜作阳极、纯铜作阴极
B.电解质溶液中一定含有Cu2+
C.阳极反应只有Cu-2e- Cu2+
D.阴极反应只有Cu2++2e- Cu
4.在铁制品上镀一层一定厚度的锌层,以下方案设计正确的是( )
A.锌作阳极,镀件作阴极,溶液中含有锌离子
B.铂作阴极,镀件作阳极,溶液中含有锌离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.锌作阴极,镀件作阳极,溶液中含有亚铁离子
5.(2021北京丰台期中)粗铜中含有锌、铁、金、银等杂质,通过电解法将其精炼,下列说法不正确的是( )
A.粗铜与电源的正极相连,主要发生氧化反应:Cu-2e- Cu2+
B.纯铜作为阴极材料,不参与电极反应,电解过程中逐渐变粗
C.用CuSO4溶液作电解质溶液,电解过程中CuSO4溶液浓度略减小
D.锌、铁、金、银等杂质沉积在阳极周围,成为阳极泥
6.如图所示,甲、乙为相互串联的两个电解池。
回答下列问题:
(1)甲池若为电解精炼铜的装置,则A极为 (填“阴”或“阳”)极,电极材料是 ,电极反应式为 ,电解质溶液可以是 。
(2)乙池中铁电极的电极反应式为 。
(3)若将乙池中的石墨电极改为银电极,则乙池为 装置,电解一段时间后,AgNO3溶液的浓度 (填“增大”“减小”或“不变”)。
题组三 电冶金
7.海水提镁的最后一步是将氯化镁电解来获取金属镁,下列有关该电解过程的叙述中,正确的是( )
A.两个电极必须都用惰性电极
B.阳极可以用活性电极,阴极必须是惰性电极
C.电解熔融状态的氯化镁
D.电解氯化镁的水溶液
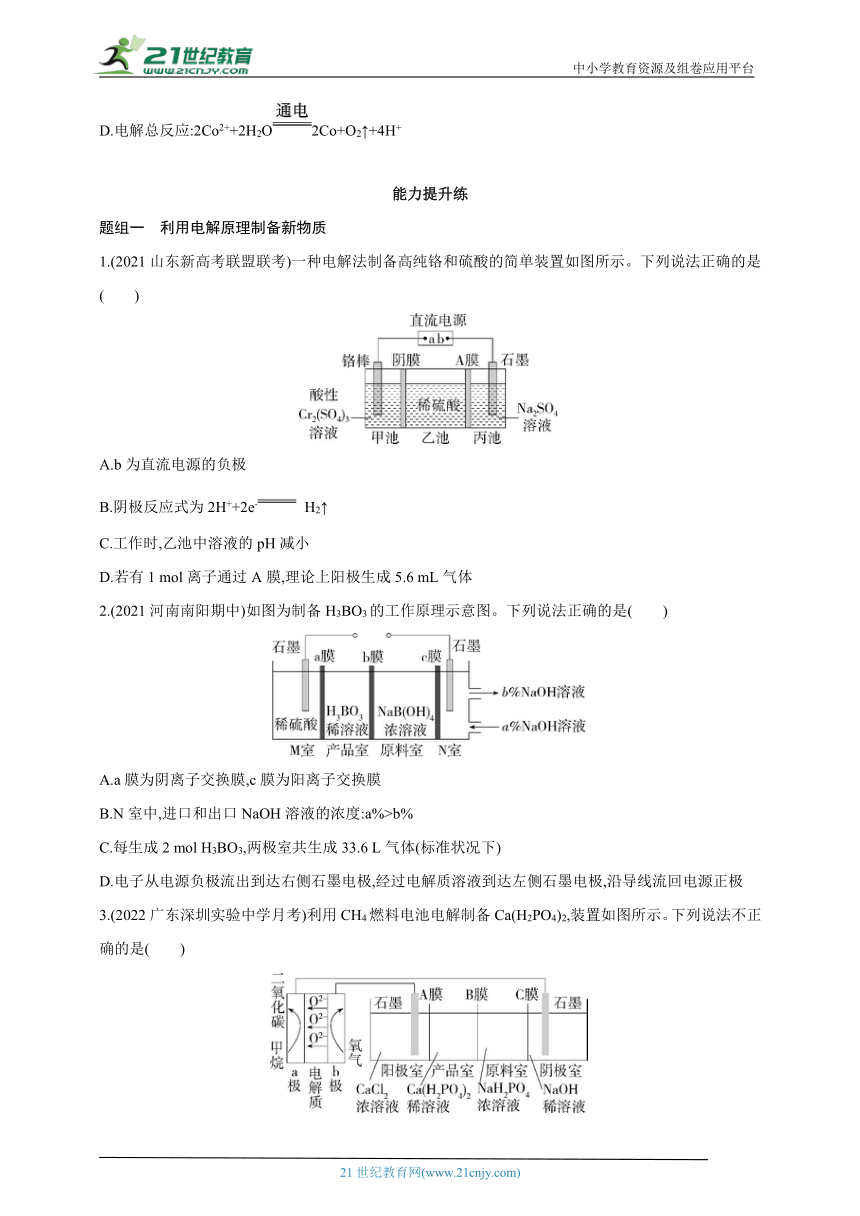
8.21世纪是钛的世纪,在800~1 000 ℃时电解TiO2可制得钛,装置如图所示,下列叙述正确的是( )
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为TiO2+4e- Ti+2O2-
D.每生成0.1 mol Ti,转移0.2 mol电子
9.(2021黑龙江哈尔滨期中)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法不正确的是( )
A.由TiO2制得1 mol金属Ti,理论上外电路转移4 mol电子
B.阳极的电极反应式为2O2--4e- O2↑
C.在制备金属钛前后,整套装置中CaO的总量不会减少
D.装置中石墨电极材料需要定期更换
10.(2021广东,16)钴(Co)的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是( )
A.工作时,Ⅰ室和Ⅱ室溶液的pH均增大
B.生成1 mol Co,Ⅰ室溶液质量理论上减少16 g
C.移除两交换膜后,石墨电极上发生的反应不变
D.电解总反应:2Co2++2H2O2Co+O2↑+4H+
能力提升练
题组一 利用电解原理制备新物质
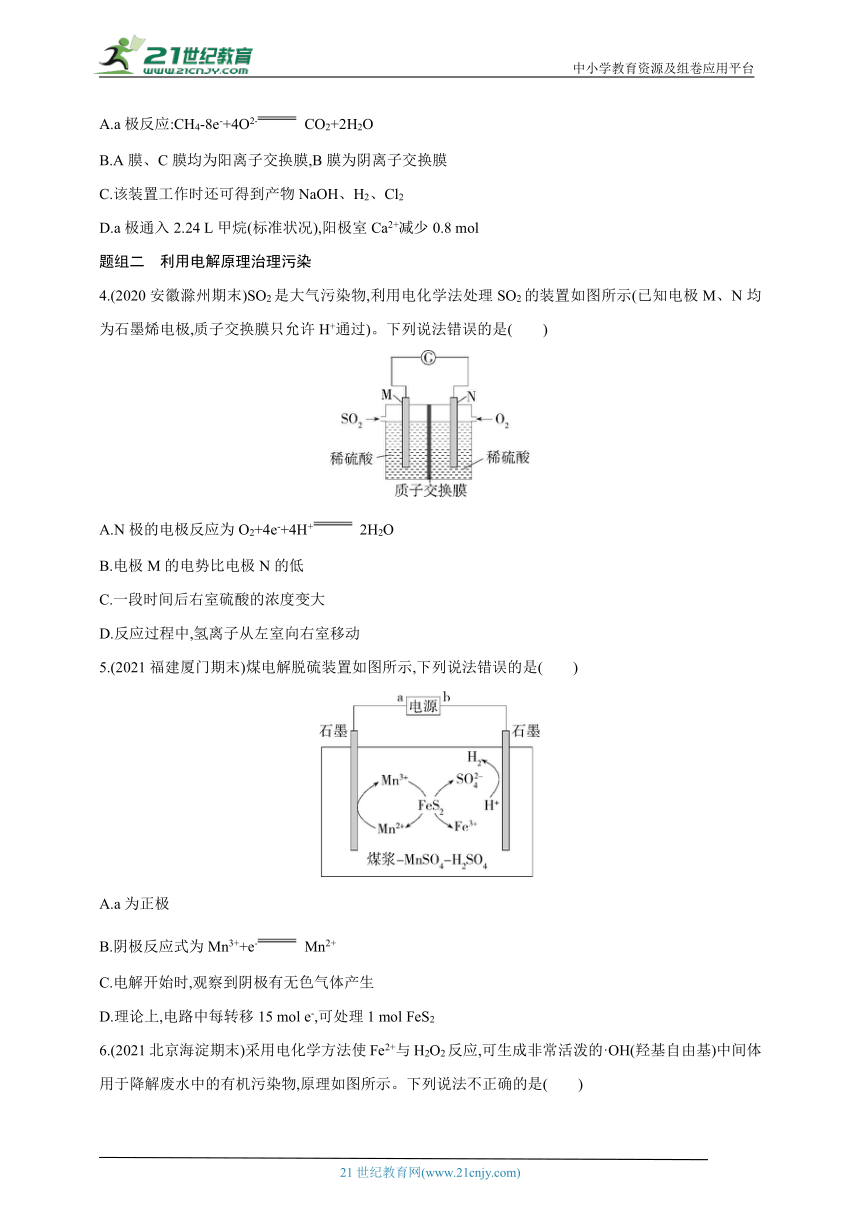
1.(2021山东新高考联盟联考)一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是( )
A.b为直流电源的负极
B.阴极反应式为2H++2e- H2↑
C.工作时,乙池中溶液的pH减小
D.若有1 mol离子通过A膜,理论上阳极生成5.6 mL气体
2.(2021河南南阳期中)如图为制备H3BO3的工作原理示意图。下列说法正确的是( )
A.a膜为阴离子交换膜,c膜为阳离子交换膜
B.N室中,进口和出口NaOH溶液的浓度:a%>b%
C.每生成2 mol H3BO3,两极室共生成33.6 L气体(标准状况下)
D.电子从电源负极流出到达右侧石墨电极,经过电解质溶液到达左侧石墨电极,沿导线流回电源正极
3.(2022广东深圳实验中学月考)利用CH4燃料电池电解制备Ca(H2PO4)2,装置如图所示。下列说法不正确的是( )
A.a极反应:CH4-8e-+4O2- CO2+2H2O
B.A膜、C膜均为阳离子交换膜,B膜为阴离子交换膜
C.该装置工作时还可得到产物NaOH、H2、Cl2
D.a极通入2.24 L甲烷(标准状况),阳极室Ca2+减少0.8 mol
题组二 利用电解原理治理污染
4.(2020安徽滁州期末)SO2是大气污染物,利用电化学法处理SO2的装置如图所示(已知电极M、N均为石墨烯电极,质子交换膜只允许H+通过)。下列说法错误的是( )
A.N极的电极反应为O2+4e-+4H+ 2H2O
B.电极M的电势比电极N的低
C.一段时间后右室硫酸的浓度变大
D.反应过程中,氢离子从左室向右室移动
5.(2021福建厦门期末)煤电解脱硫装置如图所示,下列说法错误的是( )
A.a为正极
B.阴极反应式为Mn3++e- Mn2+
C.电解开始时,观察到阴极有无色气体产生
D.理论上,电路中每转移15 mol e-,可处理1 mol FeS2
6.(2021北京海淀期末)采用电化学方法使Fe2+与H2O2反应,可生成非常活泼的·OH(羟基自由基)中间体用于降解废水中的有机污染物,原理如图所示。下列说法不正确的是( )
A.X电极上发生的电极反应为2H2O-4e- O2↑+4H+
B.可将X电极上产生的O2收集起来,输送到Y电极使用
C.根据装置推测,Y电极是阳极,·OH在该电极侧产生
D.起始时,在Y电极附近加入适量Fe2+或Fe3+,均能让装置正常工作
7.(2022吉林长春第二实验中学期中)厨房垃圾发酵液可通过电渗析法处理得到乳酸,其原理如图所示(图中HA表示乳酸分子、A-表示乳酸根离子)。下列说法正确的是( )
A.阴极反应式:4OH--4e- 2H2O+O2↑
B.H+从浓缩室通过阳离子交换膜进入左室
C.A-通过阴离子交换膜从右室进入浓缩室
D.当浓缩室中增加0.6 mol HA时,可得到4.48 L H2(标准状况)
题组三 电解原理的综合应用
8.(2022山东师大附中期中)回答下列问题:
(1)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示。
①H+向 (填“左”或“右”)移动。
②a电极为电解池的 (填“阴”或“阳”)极,写出该电极的电极反应式: 。
(2)实验室利用甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含Cr2),装置如图所示:
①M电极的电极反应式为 。
②已知电解池溶液里Cr2被还原为Cr3+,该反应的离子方程式为 。
③设NA为阿伏加德罗常数的值。当N电极消耗标准状况下2.24 L气体时,通过质子交换膜的H+数目为 。
答案全解全析
基础过关练
1.D 氯碱工业中电解饱和食盐水,得到氢氧化钠、氢气和氯气,A正确;氯离子在阳极上失去电子被氧化生成氯气,B正确;左侧阳极区食盐水浓度减小,钠离子应透过离子交换膜向阴极区移动,离子交换膜应为阳离子交换膜,C正确;根据2Cl--2e- Cl2↑可知,每生成1 mol氯气,理论上应转移电子2 mol,D错误。
2.答案 (1)负 阳 (2)2H2O+2e- H2↑+2OH- NaCl+H2O NaClO+H2↑
解析 要生成NaClO,Cl2需被NaOH充分吸收,则应在消毒液发生器c电极上产生Cl2,故a为负极,b为正极,c为阳极,d为阴极。
3.C 电解精炼铜时,粗铜为电解池的阳极,纯铜为电解池的阴极,A正确;电解质溶液中含铜离子,铜离子在阴极上得到电子析出铜,B正确;粗铜为电解池的阳极,阳极上比铜活泼的金属锌、铁、镍等会先于金属铜失电子,C错误;纯铜为电解池的阴极,电极反应为Cu2++2e- Cu,D正确。
4.A 电镀时,通常将镀层金属作阳极,镀件作阴极,含有镀层金属阳离子的溶液作电镀液。
5.D 电解法精炼粗铜时,阴极(纯铜)的电极反应式为Cu2++2e- Cu(还原反应);阳极(粗铜)主要的电极反应式为Cu-2e- Cu2+(氧化反应),还有其他活泼金属放电,不活泼的金属以单质的形式沉积在电解槽底部,形成阳极泥。根据上述分析可知,粗铜与电源的正极相连,主要发生失电子的氧化反应:Cu-2e- Cu2+,A正确;纯铜作为阴极材料,不参与电极反应,电极反应式为Cu2++2e- Cu,电解过程中不断生成铜附着在阴极上,阴极逐渐变粗,B正确;用CuSO4溶液作电解质溶液,电解过程中铁、锌等比铜活泼的金属也会放电,根据得失电子守恒可知,消耗的铜离子会略多于生成的铜离子,即CuSO4溶液浓度略减小,C正确;不活泼的金属以单质的形式沉积在电解槽底部,形成阳极泥,但锌、铁会放电生成离子,D错误。
6.答案 (1)阴 纯铜 Cu2++2e- Cu CuSO4溶液(答案合理即可) (2)Ag++e- Ag (3)电镀 不变
解析 (1)由题图可知,甲池中A极为阴极,B极为阳极,在电解精炼铜时,粗铜作阳极,纯铜作阴极,故A为纯铜,电极反应式为Cu2++2e- Cu;电解质溶液应为含有Cu2+的盐溶液,如CuSO4溶液。(2)由题图可知,乙池中铁作阴极,石墨作阳极,故铁电极的电极反应式为Ag++e- Ag。(3)若将乙池中的石墨电极改为银电极,则乙池为电镀池,且电镀过程中AgNO3溶液的浓度不变。
7.C 在阴极发生的是镁离子得到电子的反应,阴极材料可以为活性电极或惰性电极,故A错误;在阳极上发生失电子的反应,如果使用活性电极,活性电极会优先失电子,所以阳极必须用惰性电极,故B错误;电解氯化镁来获取金属镁,镁离子需要得电子,如果在水溶液中,水电离的氢离子会优先于Mg2+得电子,因此电解熔融状态的MgCl2获取金属镁,故C正确,D错误。
8.C 由O2-的移动方向可知,石墨为阳极,则b为电源正极,A错误;石墨电极作阳极,发生氧化反应,B错误;每生成0.1 mol Ti,转移0.4 mol电子,D错误。
9.B 钙还原二氧化钛反应的化学方程式为2Ca+TiO2Ti+2CaO,由TiO2制得1 mol金属Ti,理论上外电路转移4 mol电子,A正确;阳极反应式为C+2O2--4e- CO2↑,B错误;2Ca+TiO2Ti+2CaO,整套装置中CaO的总量不会减少,C正确;阳极反应式为C+2O2--4e- CO2↑,C不断被消耗,因此装置中石墨电极材料需要定期更换,D正确。
10.D 根据实验装置图,电源正极对应Ⅰ室为阳极室,电极反应式为2H2O-4e- O2↑+4H+;电源负极对应Ⅲ室为阴极室,电极反应式为Co2++2e-Co。H+通过阳离子交换膜由Ⅰ室进入Ⅱ室,Cl-通过阴离子交换膜由Ⅲ室进入Ⅱ室。A项,工作时,Ⅰ室因消耗H2O,溶液pH减小,Ⅱ室因H+由Ⅰ室迁移过来而使溶液pH减小,错误;B项,生成1 mol Co,转移2 mol e-,消耗1 mol H2O,Ⅰ室溶液质量理论上减少18 g,错误;C项,移除两交换膜后,石墨电极上发生的电极反应式为2Cl- -2e-Cl2↑,错误;D项,电解总反应为2Co2++2H2O2Co+O2↑+4H+,正确。
能力提升练
1.C 该装置制备高纯铬和硫酸,甲池中铬棒上Cr3+得电子发生还原反应,则铬棒为阴极,连接阴极的电极a为负极,则b为正极,A错误;根据分析可知,阴极反应为Cr3++3e- Cr,阳极反应为2H2O-4e- O2↑+4H+,B错误;甲池中的硫酸根离子通过阴膜进入乙池,丙池中生成的氢离子通过A膜进入乙池,所以导致乙池中硫酸浓度增大,溶液的pH减小,C正确;若有1 mol离子通过A膜,则丙池生成1 mol 氢离子,理论上阳极生成的气体(氧气)为×1=0.25 mol,不知道气体所处状况,无法计算生成气体的体积,D错误。
2.C 由装置图可知,N室中石墨为阴极,电解时阴极上水得电子生成H2和OH-,则原料室中的钠离子通过c膜进入N室,N室溶液中c(NaOH)增大,c膜为阳离子交换膜;M室中石墨电极为阳极,电解时阳极上水失电子生成O2和H+,H+通过a膜进入产品室,则a膜为阳离子交换膜,原料室中的B(OH通过b膜进入产品室,B(OH、H+发生反应生成H3BO3,所以b膜为阴离子交换膜。由分析可知,a膜和c膜均为阳离子交换膜,A错误;由分析可知,a%3.D CH4燃料电池中,甲烷失电子在负极发生氧化反应,所以a极为负极,通入氧气的b极为正极,a极的电极反应为CH4-8e-+4O2- CO2+2H2O,A正确。与电源的正极相连接的为电解池的阳极,在阳极氯离子放电,电极反应为2Cl--2e- Cl2↑,阳极室中的Ca2+通过A膜进入产品室,则A膜应为阳离子交换膜;磷酸二氢根离子由原料室通过B膜进入产品室,所以B膜为阴离子交换膜;阴极上氢离子放电生成氢气,破坏水的电离平衡,氢氧根离子浓度增大,钠离子从原料室通过C膜进入阴极室,则C膜应为阳离子交换膜,B、C正确。左侧为原电池,右侧为电解池,构成闭合回路,若a极通入标准状况下2.24 L甲烷,n(CH4)==0.1 mol,根据CH4-8e-+4O2- CO2+2H2O,可知0.1 mol甲烷反应转移0.8 mol电子,根据电荷守恒和得失电子守恒可知,阳极室Ca2+通过A膜进入产品室的物质的量为0.4 mol,D错误。
4.C N为正极,发生还原反应,电极反应为O2+4e-+4H+ 2H2O,A正确;M为负极,N为正极,则电极M的电势比电极N的低,B正确;N为正极,电极反应为O2+4e-+4H+ 2H2O,生成H2O,右室硫酸的浓度减小,C错误;原电池工作时,阳离子向正极移动,即氢离子从左室向右室移动,D正确。
5.B 从图中可以看出,在左侧石墨电极上Mn2+转化为Mn3+,则此电极为阳极,a为正极,b为负极,右侧石墨电极为阴极,A正确;阴极上H+得电子生成H2,电极反应式为2H++2e- H2↑,B错误,C正确;由Mn2+-e- Mn3+及反应FeS2+15Mn3++8H2O Fe3++15Mn2++2S+16H+可知,理论上,电路中每转移15 mol e-,可处理1 mol FeS2,D正确。
6.C 据题图可知,X电极上H2O失电子生成氧气,发生氧化反应,X电极为阳极,电极反应为2H2O-4e- O2↑+4H+,A正确;Y电极上的反应物有O2,而X电极产生O2,所以可将X电极上产生的O2收集起来,输送到Y电极使用,B正确;Y电极上Fe3+得电子转化为Fe2+,O2得电子结合氢离子生成H2O2,发生还原反应,所以Y电极为阴极,C错误;据题图可知该装置工作时Fe2+与Fe3+循环转化,所以起始时,在Y电极附近加入适量Fe2+或Fe3+,均能让装置正常工作,D正确。
7.C 阴极得电子,发生还原反应,A错误;H+从左室通过阳离子交换膜进入浓缩室,B错误;A-通过阴离子交换膜从右室进入浓缩室,C正确;当浓缩室中增加0.6 mol HA时,说明有0.6 mol A-从右室进入浓缩室,有0.6 mol电子发生转移,因此可得到0.3 mol H2,即6.72 L(标准状况)H2,D错误。
8.答案 (1)①右 ②阳 N-6e-+3F- NF3↑+4H+
(2)①CH3OH-6e-+H2O CO2↑+6H+ ②Cr2+6Fe2++14H+ 2Cr3++6Fe3++7H2O ③0.4NA
解析 (1)①由题图知,在右侧区域氢离子得电子生成氢气,发生还原反应,故b电极为阴极,H+向右移动。②a电极为电解池的阳极,该电极上NH4F发生氧化反应转化为NF3,该电极的电极反应式为N-6e-+3F- NF3↑+4H+。
(2)①由氢离子的移动方向可知,M电极为负极、N电极为正极,则b口加入甲醇,c口通入空气或氧气,M电极上CH3OH失去电子被氧化得到CO2,电极反应式为CH3OH-6e-+H2O CO2↑+6H+。②电解池中,与N电极相连的为阳极,阳极上Fe失去电子被氧化,得到Fe2+,Fe2+与Cr2发生氧化还原反应,该反应的离子方程式为Cr2+6Fe2++14H+ 2Cr3++6Fe3++7H2O。③N电极反应为O2+4H++4e- 2H2O,当消耗标准状况下2.24 L即
0.1 mol氧气时,转移0.4 mol电子,则通过质子交换膜的H+数目为0.4NA。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024人教版新教材高中化学选择性必修1
第2课时 电解原理的应用
基础过关练
题组一 氯碱工业
1.(2022河南新郑期中)如图是氯碱工业中的电解装置,下列说法不正确的是( )
A.电解总反应式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑
B.阳极反应式:2Cl--2e- Cl2↑
C.离子交换膜应为阳离子交换膜
D.每生成1 mol Cl2,此装置理论上共转移电子4 mol
2.某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置,c、d都为石墨电极。回答下列问题:
(1)a为电源的 (填“正”或“负”)极,c为电解池的 极(填“阴”或“阳”)。
(2)d电极上的电极反应式为 ,电解产生消毒液的总反应式为 。
题组二 电解精炼与电镀
3.(2020福建泉州期末)下列关于电解精炼铜的说法不正确的是( )
A.粗铜作阳极、纯铜作阴极
B.电解质溶液中一定含有Cu2+
C.阳极反应只有Cu-2e- Cu2+
D.阴极反应只有Cu2++2e- Cu
4.在铁制品上镀一层一定厚度的锌层,以下方案设计正确的是( )
A.锌作阳极,镀件作阴极,溶液中含有锌离子
B.铂作阴极,镀件作阳极,溶液中含有锌离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.锌作阴极,镀件作阳极,溶液中含有亚铁离子
5.(2021北京丰台期中)粗铜中含有锌、铁、金、银等杂质,通过电解法将其精炼,下列说法不正确的是( )
A.粗铜与电源的正极相连,主要发生氧化反应:Cu-2e- Cu2+
B.纯铜作为阴极材料,不参与电极反应,电解过程中逐渐变粗
C.用CuSO4溶液作电解质溶液,电解过程中CuSO4溶液浓度略减小
D.锌、铁、金、银等杂质沉积在阳极周围,成为阳极泥
6.如图所示,甲、乙为相互串联的两个电解池。
回答下列问题:
(1)甲池若为电解精炼铜的装置,则A极为 (填“阴”或“阳”)极,电极材料是 ,电极反应式为 ,电解质溶液可以是 。
(2)乙池中铁电极的电极反应式为 。
(3)若将乙池中的石墨电极改为银电极,则乙池为 装置,电解一段时间后,AgNO3溶液的浓度 (填“增大”“减小”或“不变”)。
题组三 电冶金
7.海水提镁的最后一步是将氯化镁电解来获取金属镁,下列有关该电解过程的叙述中,正确的是( )
A.两个电极必须都用惰性电极
B.阳极可以用活性电极,阴极必须是惰性电极
C.电解熔融状态的氯化镁
D.电解氯化镁的水溶液
8.21世纪是钛的世纪,在800~1 000 ℃时电解TiO2可制得钛,装置如图所示,下列叙述正确的是( )
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为TiO2+4e- Ti+2O2-
D.每生成0.1 mol Ti,转移0.2 mol电子
9.(2021黑龙江哈尔滨期中)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法不正确的是( )
A.由TiO2制得1 mol金属Ti,理论上外电路转移4 mol电子
B.阳极的电极反应式为2O2--4e- O2↑
C.在制备金属钛前后,整套装置中CaO的总量不会减少
D.装置中石墨电极材料需要定期更换
10.(2021广东,16)钴(Co)的合金材料广泛应用于航空航天、机械制造等领域。如图为水溶液中电解制备金属钴的装置示意图。下列说法正确的是( )
A.工作时,Ⅰ室和Ⅱ室溶液的pH均增大
B.生成1 mol Co,Ⅰ室溶液质量理论上减少16 g
C.移除两交换膜后,石墨电极上发生的反应不变
D.电解总反应:2Co2++2H2O2Co+O2↑+4H+
能力提升练
题组一 利用电解原理制备新物质
1.(2021山东新高考联盟联考)一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是( )
A.b为直流电源的负极
B.阴极反应式为2H++2e- H2↑
C.工作时,乙池中溶液的pH减小
D.若有1 mol离子通过A膜,理论上阳极生成5.6 mL气体
2.(2021河南南阳期中)如图为制备H3BO3的工作原理示意图。下列说法正确的是( )
A.a膜为阴离子交换膜,c膜为阳离子交换膜
B.N室中,进口和出口NaOH溶液的浓度:a%>b%
C.每生成2 mol H3BO3,两极室共生成33.6 L气体(标准状况下)
D.电子从电源负极流出到达右侧石墨电极,经过电解质溶液到达左侧石墨电极,沿导线流回电源正极
3.(2022广东深圳实验中学月考)利用CH4燃料电池电解制备Ca(H2PO4)2,装置如图所示。下列说法不正确的是( )
A.a极反应:CH4-8e-+4O2- CO2+2H2O
B.A膜、C膜均为阳离子交换膜,B膜为阴离子交换膜
C.该装置工作时还可得到产物NaOH、H2、Cl2
D.a极通入2.24 L甲烷(标准状况),阳极室Ca2+减少0.8 mol
题组二 利用电解原理治理污染
4.(2020安徽滁州期末)SO2是大气污染物,利用电化学法处理SO2的装置如图所示(已知电极M、N均为石墨烯电极,质子交换膜只允许H+通过)。下列说法错误的是( )
A.N极的电极反应为O2+4e-+4H+ 2H2O
B.电极M的电势比电极N的低
C.一段时间后右室硫酸的浓度变大
D.反应过程中,氢离子从左室向右室移动
5.(2021福建厦门期末)煤电解脱硫装置如图所示,下列说法错误的是( )
A.a为正极
B.阴极反应式为Mn3++e- Mn2+
C.电解开始时,观察到阴极有无色气体产生
D.理论上,电路中每转移15 mol e-,可处理1 mol FeS2
6.(2021北京海淀期末)采用电化学方法使Fe2+与H2O2反应,可生成非常活泼的·OH(羟基自由基)中间体用于降解废水中的有机污染物,原理如图所示。下列说法不正确的是( )
A.X电极上发生的电极反应为2H2O-4e- O2↑+4H+
B.可将X电极上产生的O2收集起来,输送到Y电极使用
C.根据装置推测,Y电极是阳极,·OH在该电极侧产生
D.起始时,在Y电极附近加入适量Fe2+或Fe3+,均能让装置正常工作
7.(2022吉林长春第二实验中学期中)厨房垃圾发酵液可通过电渗析法处理得到乳酸,其原理如图所示(图中HA表示乳酸分子、A-表示乳酸根离子)。下列说法正确的是( )
A.阴极反应式:4OH--4e- 2H2O+O2↑
B.H+从浓缩室通过阳离子交换膜进入左室
C.A-通过阴离子交换膜从右室进入浓缩室
D.当浓缩室中增加0.6 mol HA时,可得到4.48 L H2(标准状况)
题组三 电解原理的综合应用
8.(2022山东师大附中期中)回答下列问题:
(1)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示。
①H+向 (填“左”或“右”)移动。
②a电极为电解池的 (填“阴”或“阳”)极,写出该电极的电极反应式: 。
(2)实验室利用甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含Cr2),装置如图所示:
①M电极的电极反应式为 。
②已知电解池溶液里Cr2被还原为Cr3+,该反应的离子方程式为 。
③设NA为阿伏加德罗常数的值。当N电极消耗标准状况下2.24 L气体时,通过质子交换膜的H+数目为 。
答案全解全析
基础过关练
1.D 氯碱工业中电解饱和食盐水,得到氢氧化钠、氢气和氯气,A正确;氯离子在阳极上失去电子被氧化生成氯气,B正确;左侧阳极区食盐水浓度减小,钠离子应透过离子交换膜向阴极区移动,离子交换膜应为阳离子交换膜,C正确;根据2Cl--2e- Cl2↑可知,每生成1 mol氯气,理论上应转移电子2 mol,D错误。
2.答案 (1)负 阳 (2)2H2O+2e- H2↑+2OH- NaCl+H2O NaClO+H2↑
解析 要生成NaClO,Cl2需被NaOH充分吸收,则应在消毒液发生器c电极上产生Cl2,故a为负极,b为正极,c为阳极,d为阴极。
3.C 电解精炼铜时,粗铜为电解池的阳极,纯铜为电解池的阴极,A正确;电解质溶液中含铜离子,铜离子在阴极上得到电子析出铜,B正确;粗铜为电解池的阳极,阳极上比铜活泼的金属锌、铁、镍等会先于金属铜失电子,C错误;纯铜为电解池的阴极,电极反应为Cu2++2e- Cu,D正确。
4.A 电镀时,通常将镀层金属作阳极,镀件作阴极,含有镀层金属阳离子的溶液作电镀液。
5.D 电解法精炼粗铜时,阴极(纯铜)的电极反应式为Cu2++2e- Cu(还原反应);阳极(粗铜)主要的电极反应式为Cu-2e- Cu2+(氧化反应),还有其他活泼金属放电,不活泼的金属以单质的形式沉积在电解槽底部,形成阳极泥。根据上述分析可知,粗铜与电源的正极相连,主要发生失电子的氧化反应:Cu-2e- Cu2+,A正确;纯铜作为阴极材料,不参与电极反应,电极反应式为Cu2++2e- Cu,电解过程中不断生成铜附着在阴极上,阴极逐渐变粗,B正确;用CuSO4溶液作电解质溶液,电解过程中铁、锌等比铜活泼的金属也会放电,根据得失电子守恒可知,消耗的铜离子会略多于生成的铜离子,即CuSO4溶液浓度略减小,C正确;不活泼的金属以单质的形式沉积在电解槽底部,形成阳极泥,但锌、铁会放电生成离子,D错误。
6.答案 (1)阴 纯铜 Cu2++2e- Cu CuSO4溶液(答案合理即可) (2)Ag++e- Ag (3)电镀 不变
解析 (1)由题图可知,甲池中A极为阴极,B极为阳极,在电解精炼铜时,粗铜作阳极,纯铜作阴极,故A为纯铜,电极反应式为Cu2++2e- Cu;电解质溶液应为含有Cu2+的盐溶液,如CuSO4溶液。(2)由题图可知,乙池中铁作阴极,石墨作阳极,故铁电极的电极反应式为Ag++e- Ag。(3)若将乙池中的石墨电极改为银电极,则乙池为电镀池,且电镀过程中AgNO3溶液的浓度不变。
7.C 在阴极发生的是镁离子得到电子的反应,阴极材料可以为活性电极或惰性电极,故A错误;在阳极上发生失电子的反应,如果使用活性电极,活性电极会优先失电子,所以阳极必须用惰性电极,故B错误;电解氯化镁来获取金属镁,镁离子需要得电子,如果在水溶液中,水电离的氢离子会优先于Mg2+得电子,因此电解熔融状态的MgCl2获取金属镁,故C正确,D错误。
8.C 由O2-的移动方向可知,石墨为阳极,则b为电源正极,A错误;石墨电极作阳极,发生氧化反应,B错误;每生成0.1 mol Ti,转移0.4 mol电子,D错误。
9.B 钙还原二氧化钛反应的化学方程式为2Ca+TiO2Ti+2CaO,由TiO2制得1 mol金属Ti,理论上外电路转移4 mol电子,A正确;阳极反应式为C+2O2--4e- CO2↑,B错误;2Ca+TiO2Ti+2CaO,整套装置中CaO的总量不会减少,C正确;阳极反应式为C+2O2--4e- CO2↑,C不断被消耗,因此装置中石墨电极材料需要定期更换,D正确。
10.D 根据实验装置图,电源正极对应Ⅰ室为阳极室,电极反应式为2H2O-4e- O2↑+4H+;电源负极对应Ⅲ室为阴极室,电极反应式为Co2++2e-Co。H+通过阳离子交换膜由Ⅰ室进入Ⅱ室,Cl-通过阴离子交换膜由Ⅲ室进入Ⅱ室。A项,工作时,Ⅰ室因消耗H2O,溶液pH减小,Ⅱ室因H+由Ⅰ室迁移过来而使溶液pH减小,错误;B项,生成1 mol Co,转移2 mol e-,消耗1 mol H2O,Ⅰ室溶液质量理论上减少18 g,错误;C项,移除两交换膜后,石墨电极上发生的电极反应式为2Cl- -2e-Cl2↑,错误;D项,电解总反应为2Co2++2H2O2Co+O2↑+4H+,正确。
能力提升练
1.C 该装置制备高纯铬和硫酸,甲池中铬棒上Cr3+得电子发生还原反应,则铬棒为阴极,连接阴极的电极a为负极,则b为正极,A错误;根据分析可知,阴极反应为Cr3++3e- Cr,阳极反应为2H2O-4e- O2↑+4H+,B错误;甲池中的硫酸根离子通过阴膜进入乙池,丙池中生成的氢离子通过A膜进入乙池,所以导致乙池中硫酸浓度增大,溶液的pH减小,C正确;若有1 mol离子通过A膜,则丙池生成1 mol 氢离子,理论上阳极生成的气体(氧气)为×1=0.25 mol,不知道气体所处状况,无法计算生成气体的体积,D错误。
2.C 由装置图可知,N室中石墨为阴极,电解时阴极上水得电子生成H2和OH-,则原料室中的钠离子通过c膜进入N室,N室溶液中c(NaOH)增大,c膜为阳离子交换膜;M室中石墨电极为阳极,电解时阳极上水失电子生成O2和H+,H+通过a膜进入产品室,则a膜为阳离子交换膜,原料室中的B(OH通过b膜进入产品室,B(OH、H+发生反应生成H3BO3,所以b膜为阴离子交换膜。由分析可知,a膜和c膜均为阳离子交换膜,A错误;由分析可知,a%
4.C N为正极,发生还原反应,电极反应为O2+4e-+4H+ 2H2O,A正确;M为负极,N为正极,则电极M的电势比电极N的低,B正确;N为正极,电极反应为O2+4e-+4H+ 2H2O,生成H2O,右室硫酸的浓度减小,C错误;原电池工作时,阳离子向正极移动,即氢离子从左室向右室移动,D正确。
5.B 从图中可以看出,在左侧石墨电极上Mn2+转化为Mn3+,则此电极为阳极,a为正极,b为负极,右侧石墨电极为阴极,A正确;阴极上H+得电子生成H2,电极反应式为2H++2e- H2↑,B错误,C正确;由Mn2+-e- Mn3+及反应FeS2+15Mn3++8H2O Fe3++15Mn2++2S+16H+可知,理论上,电路中每转移15 mol e-,可处理1 mol FeS2,D正确。
6.C 据题图可知,X电极上H2O失电子生成氧气,发生氧化反应,X电极为阳极,电极反应为2H2O-4e- O2↑+4H+,A正确;Y电极上的反应物有O2,而X电极产生O2,所以可将X电极上产生的O2收集起来,输送到Y电极使用,B正确;Y电极上Fe3+得电子转化为Fe2+,O2得电子结合氢离子生成H2O2,发生还原反应,所以Y电极为阴极,C错误;据题图可知该装置工作时Fe2+与Fe3+循环转化,所以起始时,在Y电极附近加入适量Fe2+或Fe3+,均能让装置正常工作,D正确。
7.C 阴极得电子,发生还原反应,A错误;H+从左室通过阳离子交换膜进入浓缩室,B错误;A-通过阴离子交换膜从右室进入浓缩室,C正确;当浓缩室中增加0.6 mol HA时,说明有0.6 mol A-从右室进入浓缩室,有0.6 mol电子发生转移,因此可得到0.3 mol H2,即6.72 L(标准状况)H2,D错误。
8.答案 (1)①右 ②阳 N-6e-+3F- NF3↑+4H+
(2)①CH3OH-6e-+H2O CO2↑+6H+ ②Cr2+6Fe2++14H+ 2Cr3++6Fe3++7H2O ③0.4NA
解析 (1)①由题图知,在右侧区域氢离子得电子生成氢气,发生还原反应,故b电极为阴极,H+向右移动。②a电极为电解池的阳极,该电极上NH4F发生氧化反应转化为NF3,该电极的电极反应式为N-6e-+3F- NF3↑+4H+。
(2)①由氢离子的移动方向可知,M电极为负极、N电极为正极,则b口加入甲醇,c口通入空气或氧气,M电极上CH3OH失去电子被氧化得到CO2,电极反应式为CH3OH-6e-+H2O CO2↑+6H+。②电解池中,与N电极相连的为阳极,阳极上Fe失去电子被氧化,得到Fe2+,Fe2+与Cr2发生氧化还原反应,该反应的离子方程式为Cr2+6Fe2++14H+ 2Cr3++6Fe3++7H2O。③N电极反应为O2+4H++4e- 2H2O,当消耗标准状况下2.24 L即
0.1 mol氧气时,转移0.4 mol电子,则通过质子交换膜的H+数目为0.4NA。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
