2024人教版新教材高中化学选择性必修1同步练习--第二章 化学反应速率与化学平衡(含解析)
文档属性
| 名称 | 2024人教版新教材高中化学选择性必修1同步练习--第二章 化学反应速率与化学平衡(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 807.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-26 10:03:07 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024人教版新教材高中化学选择性必修1
第二章 化学反应速率与化学平衡
注意事项
1.全卷满分100分。考试用时90分钟。
2.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23
Cl 35.5。
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.被称为人体冷冻学之父的罗伯特·埃廷格在1962年写出《不朽的前景》一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是( )
A.化学反应前后质量守恒
B.低温下分子无法运动
C.温度降低,化学反应停止
D.温度越低,化学反应越慢
2.化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是( )
A.将肉类食品进行低温冷藏,能使其永远不会腐败变质
B.在化学工业中,使用催化剂一定能提高反应物的转化率
C.夏天面粉的发酵速率与冬天面粉的发酵速率相差不大
D.茶叶等包装袋中加入还原性铁粉,能显著延长茶叶的储存时间
3.2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ/mol,在V2O5存在时,该反应的机理为:
ⅰ.V2O5+SO2 2VO2+SO3(快)
ⅱ.4VO2+O2 2V2O5(慢)
下列说法正确的是( )
A.反应速率主要取决于V2O5的质量
B.VO2是该反应的催化剂
C.逆反应的活化能大于198 kJ/mol
D.反应ⅰ是决速步骤
4.下列说法正确的是( )
A.活化分子之间的碰撞一定是有效碰撞
B.一定条件下,发生反应C(石墨,s) C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C.在一恒容密闭容器中发生反应CaCO3(s) CaO(s)+CO2(g),仅增加CaCO3的质量,反应速率加快
D.对于反应2N2O5(g) 4NO2(g)+O2(g),反应达到平衡后,保持其他条件不变,增大压强,化学平衡常数增大
5.一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断不合理的是( )
A.c1∶c2=1∶3
B.X、Y的转化率相等
C.平衡时,Y和Z的生成速率之比为2∶3
D.c1的取值范围为06.在恒温时,一固定容积的容器内发生如下反应:2NO2(g) N2O4(g),达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,N2O4的体积分数 ( )
A.不变 B.增大 C.减小 D.无法判断
7.我国科学工作者首次实现二氧化碳到淀粉的人工合成,其转化涉及的第一步反应的化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。下列叙述正确的是( )
A.相同条件下,2 mol氢原子所具有的能量小于1 mol氢分子所具有的能量
B.当v(CO2)=v(CH3OH)时,反应一定达到平衡状态
C.分离出水蒸气,可增大正反应速率
D.平衡后,增大压强(压缩容器体积),可提高CO2和H2的转化率
8.工业上生产硝酸涉及氨的催化氧化,反应的热化学方程式为4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-904 kJ·mol-1,下列有关说法正确的是( )
A.该反应的ΔS<0
B.加入催化剂可降低逆反应的活化能,从而加快逆反应速率
C.恒温恒容时,增大压强,一定能使反应物中活化分子百分数增大,反应速率加快
D.达到平衡时,升高温度,正反应速率减小、逆反应速率增大
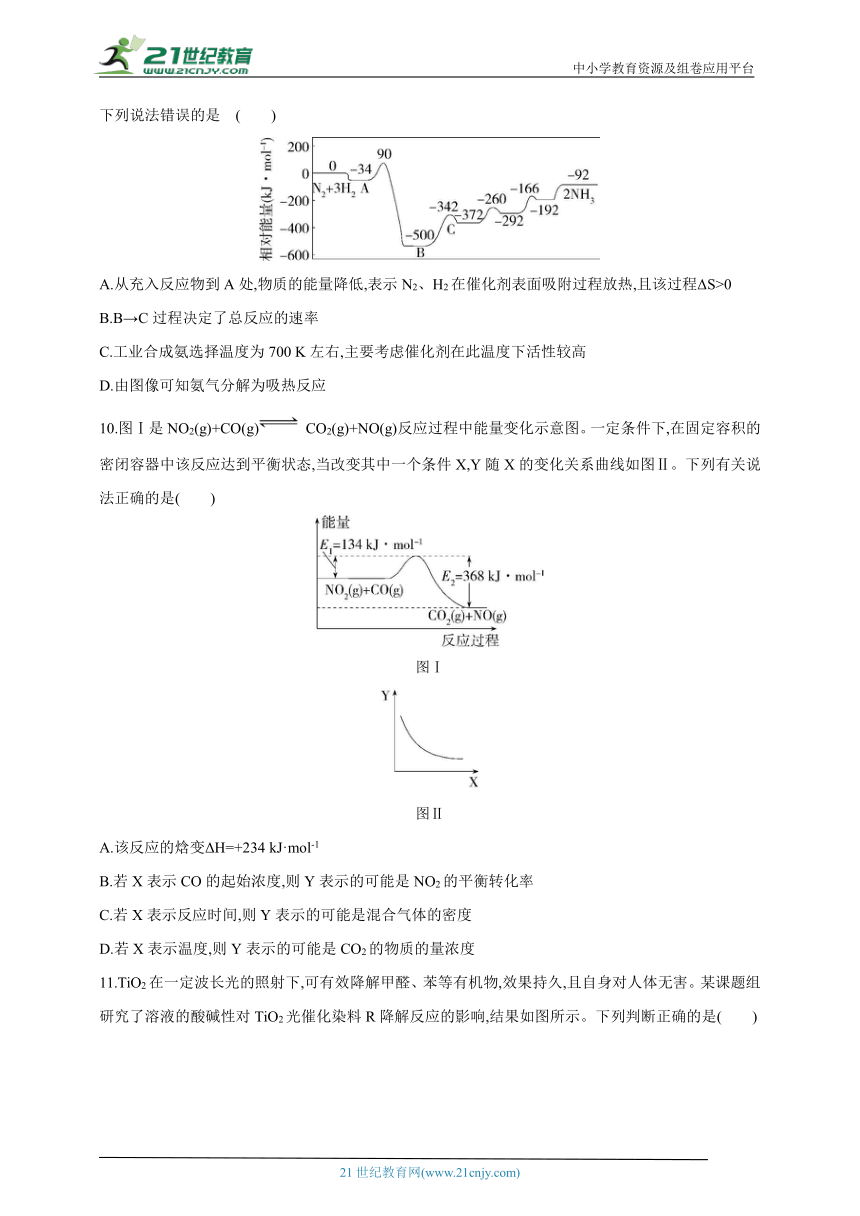
9.工业合成氨反应包含多个基元反应,其反应机理如图所示,已知各物种在催化剂表面吸附放出能量。下列说法错误的是 ( )
A.从充入反应物到A处,物质的能量降低,表示N2、H2在催化剂表面吸附过程放热,且该过程ΔS>0
B.B→C过程决定了总反应的速率
C.工业合成氨选择温度为700 K左右,主要考虑催化剂在此温度下活性较高
D.由图像可知氨气分解为吸热反应
10.图Ⅰ是NO2(g)+CO(g) CO2(g)+NO(g)反应过程中能量变化示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ。下列有关说法正确的是( )
图Ⅰ
图Ⅱ
A.该反应的焓变ΔH=+234 kJ·mol-1
B.若X表示CO的起始浓度,则Y表示的可能是NO2的平衡转化率
C.若X表示反应时间,则Y表示的可能是混合气体的密度
D.若X表示温度,则Y表示的可能是CO2的物质的量浓度
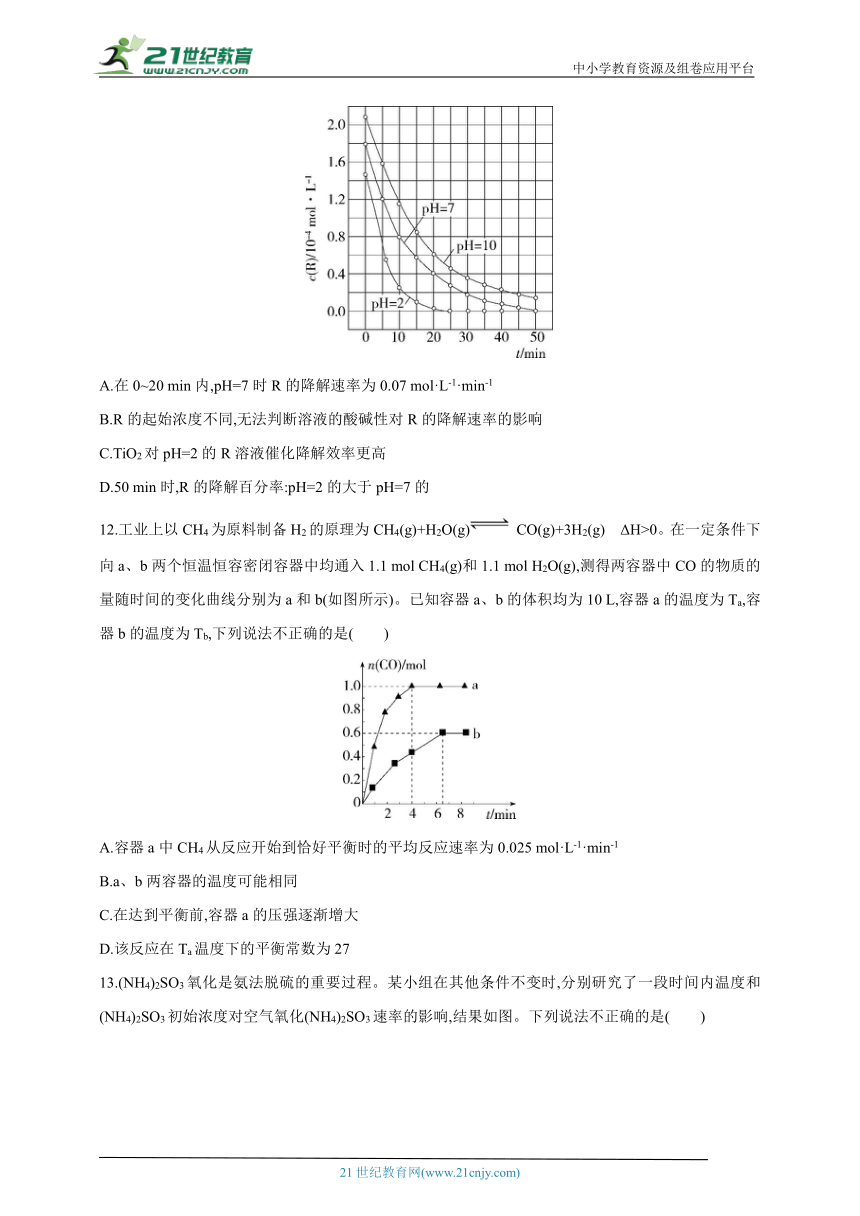
11.TiO2在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断正确的是( )
A.在0~20 min内,pH=7时R的降解速率为0.07 mol·L-1·min-1
B.R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响
C.TiO2对pH=2的R溶液催化降解效率更高
D.50 min时,R的降解百分率:pH=2的大于pH=7的
12.工业上以CH4为原料制备H2的原理为CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0。在一定条件下向a、b两个恒温恒容密闭容器中均通入1.1 mol CH4(g)和1.1 mol H2O(g),测得两容器中CO的物质的量随时间的变化曲线分别为a和b(如图所示)。已知容器a、b的体积均为10 L,容器a的温度为Ta,容器b的温度为Tb,下列说法不正确的是( )
A.容器a中CH4从反应开始到恰好平衡时的平均反应速率为0.025 mol·L-1·min-1
B.a、b两容器的温度可能相同
C.在达到平衡前,容器a的压强逐渐增大
D.该反应在Ta温度下的平衡常数为27
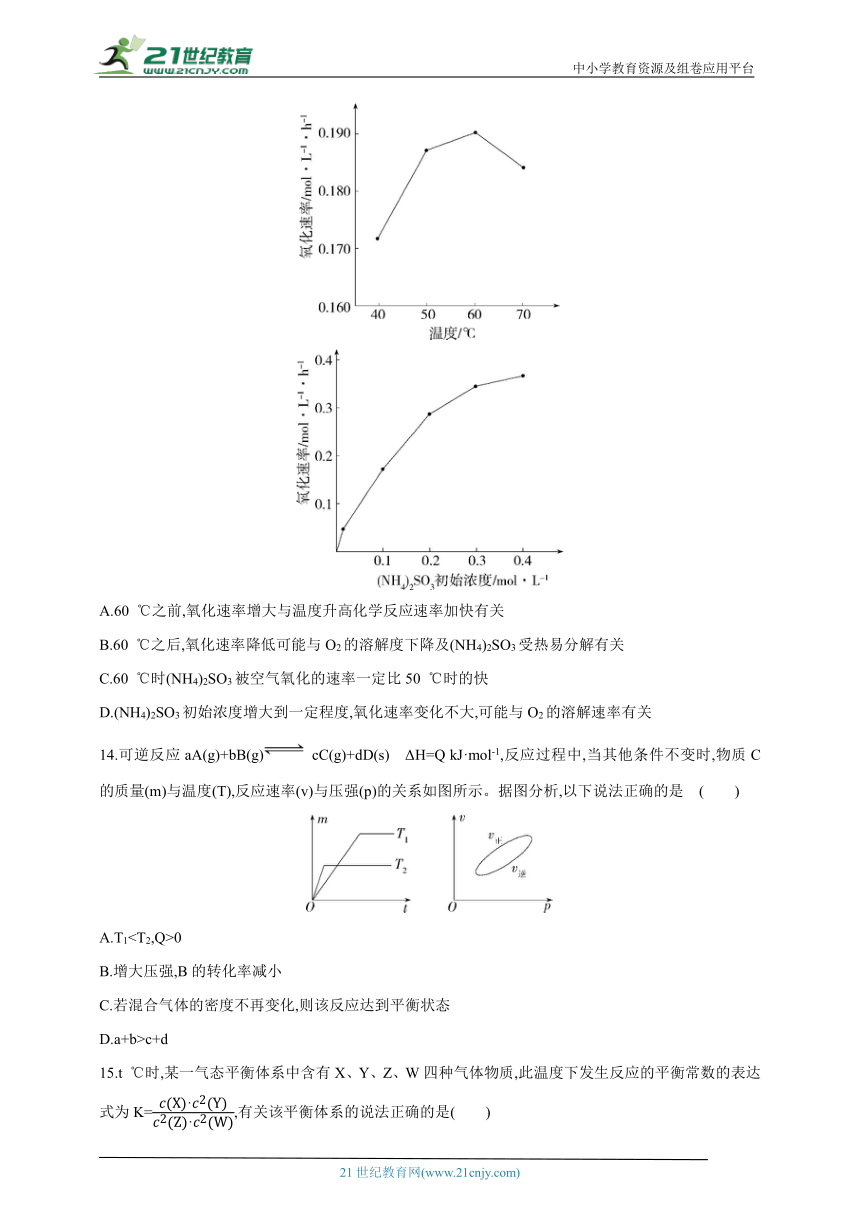
13.(NH4)2SO3氧化是氨法脱硫的重要过程。某小组在其他条件不变时,分别研究了一段时间内温度和(NH4)2SO3初始浓度对空气氧化(NH4)2SO3速率的影响,结果如图。下列说法不正确的是( )
A.60 ℃之前,氧化速率增大与温度升高化学反应速率加快有关
B.60 ℃之后,氧化速率降低可能与O2的溶解度下降及(NH4)2SO3受热易分解有关
C.60 ℃时(NH4)2SO3被空气氧化的速率一定比50 ℃时的快
D.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,可能与O2的溶解速率有关
14.可逆反应aA(g)+bB(g) cC(g)+dD(s) ΔH=Q kJ·mol-1,反应过程中,当其他条件不变时,物质C的质量(m)与温度(T),反应速率(v)与压强(p)的关系如图所示。据图分析,以下说法正确的是 ( )
A.T10
B.增大压强,B的转化率减小
C.若混合气体的密度不再变化,则该反应达到平衡状态
D.a+b>c+d
15.t ℃时,某一气态平衡体系中含有X、Y、Z、W四种气体物质,此温度下发生反应的平衡常数的表达式为K=,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K增大,则正反应为吸热反应
B.增大压强,W的质量分数增加
C.增大X的浓度,平衡向正反应方向移动
D.升高温度,若混合气体的平均相对分子质量变大,则正反应是放热反应
二、非选择题(本题共5小题,共55分)
16.(8分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)。
(1)t时刻,测得n(N2)=10 mol,n(NH3)=6 mol,则a= 。
(2)①反应达平衡时,混合气体的体积为716.8 L(标准状况),其中NH3的体积分数为25%,则平衡时NH3的物质的量为 。
②起始时混合气体与平衡时混合气体的总物质的量之比n(始)∶n(平)= 。
③a∶b= 。
④达到平衡时,N2和H2的转化率之比= 。
17.(8分)医用口罩的主要原材料是聚丙烯。工业上制备丙烯的反应原理是C4H8(g)+C2H4(g) 2C3H6(g) ΔH<0。在密闭容器中发生上述反应,v正=k正·c(C4H8)·c(C2H4),v逆=k逆·c2(C3H6),其中v正、v逆分别为正、逆反应速率,k正、k逆分别为正、逆反应速率常数。
(1)瑞典化学家阿伦尼乌斯的化学反应速率常数与温度之间关系的经验公式为k=A(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数)。下列说法正确的是 (填字母)。
A.其他条件不变,升高温度,k正增大,k逆减小
B.其他条件不变,使用催化剂,k正、k逆同倍数增大
C.其他条件不变,增大反应物浓度,k正增大,k逆不变
D.其他条件不变,增大压强,k正、k逆都增大
(2)一定条件下,向某密闭容器中投入一定量的C4H8(g)和C2H4(g),发生上述反应,平衡常数K= (用k正、k逆表示);升高温度, (填“增大”“减小”“不变”或“不确定”)。
(3)向三个体积相同的恒容密闭容器中充入C4H8(g)和C2H4(g)发生上述反应,测得有关数据如下:
容器 温度/K 起始时物质的 物质的量/mol 平衡时物质的 物质的量/mol
C4H8(g) C2H4(g) C3H6(g)
Ⅰ T1 1 2 0.5
Ⅱ T2 1 2 0.8
Ⅲ T1 2 4 a
则T1 T2(填“>”“<”或“=”,下同);a 1。
18.(12分)在密闭容器中发生反应CO2(g)+H2(g) CO(g)+H2O(g),其平衡常数(K)和温度(T)的关系如表所示。
T/℃ 700 800 830 1 000 1 200
K 0.6 0.9 1.0 1.7 2.6
(1)该反应的平衡常数表达式为K= ;由上表可知该反应的正反应为 反应(填“吸热”或“放热”)。
(2)830 ℃时,向容器中充入2 mol CO2、8 mol H2,保持温度不变,反应达到平衡后,其平衡常数 1.0(填“大于”“小于”或“等于”),此时CO2的物质的量为 。
(3)下列有利于提高平衡时CO2转化率的措施有 (填字母)。
a.使用催化剂
b.升温
c.增大CO2和H2的投料比
(4)若1 200 ℃时,在某时刻反应混合物中CO2、H2、CO、H2O的浓度分别为2 mol/L、2 mol/L、4 mol/L、4 mol/L,则此时平衡 (填“正向移动”“逆向移动”或“不移动”)。
(5)实验发现,其他条件不变,在相同时间内,向上述反应体系中投入一定量的CaO,H2的体积分数增大,实验结果如图所示。
已知:1微米=10-6米,1纳米=10-9米。
投入纳米CaO与投入微米CaO相比,H2的体积分数更高的原因是
。
19.(14分)N2O和CO是常见的环境污染性气体。
(1)对于反应N2O(g)+CO(g) CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行,第一步为Fe++N2O FeO++N2,则第二步反应为 。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能 (填“大于”“小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g) 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示。
图甲
图乙
①该反应的ΔH (填“>”或“<”)0。
②若容器Ⅰ的体积为2 L,反应在370 ℃下进行,20 s后达到平衡,则0~20 s内容器Ⅰ中用O2表示的反应速率为 。B点对应的平衡常数K= (保留两位有效数字)。
③若容器Ⅳ的体积为1 L,反应在370 ℃下进行,则起始时反应 (填“向正反应方向”“向逆反应方向”或“不”)进行。
20.(13分)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.2 kJ/mol
CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247.4 kJ/mol
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(2)工业上可用H2和CO2制备甲醇,其反应的化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
时间/h 1 2 3 4 5 6
0.90 0.85 0.83 0.81 0.80 0.80
①用H2表示的前2 h的平均反应速率v(H2)= 。
②该温度下,CO2的平衡转化率为 。
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)的关系。
①该反应的ΔH 0(填“>”或“<”)。
②曲线c表示的物质为 (填化学式)。
附加题
1.挥发性有机物(VOCs)对环境易造成污染,VOCs催化燃烧处理技术具有净化率高、燃烧温度低、无明火、不会有NOx等二次污染物产生等优点,图甲是VOCs处理过程中固体催化剂的催化原理,图乙是反应过程中的能量变化图,下列叙述正确的是( )
图甲
图乙
A.图甲中固体催化剂表面既有化学键断裂,也有化学键形成
B.图甲中固体催化剂可改变该反应的焓变
C.图乙中曲线Ⅰ使用了固体催化剂,反应活化能降低
D.VOCs催化氧化过程中所有反应均为放热反应
2.(双选)一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g) COCl2(g),其中容器Ⅰ中反应在 5 min时达到化学平衡状态。
容器 编号 温度/℃ 起始时物质的量/mol 平衡时物质的量/mol
CO Cl2 COCl2 COCl2
Ⅰ 500 1.0 1.0 0 0.8
Ⅱ 500 1.0 a 0 0.5
Ⅲ 600 0.5 0.5 0.5 0.7
下列说法中正确的是( )
A.该反应的正反应为放热反应
B.容器Ⅰ中前5 min内的平均反应速率v(CO)=0.16 mol·L-1·min-1
C.容器Ⅱ中,a=0.55
D.若容器Ⅰ恒压,达到平衡时CO的转化率小于80%
3.二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-90.7 kJ·mol-1,平衡常数为K1;
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1,平衡常数为K2;
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1,平衡常数为K3。
回答下列问题:
(1)反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH= kJ·mol-1;该反应的平衡常数K= (用K1、K2、K3表示)。
(2)下列措施中,能提高(1)中CH3OCH3产率的有 (填字母)。
A.使用过量的CO
B.升高温度
C.增大压强
(3)一定温度下,将0.2 mol CO和0.1 mol H2O(g)通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得H2的体积分数为0.1。则0~5 min内v(H2O)= ,CO的转化率α(CO)= 。
(4)将合成气以 =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如下图所示,下列说法正确的是 (填字母)。
A.ΔH<0
B.p1>p2>p3
C.若在p3和316 ℃时,起始时=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察下图,当约为 时最有利于二甲醚的合成。
答案全解全析
1.D 温度的高低影响化学反应速率的快慢,温度越低,反应速率越慢,但反应不会停止,分子运动不会停止;题述信息与反应前后质量守恒无关。
2.D 将肉类食品进行低温冷藏,只能减慢腐败变质的速率,A错误;在化学工业中,使用合适的催化剂能加快化学反应速率,但不能提高反应物的平衡转化率,B错误;夏天温度高,面粉的发酵速率比冬天发酵速率快,C错误;还原性铁粉能与茶叶包装袋中的氧气反应,降低氧气的浓度,延长茶叶的储存时间,D正确。
3.C 由反应机理可知,V2O5是该反应的催化剂,反应速率与催化剂V2O5的质量有一定关系,但V2O5的质量不是决定性因素,A、B都错误;ΔH=正反应的活化能-逆反应的活化能=
-198 kJ/mol,所以逆反应的活化能大于198 kJ/mol,C正确;慢反应是决速步骤,即反应ⅱ为决速步骤,故D错误。
4.B 活化分子之间的碰撞不一定是有效碰撞,A错误;C(石墨,s) C(金刚石,s) ΔH>0,所以等质量的石墨的能量比金刚石低,能量越低越稳定,故石墨比金刚石稳定,B正确;改变固体反应物的用量,不会影响反应速率,C错误;对于确定的反应,化学平衡常数只与温度有关,温度不变,化学平衡常数不变,D错误。
5.C 设X转化的浓度为x,则列“三段式”:
X(g) + 3Y(g) 2Z(g)
初始: c1 c2 c3
转化: x 3x 2x
平衡: 0.1 mol·L-1 0.3 mol·L-1 0.08 mol·L-1
则c1∶c2=(x+0.1 mol·L-1)∶(3x+0.3 mol·L-1)=1∶3,A正确;由A项可知,X的转化率为×100%,Y的转化率为×100%,c1∶c2=1∶3,则X、Y的转化率相等,B正确;平衡时,正、逆反应速率相等,则Y和Z的生成速率之比为3∶2,C错误;若反应向正反应方向进行到底,则c1=0,若反应向逆反应方向进行到底,则c1=0.14 mol·L-1,该反应为可逆反应,物质不可能完全转化,故有06.B 假设再次通入的NO2(g)是在与原平衡体系的温度和压强都相同的另一容器中进行反应,则所得平衡体系与原平衡完全相同,将两个容器叠加,抽去两容器中间的隔板,再压缩到原体积,体系的压强增大,化学平衡正向移动,所以重新达到平衡时NO2的体积分数减小,N2O4的体积分数增大。
7.D H原子之间形成共价键要放出能量,则2 mol H原子具有的能量大于1 mol H2分子具有的能量,A项错误;未标明速率的方向,不能确定该反应是否达到平衡状态,B项错误;分离出水蒸气的这一时刻,正反应速率不变,逆反应速率减小,随着反应进行,正反应速率逐渐减小至正、逆反应速率相等,C项错误;平衡后,压缩容器体积,压强增大,平衡正向移动,CO2和H2的转化率提高,D项正确。
8.B 该反应的ΔS>0,A错误。加入催化剂可降低正、逆反应的活化能,从而加快正、逆反应速率,B正确。恒温恒容时,若充入反应物来增大压强,单位体积内活化分子数目增大,活化分子百分数不变,反应速率加快;若充入不参与反应的气体来增大压强,单位体积内活化分子数目不变,活化分子百分数不变,反应速率不变,C错误。达到平衡时,升高温度,正、逆反应速率均增大,D错误。
9.A 从充入反应物到A处,表示N2、H2在催化剂表面的吸附过程,该过程ΔS<0,A错误;在整个转化过程中,B→C过程的活化能最大,所以此过程决定了总反应的速率,B正确;合成氨反应为放热反应,选择700 K左右的温度,主要是因为催化剂在此温度下活性较高,C正确;由题图可知,合成氨反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1,则氨气分解为吸热反应,D正确。
10.D 由于反应物的总能量高于生成物的总能量,所以该反应是放热反应,该反应的焓变ΔH=-234 kJ·mol-1,A错误;若X表示CO的起始浓度,在其他条件不变时,CO的起始浓度越高,NO2的平衡转化率越高,B错误;若X表示反应时间,由于参加该反应的物质都是气体,容器的容积不变,所以混合气体的密度不变,C错误;若X表示温度,升高温度,平衡向逆反应方向移动,c(CO2)逐渐减小,故Y表示的可能是CO2的物质的量浓度,D正确。
11.C 在0~20 min内,pH=7时R的降解速率==7×10-6 mol·L-1·min-1,A错误;根据题图可知,R的起始浓度和溶液的pH均影响R的降解速率,虽然R的起始浓度不同,但是可以通过分析三种pH条件下c(R)从1.2×10-4 mol·L-1减小为0.4×10-4 mol·L-1的三条曲线的斜率的大小来判断溶液的酸碱性对R的降解速率的影响,B错误;通过图像可知,pH=2时二氧化钛对R溶液催化降解效率更高,C正确;由题图可知,50 min时,pH=7时、pH=2时R的浓度均为0,则降解百分率pH=7的等于pH=2的,D错误。
12.B A项,容器a中CH4从反应开始到恰好平衡时的平均反应速率为=
0.025 mol·L-1·min-1,正确;B项,投入相同反应物,容器a和容器b中反应达到平衡状态所用时间不同,平衡时CO的物质的量不同,所以a、b两容器中温度一定不同,错误;C项,因为该反应条件为恒温恒容,反应后气体的物质的量增大,所以在达到平衡前,容器a的压强逐渐增大,正确;D项,该反应在Ta温度下的平衡常数为=27,正确。
13.C 一般温度越高,反应速率越快,60 ℃之前,氧化速率增大与温度升高化学反应速率加快有关,A正确;反应物浓度降低,反应速率降低,温度升高后O2的溶解度下降及(NH4)2SO3受热易分解,均使反应物浓度降低,B正确;除了温度,(NH4)2SO3被空气氧化的速率还受(NH4)2SO3初始浓度、O2在溶液中的溶解度等影响,所以60 ℃时的氧化速率不一定比50 ℃时的快,C错误;当亚硫酸铵的浓度增大到一定程度后,可能亚硫酸根离子被氧化的速率大于氧气的溶解速率,氧气的溶解速率较小导致亚硫酸根离子的氧化速率变化不大,D正确。
14.C 根据“先拐先平,数值大”可知,T2>T1,温度越高,平衡时物质C的质量(m)越小,故此反应的正反应为放热反应,Q<0,A项错误;由题图分析压强和反应速率的关系可知,增大压强,平衡正向移动,则该反应的正反应为气体物质的量减小的反应,增大压强,B的转化率增大,B项错误;由于D是固体,所以反应过程中气体质量是变量,混合气体的密度不再变化即达到平衡状态,C项正确;正反应为气体物质的量减小的反应,则a+b>c,但a+b与c+d的大小无法判断,D项错误。
15.A 根据K=知该反应的化学方程式为2Z(g)+2W(g) X(g)+2Y(g),升高温度平衡常数K增大,说明升高温度平衡正向移动,则正反应为吸热反应,A正确;增大压强,平衡向气体体积减小的方向移动,则W的质量分数减小,B错误;增大X的浓度,平衡向逆反应方向移动,C错误;升高温度混合气体的平均相对分子质量变大,说明平衡正向移动,升高温度平衡向吸热反应方向移动,则正反应为吸热反应,D错误。
16.答案 (除标注外,每空2分)(1)13(1分) (2)①8 mol(1分) ②5∶4 ③13∶27 ④9∶13
解析 (2)② N2(g)+3H2(g) 2NH3(g)
起始量(mol) 13 b 0
变化量(mol) 4 12 8
平衡量(mol) 9 b-12 8
平衡时,混合气体的物质的量为32 mol,则9+b-12+8=32,解得b=27,起始时混合气体与平衡时混合气体的物质的量之比n(始)∶n(平)=(13+27) mol∶32 mol=5∶4。③由(1)知a=13,由②知b=27,所以a∶b=13∶27。④由②可知,开始时氮气的物质的量为13 mol,氢气的物质的量为
27 mol,平衡时参加反应的氮气的物质的量为4 mol,参加反应的氢气的物质的量为12 mol,所以达到平衡时,N2和H2的转化率之比为∶=9∶13。
17.答案 (除标注外,每空2分)(1)B (2)(1分) 减小(1分) (3)> =
解析 (2)v正=k正·c(C4H8)·c(C2H4),v逆=k逆·c2(C3H6),当反应达到平衡时v正=v逆,k正·c(C4H8)·c(C2H4)=k逆·c2(C3H6)可得,由反应可知平衡常数K=;题述反应为放热反应,升高温度,平衡逆向移动,K减小,即减小。
(3)题述反应是放热反应,升高温度,平衡逆向移动,C3H6的物质的量减小,故T1>T2;该反应反应前后气体体积相等,其他条件不变,增大压强,平衡不移动,Ⅲ中的投料量是Ⅰ中的2倍,所以a=0.5×2=1。
18.答案 (除标注外,每空2分)(1)(1分) 吸热(1分) (2)等于 0.4 mol (3)b
(4)逆向移动
(5)相同质量的纳米CaO比微米CaO的表面积大,吸收CO2的速率更快,在相同时间内消耗CO2的量更多,使平衡逆向移动的程度更大
解析 (1)由题表可知,随着温度升高平衡常数逐渐增大,说明升高温度平衡正向移动,所以该反应的正反应为吸热反应。(2)对于确定的反应,平衡常数只与温度有关,温度不变,平衡常数不变,所以830 ℃时平衡常数仍为1.0。设平衡时消耗二氧化碳的物质的量为x mol,则平衡时二氧化碳的物质的量是(2-x) mol、氢气的物质的量是(8-x) mol、一氧化碳和水蒸气的物质的量均是x mol,设容器容积为V L,则K==1.0,解得x=1.6,所以此时CO2的物质的量为0.4 mol。(3)使用催化剂,平衡时CO2的转化率不变,a错误;正反应吸热,升温平衡正向移动,平衡时CO2的转化率增大,b正确;增大CO2和H2的投料比有利于增大氢气的转化率,平衡时CO2的转化率减小,c错误。(4)1 200 ℃时,在某时刻反应混合物中CO2、H2、CO、H2O的浓度分别为2 mol/L、2 mol/L、4 mol/L、4 mol/L,则此时Q==4>2.6,所以平衡逆向移动。
19.答案 (除标注外,每空2分)(1)FeO++CO Fe++CO2(3分) 大于
(2)①> ②0.000 5 mol·L-1·s-1 0.004 4 ③向逆反应方向(3分)
解析 (2)①升高温度,N2O的平衡转化率增大,故ΔH>0。②根据v=计算O2的反应速率;根据反应的化学方程式计算平衡时各组分的浓度,代入平衡常数表达式进行计算。③利用K和Q相对大小判断。
20.答案 (除标注外,每空2分)(1)CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH=+165.0 kJ/mol(3分) (2)①0.225 mol·L-1·h-1 ②40% (3)(MPa)-2 (4)①< ②C2H4
解析 (1)已知:①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.2 kJ/mol;②CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247.4 kJ/mol;根据盖斯定律,①×2-②得CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH=+165.0 kJ/mol。(2)①恒温恒容时,气体压强之比等于其物质的量之比,2 h时p后/p前=0.85,设消耗CO2的物质的量为x mol。
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始/mol 1 3 0 0
转化/mol x 3x x x
2 h时/mol 1-x 3-3x x x
则有=0.85,解得x=0.3。故前2 h的平均反应速率v(H2)==0.225 mol·L-1·h-1。②该温度下,反应进行5 h时处于平衡状态,此时p后/p前=0.80,设消耗CO2的物质的量为y mol,则有=0.80,解得y=0.4,故CO2的平衡转化率为×100%=40%。(3)设开始时投入CO2和H2的物质的量分别为1 mol、3 mol,CO2的平衡转化率为50%,则有:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始/mol 1 3 0 0
转化/mol 0.5 1.5 0.5 0.5
平衡/mol 0.5 1.5 0.5 0.5
平衡时p(CO2)=8 MPa× MPa,p(H2)=8 MPa×=4 MPa,p(CH3OH)=8 MPa× MPa,p(H2O)=8 MPa× MPa,Kp=(MPa)-2。
附加题
1.A 由题图甲可知,VOCs与O2在固体催化剂作用下发生化学反应,既有化学键断裂,又有化学键形成,A正确;催化剂只能改变化学反应速率,不能改变反应焓变,B错误;结合图乙可知,曲线Ⅱ为使用固体催化剂的能量变化曲线,C错误;结合图乙可知,反应物转化为中间产物的反应为吸热反应,D错误。
2.AC 依据表中数据可知:若温度相同,Ⅰ和Ⅲ为等效平衡,升高温度,COCl2的物质的量减小,说明平衡逆向移动,则逆反应为吸热反应,正反应为放热反应,A正确。容器Ⅰ中前5 min内的平均反应速率v(COCl2)==0.32 mol·L-1·min-1,依据反应速率之比等于化学计量数之比可知v(CO)=v(COCl2)=0.32 mol·L-1·min-1,B错误。依据题表中容器Ⅰ的数据,列出“三段式”:
CO(g)+Cl2(g) COCl2(g)
起始浓度(mol·L-1) 2 2 0
转化浓度(mol·L-1) 1.6 1.6 1.6
平衡浓度(mol·L-1) 0.4 0.4 1.6
500 ℃时反应平衡常数K==10;
依据题表中容器Ⅱ的数据,列出“三段式”:
CO(g)+Cl2(g) COCl2(g)
起始浓度(mol·L-1) 2 2a 0
转化浓度(mol·L-1) 1 1 1
平衡浓度(mol·L-1) 1 2a-1 1
Ⅰ和Ⅱ温度相同,则平衡常数相同,K==10,解得:a=0.55,C正确。根据C项分析可知,500 ℃、恒容下容器Ⅰ中CO的平衡转化率为×100%=80%,CO(g)+Cl2(g) COCl2(g)为反应后气体体积减小的反应,恒压下反应向正反应方向进行的程度比恒容时大,即恒压条件下达到平衡时CO的转化率大于80%,D错误。
3.答案 (1)-246.1 ·K2·K3 (2)AC (3)0.003 mol·L-1·min-1 15% (4)AB (5)2.0
解析 (3)设0~5 min内,CO转化的物质的量为x mol,则
CO(g)+H2O(g) CO2(g)+H2(g)
起始/mol 0.2 0.1 0 0
转化/mol x x x x
平衡/mol 0.2-x 0.1-x x x
平衡后测得H2的体积分数为0.1,则=0.1,解得x=0.03,结合v=、转化率=×100%分别计算0~5 min内v(H2O)和CO的转化率。(4)由题图可知升高温度CO的平衡转化率减小,则升高温度平衡逆向移动,故ΔH<0,A项正确;该反应为反应后气体体积减小的反应,增大压强平衡正向移动,CO的平衡转化率增大,则p1>p2>p3,B项正确;若起始时增大,其他条件不变,平衡时CO的转化率增大,C项错误。(5)由题图可知,当约为2.0时,CO转化率及DME选择性均最大,最有利于二甲醚的合成。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024人教版新教材高中化学选择性必修1
第二章 化学反应速率与化学平衡
注意事项
1.全卷满分100分。考试用时90分钟。
2.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23
Cl 35.5。
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.被称为人体冷冻学之父的罗伯特·埃廷格在1962年写出《不朽的前景》一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信息相关的是( )
A.化学反应前后质量守恒
B.低温下分子无法运动
C.温度降低,化学反应停止
D.温度越低,化学反应越慢
2.化学反应速率在工农业生产和日常生活中都有重要作用,下列说法正确的是( )
A.将肉类食品进行低温冷藏,能使其永远不会腐败变质
B.在化学工业中,使用催化剂一定能提高反应物的转化率
C.夏天面粉的发酵速率与冬天面粉的发酵速率相差不大
D.茶叶等包装袋中加入还原性铁粉,能显著延长茶叶的储存时间
3.2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ/mol,在V2O5存在时,该反应的机理为:
ⅰ.V2O5+SO2 2VO2+SO3(快)
ⅱ.4VO2+O2 2V2O5(慢)
下列说法正确的是( )
A.反应速率主要取决于V2O5的质量
B.VO2是该反应的催化剂
C.逆反应的活化能大于198 kJ/mol
D.反应ⅰ是决速步骤
4.下列说法正确的是( )
A.活化分子之间的碰撞一定是有效碰撞
B.一定条件下,发生反应C(石墨,s) C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C.在一恒容密闭容器中发生反应CaCO3(s) CaO(s)+CO2(g),仅增加CaCO3的质量,反应速率加快
D.对于反应2N2O5(g) 4NO2(g)+O2(g),反应达到平衡后,保持其他条件不变,增大压强,化学平衡常数增大
5.一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断不合理的是( )
A.c1∶c2=1∶3
B.X、Y的转化率相等
C.平衡时,Y和Z的生成速率之比为2∶3
D.c1的取值范围为0
A.不变 B.增大 C.减小 D.无法判断
7.我国科学工作者首次实现二氧化碳到淀粉的人工合成,其转化涉及的第一步反应的化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。下列叙述正确的是( )
A.相同条件下,2 mol氢原子所具有的能量小于1 mol氢分子所具有的能量
B.当v(CO2)=v(CH3OH)时,反应一定达到平衡状态
C.分离出水蒸气,可增大正反应速率
D.平衡后,增大压强(压缩容器体积),可提高CO2和H2的转化率
8.工业上生产硝酸涉及氨的催化氧化,反应的热化学方程式为4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-904 kJ·mol-1,下列有关说法正确的是( )
A.该反应的ΔS<0
B.加入催化剂可降低逆反应的活化能,从而加快逆反应速率
C.恒温恒容时,增大压强,一定能使反应物中活化分子百分数增大,反应速率加快
D.达到平衡时,升高温度,正反应速率减小、逆反应速率增大
9.工业合成氨反应包含多个基元反应,其反应机理如图所示,已知各物种在催化剂表面吸附放出能量。下列说法错误的是 ( )
A.从充入反应物到A处,物质的能量降低,表示N2、H2在催化剂表面吸附过程放热,且该过程ΔS>0
B.B→C过程决定了总反应的速率
C.工业合成氨选择温度为700 K左右,主要考虑催化剂在此温度下活性较高
D.由图像可知氨气分解为吸热反应
10.图Ⅰ是NO2(g)+CO(g) CO2(g)+NO(g)反应过程中能量变化示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ。下列有关说法正确的是( )
图Ⅰ
图Ⅱ
A.该反应的焓变ΔH=+234 kJ·mol-1
B.若X表示CO的起始浓度,则Y表示的可能是NO2的平衡转化率
C.若X表示反应时间,则Y表示的可能是混合气体的密度
D.若X表示温度,则Y表示的可能是CO2的物质的量浓度
11.TiO2在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断正确的是( )
A.在0~20 min内,pH=7时R的降解速率为0.07 mol·L-1·min-1
B.R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响
C.TiO2对pH=2的R溶液催化降解效率更高
D.50 min时,R的降解百分率:pH=2的大于pH=7的
12.工业上以CH4为原料制备H2的原理为CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0。在一定条件下向a、b两个恒温恒容密闭容器中均通入1.1 mol CH4(g)和1.1 mol H2O(g),测得两容器中CO的物质的量随时间的变化曲线分别为a和b(如图所示)。已知容器a、b的体积均为10 L,容器a的温度为Ta,容器b的温度为Tb,下列说法不正确的是( )
A.容器a中CH4从反应开始到恰好平衡时的平均反应速率为0.025 mol·L-1·min-1
B.a、b两容器的温度可能相同
C.在达到平衡前,容器a的压强逐渐增大
D.该反应在Ta温度下的平衡常数为27
13.(NH4)2SO3氧化是氨法脱硫的重要过程。某小组在其他条件不变时,分别研究了一段时间内温度和(NH4)2SO3初始浓度对空气氧化(NH4)2SO3速率的影响,结果如图。下列说法不正确的是( )
A.60 ℃之前,氧化速率增大与温度升高化学反应速率加快有关
B.60 ℃之后,氧化速率降低可能与O2的溶解度下降及(NH4)2SO3受热易分解有关
C.60 ℃时(NH4)2SO3被空气氧化的速率一定比50 ℃时的快
D.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,可能与O2的溶解速率有关
14.可逆反应aA(g)+bB(g) cC(g)+dD(s) ΔH=Q kJ·mol-1,反应过程中,当其他条件不变时,物质C的质量(m)与温度(T),反应速率(v)与压强(p)的关系如图所示。据图分析,以下说法正确的是 ( )
A.T1
B.增大压强,B的转化率减小
C.若混合气体的密度不再变化,则该反应达到平衡状态
D.a+b>c+d
15.t ℃时,某一气态平衡体系中含有X、Y、Z、W四种气体物质,此温度下发生反应的平衡常数的表达式为K=,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K增大,则正反应为吸热反应
B.增大压强,W的质量分数增加
C.增大X的浓度,平衡向正反应方向移动
D.升高温度,若混合气体的平均相对分子质量变大,则正反应是放热反应
二、非选择题(本题共5小题,共55分)
16.(8分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)。
(1)t时刻,测得n(N2)=10 mol,n(NH3)=6 mol,则a= 。
(2)①反应达平衡时,混合气体的体积为716.8 L(标准状况),其中NH3的体积分数为25%,则平衡时NH3的物质的量为 。
②起始时混合气体与平衡时混合气体的总物质的量之比n(始)∶n(平)= 。
③a∶b= 。
④达到平衡时,N2和H2的转化率之比= 。
17.(8分)医用口罩的主要原材料是聚丙烯。工业上制备丙烯的反应原理是C4H8(g)+C2H4(g) 2C3H6(g) ΔH<0。在密闭容器中发生上述反应,v正=k正·c(C4H8)·c(C2H4),v逆=k逆·c2(C3H6),其中v正、v逆分别为正、逆反应速率,k正、k逆分别为正、逆反应速率常数。
(1)瑞典化学家阿伦尼乌斯的化学反应速率常数与温度之间关系的经验公式为k=A(其中,k为速率常数,A、R为常数,Ea为活化能,T为绝对温度,e为自然对数底数)。下列说法正确的是 (填字母)。
A.其他条件不变,升高温度,k正增大,k逆减小
B.其他条件不变,使用催化剂,k正、k逆同倍数增大
C.其他条件不变,增大反应物浓度,k正增大,k逆不变
D.其他条件不变,增大压强,k正、k逆都增大
(2)一定条件下,向某密闭容器中投入一定量的C4H8(g)和C2H4(g),发生上述反应,平衡常数K= (用k正、k逆表示);升高温度, (填“增大”“减小”“不变”或“不确定”)。
(3)向三个体积相同的恒容密闭容器中充入C4H8(g)和C2H4(g)发生上述反应,测得有关数据如下:
容器 温度/K 起始时物质的 物质的量/mol 平衡时物质的 物质的量/mol
C4H8(g) C2H4(g) C3H6(g)
Ⅰ T1 1 2 0.5
Ⅱ T2 1 2 0.8
Ⅲ T1 2 4 a
则T1 T2(填“>”“<”或“=”,下同);a 1。
18.(12分)在密闭容器中发生反应CO2(g)+H2(g) CO(g)+H2O(g),其平衡常数(K)和温度(T)的关系如表所示。
T/℃ 700 800 830 1 000 1 200
K 0.6 0.9 1.0 1.7 2.6
(1)该反应的平衡常数表达式为K= ;由上表可知该反应的正反应为 反应(填“吸热”或“放热”)。
(2)830 ℃时,向容器中充入2 mol CO2、8 mol H2,保持温度不变,反应达到平衡后,其平衡常数 1.0(填“大于”“小于”或“等于”),此时CO2的物质的量为 。
(3)下列有利于提高平衡时CO2转化率的措施有 (填字母)。
a.使用催化剂
b.升温
c.增大CO2和H2的投料比
(4)若1 200 ℃时,在某时刻反应混合物中CO2、H2、CO、H2O的浓度分别为2 mol/L、2 mol/L、4 mol/L、4 mol/L,则此时平衡 (填“正向移动”“逆向移动”或“不移动”)。
(5)实验发现,其他条件不变,在相同时间内,向上述反应体系中投入一定量的CaO,H2的体积分数增大,实验结果如图所示。
已知:1微米=10-6米,1纳米=10-9米。
投入纳米CaO与投入微米CaO相比,H2的体积分数更高的原因是
。
19.(14分)N2O和CO是常见的环境污染性气体。
(1)对于反应N2O(g)+CO(g) CO2(g)+N2(g)来说,“Fe+”可作为此反应的催化剂。其总反应分两步进行,第一步为Fe++N2O FeO++N2,则第二步反应为 。
已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能 (填“大于”“小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:2N2O(g) 2N2(g)+O2(g),容器Ⅰ、Ⅱ、Ⅲ中N2O的平衡转化率如图乙所示。
图甲
图乙
①该反应的ΔH (填“>”或“<”)0。
②若容器Ⅰ的体积为2 L,反应在370 ℃下进行,20 s后达到平衡,则0~20 s内容器Ⅰ中用O2表示的反应速率为 。B点对应的平衡常数K= (保留两位有效数字)。
③若容器Ⅳ的体积为1 L,反应在370 ℃下进行,则起始时反应 (填“向正反应方向”“向逆反应方向”或“不”)进行。
20.(13分)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)已知:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.2 kJ/mol
CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247.4 kJ/mol
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(2)工业上可用H2和CO2制备甲醇,其反应的化学方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g)。某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表所示:
时间/h 1 2 3 4 5 6
0.90 0.85 0.83 0.81 0.80 0.80
①用H2表示的前2 h的平均反应速率v(H2)= 。
②该温度下,CO2的平衡转化率为 。
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3通入一恒压密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)的关系。
①该反应的ΔH 0(填“>”或“<”)。
②曲线c表示的物质为 (填化学式)。
附加题
1.挥发性有机物(VOCs)对环境易造成污染,VOCs催化燃烧处理技术具有净化率高、燃烧温度低、无明火、不会有NOx等二次污染物产生等优点,图甲是VOCs处理过程中固体催化剂的催化原理,图乙是反应过程中的能量变化图,下列叙述正确的是( )
图甲
图乙
A.图甲中固体催化剂表面既有化学键断裂,也有化学键形成
B.图甲中固体催化剂可改变该反应的焓变
C.图乙中曲线Ⅰ使用了固体催化剂,反应活化能降低
D.VOCs催化氧化过程中所有反应均为放热反应
2.(双选)一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g) COCl2(g),其中容器Ⅰ中反应在 5 min时达到化学平衡状态。
容器 编号 温度/℃ 起始时物质的量/mol 平衡时物质的量/mol
CO Cl2 COCl2 COCl2
Ⅰ 500 1.0 1.0 0 0.8
Ⅱ 500 1.0 a 0 0.5
Ⅲ 600 0.5 0.5 0.5 0.7
下列说法中正确的是( )
A.该反应的正反应为放热反应
B.容器Ⅰ中前5 min内的平均反应速率v(CO)=0.16 mol·L-1·min-1
C.容器Ⅱ中,a=0.55
D.若容器Ⅰ恒压,达到平衡时CO的转化率小于80%
3.二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-90.7 kJ·mol-1,平衡常数为K1;
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1,平衡常数为K2;
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1,平衡常数为K3。
回答下列问题:
(1)反应3H2(g)+3CO(g) CH3OCH3(g)+CO2(g)的ΔH= kJ·mol-1;该反应的平衡常数K= (用K1、K2、K3表示)。
(2)下列措施中,能提高(1)中CH3OCH3产率的有 (填字母)。
A.使用过量的CO
B.升高温度
C.增大压强
(3)一定温度下,将0.2 mol CO和0.1 mol H2O(g)通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得H2的体积分数为0.1。则0~5 min内v(H2O)= ,CO的转化率α(CO)= 。
(4)将合成气以 =2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g) CH3OCH3(g)+H2O(g) ΔH,其中CO的平衡转化率随温度、压强的变化关系如下图所示,下列说法正确的是 (填字母)。
A.ΔH<0
B.p1>p2>p3
C.若在p3和316 ℃时,起始时=3,则平衡时,α(CO)小于50%
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(DME)。观察下图,当约为 时最有利于二甲醚的合成。
答案全解全析
1.D 温度的高低影响化学反应速率的快慢,温度越低,反应速率越慢,但反应不会停止,分子运动不会停止;题述信息与反应前后质量守恒无关。
2.D 将肉类食品进行低温冷藏,只能减慢腐败变质的速率,A错误;在化学工业中,使用合适的催化剂能加快化学反应速率,但不能提高反应物的平衡转化率,B错误;夏天温度高,面粉的发酵速率比冬天发酵速率快,C错误;还原性铁粉能与茶叶包装袋中的氧气反应,降低氧气的浓度,延长茶叶的储存时间,D正确。
3.C 由反应机理可知,V2O5是该反应的催化剂,反应速率与催化剂V2O5的质量有一定关系,但V2O5的质量不是决定性因素,A、B都错误;ΔH=正反应的活化能-逆反应的活化能=
-198 kJ/mol,所以逆反应的活化能大于198 kJ/mol,C正确;慢反应是决速步骤,即反应ⅱ为决速步骤,故D错误。
4.B 活化分子之间的碰撞不一定是有效碰撞,A错误;C(石墨,s) C(金刚石,s) ΔH>0,所以等质量的石墨的能量比金刚石低,能量越低越稳定,故石墨比金刚石稳定,B正确;改变固体反应物的用量,不会影响反应速率,C错误;对于确定的反应,化学平衡常数只与温度有关,温度不变,化学平衡常数不变,D错误。
5.C 设X转化的浓度为x,则列“三段式”:
X(g) + 3Y(g) 2Z(g)
初始: c1 c2 c3
转化: x 3x 2x
平衡: 0.1 mol·L-1 0.3 mol·L-1 0.08 mol·L-1
则c1∶c2=(x+0.1 mol·L-1)∶(3x+0.3 mol·L-1)=1∶3,A正确;由A项可知,X的转化率为×100%,Y的转化率为×100%,c1∶c2=1∶3,则X、Y的转化率相等,B正确;平衡时,正、逆反应速率相等,则Y和Z的生成速率之比为3∶2,C错误;若反应向正反应方向进行到底,则c1=0,若反应向逆反应方向进行到底,则c1=0.14 mol·L-1,该反应为可逆反应,物质不可能完全转化,故有0
7.D H原子之间形成共价键要放出能量,则2 mol H原子具有的能量大于1 mol H2分子具有的能量,A项错误;未标明速率的方向,不能确定该反应是否达到平衡状态,B项错误;分离出水蒸气的这一时刻,正反应速率不变,逆反应速率减小,随着反应进行,正反应速率逐渐减小至正、逆反应速率相等,C项错误;平衡后,压缩容器体积,压强增大,平衡正向移动,CO2和H2的转化率提高,D项正确。
8.B 该反应的ΔS>0,A错误。加入催化剂可降低正、逆反应的活化能,从而加快正、逆反应速率,B正确。恒温恒容时,若充入反应物来增大压强,单位体积内活化分子数目增大,活化分子百分数不变,反应速率加快;若充入不参与反应的气体来增大压强,单位体积内活化分子数目不变,活化分子百分数不变,反应速率不变,C错误。达到平衡时,升高温度,正、逆反应速率均增大,D错误。
9.A 从充入反应物到A处,表示N2、H2在催化剂表面的吸附过程,该过程ΔS<0,A错误;在整个转化过程中,B→C过程的活化能最大,所以此过程决定了总反应的速率,B正确;合成氨反应为放热反应,选择700 K左右的温度,主要是因为催化剂在此温度下活性较高,C正确;由题图可知,合成氨反应为N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1,则氨气分解为吸热反应,D正确。
10.D 由于反应物的总能量高于生成物的总能量,所以该反应是放热反应,该反应的焓变ΔH=-234 kJ·mol-1,A错误;若X表示CO的起始浓度,在其他条件不变时,CO的起始浓度越高,NO2的平衡转化率越高,B错误;若X表示反应时间,由于参加该反应的物质都是气体,容器的容积不变,所以混合气体的密度不变,C错误;若X表示温度,升高温度,平衡向逆反应方向移动,c(CO2)逐渐减小,故Y表示的可能是CO2的物质的量浓度,D正确。
11.C 在0~20 min内,pH=7时R的降解速率==7×10-6 mol·L-1·min-1,A错误;根据题图可知,R的起始浓度和溶液的pH均影响R的降解速率,虽然R的起始浓度不同,但是可以通过分析三种pH条件下c(R)从1.2×10-4 mol·L-1减小为0.4×10-4 mol·L-1的三条曲线的斜率的大小来判断溶液的酸碱性对R的降解速率的影响,B错误;通过图像可知,pH=2时二氧化钛对R溶液催化降解效率更高,C正确;由题图可知,50 min时,pH=7时、pH=2时R的浓度均为0,则降解百分率pH=7的等于pH=2的,D错误。
12.B A项,容器a中CH4从反应开始到恰好平衡时的平均反应速率为=
0.025 mol·L-1·min-1,正确;B项,投入相同反应物,容器a和容器b中反应达到平衡状态所用时间不同,平衡时CO的物质的量不同,所以a、b两容器中温度一定不同,错误;C项,因为该反应条件为恒温恒容,反应后气体的物质的量增大,所以在达到平衡前,容器a的压强逐渐增大,正确;D项,该反应在Ta温度下的平衡常数为=27,正确。
13.C 一般温度越高,反应速率越快,60 ℃之前,氧化速率增大与温度升高化学反应速率加快有关,A正确;反应物浓度降低,反应速率降低,温度升高后O2的溶解度下降及(NH4)2SO3受热易分解,均使反应物浓度降低,B正确;除了温度,(NH4)2SO3被空气氧化的速率还受(NH4)2SO3初始浓度、O2在溶液中的溶解度等影响,所以60 ℃时的氧化速率不一定比50 ℃时的快,C错误;当亚硫酸铵的浓度增大到一定程度后,可能亚硫酸根离子被氧化的速率大于氧气的溶解速率,氧气的溶解速率较小导致亚硫酸根离子的氧化速率变化不大,D正确。
14.C 根据“先拐先平,数值大”可知,T2>T1,温度越高,平衡时物质C的质量(m)越小,故此反应的正反应为放热反应,Q<0,A项错误;由题图分析压强和反应速率的关系可知,增大压强,平衡正向移动,则该反应的正反应为气体物质的量减小的反应,增大压强,B的转化率增大,B项错误;由于D是固体,所以反应过程中气体质量是变量,混合气体的密度不再变化即达到平衡状态,C项正确;正反应为气体物质的量减小的反应,则a+b>c,但a+b与c+d的大小无法判断,D项错误。
15.A 根据K=知该反应的化学方程式为2Z(g)+2W(g) X(g)+2Y(g),升高温度平衡常数K增大,说明升高温度平衡正向移动,则正反应为吸热反应,A正确;增大压强,平衡向气体体积减小的方向移动,则W的质量分数减小,B错误;增大X的浓度,平衡向逆反应方向移动,C错误;升高温度混合气体的平均相对分子质量变大,说明平衡正向移动,升高温度平衡向吸热反应方向移动,则正反应为吸热反应,D错误。
16.答案 (除标注外,每空2分)(1)13(1分) (2)①8 mol(1分) ②5∶4 ③13∶27 ④9∶13
解析 (2)② N2(g)+3H2(g) 2NH3(g)
起始量(mol) 13 b 0
变化量(mol) 4 12 8
平衡量(mol) 9 b-12 8
平衡时,混合气体的物质的量为32 mol,则9+b-12+8=32,解得b=27,起始时混合气体与平衡时混合气体的物质的量之比n(始)∶n(平)=(13+27) mol∶32 mol=5∶4。③由(1)知a=13,由②知b=27,所以a∶b=13∶27。④由②可知,开始时氮气的物质的量为13 mol,氢气的物质的量为
27 mol,平衡时参加反应的氮气的物质的量为4 mol,参加反应的氢气的物质的量为12 mol,所以达到平衡时,N2和H2的转化率之比为∶=9∶13。
17.答案 (除标注外,每空2分)(1)B (2)(1分) 减小(1分) (3)> =
解析 (2)v正=k正·c(C4H8)·c(C2H4),v逆=k逆·c2(C3H6),当反应达到平衡时v正=v逆,k正·c(C4H8)·c(C2H4)=k逆·c2(C3H6)可得,由反应可知平衡常数K=;题述反应为放热反应,升高温度,平衡逆向移动,K减小,即减小。
(3)题述反应是放热反应,升高温度,平衡逆向移动,C3H6的物质的量减小,故T1>T2;该反应反应前后气体体积相等,其他条件不变,增大压强,平衡不移动,Ⅲ中的投料量是Ⅰ中的2倍,所以a=0.5×2=1。
18.答案 (除标注外,每空2分)(1)(1分) 吸热(1分) (2)等于 0.4 mol (3)b
(4)逆向移动
(5)相同质量的纳米CaO比微米CaO的表面积大,吸收CO2的速率更快,在相同时间内消耗CO2的量更多,使平衡逆向移动的程度更大
解析 (1)由题表可知,随着温度升高平衡常数逐渐增大,说明升高温度平衡正向移动,所以该反应的正反应为吸热反应。(2)对于确定的反应,平衡常数只与温度有关,温度不变,平衡常数不变,所以830 ℃时平衡常数仍为1.0。设平衡时消耗二氧化碳的物质的量为x mol,则平衡时二氧化碳的物质的量是(2-x) mol、氢气的物质的量是(8-x) mol、一氧化碳和水蒸气的物质的量均是x mol,设容器容积为V L,则K==1.0,解得x=1.6,所以此时CO2的物质的量为0.4 mol。(3)使用催化剂,平衡时CO2的转化率不变,a错误;正反应吸热,升温平衡正向移动,平衡时CO2的转化率增大,b正确;增大CO2和H2的投料比有利于增大氢气的转化率,平衡时CO2的转化率减小,c错误。(4)1 200 ℃时,在某时刻反应混合物中CO2、H2、CO、H2O的浓度分别为2 mol/L、2 mol/L、4 mol/L、4 mol/L,则此时Q==4>2.6,所以平衡逆向移动。
19.答案 (除标注外,每空2分)(1)FeO++CO Fe++CO2(3分) 大于
(2)①> ②0.000 5 mol·L-1·s-1 0.004 4 ③向逆反应方向(3分)
解析 (2)①升高温度,N2O的平衡转化率增大,故ΔH>0。②根据v=计算O2的反应速率;根据反应的化学方程式计算平衡时各组分的浓度,代入平衡常数表达式进行计算。③利用K和Q相对大小判断。
20.答案 (除标注外,每空2分)(1)CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH=+165.0 kJ/mol(3分) (2)①0.225 mol·L-1·h-1 ②40% (3)(MPa)-2 (4)①< ②C2H4
解析 (1)已知:①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.2 kJ/mol;②CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH=+247.4 kJ/mol;根据盖斯定律,①×2-②得CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH=+165.0 kJ/mol。(2)①恒温恒容时,气体压强之比等于其物质的量之比,2 h时p后/p前=0.85,设消耗CO2的物质的量为x mol。
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始/mol 1 3 0 0
转化/mol x 3x x x
2 h时/mol 1-x 3-3x x x
则有=0.85,解得x=0.3。故前2 h的平均反应速率v(H2)==0.225 mol·L-1·h-1。②该温度下,反应进行5 h时处于平衡状态,此时p后/p前=0.80,设消耗CO2的物质的量为y mol,则有=0.80,解得y=0.4,故CO2的平衡转化率为×100%=40%。(3)设开始时投入CO2和H2的物质的量分别为1 mol、3 mol,CO2的平衡转化率为50%,则有:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始/mol 1 3 0 0
转化/mol 0.5 1.5 0.5 0.5
平衡/mol 0.5 1.5 0.5 0.5
平衡时p(CO2)=8 MPa× MPa,p(H2)=8 MPa×=4 MPa,p(CH3OH)=8 MPa× MPa,p(H2O)=8 MPa× MPa,Kp=(MPa)-2。
附加题
1.A 由题图甲可知,VOCs与O2在固体催化剂作用下发生化学反应,既有化学键断裂,又有化学键形成,A正确;催化剂只能改变化学反应速率,不能改变反应焓变,B错误;结合图乙可知,曲线Ⅱ为使用固体催化剂的能量变化曲线,C错误;结合图乙可知,反应物转化为中间产物的反应为吸热反应,D错误。
2.AC 依据表中数据可知:若温度相同,Ⅰ和Ⅲ为等效平衡,升高温度,COCl2的物质的量减小,说明平衡逆向移动,则逆反应为吸热反应,正反应为放热反应,A正确。容器Ⅰ中前5 min内的平均反应速率v(COCl2)==0.32 mol·L-1·min-1,依据反应速率之比等于化学计量数之比可知v(CO)=v(COCl2)=0.32 mol·L-1·min-1,B错误。依据题表中容器Ⅰ的数据,列出“三段式”:
CO(g)+Cl2(g) COCl2(g)
起始浓度(mol·L-1) 2 2 0
转化浓度(mol·L-1) 1.6 1.6 1.6
平衡浓度(mol·L-1) 0.4 0.4 1.6
500 ℃时反应平衡常数K==10;
依据题表中容器Ⅱ的数据,列出“三段式”:
CO(g)+Cl2(g) COCl2(g)
起始浓度(mol·L-1) 2 2a 0
转化浓度(mol·L-1) 1 1 1
平衡浓度(mol·L-1) 1 2a-1 1
Ⅰ和Ⅱ温度相同,则平衡常数相同,K==10,解得:a=0.55,C正确。根据C项分析可知,500 ℃、恒容下容器Ⅰ中CO的平衡转化率为×100%=80%,CO(g)+Cl2(g) COCl2(g)为反应后气体体积减小的反应,恒压下反应向正反应方向进行的程度比恒容时大,即恒压条件下达到平衡时CO的转化率大于80%,D错误。
3.答案 (1)-246.1 ·K2·K3 (2)AC (3)0.003 mol·L-1·min-1 15% (4)AB (5)2.0
解析 (3)设0~5 min内,CO转化的物质的量为x mol,则
CO(g)+H2O(g) CO2(g)+H2(g)
起始/mol 0.2 0.1 0 0
转化/mol x x x x
平衡/mol 0.2-x 0.1-x x x
平衡后测得H2的体积分数为0.1,则=0.1,解得x=0.03,结合v=、转化率=×100%分别计算0~5 min内v(H2O)和CO的转化率。(4)由题图可知升高温度CO的平衡转化率减小,则升高温度平衡逆向移动,故ΔH<0,A项正确;该反应为反应后气体体积减小的反应,增大压强平衡正向移动,CO的平衡转化率增大,则p1>p2>p3,B项正确;若起始时增大,其他条件不变,平衡时CO的转化率增大,C项错误。(5)由题图可知,当约为2.0时,CO转化率及DME选择性均最大,最有利于二甲醚的合成。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
