第三单元 物质构成的奥秘 综合复习题 (含解析) 2022-2023学年上学期贵州省各地九年级化学期末试题选编
文档属性
| 名称 | 第三单元 物质构成的奥秘 综合复习题 (含解析) 2022-2023学年上学期贵州省各地九年级化学期末试题选编 |

|
|
| 格式 | docx | ||
| 文件大小 | 144.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-25 00:00:00 | ||
图片预览



文档简介
第3单元 物质构成的奥秘 综合复习题
一、单选题
1.(2022春·贵州铜仁·九年级期末)学习知识讲究活学活用、触类旁通,请从分子的角度分析下列解释正确的是
A.变瘪的乒乓球放入热水中能鼓起来——分子体积变大
B.10mL玉米粒与10mL黄豆混合,总体积小于20mL——分子之间有间隔
C.切开成熟的菠萝能闻到浓浓的香味——分子在不断地运动
D.1000L氧气加压后可装入20L的钢瓶中——分子的体积和质量都很小
2.(2022秋·贵州黔东南·九年级统考期末)通过对宏观现象的观察推理,可以建立起对微观粒子的认识。下列对于宏观事实的微观解释错误的是
A.把蔗糖放入水中,蔗糖固体很快消失——分子之间有间隔,蔗糖分子不断运动分散到水中
B.水银温度计的汞柱升高或降低——汞分子间隔发生变化
C.品红在热水中比在冷水中扩散的更快——温度越高分子运动速率越快
D.氢气在氧气中燃烧生成水——化学变化中分子分为原子,原子又重新结合成新的分子
3.(2022秋·贵州毕节·九年级统考期末)放学回家就闻到了饭菜的香味,由此可以说明
A.分子之间有间隔 B.分子可以分为原子
C.分子是不断运动的 D.分子可构成物质
4.(2022秋·贵州铜仁·九年级期末)压缩气体可使气体液化,气体液化后
A.分子的质量变小 B.分子的体积变小 C.分子的间隙变小 D.分子的数目减少
5.(2022秋·贵州黔东南·九年级期末)为形象展示水分解的微观过程,某同学制作了一些模型,表示相应的微观粒子.其中表示水分解过程中不能再分的粒子是( )
A. B. C. D.
6.(2022秋·贵州六盘水·九年级统考期末)下列物质中含有氧气分子的是
①高锰酸钾;②液氧;③H2O2;④洁净的空气;⑤氧化汞;⑥CO2
A.①② B.②③⑥ C.②④ D.①②③⑤
7.(2022秋·贵州黔东南·九年级期末)下列粒子在人体中起着重要的作用,其中属于阴离子的是
A. B. C. D.
8.(2022秋·贵州贵阳·九年级统考期末)核电荷数少于核外电子数的一定是
A.分子 B.原子
C.阳离子 D.阴离子
9.(2022秋·贵州铜仁·九年级期末)下列物质由分子构成的是
A.金刚石 B.二氧化碳 C.氯化钠 D.汞
10.(2022秋·贵州铜仁·九年级期末)对于Fe、Fe2+、Fe3+三种粒子的判断,正确的是
①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同 ④质量几乎相等 ⑤所含的质子数相等.
A.①③④⑤ B.②③④ C.①④⑤ D.③④⑤
11.(2022秋·贵州安顺·九年级统考期末)氟在元素周期表中的某些信息如图所示,下列相关说法错误的是
A.氟的核电荷数为9
B.氟原子在化学反应中易得电子
C.①处的符号为Fe
D.氟属于非金属元素
12.(2022秋·贵州铜仁·九年级期末)地壳中最多的金属元素是
A.Si B.O C.Al D.Ca
13.(2022春·贵州铜仁·九年级期末)恒星是目前发现含锂元素最高的,距地球约4500光年。如图为锂在元素周期表中的部分信息,下列有关锂的说法正确的是
A.属于非金属元素 B.原子核内有3个质子
C.相对原子质量为6.941g D.原子核外有7个电子
14.(2022春·贵州铜仁·九年级期末)某品牌儿童牙膏包装盒上标注有“不含氟”的字样。这里的“氟”指的是
A.原子 B.元素 C.分子 D.单质
15.(2022秋·贵州铜仁·九年级期末)中国古代曾用含砷元素的物质防治农作物病虫害。砷元素在元素周期表中的信息如下图。下列有关砷元素的说法正确的是
A.元素符号是AS B.属于金属元素
C.原子的核外电子数是33 D.相对原子质量为74.92g
16.(2022秋·贵州黔西·九年级期末)不同种元素最本质的区别是
A.质子数不同
B.中子数不同
C.相对原子质量不同
D.中子数与核外电子数之和不同
17.(2022秋·贵州黔东南·九年级期末)下 图是元素周期表中提供的碘元素部分信息及碘原子结构示意图。下列说法错误的是
A.碘单质(I2)是由碘原子直接构成的
B.碘的相对原子质量为127,原子核内质子数为53
C.碘原子核外共有53个电子,最外层有7个电子
D.碘元素属于非金属元素,碘原子在化学反应中容易得到电子
18.(2022秋·贵州铜仁·九年级期末)2017年5月9日,中国科学院发布了113号、115号、117号及118号四种元素的中文名称,其中一种元素在元素周期表中的信息如图所示,下列有关该元素说法错误的是
A.相对原子质量为288 B.核内有115个质子
C.是非金属元素 D.核内有 173 个中子
二、填空题
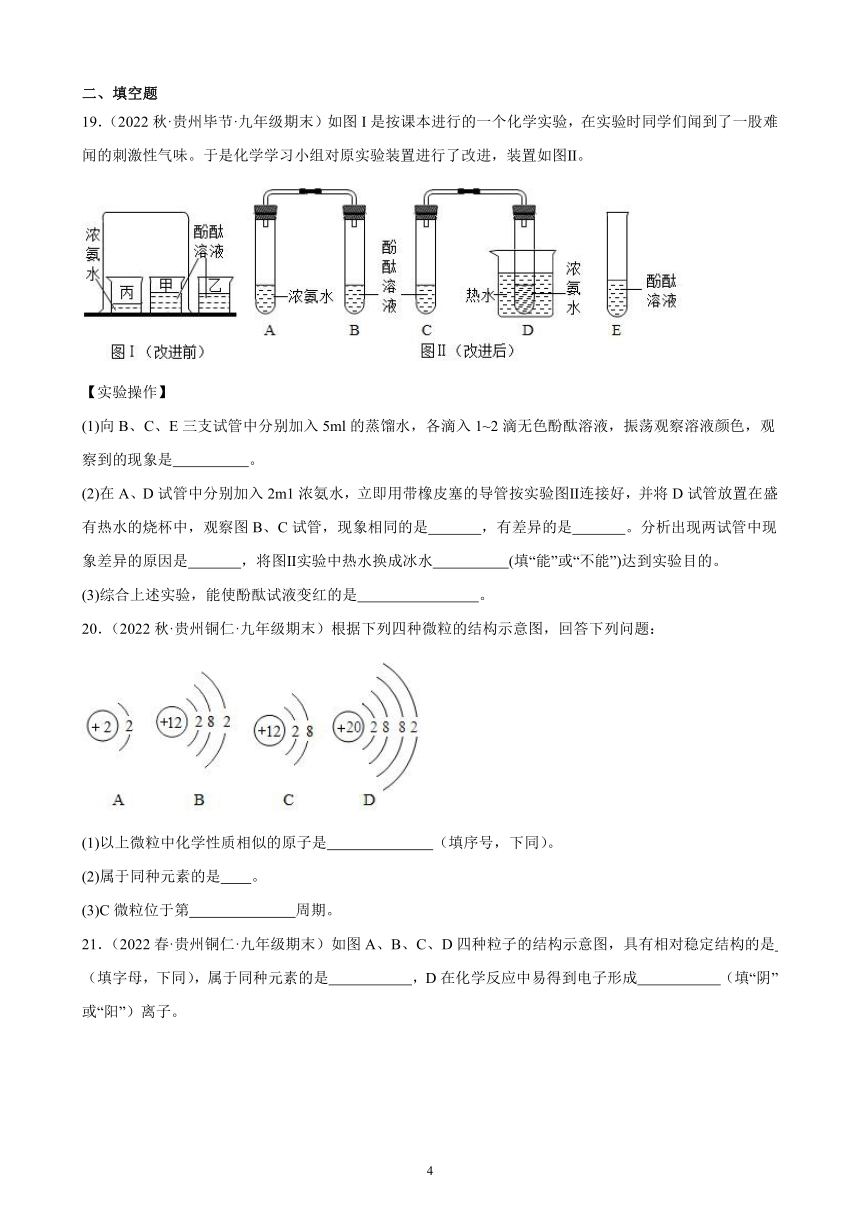
19.(2022秋·贵州毕节·九年级期末)如图I是按课本进行的一个化学实验,在实验时同学们闻到了一股难闻的刺激性气味。于是化学学习小组对原实验装置进行了改进,装置如图Ⅱ。
【实验操作】
(1)向B、C、E三支试管中分别加入5ml的蒸馏水,各滴入1~2滴无色酚酞溶液,振荡观察溶液颜色,观察到的现象是 。
(2)在A、D试管中分别加入2m1浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有热水的烧杯中,观察图B、C试管,现象相同的是 ,有差异的是 。分析出现两试管中现象差异的原因是 ,将图Ⅱ实验中热水换成冰水 (填“能”或“不能”)达到实验目的。
(3)综合上述实验,能使酚酞试液变红的是 。
20.(2022秋·贵州铜仁·九年级期末)根据下列四种微粒的结构示意图,回答下列问题:
(1)以上微粒中化学性质相似的原子是 (填序号,下同)。
(2)属于同种元素的是 。
(3)C微粒位于第 周期。
21.(2022春·贵州铜仁·九年级期末)如图A、B、C、D四种粒子的结构示意图,具有相对稳定结构的是 (填字母,下同),属于同种元素的是 ,D在化学反应中易得到电子形成 (填“阴”或“阳”)离子。
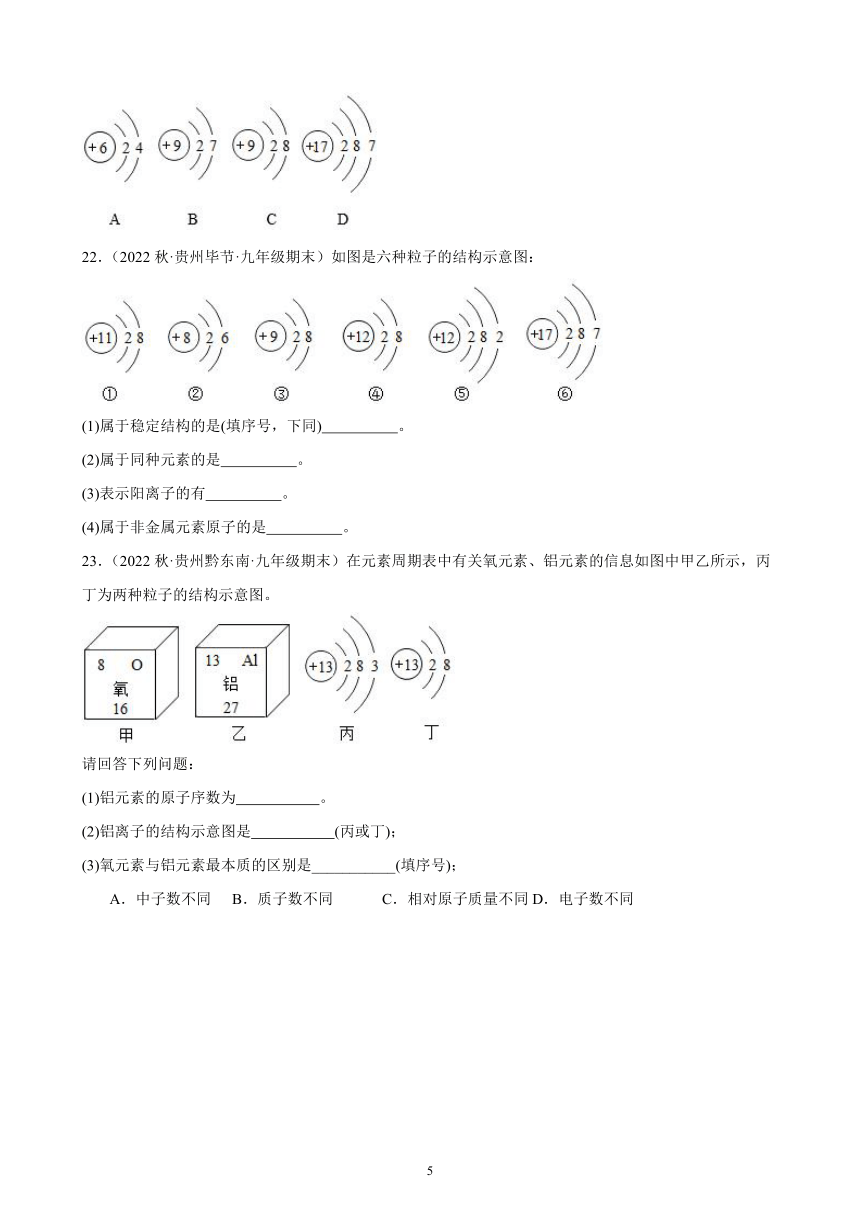
22.(2022秋·贵州毕节·九年级期末)如图是六种粒子的结构示意图:
(1)属于稳定结构的是(填序号,下同) 。
(2)属于同种元素的是 。
(3)表示阳离子的有 。
(4)属于非金属元素原子的是 。
23.(2022秋·贵州黔东南·九年级期末)在元素周期表中有关氧元素、铝元素的信息如图中甲乙所示,丙丁为两种粒子的结构示意图。
请回答下列问题:
(1)铝元素的原子序数为 。
(2)铝离子的结构示意图是 (丙或丁);
(3)氧元素与铝元素最本质的区别是___________(填序号);
A.中子数不同 B.质子数不同 C.相对原子质量不同 D.电子数不同
参考答案:
1.C
【详解】A、变瘪的乒乓球放入热水中能鼓起来——分子之间的间隔变大,不是体积变大,错误;
B、10mL玉米粒与10mL黄豆混合体现的是物质之间的间隔,不是分子之间的间隔,错误;
C、切开成熟的菠萝能闻到浓浓的香味——分子在不断地运动,运动到人周围被人闻到香味,正确;
D、1000L氧气加压后可装入20L的钢瓶中——分子之间有间隔,加压后间隔变小,错误;
故选C。
2.B
【详解】A、把蔗糖放入水中,蔗糖固体很快消失,说明蔗糖分子在不断运动,均匀的分散到水分子中,也能说明分子之间有间隔,不符合题意;
B、汞是由汞原子构成的,水银温度计的汞柱升高或降低是由于汞原子之间的间隔发生了改变,符合题意;
C、品红能够扩散到水中说明分子在不断运动,热水中扩散速度更快说明温度越高分子运动越快,不符合题意;
D、化学变化的微观实质是分子的破裂原子的重新组合,氢气在氧气中燃烧生成水,微观过程应为氢分子和氧分子分为氢原子和氧原子,氢、氧原子又重新组合为新的水分子,不符合题意;
故选B。
3.C
【详解】闻到了饭菜的香味,由此可以说明分子是不断运动的,运动到人周围,被人闻到香味;
故选C。
4.C
【详解】物质状态的改变,从微观方面分析是构成物质的微粒间的间隙发生了改变,气态物质分子间的距离较大,液态和固态物质分子间距离较小,所以气体液化后体积变小,是分子间间隙变小,分子的质量、体积和分子数目都不变,故C选项正确。
5.C
【详解】水分解过程中不能再分的粒子是氢原子和氧原子,观察选项,故选C。
6.C
【分析】氧气由氧分子构成,氧气中含有氧气分子;
【详解】①高锰酸钾是由钾离子和高锰酸根离子构成的,含有氧元素,不含氧分子;
②液氧是液态的氧气,氧气由氧分子构成;
③过氧化氢是由过氧化氢分子构成,不含氧分子;
④洁净的空气中含有氮气、氧气等物质,含有氧分子;
⑤氧化汞中含有氧元素,不含氧分子;
⑥CO2是由二氧化碳分子构成,不含氧分子;
故选C。
7.D
【分析】在微粒结构示意图中,圆圈内的数字表示该微粒的核内质子数,外部数字为核为电子数,当核内质数等于核外电子数时,表示原子;核内质子数大于核外电子数时,表示阳离子;核内质子数小于核外电子数时,表示阴离子。
【详解】A、核内质数等于核外电子数,该微粒为原子;
B、核内质子数大于核列电子数,该微粒为阳离子;
C、核内质子数大于核列电子数,该微粒为阳离子;
D、核内质子数小于核列电子数,该微粒为阴离子;
故选D。
8.D
【分析】微粒构成中,原子核带正电,核外电子带负电。核电荷数=核外电子数时,微粒不显电性,为中性原子;核电荷数>核外电子数时,微粒带正电,为阳离子;核电荷数<核外电子数时,微粒带负电,为阴离子。
【详解】A、分子是由原子构成的,不显电性,错误;
B、核电荷数=核外电子数时,微粒不显电性,为中性原子,错误;
C、核电荷数>核外电子数时,微粒带正电,为阳离子,错误;
D、核电荷数<核外电子数时,微粒带负电,为阴离子,正确。
故选D。
9.B
【详解】A.金刚石是由碳原子构成的,故错误;
B.二氧化碳是由二氧化碳分子构成的,故正确;
C.氯化钠是由氯离子和钠离子构成的,故错误;
D.汞是由汞原子构成的,故错误。故选B。
10.C
【详解】①它们都属于铁元素,故核电荷数相同。正确。
②它们核外电子数不等。Fe没有失去电子,而Fe2+失去2个电子,Fe3+则失去3个电子。错误。
③由于它们核外电子数不等,所以它们的电子层结构也不完全相同。错误。
④它们只是核外电子数不同,质子数与中子数完全相同,而电子虽有质量,但很小,一般忽略不计,所以它们的质量几乎相等。正确。
⑤它们都属于铁元素,故质子数相同。正确。
故选C。
11.C
【详解】A、原子中原子序数=核电荷数,元素周期表中左上角数字表示原子序数,则F的核电荷数=原子序数=9,故选项说法正确;
B、F原子的核电荷数=原子序数=核外电子数=9,根据原子核外电子排布规律可知F的原子核最外层电子数为7,则在反应中容易得到电子,故选项说法正确;
C、氟元素的符号为F,不是Fe,元素周期表中右上角字母为元素符号,则①处的符号为F,故选项说法错误;
D、氟的偏旁为“气”,则氟元素属于非金属元素,故选项说法正确。
故选C。
12.C
【详解】元素符号的书写,一个字母大写,两个字母第一个字母大写,第二个字母小写。地壳中含量最多的前五种元素有:O、Si、Al、Fe、Ca,金属元素是汉字中带钅字旁的元素(金与汞除外),所以地壳中含量最多的金属元素是Al;故选C。
13.B
【详解】A、由“金”字旁可知,锂属于金属元素,不符合题意;
B、在元素周期表中,元素名称左上角的数字表示原子序数,原子序数=质子数=3,符合题意;
C、在元素周期表中,元素名称下方的数字表示相对原子质量,相对原子质量是一个比值,单位为“1”,常省略不写,故锂的相对原子质量为6.941,不符合题意;
D、在原子中,质子数=原子序数=核外电子数=3,不符合题意。
故选B。
14.B
【详解】“氟”不是以单质、分子、原子、离子等形式存在,这里所指的“氟”是强调存在的元素。
故选B。
15.C
【详解】A、元素符号第一个字母大小,第二个字母小写,砷元素的元素符号为As,故A说法不正确;
B、砷是“石”字旁,属于非金属元素,故B说法不正确;
C、砷原子的核外电子数是33,因为原子中,核外电子数=核内质子数=原子的序数,故C说法正确;
D、砷的相对原子质量为74.92 ,不带单位“g”,故D说法不正确。
故选C。
16.A
【详解】元素是具有相同核电荷数 ( 即核内质子数 ) 的一类原子的总称,不同种元素之间的本质区别是质子数不同,故选A。
17.A
【详解】A、碘单质(I2)是由碘分子构成的,不是由碘原子直接构成的,错误;B、根据元素周期表中提供信息可知,碘的相对原子质量为127,碘的原子序数为53,原子序数=质子数,原子核内质子数为53,正确;C、根据碘原子的结构示意图,可知碘原子核外共有53个电子,最外层有7个电子,正确;D、根据碘原子的结构示意图和元素周期表可知,碘元素属于非金属元素,最外层电子数是7个多于4个,碘原子在化学反应中容易得到电子,正确。故选A。
点睛:元素周期表可提供的信息有原子序数、元素符号、元素名称、相对原子质量。
18.C
【详解】A、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为288,故选项说法正确。
B、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是镁,带“钅”字旁,属于金属元素,故选项说法错误。
C、根据元素周期表中的一格可知,左上角的数字为115,表示原子序数为115;根据原子序数=核电荷数=质子数=核外电子数,则核内有115个质子,故选项说法正确。
D、镁原子的相对原子质量为288,核内有115个质子,则中子数为288-115=173,故选项说法正确。
故选B。
19.(1)B、C试管中的酚酞溶液变红,E试管中的酚酞溶液不变色
(2) B、C试管中的酚酞溶液变红 C试管中比B 试管中先变红 温度越高,分子运动速率越快,即变红的速度越快 能
(3)浓氨水
【详解】(1)氨水呈碱性,能使无色酚酞溶液变红,分子在不断运动,向B、C、E三支试管中分别加入5ml的蒸馏水,各滴入1~2滴无色酚酞溶液,可观察到B、C试管中的酚酞溶液变红,E试管中的酚酞溶液不变色;
(2)在A、D试管中分别加入2ml浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有热水的烧杯中,观察图B、C试管,现象相同的是B、C试管中的酚酞溶液变红,有差异的是C试管中比B 试管中先变红;两试管中现象差异的原因是温度越高,分子运动速率越快,即变红的速度越快,将图Ⅱ实验中热水换成冰水C中的酚酞变红的速度比B中的更慢,但是能达到实验目的;
(3)综合上述实验,能使酚酞试液变红的是浓氨水,氨水呈碱性,能使酚酞溶液变红。
20.(1)BD/DB
(2)BC/CB
(3)三/3
【详解】(1)粒子最外层电子数相同则其化学性质相似,ABD最外层电子数都是2,但A仅有一个电子层,最外层为2即是稳定状态,故应填BD。
(2)对于粒子,核电荷数=原子序数,BC的核电荷数都是12,故其都是12号元素镁,故填BC;
(3)C是镁元素的离子,失去最外层电子形成,所以镁原子核外有3个电子层,元素所在周期数与对应元素的原子的电子层数相同,属于第三周期元素。
21. C BC 阴
【详解】C的最外层电子数为8,达到了相对稳定结构;
元素是质子数相同的一类原子的总称,B、C质子数相同,属于同种元素;
由图可知,D的最外层电子数为7,大于4,在化学反应中,易得到电子形成阴离子。
22.(1)①③④
(2)④⑤
(3)①④
(4)②⑥
【分析】根据原子结构示意图和离子结构示意图分析回答问题以及原子核内质子数大于核外电子数表示阳离子等。
【详解】(1)相对稳定结构是指最外层电子数为8的结构,①③④最外层电子数都为8,属于稳定结构;
故填:①③④;
(2)质子数相同的一类原子总称为元素,④和⑤质子数都为12,属于同种元素;
故填:④⑤;
(3)阳离子中质子数大于核外电子数,①和④中质子数大于核外电子数,表示阳离子;
故填:①④
(4)原子中质子数=核外电子数,图中②⑤⑥质子数=核外电子数,属于原子,②为氧原子,⑤为镁原子,⑥为氯原子,②和⑥属于非金属元素原子;
故填:②⑥。
【点睛】明确相对稳定结构、元素、离子与原子结构示意图是解答本题关键。
23.(1)13
(2)丁
(3)B
【分析】元素周期表中,方格中左上角是原子序数,右上角是元素符号,中间是元素名称,下面是相对原子质量;
原子中,核电荷数=核内质子数=核外电子数=原子序数
除汞外,金属元素的名称都带金字旁,非金属元素的名称不带金字旁:
相对原子质量质子数+中子数,单位不是g。
【详解】(1)由图可知,铝元素的原子序数为13。
(2)铝离子的结构示意图是丁,因为核内质子数为13,核外电子数为10,质子数不等于电子数的是离子,相等的是原子。
(3)元素是质子数相同的一类原子的总称,故氧元素与铝元素最本质的区别是质子数不同。
故选:B
一、单选题
1.(2022春·贵州铜仁·九年级期末)学习知识讲究活学活用、触类旁通,请从分子的角度分析下列解释正确的是
A.变瘪的乒乓球放入热水中能鼓起来——分子体积变大
B.10mL玉米粒与10mL黄豆混合,总体积小于20mL——分子之间有间隔
C.切开成熟的菠萝能闻到浓浓的香味——分子在不断地运动
D.1000L氧气加压后可装入20L的钢瓶中——分子的体积和质量都很小
2.(2022秋·贵州黔东南·九年级统考期末)通过对宏观现象的观察推理,可以建立起对微观粒子的认识。下列对于宏观事实的微观解释错误的是
A.把蔗糖放入水中,蔗糖固体很快消失——分子之间有间隔,蔗糖分子不断运动分散到水中
B.水银温度计的汞柱升高或降低——汞分子间隔发生变化
C.品红在热水中比在冷水中扩散的更快——温度越高分子运动速率越快
D.氢气在氧气中燃烧生成水——化学变化中分子分为原子,原子又重新结合成新的分子
3.(2022秋·贵州毕节·九年级统考期末)放学回家就闻到了饭菜的香味,由此可以说明
A.分子之间有间隔 B.分子可以分为原子
C.分子是不断运动的 D.分子可构成物质
4.(2022秋·贵州铜仁·九年级期末)压缩气体可使气体液化,气体液化后
A.分子的质量变小 B.分子的体积变小 C.分子的间隙变小 D.分子的数目减少
5.(2022秋·贵州黔东南·九年级期末)为形象展示水分解的微观过程,某同学制作了一些模型,表示相应的微观粒子.其中表示水分解过程中不能再分的粒子是( )
A. B. C. D.
6.(2022秋·贵州六盘水·九年级统考期末)下列物质中含有氧气分子的是
①高锰酸钾;②液氧;③H2O2;④洁净的空气;⑤氧化汞;⑥CO2
A.①② B.②③⑥ C.②④ D.①②③⑤
7.(2022秋·贵州黔东南·九年级期末)下列粒子在人体中起着重要的作用,其中属于阴离子的是
A. B. C. D.
8.(2022秋·贵州贵阳·九年级统考期末)核电荷数少于核外电子数的一定是
A.分子 B.原子
C.阳离子 D.阴离子
9.(2022秋·贵州铜仁·九年级期末)下列物质由分子构成的是
A.金刚石 B.二氧化碳 C.氯化钠 D.汞
10.(2022秋·贵州铜仁·九年级期末)对于Fe、Fe2+、Fe3+三种粒子的判断,正确的是
①核电荷数相同 ②核外电子数相等 ③电子层结构完全相同 ④质量几乎相等 ⑤所含的质子数相等.
A.①③④⑤ B.②③④ C.①④⑤ D.③④⑤
11.(2022秋·贵州安顺·九年级统考期末)氟在元素周期表中的某些信息如图所示,下列相关说法错误的是
A.氟的核电荷数为9
B.氟原子在化学反应中易得电子
C.①处的符号为Fe
D.氟属于非金属元素
12.(2022秋·贵州铜仁·九年级期末)地壳中最多的金属元素是
A.Si B.O C.Al D.Ca
13.(2022春·贵州铜仁·九年级期末)恒星是目前发现含锂元素最高的,距地球约4500光年。如图为锂在元素周期表中的部分信息,下列有关锂的说法正确的是
A.属于非金属元素 B.原子核内有3个质子
C.相对原子质量为6.941g D.原子核外有7个电子
14.(2022春·贵州铜仁·九年级期末)某品牌儿童牙膏包装盒上标注有“不含氟”的字样。这里的“氟”指的是
A.原子 B.元素 C.分子 D.单质
15.(2022秋·贵州铜仁·九年级期末)中国古代曾用含砷元素的物质防治农作物病虫害。砷元素在元素周期表中的信息如下图。下列有关砷元素的说法正确的是
A.元素符号是AS B.属于金属元素
C.原子的核外电子数是33 D.相对原子质量为74.92g
16.(2022秋·贵州黔西·九年级期末)不同种元素最本质的区别是
A.质子数不同
B.中子数不同
C.相对原子质量不同
D.中子数与核外电子数之和不同
17.(2022秋·贵州黔东南·九年级期末)下 图是元素周期表中提供的碘元素部分信息及碘原子结构示意图。下列说法错误的是
A.碘单质(I2)是由碘原子直接构成的
B.碘的相对原子质量为127,原子核内质子数为53
C.碘原子核外共有53个电子,最外层有7个电子
D.碘元素属于非金属元素,碘原子在化学反应中容易得到电子
18.(2022秋·贵州铜仁·九年级期末)2017年5月9日,中国科学院发布了113号、115号、117号及118号四种元素的中文名称,其中一种元素在元素周期表中的信息如图所示,下列有关该元素说法错误的是
A.相对原子质量为288 B.核内有115个质子
C.是非金属元素 D.核内有 173 个中子
二、填空题
19.(2022秋·贵州毕节·九年级期末)如图I是按课本进行的一个化学实验,在实验时同学们闻到了一股难闻的刺激性气味。于是化学学习小组对原实验装置进行了改进,装置如图Ⅱ。
【实验操作】
(1)向B、C、E三支试管中分别加入5ml的蒸馏水,各滴入1~2滴无色酚酞溶液,振荡观察溶液颜色,观察到的现象是 。
(2)在A、D试管中分别加入2m1浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有热水的烧杯中,观察图B、C试管,现象相同的是 ,有差异的是 。分析出现两试管中现象差异的原因是 ,将图Ⅱ实验中热水换成冰水 (填“能”或“不能”)达到实验目的。
(3)综合上述实验,能使酚酞试液变红的是 。
20.(2022秋·贵州铜仁·九年级期末)根据下列四种微粒的结构示意图,回答下列问题:
(1)以上微粒中化学性质相似的原子是 (填序号,下同)。
(2)属于同种元素的是 。
(3)C微粒位于第 周期。
21.(2022春·贵州铜仁·九年级期末)如图A、B、C、D四种粒子的结构示意图,具有相对稳定结构的是 (填字母,下同),属于同种元素的是 ,D在化学反应中易得到电子形成 (填“阴”或“阳”)离子。
22.(2022秋·贵州毕节·九年级期末)如图是六种粒子的结构示意图:
(1)属于稳定结构的是(填序号,下同) 。
(2)属于同种元素的是 。
(3)表示阳离子的有 。
(4)属于非金属元素原子的是 。
23.(2022秋·贵州黔东南·九年级期末)在元素周期表中有关氧元素、铝元素的信息如图中甲乙所示,丙丁为两种粒子的结构示意图。
请回答下列问题:
(1)铝元素的原子序数为 。
(2)铝离子的结构示意图是 (丙或丁);
(3)氧元素与铝元素最本质的区别是___________(填序号);
A.中子数不同 B.质子数不同 C.相对原子质量不同 D.电子数不同
参考答案:
1.C
【详解】A、变瘪的乒乓球放入热水中能鼓起来——分子之间的间隔变大,不是体积变大,错误;
B、10mL玉米粒与10mL黄豆混合体现的是物质之间的间隔,不是分子之间的间隔,错误;
C、切开成熟的菠萝能闻到浓浓的香味——分子在不断地运动,运动到人周围被人闻到香味,正确;
D、1000L氧气加压后可装入20L的钢瓶中——分子之间有间隔,加压后间隔变小,错误;
故选C。
2.B
【详解】A、把蔗糖放入水中,蔗糖固体很快消失,说明蔗糖分子在不断运动,均匀的分散到水分子中,也能说明分子之间有间隔,不符合题意;
B、汞是由汞原子构成的,水银温度计的汞柱升高或降低是由于汞原子之间的间隔发生了改变,符合题意;
C、品红能够扩散到水中说明分子在不断运动,热水中扩散速度更快说明温度越高分子运动越快,不符合题意;
D、化学变化的微观实质是分子的破裂原子的重新组合,氢气在氧气中燃烧生成水,微观过程应为氢分子和氧分子分为氢原子和氧原子,氢、氧原子又重新组合为新的水分子,不符合题意;
故选B。
3.C
【详解】闻到了饭菜的香味,由此可以说明分子是不断运动的,运动到人周围,被人闻到香味;
故选C。
4.C
【详解】物质状态的改变,从微观方面分析是构成物质的微粒间的间隙发生了改变,气态物质分子间的距离较大,液态和固态物质分子间距离较小,所以气体液化后体积变小,是分子间间隙变小,分子的质量、体积和分子数目都不变,故C选项正确。
5.C
【详解】水分解过程中不能再分的粒子是氢原子和氧原子,观察选项,故选C。
6.C
【分析】氧气由氧分子构成,氧气中含有氧气分子;
【详解】①高锰酸钾是由钾离子和高锰酸根离子构成的,含有氧元素,不含氧分子;
②液氧是液态的氧气,氧气由氧分子构成;
③过氧化氢是由过氧化氢分子构成,不含氧分子;
④洁净的空气中含有氮气、氧气等物质,含有氧分子;
⑤氧化汞中含有氧元素,不含氧分子;
⑥CO2是由二氧化碳分子构成,不含氧分子;
故选C。
7.D
【分析】在微粒结构示意图中,圆圈内的数字表示该微粒的核内质子数,外部数字为核为电子数,当核内质数等于核外电子数时,表示原子;核内质子数大于核外电子数时,表示阳离子;核内质子数小于核外电子数时,表示阴离子。
【详解】A、核内质数等于核外电子数,该微粒为原子;
B、核内质子数大于核列电子数,该微粒为阳离子;
C、核内质子数大于核列电子数,该微粒为阳离子;
D、核内质子数小于核列电子数,该微粒为阴离子;
故选D。
8.D
【分析】微粒构成中,原子核带正电,核外电子带负电。核电荷数=核外电子数时,微粒不显电性,为中性原子;核电荷数>核外电子数时,微粒带正电,为阳离子;核电荷数<核外电子数时,微粒带负电,为阴离子。
【详解】A、分子是由原子构成的,不显电性,错误;
B、核电荷数=核外电子数时,微粒不显电性,为中性原子,错误;
C、核电荷数>核外电子数时,微粒带正电,为阳离子,错误;
D、核电荷数<核外电子数时,微粒带负电,为阴离子,正确。
故选D。
9.B
【详解】A.金刚石是由碳原子构成的,故错误;
B.二氧化碳是由二氧化碳分子构成的,故正确;
C.氯化钠是由氯离子和钠离子构成的,故错误;
D.汞是由汞原子构成的,故错误。故选B。
10.C
【详解】①它们都属于铁元素,故核电荷数相同。正确。
②它们核外电子数不等。Fe没有失去电子,而Fe2+失去2个电子,Fe3+则失去3个电子。错误。
③由于它们核外电子数不等,所以它们的电子层结构也不完全相同。错误。
④它们只是核外电子数不同,质子数与中子数完全相同,而电子虽有质量,但很小,一般忽略不计,所以它们的质量几乎相等。正确。
⑤它们都属于铁元素,故质子数相同。正确。
故选C。
11.C
【详解】A、原子中原子序数=核电荷数,元素周期表中左上角数字表示原子序数,则F的核电荷数=原子序数=9,故选项说法正确;
B、F原子的核电荷数=原子序数=核外电子数=9,根据原子核外电子排布规律可知F的原子核最外层电子数为7,则在反应中容易得到电子,故选项说法正确;
C、氟元素的符号为F,不是Fe,元素周期表中右上角字母为元素符号,则①处的符号为F,故选项说法错误;
D、氟的偏旁为“气”,则氟元素属于非金属元素,故选项说法正确。
故选C。
12.C
【详解】元素符号的书写,一个字母大写,两个字母第一个字母大写,第二个字母小写。地壳中含量最多的前五种元素有:O、Si、Al、Fe、Ca,金属元素是汉字中带钅字旁的元素(金与汞除外),所以地壳中含量最多的金属元素是Al;故选C。
13.B
【详解】A、由“金”字旁可知,锂属于金属元素,不符合题意;
B、在元素周期表中,元素名称左上角的数字表示原子序数,原子序数=质子数=3,符合题意;
C、在元素周期表中,元素名称下方的数字表示相对原子质量,相对原子质量是一个比值,单位为“1”,常省略不写,故锂的相对原子质量为6.941,不符合题意;
D、在原子中,质子数=原子序数=核外电子数=3,不符合题意。
故选B。
14.B
【详解】“氟”不是以单质、分子、原子、离子等形式存在,这里所指的“氟”是强调存在的元素。
故选B。
15.C
【详解】A、元素符号第一个字母大小,第二个字母小写,砷元素的元素符号为As,故A说法不正确;
B、砷是“石”字旁,属于非金属元素,故B说法不正确;
C、砷原子的核外电子数是33,因为原子中,核外电子数=核内质子数=原子的序数,故C说法正确;
D、砷的相对原子质量为74.92 ,不带单位“g”,故D说法不正确。
故选C。
16.A
【详解】元素是具有相同核电荷数 ( 即核内质子数 ) 的一类原子的总称,不同种元素之间的本质区别是质子数不同,故选A。
17.A
【详解】A、碘单质(I2)是由碘分子构成的,不是由碘原子直接构成的,错误;B、根据元素周期表中提供信息可知,碘的相对原子质量为127,碘的原子序数为53,原子序数=质子数,原子核内质子数为53,正确;C、根据碘原子的结构示意图,可知碘原子核外共有53个电子,最外层有7个电子,正确;D、根据碘原子的结构示意图和元素周期表可知,碘元素属于非金属元素,最外层电子数是7个多于4个,碘原子在化学反应中容易得到电子,正确。故选A。
点睛:元素周期表可提供的信息有原子序数、元素符号、元素名称、相对原子质量。
18.C
【详解】A、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为288,故选项说法正确。
B、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称是镁,带“钅”字旁,属于金属元素,故选项说法错误。
C、根据元素周期表中的一格可知,左上角的数字为115,表示原子序数为115;根据原子序数=核电荷数=质子数=核外电子数,则核内有115个质子,故选项说法正确。
D、镁原子的相对原子质量为288,核内有115个质子,则中子数为288-115=173,故选项说法正确。
故选B。
19.(1)B、C试管中的酚酞溶液变红,E试管中的酚酞溶液不变色
(2) B、C试管中的酚酞溶液变红 C试管中比B 试管中先变红 温度越高,分子运动速率越快,即变红的速度越快 能
(3)浓氨水
【详解】(1)氨水呈碱性,能使无色酚酞溶液变红,分子在不断运动,向B、C、E三支试管中分别加入5ml的蒸馏水,各滴入1~2滴无色酚酞溶液,可观察到B、C试管中的酚酞溶液变红,E试管中的酚酞溶液不变色;
(2)在A、D试管中分别加入2ml浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有热水的烧杯中,观察图B、C试管,现象相同的是B、C试管中的酚酞溶液变红,有差异的是C试管中比B 试管中先变红;两试管中现象差异的原因是温度越高,分子运动速率越快,即变红的速度越快,将图Ⅱ实验中热水换成冰水C中的酚酞变红的速度比B中的更慢,但是能达到实验目的;
(3)综合上述实验,能使酚酞试液变红的是浓氨水,氨水呈碱性,能使酚酞溶液变红。
20.(1)BD/DB
(2)BC/CB
(3)三/3
【详解】(1)粒子最外层电子数相同则其化学性质相似,ABD最外层电子数都是2,但A仅有一个电子层,最外层为2即是稳定状态,故应填BD。
(2)对于粒子,核电荷数=原子序数,BC的核电荷数都是12,故其都是12号元素镁,故填BC;
(3)C是镁元素的离子,失去最外层电子形成,所以镁原子核外有3个电子层,元素所在周期数与对应元素的原子的电子层数相同,属于第三周期元素。
21. C BC 阴
【详解】C的最外层电子数为8,达到了相对稳定结构;
元素是质子数相同的一类原子的总称,B、C质子数相同,属于同种元素;
由图可知,D的最外层电子数为7,大于4,在化学反应中,易得到电子形成阴离子。
22.(1)①③④
(2)④⑤
(3)①④
(4)②⑥
【分析】根据原子结构示意图和离子结构示意图分析回答问题以及原子核内质子数大于核外电子数表示阳离子等。
【详解】(1)相对稳定结构是指最外层电子数为8的结构,①③④最外层电子数都为8,属于稳定结构;
故填:①③④;
(2)质子数相同的一类原子总称为元素,④和⑤质子数都为12,属于同种元素;
故填:④⑤;
(3)阳离子中质子数大于核外电子数,①和④中质子数大于核外电子数,表示阳离子;
故填:①④
(4)原子中质子数=核外电子数,图中②⑤⑥质子数=核外电子数,属于原子,②为氧原子,⑤为镁原子,⑥为氯原子,②和⑥属于非金属元素原子;
故填:②⑥。
【点睛】明确相对稳定结构、元素、离子与原子结构示意图是解答本题关键。
23.(1)13
(2)丁
(3)B
【分析】元素周期表中,方格中左上角是原子序数,右上角是元素符号,中间是元素名称,下面是相对原子质量;
原子中,核电荷数=核内质子数=核外电子数=原子序数
除汞外,金属元素的名称都带金字旁,非金属元素的名称不带金字旁:
相对原子质量质子数+中子数,单位不是g。
【详解】(1)由图可知,铝元素的原子序数为13。
(2)铝离子的结构示意图是丁,因为核内质子数为13,核外电子数为10,质子数不等于电子数的是离子,相等的是原子。
(3)元素是质子数相同的一类原子的总称,故氧元素与铝元素最本质的区别是质子数不同。
故选:B
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
