1.3.1氧化还原反应 课件(共27张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册+
文档属性
| 名称 | 1.3.1氧化还原反应 课件(共27张PPT)2023-2024学年高一上学期化学人教版(2019)必修第一册+ |  | |
| 格式 | pptx | ||
| 文件大小 | 13.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-26 11:25:01 | ||
图片预览




文档简介
(共27张PPT)
第一章 物质及其变化
第三节 氧化还原反应
第1课时 认识氧化还原反应
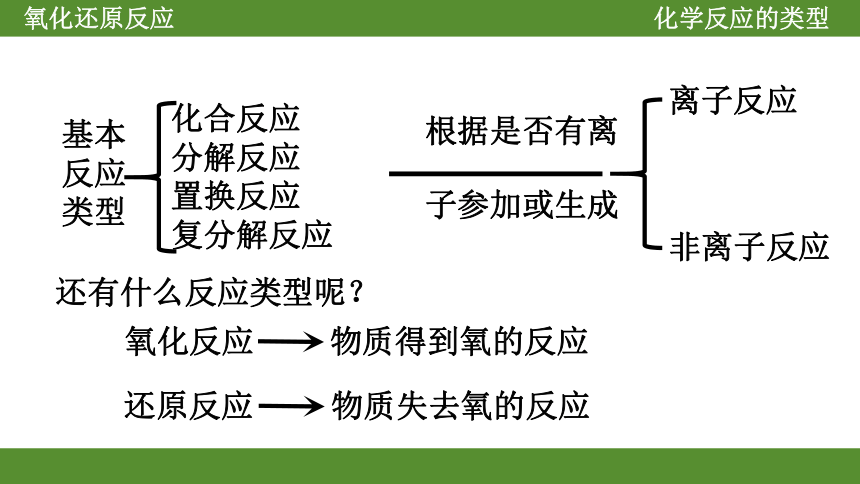
氧化还原反应
化合反应
分解反应
置换反应
复分解反应
基本反应类型
离子反应
非离子反应
根据是否有离
子参加或生成
还有什么反应类型呢?
氧化反应
还原反应
物质得到氧的反应
物质失去氧的反应
化学反应的类型
氧化还原反应
燃料的燃烧
金属的锈蚀
植物光合作用
电池放电
生活中常见的氧化还原反应
氧化还原反应
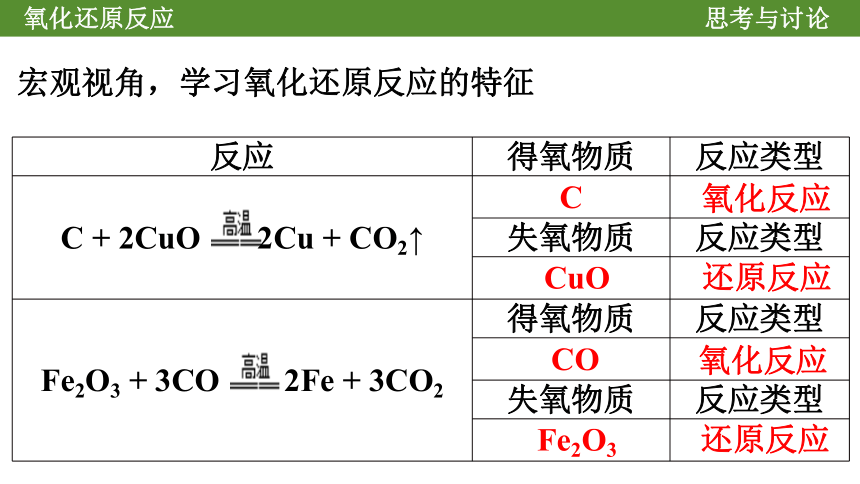
C
氧化反应
CuO
还原反应
CO
氧化反应
Fe2O3
还原反应
反应 得氧物质 反应类型
C + 2CuO 2Cu + CO2↑
失氧物质 反应类型
Fe2O3 + 3CO 2Fe + 3CO2 得氧物质 反应类型
失氧物质 反应类型
宏观视角,学习氧化还原反应的特征
思考与讨论
氧化还原反应
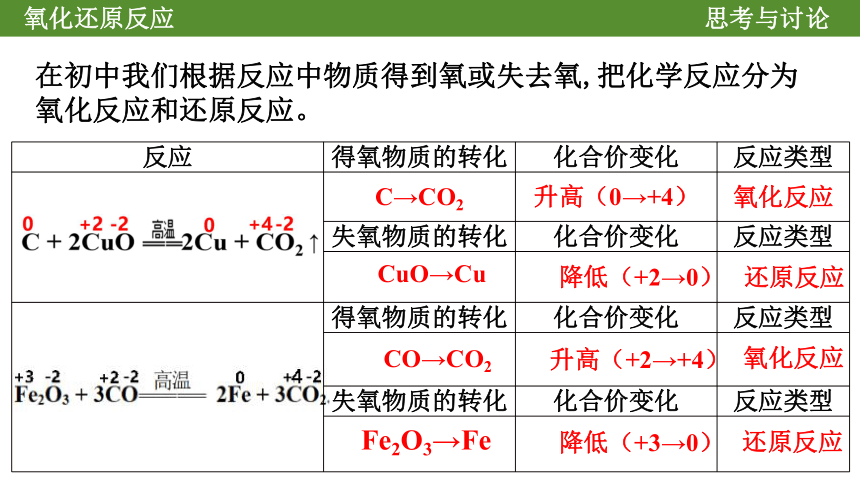
在初中我们根据反应中物质得到氧或失去氧,把化学反应分为氧化反应和还原反应。
CuO→Cu
降低(+2→0)
还原反应
CO→CO2
升高(+2→+4)
氧化反应
Fe2O3→Fe
降低(+3→0)
还原反应
反应 得氧物质的转化 化合价变化 反应类型
C→CO2 升高(0→+4) 氧化反应
失氧物质的转化 化合价变化 反应类型
得氧物质的转化 化合价变化 反应类型
失氧物质的转化 化合价变化 反应类型
思考与讨论
氧化还原反应
外部特征:反应前后有元素化合价升降的变化
所含元素化合价降低发生的反应叫还原反应
所含元素化合价升高发生的反应叫氧化反应
非氧化还原反应:元素化合价没有升降的化学反应
氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应
氧化还原反应相关概念
所含元素发生氧化反应得到的产物叫氧化产物
所含元素发生还原反应得到的产物叫还原产物
所含元素化合价升高的反应物叫还原剂
所含元素化合价降低的反应物叫氧化剂
氧化还原反应
(1)化合价原则:在化合物里,元素正负化合价的代数和为零。
(2)在化合物里,氢通常显+1价,氧通常显-2价。
(3)金属元素通常显正价。单质分子里,元素的化合价为零。
(4)许多元素具有可变化合价。例如:Fe元素有+2、+3价;
Cl元素有-1、+1、+3、+5、+7价。
(5)元素最高正价=原子最外层电子数,元素最低负价=原子最外层电子数-8。
化合价旧知回顾
注意事项:
(1)氧元素在过氧化物中(例:H2O2 、Na2O2 )显-1价。
(2)氢元素在金属氢化物中(例:NaH 、CaH2)显-1价。
(3)像Cl、N、S、Mn等具有可变价态的元素,根据化合物中各元素化合价代数和为0进行求算。
氧化还原反应
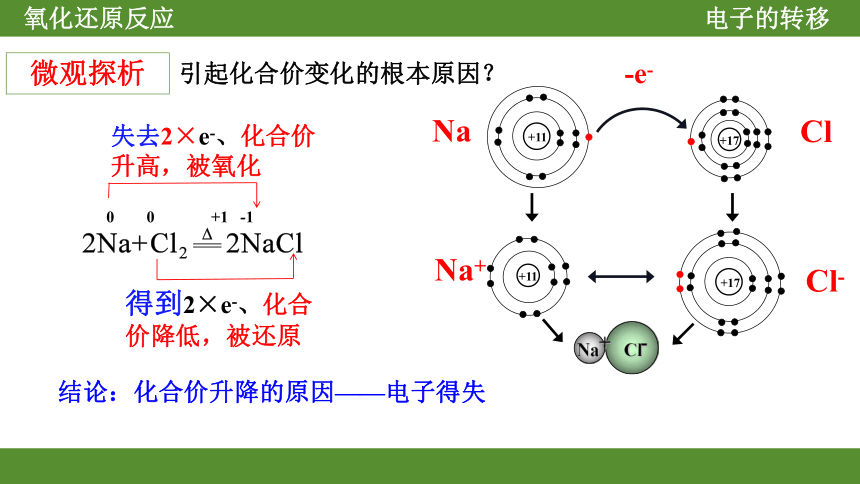
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
0 0 +1 -1
失去2×e-、化合价升高,被氧化
得到2×e-、化合价降低,被还原
微观探析
引起化合价变化的根本原因?
结论:化合价升降的原因——电子得失
-e-
电子的转移
氧化还原反应
实验现象是大量微观粒子发生变化时的宏观表象
微观视角认识氧化还原反应
氧化还原反应
请借助锌与稀硫酸反应的微观示意图,分析该反应的微观实质是什么?
Zn - 2e-=Zn2+ 2H+ + 2e- =H2
该反应的微观实质是电子的转移。请问如何证明?
微观实质
氧化还原反应
微观实质
氧化还原反应
H
Cl
均不容易失去e-
共用电子对偏向氯,偏离氢
0 0 +1 -1
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
结论:
化合价升降的原因——共用电子对偏移
微观探析
+17
+1
形成共用电子对,双方都达到稳定结构——共赢
H Cl
+1 -1
引起化合价变化的根本原因?
+1
+17
共用电子对的偏移
氧化还原反应
依据碳酸钠与氯化钙反应的微观示意图,说出该反应的微观实质是什么?是否存在电子转移?
小结:依据有无电子转移(或电子对的偏移),将反应分为氧化还原反应和非氧化还原反应
Ca2+ +CO32-=CaCO3 ↓ 复分解反应无电子转移
复分解反应微观实质
氧化还原反应
氧化还原反应的特征
氧化还原反应的本质
元素化合价的变化
电子的转移(电子的得失或共用电子对的偏移)
根本原因
电子转移、化合价升降、反应类型的关系:
氧化剂 得电子→化合价降低→还原反应(得降还)
还原剂 失电子→化合价升高→氧化反应(失升氧)
规律:得电子总数=失电子总数
化合价降低总数=化合价升高总数
电
子
守
恒
微观实质
宏观特征
微观实质
氧化还原反应
氧化剂
还原反应
还原产物
发生
生成
发生
生成
还原剂
氧化反应
氧化产物
得电子,化合价降低,被还原
失电子,化合价升高,被氧化
e-
同时发生
同时生成
对立统一的思想
电子守恒
得
失
氧化还原反应总结
氧化还原反应
双线桥
氧化还原反应
双线桥
氧化还原反应
单线桥
氧化还原反应
单线桥
氧化还原反应
氧化还原反应
用双线桥法表示下列方程式电子转移的方向和数目
MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
△
+4 -1 +2 0
得到2 e-,
化合价降低,被还原
化合价升高,被氧化
失去2 ×e-,
易错警醒:
该反应中,只有一部分氯原子化合价发生变化,还有一部分氯原子价态不变,故失去电子数为2×e-,而不是4 ×e-。
部分氧化还原反应反应
氧化还原反应
甲醛(HCHO)是室内空气污染的主要污染物之一,活性高锰酸钾球是以高锰酸钾为原料,以活性氧化铝为载体,经过二次深加工的一种产品,可用于空气净化除甲醛。其反应原理是:
5HCHO+4KMnO4+6H2SO4===5CO2↑+K2SO4+4MnSO4+11H2O
请分析该反应是否属于氧化还原反应?
0
+4
+7
+2
练习
属于
氧化还原反应
氧化还原反应
氧化还原反应和之前学习的四个基本反应类型之间存在什么关系呢?
氧化还原反应与四大基本反应
氧化还原反应
氧化还原反应和之前学习的四个基本反应类型之间存在什么关系呢?
氧化还原反应与四大基本反应
氧化还原反应
氧化还原反应概念的发展:
电子转移(电子得失或共用电子对偏移)
得氧、失氧
元素化合价升降
元素(宏观视角)
电子(微观视角)
局限性
特征
本质
阅读教材P25科学史话—氧化还原反应概念的发展,人们对氧化还原反应的认识经过了几个发展阶段?
科学史话
氧化还原反应
思考:1.有单质参加或生成的化学反应一定是氧化还原反应吗?
不一定
2.当反应中一种元素被氧化时,一定有另一种元素被还原吗?
不一定
3.某元素从游离态到化合态,该元素一定被氧化吗?
不一定
思考讨论
Cl2 → HCl
氧化还原反应
第一章 物质及其变化
第三节 氧化还原反应
第1课时 认识氧化还原反应
氧化还原反应
化合反应
分解反应
置换反应
复分解反应
基本反应类型
离子反应
非离子反应
根据是否有离
子参加或生成
还有什么反应类型呢?
氧化反应
还原反应
物质得到氧的反应
物质失去氧的反应
化学反应的类型
氧化还原反应
燃料的燃烧
金属的锈蚀
植物光合作用
电池放电
生活中常见的氧化还原反应
氧化还原反应
C
氧化反应
CuO
还原反应
CO
氧化反应
Fe2O3
还原反应
反应 得氧物质 反应类型
C + 2CuO 2Cu + CO2↑
失氧物质 反应类型
Fe2O3 + 3CO 2Fe + 3CO2 得氧物质 反应类型
失氧物质 反应类型
宏观视角,学习氧化还原反应的特征
思考与讨论
氧化还原反应
在初中我们根据反应中物质得到氧或失去氧,把化学反应分为氧化反应和还原反应。
CuO→Cu
降低(+2→0)
还原反应
CO→CO2
升高(+2→+4)
氧化反应
Fe2O3→Fe
降低(+3→0)
还原反应
反应 得氧物质的转化 化合价变化 反应类型
C→CO2 升高(0→+4) 氧化反应
失氧物质的转化 化合价变化 反应类型
得氧物质的转化 化合价变化 反应类型
失氧物质的转化 化合价变化 反应类型
思考与讨论
氧化还原反应
外部特征:反应前后有元素化合价升降的变化
所含元素化合价降低发生的反应叫还原反应
所含元素化合价升高发生的反应叫氧化反应
非氧化还原反应:元素化合价没有升降的化学反应
氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应
氧化还原反应相关概念
所含元素发生氧化反应得到的产物叫氧化产物
所含元素发生还原反应得到的产物叫还原产物
所含元素化合价升高的反应物叫还原剂
所含元素化合价降低的反应物叫氧化剂
氧化还原反应
(1)化合价原则:在化合物里,元素正负化合价的代数和为零。
(2)在化合物里,氢通常显+1价,氧通常显-2价。
(3)金属元素通常显正价。单质分子里,元素的化合价为零。
(4)许多元素具有可变化合价。例如:Fe元素有+2、+3价;
Cl元素有-1、+1、+3、+5、+7价。
(5)元素最高正价=原子最外层电子数,元素最低负价=原子最外层电子数-8。
化合价旧知回顾
注意事项:
(1)氧元素在过氧化物中(例:H2O2 、Na2O2 )显-1价。
(2)氢元素在金属氢化物中(例:NaH 、CaH2)显-1价。
(3)像Cl、N、S、Mn等具有可变价态的元素,根据化合物中各元素化合价代数和为0进行求算。
氧化还原反应
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
0 0 +1 -1
失去2×e-、化合价升高,被氧化
得到2×e-、化合价降低,被还原
微观探析
引起化合价变化的根本原因?
结论:化合价升降的原因——电子得失
-e-
电子的转移
氧化还原反应
实验现象是大量微观粒子发生变化时的宏观表象
微观视角认识氧化还原反应
氧化还原反应
请借助锌与稀硫酸反应的微观示意图,分析该反应的微观实质是什么?
Zn - 2e-=Zn2+ 2H+ + 2e- =H2
该反应的微观实质是电子的转移。请问如何证明?
微观实质
氧化还原反应
微观实质
氧化还原反应
H
Cl
均不容易失去e-
共用电子对偏向氯,偏离氢
0 0 +1 -1
电子对偏离,化合价升高,被氧化
电子对偏向,化合价降低,被还原
结论:
化合价升降的原因——共用电子对偏移
微观探析
+17
+1
形成共用电子对,双方都达到稳定结构——共赢
H Cl
+1 -1
引起化合价变化的根本原因?
+1
+17
共用电子对的偏移
氧化还原反应
依据碳酸钠与氯化钙反应的微观示意图,说出该反应的微观实质是什么?是否存在电子转移?
小结:依据有无电子转移(或电子对的偏移),将反应分为氧化还原反应和非氧化还原反应
Ca2+ +CO32-=CaCO3 ↓ 复分解反应无电子转移
复分解反应微观实质
氧化还原反应
氧化还原反应的特征
氧化还原反应的本质
元素化合价的变化
电子的转移(电子的得失或共用电子对的偏移)
根本原因
电子转移、化合价升降、反应类型的关系:
氧化剂 得电子→化合价降低→还原反应(得降还)
还原剂 失电子→化合价升高→氧化反应(失升氧)
规律:得电子总数=失电子总数
化合价降低总数=化合价升高总数
电
子
守
恒
微观实质
宏观特征
微观实质
氧化还原反应
氧化剂
还原反应
还原产物
发生
生成
发生
生成
还原剂
氧化反应
氧化产物
得电子,化合价降低,被还原
失电子,化合价升高,被氧化
e-
同时发生
同时生成
对立统一的思想
电子守恒
得
失
氧化还原反应总结
氧化还原反应
双线桥
氧化还原反应
双线桥
氧化还原反应
单线桥
氧化还原反应
单线桥
氧化还原反应
氧化还原反应
用双线桥法表示下列方程式电子转移的方向和数目
MnO2+4HCl(浓) = MnCl2+Cl2↑ + 2H2O
△
+4 -1 +2 0
得到2 e-,
化合价降低,被还原
化合价升高,被氧化
失去2 ×e-,
易错警醒:
该反应中,只有一部分氯原子化合价发生变化,还有一部分氯原子价态不变,故失去电子数为2×e-,而不是4 ×e-。
部分氧化还原反应反应
氧化还原反应
甲醛(HCHO)是室内空气污染的主要污染物之一,活性高锰酸钾球是以高锰酸钾为原料,以活性氧化铝为载体,经过二次深加工的一种产品,可用于空气净化除甲醛。其反应原理是:
5HCHO+4KMnO4+6H2SO4===5CO2↑+K2SO4+4MnSO4+11H2O
请分析该反应是否属于氧化还原反应?
0
+4
+7
+2
练习
属于
氧化还原反应
氧化还原反应
氧化还原反应和之前学习的四个基本反应类型之间存在什么关系呢?
氧化还原反应与四大基本反应
氧化还原反应
氧化还原反应和之前学习的四个基本反应类型之间存在什么关系呢?
氧化还原反应与四大基本反应
氧化还原反应
氧化还原反应概念的发展:
电子转移(电子得失或共用电子对偏移)
得氧、失氧
元素化合价升降
元素(宏观视角)
电子(微观视角)
局限性
特征
本质
阅读教材P25科学史话—氧化还原反应概念的发展,人们对氧化还原反应的认识经过了几个发展阶段?
科学史话
氧化还原反应
思考:1.有单质参加或生成的化学反应一定是氧化还原反应吗?
不一定
2.当反应中一种元素被氧化时,一定有另一种元素被还原吗?
不一定
3.某元素从游离态到化合态,该元素一定被氧化吗?
不一定
思考讨论
Cl2 → HCl
氧化还原反应
