2023-2024学年人教版高中化学选择性必修2 3.4.1配合物与超分子 课件(共17张PPT)
文档属性
| 名称 | 2023-2024学年人教版高中化学选择性必修2 3.4.1配合物与超分子 课件(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-26 14:25:17 | ||
图片预览


文档简介
(共17张PPT)
第一课时 配合物
第三章第四节 配合物与超分子
人教版 普通高中教科书 化学选择性必修2
徐光宪院士建立了具有普适性的串级萃取理论
提升了利用配合物萃取分离稀土元素的效率
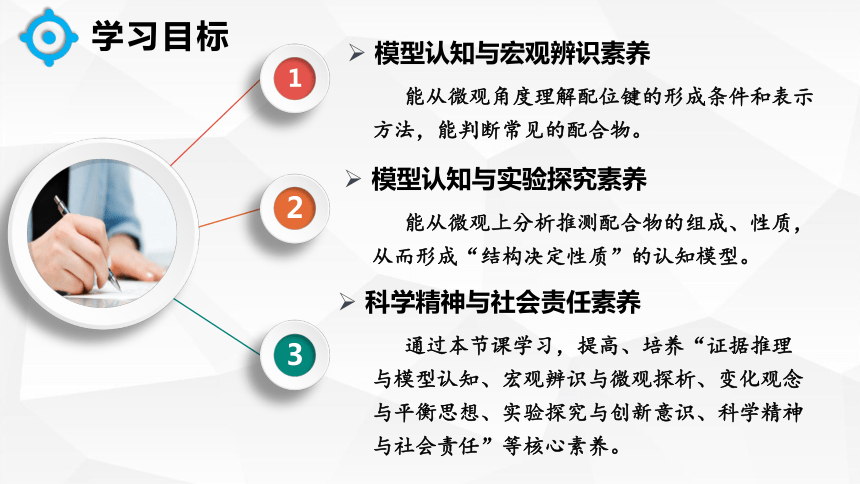
学习目标
1
模型认知与宏观辨识素养
能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。
2
模型认知与实验探究素养
能从微观上分析推测配合物的组成、性质,从而形成“结构决定性质”的认知模型。
3
科学精神与社会责任素养
通过本节课学习,提高、培养“证据推理与模型认知、宏观辨识与微观探析、变化观念与平衡思想、实验探究与创新意识、科学精神与社会责任”等核心素养。
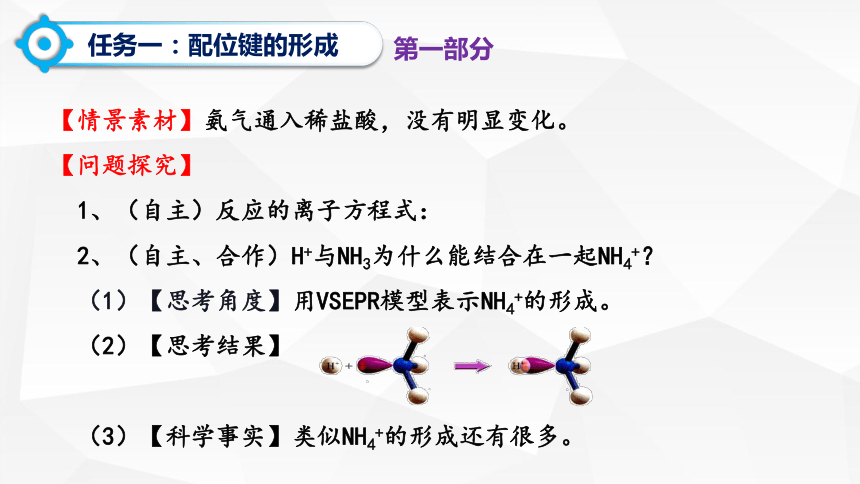
任务一:配位键的形成
【情景素材】氨气通入稀盐酸,没有明显变化。
【问题探究】
1、(自主)反应的离子方程式:
2、(自主、合作)H+与NH3为什么能结合在一起NH4+?
(1)【思考角度】用VSEPR模型表示NH4+的形成。
(2)【思考结果】
(3)【科学事实】类似NH4+的形成还有很多。
第一部分
第一部分
【归纳总结】
A空【电子对接受体】
+
B孤【电子对给予体】
轨道
重叠
配位键:B→A
[H N H]+
H
H
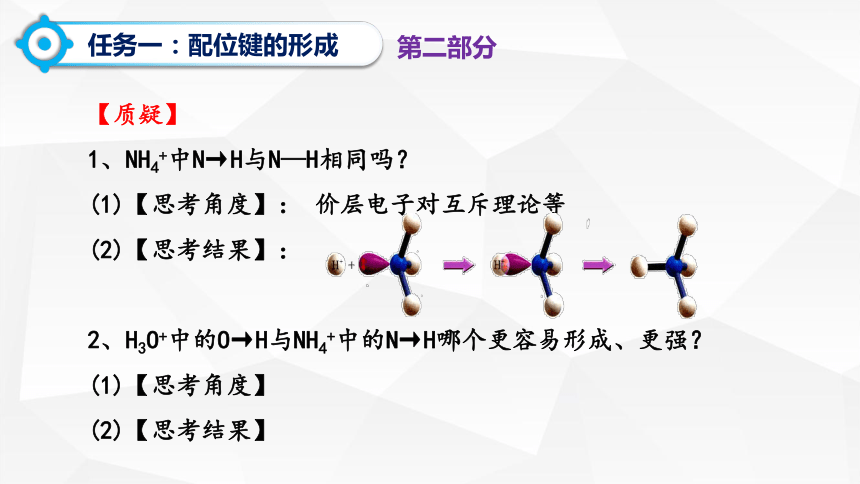
【质疑】
1、NH4+中N→H与N—H相同吗?
(1)【思考角度】: 价层电子对互斥理论等
(2)【思考结果】:
2、H3O+中的O→H与NH4+中的N→H哪个更容易形成、更强?
(1)【思考角度】
(2)【思考结果】
任务一:配位键的形成
第二部分
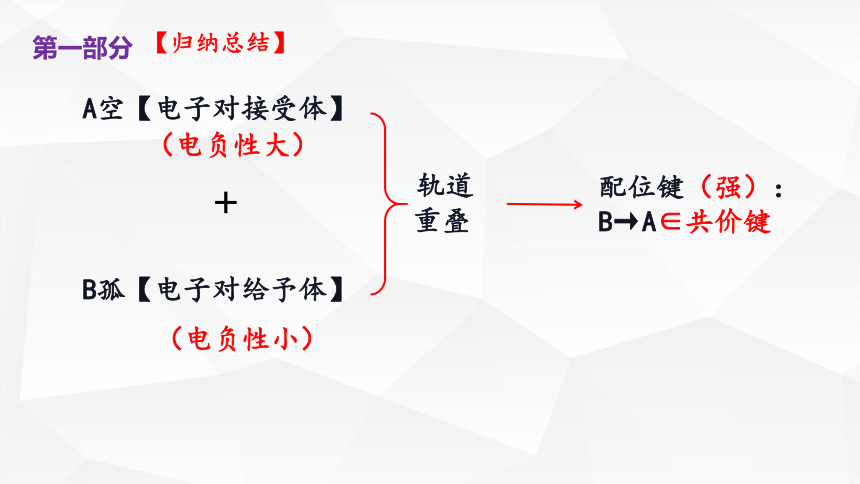
A空【电子对接受体】
+
B孤【电子对给予体】
轨道
重叠
配位键(强): B→A∈共价键
(电负性大)
(电负性小)
第一部分
【归纳总结】
【情景问题】以下微粒:①N2H5+、②CH4、③OH- ④NH4+、⑤Fe(CO)5、⑥Fe(SCN)3、⑦H3O+、⑧[Ag(NH3)2]OH
1、含配位键的有⑤⑥⑧,还有 。
2、配位键中提供孤电子对的粒子通常是
。
3、配位键中提供空轨道的粒子通常是
。
4、思考:Cu2+与NH3、H2O能否形成配位键?若能,请完成(1)(2)(填“>”或“<”):
(1)成键难易NH3 H2O (2)成键强弱NH3 H2O
① ④ ⑦
N O S等ⅤA ⅥA ⅦA 非金属元素
H+ B 过渡区域金属原子或离子
>
>
任务一:配位键的形成
第三部分
(3)某同学进行如下实验:
①取少量白色CuSO4粉末于试管内,然后加水振荡,得天蓝色溶液。
②取少量白色K2SO4粉末于试管内,然后加水振荡,得无色溶液。
其中实验②的目的是什么?
CuSO4溶液呈天蓝色的原因是什么(已知溶液中一个Cu2+与四个H2O结合可形成新离子)?
对照实验,排除SO42-对溶液颜色产生的干扰。
Cu2+与H2O 形成了新的离子。
[Cu(H2O)4]2+
平行四边形结构
结构式
步骤 现象
①向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水,首先形成难溶物;
②继续添加氨水并振荡试管,观察实验现象;
③再向试管中加入极性较小的溶剂(如加入8ml95%乙醇),并用玻璃棒摩擦试管壁,观察实验现象。
形成蓝色沉淀
难溶物溶解,得到深蓝色的透明溶液
析出深蓝色晶体
【资料】
1、乙醇的作用是降低沉淀刚好溶解后生成的物质的溶解度。玻璃杯摩擦试管内壁目的是产生晶种,加速沉淀生成。
2、取上述实验最后沉淀(已洗涤干净)1mol,溶于水,①加入足量BaCl2溶液,得到1mol沉淀。②加热,没有NH3放出③测其电导率,存在2mol导电离子(不考虑水的电离)
3、溶液中一个Cu2+可与四个NH3通过配位键结合形成新离子:[Cu(NH3)4]2+。
任务二:配合物组成、性质
第一部分:【实验】
【问题】
写出沉淀刚好溶解时所得溶质的化学式、最后所得晶体的化学式(已知:1mol晶体中含1mol结晶水)、最后所得晶体在水中的电离方程式及整个过程发生反应的方程式。
(1)【思维角度】微观分析
(2)【思维结果】
沉淀刚好溶解时所得溶质的化学式:
最后所得晶体的化学式:
最后所得的晶体在水中的电离方程式:
整个过程发生反应的方程式:
[Cu(NH3)4](OH)2
[Cu(NH3)4]SO4 ·H2O
Cu(NH3)4]SO4=〔Cu(NH3)4〕 2++SO42-
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
第一部分:【实验】
[Cu(N H 3)4 ]2+ S O 42-
内界(配离子)
配合物
外界离子
配位体
配
位
数
配位原子
中心原子
配合物的表示方法:
有时配位体数并不一定等于配位数
【质疑】配合物一定是由内界和外界组成吗?
不一定,有的配合物没有外界。如【任务一】第三部分中的Fe(CO)5、Fe(SCN)3。有的配合物有多种配体。如[Cu(NH3)2(H2O)2] SO4、[Co(SO4)(NH3)5]Br、[Co(NH3)5Br]SO4。
第一部分:【实验】归纳总结
具有空轨道的原子或离子,常是过渡金属的原子或离子。
提供孤电子对的原子,常是ⅤA ⅥA ⅦA族原子
含有配原子的化合物
中心原子与配原子形成配位键的数目。
某实验小组,完成了实验1—3,探究配合物的性质、用途。请完善下列实验报告:
实验1 操作 向FeCl3溶液中滴加KSCN溶液【已知硫氰化铁化学式:Fe(SCN)3】
现象
离子方程式
Fe3++3SCN- Fe(SCN)3
溶液变红色
实验2 操作 将CuCl2固体溶于水,然后再加入几滴浓盐酸
现象 溶液由蓝色变成黄绿色(已知:[Cu(H2O)4]2+:蓝色,[CuCl4]2-:黄绿色)
离子方程式
解释 反应发生的原因:
[Cu(H2O)4]2+ +4Cl- [CuCl4]2- +4H2O
[CuCl4]2-比[Cu(H2O)4]2+稳定性强
任务二:配合物组成、性质
第二部分:【情景问题】
实验3 操作 向AgNO3溶液中滴加稀氨水
现象 产生白色沉淀,继续滴加氨水,沉淀溶解。
离子方程式
解释 用平衡移动原理解释[Ag(NH3)2]+的生成:
Ag++NH3·H2O = AgOH↓+NH4+
AgOH+2NH3·H2O = [Ag(NH3)2]++ OH- + 2H2O
AgOH存在溶解平衡:AgOH(s) Ag+(aq)+OH-(aq),向其中滴加氨水,Ag+与NH3能发生如下反应:Ag++2NH3==[Ag(NH3)2]+,生成更稳定的[Ag(NH3)2]+,促使沉淀溶解平衡右移,使沉淀溶解.
【结论】上述实验1—实验3,
体现了配合物具有 等性质,
及 用途。
大多配合物有颜色、配合物可以改变物质稳定性、溶解性
离子检验,配制溶液(银氨溶液)等
A空【电子对接受体】
+
B孤【电子对给予体】
轨道
重叠
配位键 B→A ∈共价键
(强)
(电负性大)
(电负性小)
配合物(组成中含有配位键的化合物)
颜色、溶解性、稳定性
我的收获
在科学研究和生产实践中,经常利用金属离子和与之配位的物质的性质不同,进行溶解、沉淀或萃取操作来达到分离提纯、分析检测的目的。
现有如下配合物,指出其中配离子、中心离子、配位原子、配体和配位数。
配合物 配离子 中心原子(离子) 配位原子 配位体 配位数
[Co(NH3)6]Cl3
[Cu(H2O)4]SO4
[Fe(H2O)6]2(SO4)3
[Ag(NH3)2]OH
[Cu(NH3)4]SO4
6
Co3+
N
[Cu(H2O)4]2+
Cu2+
O
H2O
4
[Fe(H2O)6]3+
Fe3+
O
H2O
6
[Ag(NH3)2]+
Ag+
N
NH3
2
[Cu(NH3)4]2+
Cu2+
N
NH3
4
学以致用
[Co(NH3)6]3+
NH3
谢谢!
祝同学们进步!
第一课时 配合物
第三章第四节 配合物与超分子
人教版 普通高中教科书 化学选择性必修2
徐光宪院士建立了具有普适性的串级萃取理论
提升了利用配合物萃取分离稀土元素的效率
学习目标
1
模型认知与宏观辨识素养
能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。
2
模型认知与实验探究素养
能从微观上分析推测配合物的组成、性质,从而形成“结构决定性质”的认知模型。
3
科学精神与社会责任素养
通过本节课学习,提高、培养“证据推理与模型认知、宏观辨识与微观探析、变化观念与平衡思想、实验探究与创新意识、科学精神与社会责任”等核心素养。
任务一:配位键的形成
【情景素材】氨气通入稀盐酸,没有明显变化。
【问题探究】
1、(自主)反应的离子方程式:
2、(自主、合作)H+与NH3为什么能结合在一起NH4+?
(1)【思考角度】用VSEPR模型表示NH4+的形成。
(2)【思考结果】
(3)【科学事实】类似NH4+的形成还有很多。
第一部分
第一部分
【归纳总结】
A空【电子对接受体】
+
B孤【电子对给予体】
轨道
重叠
配位键:B→A
[H N H]+
H
H
【质疑】
1、NH4+中N→H与N—H相同吗?
(1)【思考角度】: 价层电子对互斥理论等
(2)【思考结果】:
2、H3O+中的O→H与NH4+中的N→H哪个更容易形成、更强?
(1)【思考角度】
(2)【思考结果】
任务一:配位键的形成
第二部分
A空【电子对接受体】
+
B孤【电子对给予体】
轨道
重叠
配位键(强): B→A∈共价键
(电负性大)
(电负性小)
第一部分
【归纳总结】
【情景问题】以下微粒:①N2H5+、②CH4、③OH- ④NH4+、⑤Fe(CO)5、⑥Fe(SCN)3、⑦H3O+、⑧[Ag(NH3)2]OH
1、含配位键的有⑤⑥⑧,还有 。
2、配位键中提供孤电子对的粒子通常是
。
3、配位键中提供空轨道的粒子通常是
。
4、思考:Cu2+与NH3、H2O能否形成配位键?若能,请完成(1)(2)(填“>”或“<”):
(1)成键难易NH3 H2O (2)成键强弱NH3 H2O
① ④ ⑦
N O S等ⅤA ⅥA ⅦA 非金属元素
H+ B 过渡区域金属原子或离子
>
>
任务一:配位键的形成
第三部分
(3)某同学进行如下实验:
①取少量白色CuSO4粉末于试管内,然后加水振荡,得天蓝色溶液。
②取少量白色K2SO4粉末于试管内,然后加水振荡,得无色溶液。
其中实验②的目的是什么?
CuSO4溶液呈天蓝色的原因是什么(已知溶液中一个Cu2+与四个H2O结合可形成新离子)?
对照实验,排除SO42-对溶液颜色产生的干扰。
Cu2+与H2O 形成了新的离子。
[Cu(H2O)4]2+
平行四边形结构
结构式
步骤 现象
①向盛有4mL 0.1mol/L CuSO4溶液的试管里滴加几滴1 mol/L 氨水,首先形成难溶物;
②继续添加氨水并振荡试管,观察实验现象;
③再向试管中加入极性较小的溶剂(如加入8ml95%乙醇),并用玻璃棒摩擦试管壁,观察实验现象。
形成蓝色沉淀
难溶物溶解,得到深蓝色的透明溶液
析出深蓝色晶体
【资料】
1、乙醇的作用是降低沉淀刚好溶解后生成的物质的溶解度。玻璃杯摩擦试管内壁目的是产生晶种,加速沉淀生成。
2、取上述实验最后沉淀(已洗涤干净)1mol,溶于水,①加入足量BaCl2溶液,得到1mol沉淀。②加热,没有NH3放出③测其电导率,存在2mol导电离子(不考虑水的电离)
3、溶液中一个Cu2+可与四个NH3通过配位键结合形成新离子:[Cu(NH3)4]2+。
任务二:配合物组成、性质
第一部分:【实验】
【问题】
写出沉淀刚好溶解时所得溶质的化学式、最后所得晶体的化学式(已知:1mol晶体中含1mol结晶水)、最后所得晶体在水中的电离方程式及整个过程发生反应的方程式。
(1)【思维角度】微观分析
(2)【思维结果】
沉淀刚好溶解时所得溶质的化学式:
最后所得晶体的化学式:
最后所得的晶体在水中的电离方程式:
整个过程发生反应的方程式:
[Cu(NH3)4](OH)2
[Cu(NH3)4]SO4 ·H2O
Cu(NH3)4]SO4=〔Cu(NH3)4〕 2++SO42-
Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
第一部分:【实验】
[Cu(N H 3)4 ]2+ S O 42-
内界(配离子)
配合物
外界离子
配位体
配
位
数
配位原子
中心原子
配合物的表示方法:
有时配位体数并不一定等于配位数
【质疑】配合物一定是由内界和外界组成吗?
不一定,有的配合物没有外界。如【任务一】第三部分中的Fe(CO)5、Fe(SCN)3。有的配合物有多种配体。如[Cu(NH3)2(H2O)2] SO4、[Co(SO4)(NH3)5]Br、[Co(NH3)5Br]SO4。
第一部分:【实验】归纳总结
具有空轨道的原子或离子,常是过渡金属的原子或离子。
提供孤电子对的原子,常是ⅤA ⅥA ⅦA族原子
含有配原子的化合物
中心原子与配原子形成配位键的数目。
某实验小组,完成了实验1—3,探究配合物的性质、用途。请完善下列实验报告:
实验1 操作 向FeCl3溶液中滴加KSCN溶液【已知硫氰化铁化学式:Fe(SCN)3】
现象
离子方程式
Fe3++3SCN- Fe(SCN)3
溶液变红色
实验2 操作 将CuCl2固体溶于水,然后再加入几滴浓盐酸
现象 溶液由蓝色变成黄绿色(已知:[Cu(H2O)4]2+:蓝色,[CuCl4]2-:黄绿色)
离子方程式
解释 反应发生的原因:
[Cu(H2O)4]2+ +4Cl- [CuCl4]2- +4H2O
[CuCl4]2-比[Cu(H2O)4]2+稳定性强
任务二:配合物组成、性质
第二部分:【情景问题】
实验3 操作 向AgNO3溶液中滴加稀氨水
现象 产生白色沉淀,继续滴加氨水,沉淀溶解。
离子方程式
解释 用平衡移动原理解释[Ag(NH3)2]+的生成:
Ag++NH3·H2O = AgOH↓+NH4+
AgOH+2NH3·H2O = [Ag(NH3)2]++ OH- + 2H2O
AgOH存在溶解平衡:AgOH(s) Ag+(aq)+OH-(aq),向其中滴加氨水,Ag+与NH3能发生如下反应:Ag++2NH3==[Ag(NH3)2]+,生成更稳定的[Ag(NH3)2]+,促使沉淀溶解平衡右移,使沉淀溶解.
【结论】上述实验1—实验3,
体现了配合物具有 等性质,
及 用途。
大多配合物有颜色、配合物可以改变物质稳定性、溶解性
离子检验,配制溶液(银氨溶液)等
A空【电子对接受体】
+
B孤【电子对给予体】
轨道
重叠
配位键 B→A ∈共价键
(强)
(电负性大)
(电负性小)
配合物(组成中含有配位键的化合物)
颜色、溶解性、稳定性
我的收获
在科学研究和生产实践中,经常利用金属离子和与之配位的物质的性质不同,进行溶解、沉淀或萃取操作来达到分离提纯、分析检测的目的。
现有如下配合物,指出其中配离子、中心离子、配位原子、配体和配位数。
配合物 配离子 中心原子(离子) 配位原子 配位体 配位数
[Co(NH3)6]Cl3
[Cu(H2O)4]SO4
[Fe(H2O)6]2(SO4)3
[Ag(NH3)2]OH
[Cu(NH3)4]SO4
6
Co3+
N
[Cu(H2O)4]2+
Cu2+
O
H2O
4
[Fe(H2O)6]3+
Fe3+
O
H2O
6
[Ag(NH3)2]+
Ag+
N
NH3
2
[Cu(NH3)4]2+
Cu2+
N
NH3
4
学以致用
[Co(NH3)6]3+
NH3
谢谢!
祝同学们进步!
