2.2.2离子反应 课件(共38张PPT)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.2.2离子反应 课件(共38张PPT)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-27 08:29:18 | ||
图片预览










文档简介
(共38张PPT)
第二章 元素与物质世界
第二节第二课时
离子反应
第2章 元素与物质世界
知识迁移
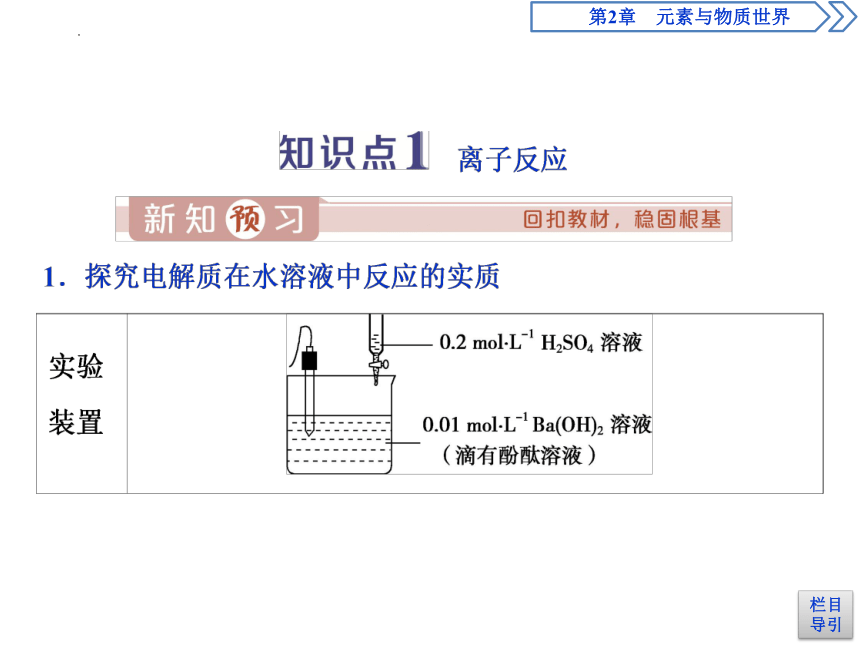
在时间为80s左右时,电导率是否为“0”?为什么会出现这种情况?
水部分电离 H2O H++OH-,
BaSO4虽然是难溶盐,但在水溶液中有极少量发生完全电离BaSO4=Ba2++SO42-,使溶液中离子浓度不为零
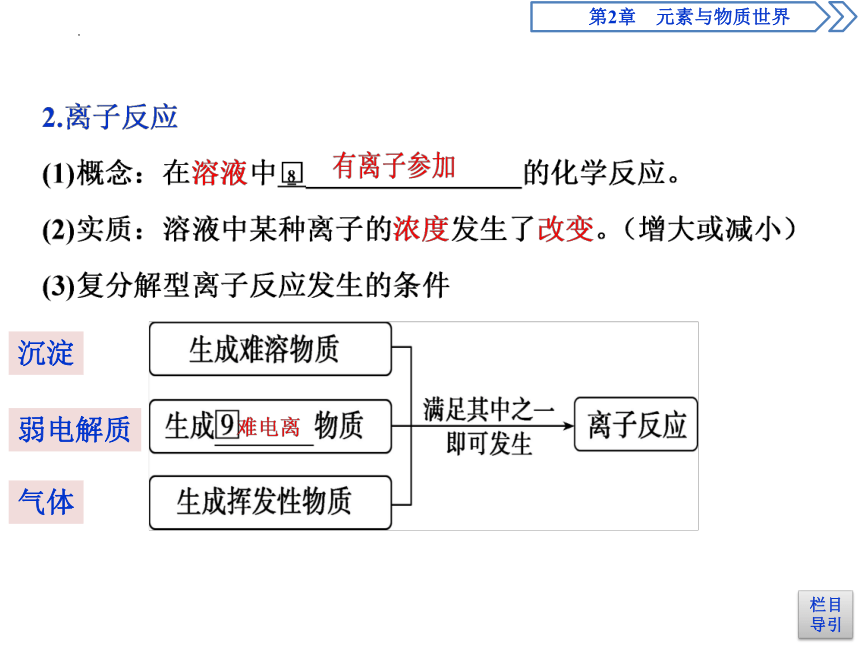
沉淀
弱电解质
气体
注意:
1.固体、气体之间的反应不是离子反应。
例:2KClO3 = 2KCl + 3O2↑
2 H2+O2 = 2H2O
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
石灰乳
浓硫酸、石灰乳不能拆分;稀硫酸、澄清石灰水拆成离子
加热
2.在水溶液中写成分子形式的物质:
(单质、氧化物、气体、非电解质、弱酸、弱碱、水、难溶盐)
除强酸、强碱、可溶性盐以外的其他物质
点燃
六
四
口诀
不拆:HCO3-、HS-、HSO3-
拆:HSO4- → H++SO42-
判断溶解性
MgCO3
PbSO4
Ag2SO4
CaSO4
CuSO4
BaCO3
BaSO4
MgSO4
PbCO3
K2CO3
Ba(HCO3)2
Na2CO3
MgCl2
AgCl
FeCO3
KCl
Ag2CO3
CuCO3
(NH4)2SO4
Cu(NO3)2
2.书写方法:
方法一:化学方程式改写为离子方程式
以碳酸钙与盐酸反应为例
查
拆
删
写
根据客观事实,正确书写化学方程式
把易溶于水且易电离的物质改写成离子符号表示
删去未反应的离子符号
检查是否配平(原子、电荷守恒)
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
CaCO3 + 2H+ + 2Cl- = Ca2++ 2Cl- + H2O + CO2↑
CaCO3 + 2H+ + 2Cl- = Ca2++ 2Cl- + H2O + CO2↑
CaCO3 + 2H+ = Ca2++ H2O + CO2↑
方法二:根据离子反应实质直接书写
H2SO4 = 2H+ + SO42-
Ba(OH)2 = Ba2+ + 2OH-
2H+
SO42-
Ba2+
2OH-
BaSO4↓
2H2O
2H+ + 2OH-+Ba2+ +SO42-=BaSO4↓+2H2O
量不同,方程式不同(以少量为基准,固定系数为1)
CO2与NaOH反应:
Na2CO3与HCl反应:
CO2少量:
NaOH少量:
Na2CO3少量:
HCl少量:
Ca(HCO3)2与NaOH反应:
NaHSO4与Ba(OH)2反应:
Ca(HCO3)2少量:
NaOH少量:
NaHSO4少量:
Ba(OH)2少量:
4.离子方程式正误判断:
1.拆
2.事实
3.三大守恒
4.符号
可溶性强电解质在水中拆分
原子、电荷、转移电子
↓ ↑ =
微粒关系、反应符合客观事实
Fe → Fe2+
盐酸
CaCO3+2H+===Ca2++H2O+CO2↑
CO32-+2H+===CO2↑+H2O
CaCO3+2H+===Ca2++H2O+CO2↑
√
×
Cu+2Ag+===Cu2++2Ag
Cu+Ag+===Cu2++Ag
√
×
稀H2SO4与Ba(OH)2溶液反应
不能写成H++OH-+SO42-+Ba2+=BaSO4↓+H2O,
应写成2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O。
排除CO32-的干扰
试剂添加顺序可以颠倒,也可混加
排除Ag+、CO32-、SO32-的干扰
试剂添加顺序不可以颠倒,不可混加
回顾CO32-的检验:
白色沉淀
沉淀溶解,
产生无色无味气体(CO2)
白色沉淀(CaCO3)
待测液
CaCl2溶液
稀HCl
气体通入
澄清石灰水中
排除HCO3-、HSO3-的干扰
排除SO32-的干扰
存在CO32-
(CaCO3或CaSO3)
2.判断离子能否大量共存
原则——
有色离子:Cu2+蓝色 Fe2+浅绿色 Fe3+黄色 MnO4-紫色
复分解反应发生的条件:↓,↑,弱电解质
a.与H+不共存:OH- ;HCO3-、HSO3-、HS- ; CO32-、SO32-、S2-、CH3COO-等
( HCO3-+H+=CO2↑+H2O)
b.与OH-不共存:
H+;HCO3-、HSO3-、HS-;NH4+;Mg2+、Cu2+、Fe3+、Al3+、Ag+等
(HCO3-+OH-=CO32-+H2O) (与OH-生成难溶碱)
c.关于可溶性盐的口诀:盐酸盐除银都可溶AgCl↓
硫酸钙银是微溶,硫酸钡铅是难溶
CaSO4↓、Ag2SO4↓、BaSO4↓、PbSO4↓
碳酸盐只溶钾钠铵
除K2CO3、Na2CO3、(NH4)2CO3都是沉淀
指示剂变色范围
石蕊试液: 5 ~ 8
酚酞试液: 8 ~ 10
甲基橙: 3.1 ~ 4.4
红
紫
蓝
红
橙
黄
红
浅红
无
蓝色石蕊试纸:遇酸变红 红色石蕊试纸:遇碱变蓝
常温下 “酸性”:PH<7的溶液
“碱性”:PH>7的溶液
PH试纸遇酸变红,遇碱变蓝
3.物质除杂
原则:除去杂质,不引入新的杂质
将杂质离子转化为沉淀或气体
实例---食盐精制 p59
环节一:除去不溶性杂质
粗盐
溶解
过滤
蒸发
搅拌,
加速溶解
引流,
防止冲破滤纸
搅拌,
使液体受热均匀,
防止液体飞溅
玻璃棒作用:
环节二:除去可溶性杂质离子
原则:除去杂质,不引入新的杂质
CO32-
OH-
Ba2+
过量
过量
NaOH溶液
过量
BaCl2溶液
过量
Na2CO3溶液
BaSO4
Mg(OH)2
CaCO3
BaCO3 沉淀
滤液
精盐
过滤
过量
HCl
蒸发
方案是唯一的吗?
只要保证Na2CO3在BaCl2之后就行
产率=
除去可溶性杂质离子SO42- Mg2+ Ca 2+
第二章 元素与物质世界
第二节第二课时
离子反应
第2章 元素与物质世界
知识迁移
在时间为80s左右时,电导率是否为“0”?为什么会出现这种情况?
水部分电离 H2O H++OH-,
BaSO4虽然是难溶盐,但在水溶液中有极少量发生完全电离BaSO4=Ba2++SO42-,使溶液中离子浓度不为零
沉淀
弱电解质
气体
注意:
1.固体、气体之间的反应不是离子反应。
例:2KClO3 = 2KCl + 3O2↑
2 H2+O2 = 2H2O
2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
石灰乳
浓硫酸、石灰乳不能拆分;稀硫酸、澄清石灰水拆成离子
加热
2.在水溶液中写成分子形式的物质:
(单质、氧化物、气体、非电解质、弱酸、弱碱、水、难溶盐)
除强酸、强碱、可溶性盐以外的其他物质
点燃
六
四
口诀
不拆:HCO3-、HS-、HSO3-
拆:HSO4- → H++SO42-
判断溶解性
MgCO3
PbSO4
Ag2SO4
CaSO4
CuSO4
BaCO3
BaSO4
MgSO4
PbCO3
K2CO3
Ba(HCO3)2
Na2CO3
MgCl2
AgCl
FeCO3
KCl
Ag2CO3
CuCO3
(NH4)2SO4
Cu(NO3)2
2.书写方法:
方法一:化学方程式改写为离子方程式
以碳酸钙与盐酸反应为例
查
拆
删
写
根据客观事实,正确书写化学方程式
把易溶于水且易电离的物质改写成离子符号表示
删去未反应的离子符号
检查是否配平(原子、电荷守恒)
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
CaCO3 + 2H+ + 2Cl- = Ca2++ 2Cl- + H2O + CO2↑
CaCO3 + 2H+ + 2Cl- = Ca2++ 2Cl- + H2O + CO2↑
CaCO3 + 2H+ = Ca2++ H2O + CO2↑
方法二:根据离子反应实质直接书写
H2SO4 = 2H+ + SO42-
Ba(OH)2 = Ba2+ + 2OH-
2H+
SO42-
Ba2+
2OH-
BaSO4↓
2H2O
2H+ + 2OH-+Ba2+ +SO42-=BaSO4↓+2H2O
量不同,方程式不同(以少量为基准,固定系数为1)
CO2与NaOH反应:
Na2CO3与HCl反应:
CO2少量:
NaOH少量:
Na2CO3少量:
HCl少量:
Ca(HCO3)2与NaOH反应:
NaHSO4与Ba(OH)2反应:
Ca(HCO3)2少量:
NaOH少量:
NaHSO4少量:
Ba(OH)2少量:
4.离子方程式正误判断:
1.拆
2.事实
3.三大守恒
4.符号
可溶性强电解质在水中拆分
原子、电荷、转移电子
↓ ↑ =
微粒关系、反应符合客观事实
Fe → Fe2+
盐酸
CaCO3+2H+===Ca2++H2O+CO2↑
CO32-+2H+===CO2↑+H2O
CaCO3+2H+===Ca2++H2O+CO2↑
√
×
Cu+2Ag+===Cu2++2Ag
Cu+Ag+===Cu2++Ag
√
×
稀H2SO4与Ba(OH)2溶液反应
不能写成H++OH-+SO42-+Ba2+=BaSO4↓+H2O,
应写成2H++2OH-+SO42-+Ba2+=BaSO4↓+2H2O。
排除CO32-的干扰
试剂添加顺序可以颠倒,也可混加
排除Ag+、CO32-、SO32-的干扰
试剂添加顺序不可以颠倒,不可混加
回顾CO32-的检验:
白色沉淀
沉淀溶解,
产生无色无味气体(CO2)
白色沉淀(CaCO3)
待测液
CaCl2溶液
稀HCl
气体通入
澄清石灰水中
排除HCO3-、HSO3-的干扰
排除SO32-的干扰
存在CO32-
(CaCO3或CaSO3)
2.判断离子能否大量共存
原则——
有色离子:Cu2+蓝色 Fe2+浅绿色 Fe3+黄色 MnO4-紫色
复分解反应发生的条件:↓,↑,弱电解质
a.与H+不共存:OH- ;HCO3-、HSO3-、HS- ; CO32-、SO32-、S2-、CH3COO-等
( HCO3-+H+=CO2↑+H2O)
b.与OH-不共存:
H+;HCO3-、HSO3-、HS-;NH4+;Mg2+、Cu2+、Fe3+、Al3+、Ag+等
(HCO3-+OH-=CO32-+H2O) (与OH-生成难溶碱)
c.关于可溶性盐的口诀:盐酸盐除银都可溶AgCl↓
硫酸钙银是微溶,硫酸钡铅是难溶
CaSO4↓、Ag2SO4↓、BaSO4↓、PbSO4↓
碳酸盐只溶钾钠铵
除K2CO3、Na2CO3、(NH4)2CO3都是沉淀
指示剂变色范围
石蕊试液: 5 ~ 8
酚酞试液: 8 ~ 10
甲基橙: 3.1 ~ 4.4
红
紫
蓝
红
橙
黄
红
浅红
无
蓝色石蕊试纸:遇酸变红 红色石蕊试纸:遇碱变蓝
常温下 “酸性”:PH<7的溶液
“碱性”:PH>7的溶液
PH试纸遇酸变红,遇碱变蓝
3.物质除杂
原则:除去杂质,不引入新的杂质
将杂质离子转化为沉淀或气体
实例---食盐精制 p59
环节一:除去不溶性杂质
粗盐
溶解
过滤
蒸发
搅拌,
加速溶解
引流,
防止冲破滤纸
搅拌,
使液体受热均匀,
防止液体飞溅
玻璃棒作用:
环节二:除去可溶性杂质离子
原则:除去杂质,不引入新的杂质
CO32-
OH-
Ba2+
过量
过量
NaOH溶液
过量
BaCl2溶液
过量
Na2CO3溶液
BaSO4
Mg(OH)2
CaCO3
BaCO3 沉淀
滤液
精盐
过滤
过量
HCl
蒸发
方案是唯一的吗?
只要保证Na2CO3在BaCl2之后就行
产率=
除去可溶性杂质离子SO42- Mg2+ Ca 2+
