高中化学人教版选择性必修一 第三章 第一节 电离平衡第二课时 电离平衡常数 课件(共23张PPT)
文档属性
| 名称 | 高中化学人教版选择性必修一 第三章 第一节 电离平衡第二课时 电离平衡常数 课件(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-28 09:40:10 | ||
图片预览







文档简介
(共23张PPT)
第一节 电离平衡
第二课时 电离平衡常数
第三章 水溶液中的离子反应与平衡
【考纲要求】
了解电离平衡常数的含义。
能利用电离平衡常数进行相关计算。
能用电离常数从理论上解释弱电解质电离平衡的移动
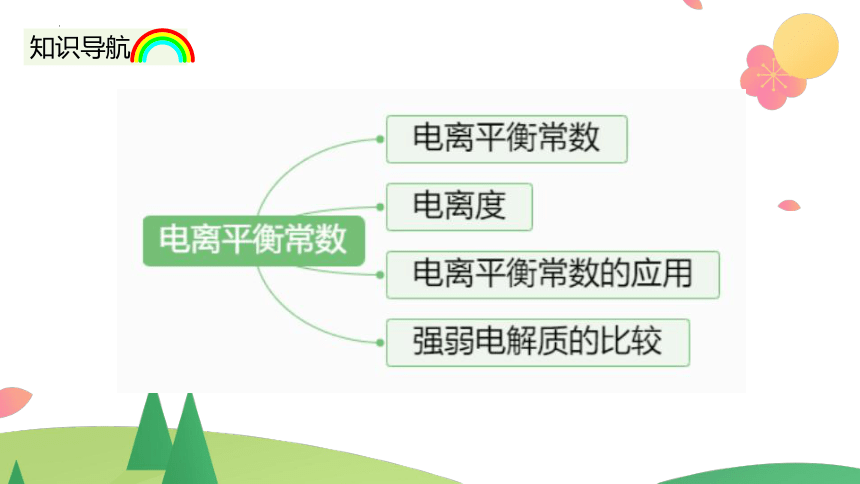
知识导航
1.概念
在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,用 K 表示。
一.电离平衡常数
Ka表示弱酸的电离平衡常数
Kb表示弱碱的电离平衡常数
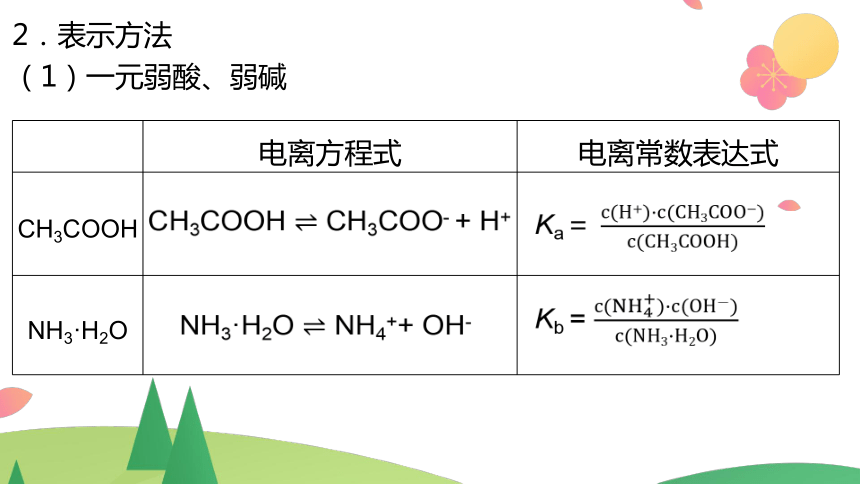
2.表示方法
(1)一元弱酸、弱碱
电离方程式 电离常数表达式
CH3COOH
NH3·H2O
CH3COOH CH3COO- + H+
Ka=
NH3·H2O NH4++ OH-
Kb =
电离方程式 电离常数表达式
H2CO3
Cu(OH)2
H2CO3 H+ +
HCO3- H+ +
K1=
K2=
Cu(OH)2 Cu2+ + 2OH-
K=
2.表示方法
(2)多元弱酸、弱碱
一般多元弱酸各步电离常数的大小为Ka1 Ka2 Ka3,
因此,多元弱酸的酸性主要由第一步电离决定。
由于多元弱碱为难溶碱,所以一般不用电离平衡常数,而用以后要学到的难溶物的溶度积常数。
电离平衡常数表示弱电解质的电离能力。
一定温度下,K值越大,弱电解质的电离程度越大,
酸性(或碱性)越强。
CH3COOH H2CO3 H2S
K=1.8×10-5 K1=4.3×10-7 K2=5.6×10-11 K1=9.1×10-8
K2=1.1×10-12
酸性:CH3COOH>H2CO3>H2S>HCO3 >HS
3.电离平衡常数的意义
4.电离常数的影响因素
(1)内因:同一温度下,不同的弱电解质的电离常数不同,说明电离常数首先由物质的本性所决定。
(2)外因:对于同一弱电解质,电离平衡常数只与温度有关,由于电离为吸热过程,所以电离平衡常数随温度升高而增大。
5.电离常数的计算——三段式法
例:25 ℃ a mol·L-1的CH3COOH
CH3COOH CH3COO-+H+
起始浓度/mol·L-1 a 0 0
变化浓度/mol·L-1 x x x
平衡浓度/mol·L-1 a-x x x
【注意】由于弱电解质的电离程度比较小,
平衡时弱电解质的浓度(a-x) mol·L-1一般近似为a mol·L-1
二.电离度
1.定义:
弱电解质在溶液中达到电离平衡状态时,已电离的电解质分子数占原有电解质分子总数(包括已电离和未电离)的百分率,称为电离度。
2.表达式:电离度通常用ɑ表示。
3.意义:
电离度实质上表示的是弱电解质达到电离平衡时的转化率,即表示弱电解质在水中的电离程度。
特别提示
①温度相同,浓度相同时,不同弱电解质的电离度不同。
若不同的一元弱酸的ɑ越大,表示其酸性相对越强。
②同一弱电解质的浓度不同,电离度也不同,溶液越稀,电离度越大。
三.电离平衡常数的应用
1.根据电离平衡常数可以判断弱酸(或弱碱)的相对强弱,相同条件下,电离平衡常数越大,酸性(或碱性)越强。
2.根据浓度商Q与电离平衡常数K的相对大小判断电离平衡的移动方向。
3.根据电离平衡常数判断溶液中微粒浓度比值的变化情况。
如0.1 mol·L-1 CH3COOH溶液加水稀释,
加水稀释时,c(H+)减小,Ka值不变, 则增大
四.强酸与弱酸的比较
1.镁条与等浓度、等体积盐酸、醋酸的反应
向两个锥形瓶中各加入0.05 g镁条,盖紧橡胶塞,然后用注射器分别注入2 mL 2 mol·L-1盐酸、2 mL 2 mol·L-1醋酸,测得锥形瓶内气体的压强随时间的变化如图所示。
宏观辨识 微观探析
反应初期 盐酸的反应速率比醋酸大 盐酸是强酸,完全电离,醋酸是弱酸,部分电离,同浓度的盐酸和醋酸,盐酸中的c(H+)较大,因而反应速率较大
反应过程中 盐酸的反应速率始终比醋酸大,盐酸的反应速率减小明显,醋酸的反应速率减小不明显 醋酸中存在电离平衡,随反应的进行,电离平衡正向移动,消耗的氢离子能及时电离补充,所以一段时间速率变化不明显
最终 二者产生的氢气的量基本相等,速率几乎都变为零 镁条稍微过量,两种酸的物质的量相同,随醋酸电离,平衡正向移动,醋酸几乎消耗完全,最终二者与镁条反应的氢离子的物质的量几乎相同,因而产生的H2的量几乎相同。两种酸都几乎消耗完全,反应停止,因而反应速率几乎都变为0
2.一元强酸和一元弱酸的比较
(1)相同体积、相同物质的量浓度的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较/酸 c(H+) 酸性 中和碱的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸 大 强 相同 相同 大
一元弱酸 小 弱 小
(2)相同体积、相同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较/酸 c(H+) 酸性 中和碱的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸 相同 相同 小 少 相同
一元弱酸 大 多 效果检测
1.已知25℃时①HNO2、②HClO、③HCN的电离常数依次为7.24×10-4、2.90×10-8、6.17×10-10,该温度下相同浓度的上述三种酸溶液,酸性由强到弱的顺序正确的是
A.③>②>① B.①>②>③ C.①>③>② D.②>①>③
【答案】B
2.(2021·南宁市第四中学高二开学考试)已知25 ℃下,醋酸溶液中各粒子存在下述关系:K= =1.75×10-5,下列有关说法可能成立的是
A.25 ℃下,向该溶液中加入一定量的盐酸时,K=8×10-5
B.25 ℃下,向该溶液中加入一定量的盐酸时,K=8×10-4
C.标准状况下,醋酸溶液中K=1.75×10-5
D.升高到一定温度,K=7.2×10-5
【答案】D
3.(2021·广西高二期末)一定温度下,将浓度为溶液加水不断稀释,始终保持增大的是
A. B.
C. D.
【答案】D
4.相同温度下,根据三种酸的电离常数,下列判断正确的是
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-=HY+Z-能够发生
C.由电离平衡常数可以判断,HZ属于强酸,HX和HY属于弱酸
D.相同温度下,1mol·L-1 HX溶液的电离常数大于0.1mol·L-1 HX溶液的电离常数
【答案】B
酸 HX HY HZ
电离常数K/(mol·L-1) 9×10-7 9×10-6 1×10-2
【答案】C
本课结束
第一节 电离平衡
第二课时 电离平衡常数
第三章 水溶液中的离子反应与平衡
【考纲要求】
了解电离平衡常数的含义。
能利用电离平衡常数进行相关计算。
能用电离常数从理论上解释弱电解质电离平衡的移动
知识导航
1.概念
在一定条件下,当弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,用 K 表示。
一.电离平衡常数
Ka表示弱酸的电离平衡常数
Kb表示弱碱的电离平衡常数
2.表示方法
(1)一元弱酸、弱碱
电离方程式 电离常数表达式
CH3COOH
NH3·H2O
CH3COOH CH3COO- + H+
Ka=
NH3·H2O NH4++ OH-
Kb =
电离方程式 电离常数表达式
H2CO3
Cu(OH)2
H2CO3 H+ +
HCO3- H+ +
K1=
K2=
Cu(OH)2 Cu2+ + 2OH-
K=
2.表示方法
(2)多元弱酸、弱碱
一般多元弱酸各步电离常数的大小为Ka1 Ka2 Ka3,
因此,多元弱酸的酸性主要由第一步电离决定。
由于多元弱碱为难溶碱,所以一般不用电离平衡常数,而用以后要学到的难溶物的溶度积常数。
电离平衡常数表示弱电解质的电离能力。
一定温度下,K值越大,弱电解质的电离程度越大,
酸性(或碱性)越强。
CH3COOH H2CO3 H2S
K=1.8×10-5 K1=4.3×10-7 K2=5.6×10-11 K1=9.1×10-8
K2=1.1×10-12
酸性:CH3COOH>H2CO3>H2S>HCO3 >HS
3.电离平衡常数的意义
4.电离常数的影响因素
(1)内因:同一温度下,不同的弱电解质的电离常数不同,说明电离常数首先由物质的本性所决定。
(2)外因:对于同一弱电解质,电离平衡常数只与温度有关,由于电离为吸热过程,所以电离平衡常数随温度升高而增大。
5.电离常数的计算——三段式法
例:25 ℃ a mol·L-1的CH3COOH
CH3COOH CH3COO-+H+
起始浓度/mol·L-1 a 0 0
变化浓度/mol·L-1 x x x
平衡浓度/mol·L-1 a-x x x
【注意】由于弱电解质的电离程度比较小,
平衡时弱电解质的浓度(a-x) mol·L-1一般近似为a mol·L-1
二.电离度
1.定义:
弱电解质在溶液中达到电离平衡状态时,已电离的电解质分子数占原有电解质分子总数(包括已电离和未电离)的百分率,称为电离度。
2.表达式:电离度通常用ɑ表示。
3.意义:
电离度实质上表示的是弱电解质达到电离平衡时的转化率,即表示弱电解质在水中的电离程度。
特别提示
①温度相同,浓度相同时,不同弱电解质的电离度不同。
若不同的一元弱酸的ɑ越大,表示其酸性相对越强。
②同一弱电解质的浓度不同,电离度也不同,溶液越稀,电离度越大。
三.电离平衡常数的应用
1.根据电离平衡常数可以判断弱酸(或弱碱)的相对强弱,相同条件下,电离平衡常数越大,酸性(或碱性)越强。
2.根据浓度商Q与电离平衡常数K的相对大小判断电离平衡的移动方向。
3.根据电离平衡常数判断溶液中微粒浓度比值的变化情况。
如0.1 mol·L-1 CH3COOH溶液加水稀释,
加水稀释时,c(H+)减小,Ka值不变, 则增大
四.强酸与弱酸的比较
1.镁条与等浓度、等体积盐酸、醋酸的反应
向两个锥形瓶中各加入0.05 g镁条,盖紧橡胶塞,然后用注射器分别注入2 mL 2 mol·L-1盐酸、2 mL 2 mol·L-1醋酸,测得锥形瓶内气体的压强随时间的变化如图所示。
宏观辨识 微观探析
反应初期 盐酸的反应速率比醋酸大 盐酸是强酸,完全电离,醋酸是弱酸,部分电离,同浓度的盐酸和醋酸,盐酸中的c(H+)较大,因而反应速率较大
反应过程中 盐酸的反应速率始终比醋酸大,盐酸的反应速率减小明显,醋酸的反应速率减小不明显 醋酸中存在电离平衡,随反应的进行,电离平衡正向移动,消耗的氢离子能及时电离补充,所以一段时间速率变化不明显
最终 二者产生的氢气的量基本相等,速率几乎都变为零 镁条稍微过量,两种酸的物质的量相同,随醋酸电离,平衡正向移动,醋酸几乎消耗完全,最终二者与镁条反应的氢离子的物质的量几乎相同,因而产生的H2的量几乎相同。两种酸都几乎消耗完全,反应停止,因而反应速率几乎都变为0
2.一元强酸和一元弱酸的比较
(1)相同体积、相同物质的量浓度的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较/酸 c(H+) 酸性 中和碱的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸 大 强 相同 相同 大
一元弱酸 小 弱 小
(2)相同体积、相同c(H+)的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较
比较/酸 c(H+) 酸性 中和碱的能力 与足量活泼金属反应产生H2的总量 与同一金属反应时的起始反应速率
一元强酸 相同 相同 小 少 相同
一元弱酸 大 多 效果检测
1.已知25℃时①HNO2、②HClO、③HCN的电离常数依次为7.24×10-4、2.90×10-8、6.17×10-10,该温度下相同浓度的上述三种酸溶液,酸性由强到弱的顺序正确的是
A.③>②>① B.①>②>③ C.①>③>② D.②>①>③
【答案】B
2.(2021·南宁市第四中学高二开学考试)已知25 ℃下,醋酸溶液中各粒子存在下述关系:K= =1.75×10-5,下列有关说法可能成立的是
A.25 ℃下,向该溶液中加入一定量的盐酸时,K=8×10-5
B.25 ℃下,向该溶液中加入一定量的盐酸时,K=8×10-4
C.标准状况下,醋酸溶液中K=1.75×10-5
D.升高到一定温度,K=7.2×10-5
【答案】D
3.(2021·广西高二期末)一定温度下,将浓度为溶液加水不断稀释,始终保持增大的是
A. B.
C. D.
【答案】D
4.相同温度下,根据三种酸的电离常数,下列判断正确的是
A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y-=HY+Z-能够发生
C.由电离平衡常数可以判断,HZ属于强酸,HX和HY属于弱酸
D.相同温度下,1mol·L-1 HX溶液的电离常数大于0.1mol·L-1 HX溶液的电离常数
【答案】B
酸 HX HY HZ
电离常数K/(mol·L-1) 9×10-7 9×10-6 1×10-2
【答案】C
本课结束
