7.2.1乙烯 课件(共30张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 7.2.1乙烯 课件(共30张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 10.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-27 18:19:36 | ||
图片预览








文档简介
(共30张PPT)
乙烯与有机高分子材料
——第一课时 乙烯
问题:怎么使未成熟的香蕉快速成熟?
小妙招:将未成熟的香蕉和成熟苹果放在一个塑料袋里,扎紧袋口放置一段时间。
原理:成熟的苹果能够释放出一种具有催熟作用的气体—— 。
生活小妙招
乙烯
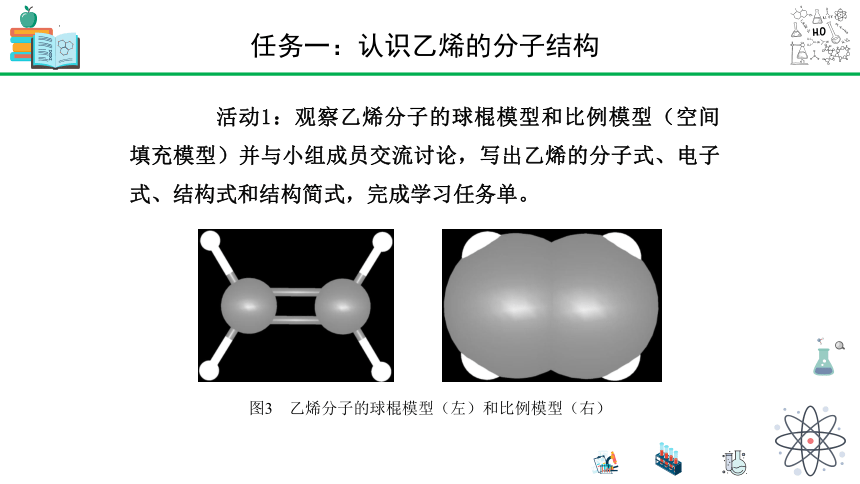
活动1:观察乙烯分子的球棍模型和比例模型(空间填充模型)并与小组成员交流讨论,写出乙烯的分子式、电子式、结构式和结构简式,完成学习任务单。
任务一:认识乙烯的分子结构
图3 乙烯分子的球棍模型(左)和比例模型(右)
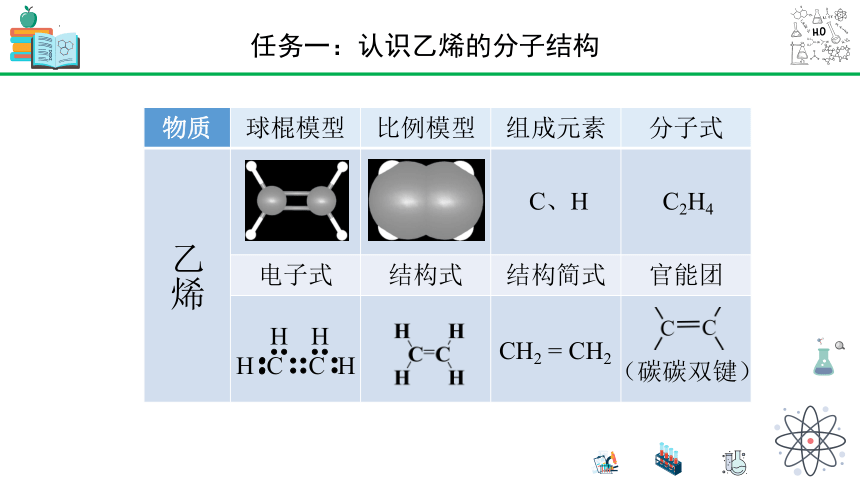
物质 球棍模型 比例模型 组成元素 分子式
乙烯
电子式 结构式 结构简式 官能团
C、H
C2H4
H
H C C H
H
CH2 = CH2
(碳碳双键)
任务一:认识乙烯的分子结构
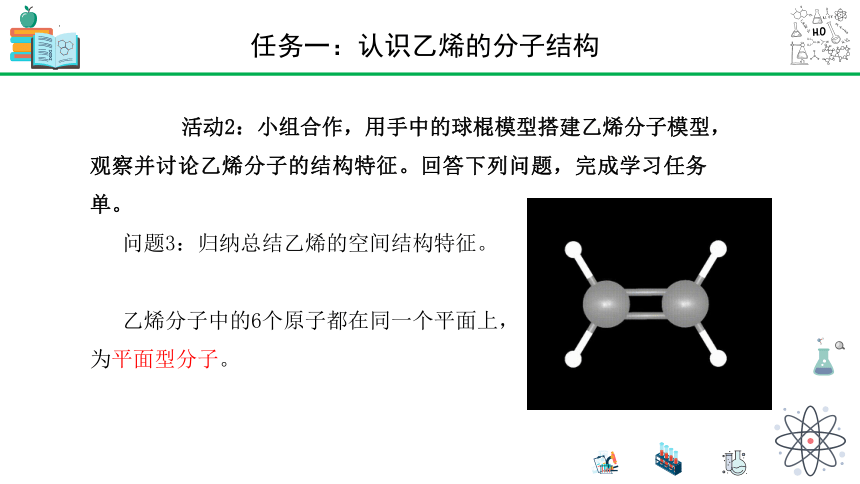
活动2:小组合作,用手中的球棍模型搭建乙烯分子模型,观察并讨论乙烯分子的结构特征。回答下列问题,完成学习任务单。
问题1:碳碳双键能否自由旋转?这对于乙烯的空间结构有何影响?
问题2:乙烯分子中哪些原子一定共平面,有几个原子一定共平面?
问题3:归纳总结乙烯的空间结构特征。
任务一:认识乙烯的分子结构
活动2:小组合作,用手中的球棍模型搭建乙烯分子模型,观察并讨论乙烯分子的结构特征。回答下列问题,完成学习任务单。
问题1:碳碳双键能否自由旋转?这对于乙烯的空间结构有何影响?
不能自由旋转
与双键碳原子直接相连的原子一定共平面
①
③
②
④
任务一:认识乙烯的分子结构
活动2:小组合作,用手中的球棍模型搭建乙烯分子模型,观察并讨论乙烯分子的结构特征。回答下列问题,完成学习任务单。
问题2:乙烯分子中哪些原子一定共平面,有几个原子一定共平面?
2个C原子和6个H原子一定共平面。
任务一:认识乙烯的分子结构
活动2:小组合作,用手中的球棍模型搭建乙烯分子模型,观察并讨论乙烯分子的结构特征。回答下列问题,完成学习任务单。
问题3:归纳总结乙烯的空间结构特征。
乙烯分子中的6个原子都在同一个平面上,
为平面型分子。
任务一:认识乙烯的分子结构
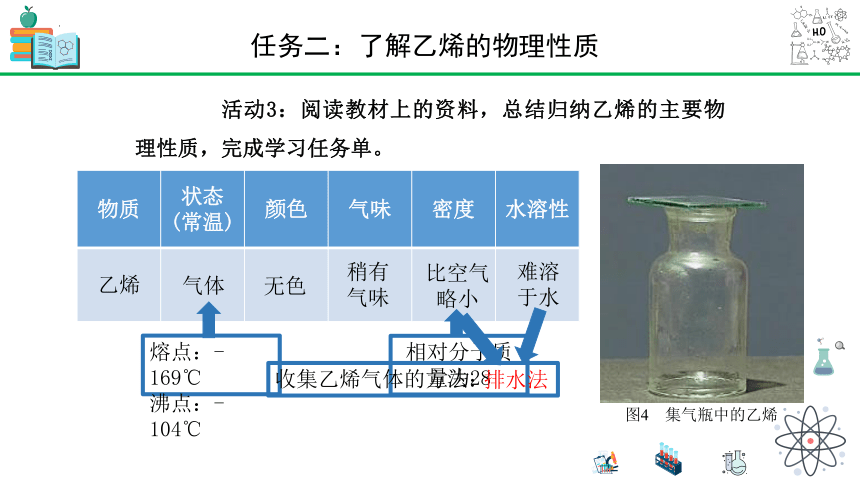
活动3:阅读教材上的资料,总结归纳乙烯的主要物理性质,完成学习任务单。
图4 集气瓶中的乙烯
物质 状态 (常温) 颜色 气味 密度 水溶性
乙烯
气体
难溶于水
比空气略小
稍有气味
无色
熔点:-169℃
沸点:-104℃
相对分子质量为28
收集乙烯气体的方法:
排水法
任务二:了解乙烯的物理性质
活动4:分析下列数据,回答下列问题,完成学习任务单。
资料:乙烯分子中碳碳双键的键能为615 kJ/mol,乙烷分子中碳碳单键的键能为348 kJ/mol。
问题1:碳碳双键是否是两个碳碳单键的简单叠加?为什么?
问题2:相比于乙烷,乙烯的化学性质更加稳定还是更加活泼?判断的依据是什么?
问题3:乙烯的化学性质主要由什么决定?
615 kJ/mol
348 kJ/mol
任务三:探究乙烯的化学性质
活动4:分析下列数据,回答下列问题,完成学习任务单。
资料:乙烯分子中碳碳双键的键能为615 kJ/mol,乙烷分子中碳碳单键的键能为348 kJ/mol。
问题1:碳碳双键是否是两个碳碳单键的简单叠加?为什么?
不是。碳碳双键中有一个键比较特殊,比通常的碳碳单键键能小,容易断裂。
615 kJ/mol
348 kJ/mol
任务三:探究乙烯的化学性质
活动4:分析下列数据,回答下列问题,完成学习任务单。
资料:乙烯分子中碳碳双键的键能为615 kJ/mol,乙烷分子中碳碳单键的键能为348 kJ/mol。
问题2:相比于乙烷,乙烯的化学性质更加稳定还是更加活泼?判断的依据是什么?
乙烯碳碳双键的其中一个键较容易断裂,因此化学性质更加活泼。
615 kJ/mol
348 kJ/mol
任务三:探究乙烯的化学性质
活动4:分析下列数据,回答下列问题,完成学习任务单。
资料:乙烯分子中碳碳双键的键能为615 kJ/mol,乙烷分子中碳碳单键的键能为348 kJ/mol。
问题3:乙烯的化学性质主要由什么决定?
乙烯的化学性质主要由它的官能团——碳碳双键( )决定。
615 kJ/mol
348 kJ/mol
任务三:探究乙烯的化学性质
活动5:探究乙烯的氧化反应
完成实验7-2,观察、记录并分析相关实验现象,预测反应产物,试着写出相关化学方程式,完成学习任务单。
【实验7-2】
(1)点燃纯净的乙烯,观察燃烧时的现象。
(2)将乙烯通入盛有酸性高锰酸钾溶液的试管中,观察现象。
任务三:探究乙烯的化学性质
活动5:探究乙烯的氧化反应
(1)乙烯的燃烧
现象:火焰明亮且伴有黑烟。
化学方程式:C2H4 + 3O2 2CO2 + 2H2O
课后思考:如何设计实验验证乙烯燃烧的产物?
乙烯含碳量高,燃烧不完全,生成碳单质小颗粒。
点燃
任务三:探究乙烯的化学性质
活动5:探究乙烯的氧化反应
(2)乙烯与酸性高锰酸钾溶液的反应
现象:乙烯可使酸性高锰酸钾溶液褪色。
原因:乙烯被高锰酸钾氧化。
课后思考:
①猜测乙烯被高锰酸钾氧化成什么物质?如何验证?
②除了高锰酸钾,还有哪些物质可以氧化乙烯?
任务三:探究乙烯的化学性质
活动6:探究乙烯的加成反应
(1)完成实验7-3:将乙烯通入溴的四氯化碳溶液中,观察实验现象,完成学习任务单。
实验现象:溴的四氯化碳溶液褪色。
结论:乙烯与溴单质发生了化学反应使其褪色。
应用:乙烯与烷烃的鉴别、除杂。
任务三:探究乙烯的化学性质
活动6:探究乙烯的加成反应
(2)小组合作,利用手中的球棍模型模拟乙烯和溴反应的过程,分析断键和成键情况,完成学习任务单。
任务三:探究乙烯的化学性质
活动6:探究乙烯的加成反应
1,2 - 二溴乙烷
CH2 = CH2 + Br2 CH2BrCH2Br
任务三:探究乙烯的化学性质
活动7:加成反应的迁移应用
(1)结合教材,归纳加成反应的定义。写出乙烯分别与氢气、氯气、氯化氢和水发生加成反应的化学方程式,完成学习任务单。
加成反应:有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应。
任务三:探究乙烯的化学性质
活动7:加成反应的迁移应用
CH2=CH2 + Cl2 CH2ClCH2Cl
CH2=CH2 + H2 CH3CH3
催化剂
CH2=CH2 + HCl CH3CH2Cl
催化剂
(工业制取乙醇)
CH2=CH2 + H2O CH3CH2OH
催化剂
加热,加压
任务三:探究乙烯的化学性质
活动7:加成反应的迁移应用
(2)提升训练:写出丙烯和氯化氢加成反应的化学方程式,完成学习任务单。
Cl
产物可能有两种!
CH2 = CHCH3 + HCl CH3CHCH3
CH2 = CHCH3 + HCl ClCH2CH2CH3
任务三:探究乙烯的化学性质
活动8:探究乙烯的聚合反应
思考:乙烯分子之间能否发生加成反应?如果能,请小组合作用球棍模型模拟多个乙烯分子发生加成反应的过程。
CH2 = CH2 + CH2 = CH2 + CH2 = CH2 + CH2 = CH2 + …
—CH2—CH2— + —CH2—CH2— + —CH2—CH2— + —CH2—CH2— + …
…—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—…
任务三:探究乙烯的化学性质
活动8:探究乙烯的聚合反应
上述过程可以表示为:
n CH2 = CH2 —CH2—CH2—
催化剂
n
聚乙烯
任务三:探究乙烯的化学性质
活动8:探究乙烯的聚合反应
概念归纳:
(1)聚合反应:由相对分子质量小的化合物分子相互结合成相对分子质量大的聚合物的反应叫做聚合反应。
(2)加聚反应:发生加成反应的聚合反应,叫做加成聚合反应。
任务三:探究乙烯的化学性质
活动8:探究乙烯的聚合反应
思考:结合教材信息归纳链节、聚合度、单体的概念并在乙烯的聚合反应中指出以上概念。
聚合反应
链节:聚合物中重复的结构单元。
聚合度:链节的数目。
单体:能合成高分子的小分子物质。
任务三:探究乙烯的化学性质
活动8:探究乙烯的聚合反应
思考:结合教材信息归纳链节、聚合度、单体的概念并在乙烯的聚合反应中指出以上概念。
n CH2 = CH2 —CH2—CH2—
催化剂
n
单体
聚合度
链节
任务三:探究乙烯的化学性质
活动8:探究乙烯的聚合反应
课堂练习:指出以下聚合物的单体。
—CH—CH2—
n
Cl
—CH2—CH—
n
CH3
CH—CH2
Cl
CH2—CH
CH3
任务三:探究乙烯的化学性质
活动9:搜集资料,归纳整理乙烯的用途。
(1)石油化学工业重要的基本原料
用于制造塑料,生产药物,合成乙醇、乙醛、合成纤维、合成橡胶、合成树脂等有机产品;
(2)植物生长调节剂。
任务四:了解乙烯的用途
聚乙烯塑料
乙醇
药物
催熟水果
4 乙烯的应用价值
1 乙烯的结构特征
3 乙烯的化学性质
乙烯的氧化反应
乙烯的加成反应
乙烯的聚合反应
2 乙烯的物理性质
课堂小结
乙烯与有机高分子材料
——第一课时 乙烯
问题:怎么使未成熟的香蕉快速成熟?
小妙招:将未成熟的香蕉和成熟苹果放在一个塑料袋里,扎紧袋口放置一段时间。
原理:成熟的苹果能够释放出一种具有催熟作用的气体—— 。
生活小妙招
乙烯
活动1:观察乙烯分子的球棍模型和比例模型(空间填充模型)并与小组成员交流讨论,写出乙烯的分子式、电子式、结构式和结构简式,完成学习任务单。
任务一:认识乙烯的分子结构
图3 乙烯分子的球棍模型(左)和比例模型(右)
物质 球棍模型 比例模型 组成元素 分子式
乙烯
电子式 结构式 结构简式 官能团
C、H
C2H4
H
H C C H
H
CH2 = CH2
(碳碳双键)
任务一:认识乙烯的分子结构
活动2:小组合作,用手中的球棍模型搭建乙烯分子模型,观察并讨论乙烯分子的结构特征。回答下列问题,完成学习任务单。
问题1:碳碳双键能否自由旋转?这对于乙烯的空间结构有何影响?
问题2:乙烯分子中哪些原子一定共平面,有几个原子一定共平面?
问题3:归纳总结乙烯的空间结构特征。
任务一:认识乙烯的分子结构
活动2:小组合作,用手中的球棍模型搭建乙烯分子模型,观察并讨论乙烯分子的结构特征。回答下列问题,完成学习任务单。
问题1:碳碳双键能否自由旋转?这对于乙烯的空间结构有何影响?
不能自由旋转
与双键碳原子直接相连的原子一定共平面
①
③
②
④
任务一:认识乙烯的分子结构
活动2:小组合作,用手中的球棍模型搭建乙烯分子模型,观察并讨论乙烯分子的结构特征。回答下列问题,完成学习任务单。
问题2:乙烯分子中哪些原子一定共平面,有几个原子一定共平面?
2个C原子和6个H原子一定共平面。
任务一:认识乙烯的分子结构
活动2:小组合作,用手中的球棍模型搭建乙烯分子模型,观察并讨论乙烯分子的结构特征。回答下列问题,完成学习任务单。
问题3:归纳总结乙烯的空间结构特征。
乙烯分子中的6个原子都在同一个平面上,
为平面型分子。
任务一:认识乙烯的分子结构
活动3:阅读教材上的资料,总结归纳乙烯的主要物理性质,完成学习任务单。
图4 集气瓶中的乙烯
物质 状态 (常温) 颜色 气味 密度 水溶性
乙烯
气体
难溶于水
比空气略小
稍有气味
无色
熔点:-169℃
沸点:-104℃
相对分子质量为28
收集乙烯气体的方法:
排水法
任务二:了解乙烯的物理性质
活动4:分析下列数据,回答下列问题,完成学习任务单。
资料:乙烯分子中碳碳双键的键能为615 kJ/mol,乙烷分子中碳碳单键的键能为348 kJ/mol。
问题1:碳碳双键是否是两个碳碳单键的简单叠加?为什么?
问题2:相比于乙烷,乙烯的化学性质更加稳定还是更加活泼?判断的依据是什么?
问题3:乙烯的化学性质主要由什么决定?
615 kJ/mol
348 kJ/mol
任务三:探究乙烯的化学性质
活动4:分析下列数据,回答下列问题,完成学习任务单。
资料:乙烯分子中碳碳双键的键能为615 kJ/mol,乙烷分子中碳碳单键的键能为348 kJ/mol。
问题1:碳碳双键是否是两个碳碳单键的简单叠加?为什么?
不是。碳碳双键中有一个键比较特殊,比通常的碳碳单键键能小,容易断裂。
615 kJ/mol
348 kJ/mol
任务三:探究乙烯的化学性质
活动4:分析下列数据,回答下列问题,完成学习任务单。
资料:乙烯分子中碳碳双键的键能为615 kJ/mol,乙烷分子中碳碳单键的键能为348 kJ/mol。
问题2:相比于乙烷,乙烯的化学性质更加稳定还是更加活泼?判断的依据是什么?
乙烯碳碳双键的其中一个键较容易断裂,因此化学性质更加活泼。
615 kJ/mol
348 kJ/mol
任务三:探究乙烯的化学性质
活动4:分析下列数据,回答下列问题,完成学习任务单。
资料:乙烯分子中碳碳双键的键能为615 kJ/mol,乙烷分子中碳碳单键的键能为348 kJ/mol。
问题3:乙烯的化学性质主要由什么决定?
乙烯的化学性质主要由它的官能团——碳碳双键( )决定。
615 kJ/mol
348 kJ/mol
任务三:探究乙烯的化学性质
活动5:探究乙烯的氧化反应
完成实验7-2,观察、记录并分析相关实验现象,预测反应产物,试着写出相关化学方程式,完成学习任务单。
【实验7-2】
(1)点燃纯净的乙烯,观察燃烧时的现象。
(2)将乙烯通入盛有酸性高锰酸钾溶液的试管中,观察现象。
任务三:探究乙烯的化学性质
活动5:探究乙烯的氧化反应
(1)乙烯的燃烧
现象:火焰明亮且伴有黑烟。
化学方程式:C2H4 + 3O2 2CO2 + 2H2O
课后思考:如何设计实验验证乙烯燃烧的产物?
乙烯含碳量高,燃烧不完全,生成碳单质小颗粒。
点燃
任务三:探究乙烯的化学性质
活动5:探究乙烯的氧化反应
(2)乙烯与酸性高锰酸钾溶液的反应
现象:乙烯可使酸性高锰酸钾溶液褪色。
原因:乙烯被高锰酸钾氧化。
课后思考:
①猜测乙烯被高锰酸钾氧化成什么物质?如何验证?
②除了高锰酸钾,还有哪些物质可以氧化乙烯?
任务三:探究乙烯的化学性质
活动6:探究乙烯的加成反应
(1)完成实验7-3:将乙烯通入溴的四氯化碳溶液中,观察实验现象,完成学习任务单。
实验现象:溴的四氯化碳溶液褪色。
结论:乙烯与溴单质发生了化学反应使其褪色。
应用:乙烯与烷烃的鉴别、除杂。
任务三:探究乙烯的化学性质
活动6:探究乙烯的加成反应
(2)小组合作,利用手中的球棍模型模拟乙烯和溴反应的过程,分析断键和成键情况,完成学习任务单。
任务三:探究乙烯的化学性质
活动6:探究乙烯的加成反应
1,2 - 二溴乙烷
CH2 = CH2 + Br2 CH2BrCH2Br
任务三:探究乙烯的化学性质
活动7:加成反应的迁移应用
(1)结合教材,归纳加成反应的定义。写出乙烯分别与氢气、氯气、氯化氢和水发生加成反应的化学方程式,完成学习任务单。
加成反应:有机物分子中的不饱和碳原子与其他原子或原子团直接结合生成新的化合物的反应。
任务三:探究乙烯的化学性质
活动7:加成反应的迁移应用
CH2=CH2 + Cl2 CH2ClCH2Cl
CH2=CH2 + H2 CH3CH3
催化剂
CH2=CH2 + HCl CH3CH2Cl
催化剂
(工业制取乙醇)
CH2=CH2 + H2O CH3CH2OH
催化剂
加热,加压
任务三:探究乙烯的化学性质
活动7:加成反应的迁移应用
(2)提升训练:写出丙烯和氯化氢加成反应的化学方程式,完成学习任务单。
Cl
产物可能有两种!
CH2 = CHCH3 + HCl CH3CHCH3
CH2 = CHCH3 + HCl ClCH2CH2CH3
任务三:探究乙烯的化学性质
活动8:探究乙烯的聚合反应
思考:乙烯分子之间能否发生加成反应?如果能,请小组合作用球棍模型模拟多个乙烯分子发生加成反应的过程。
CH2 = CH2 + CH2 = CH2 + CH2 = CH2 + CH2 = CH2 + …
—CH2—CH2— + —CH2—CH2— + —CH2—CH2— + —CH2—CH2— + …
…—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—…
任务三:探究乙烯的化学性质
活动8:探究乙烯的聚合反应
上述过程可以表示为:
n CH2 = CH2 —CH2—CH2—
催化剂
n
聚乙烯
任务三:探究乙烯的化学性质
活动8:探究乙烯的聚合反应
概念归纳:
(1)聚合反应:由相对分子质量小的化合物分子相互结合成相对分子质量大的聚合物的反应叫做聚合反应。
(2)加聚反应:发生加成反应的聚合反应,叫做加成聚合反应。
任务三:探究乙烯的化学性质
活动8:探究乙烯的聚合反应
思考:结合教材信息归纳链节、聚合度、单体的概念并在乙烯的聚合反应中指出以上概念。
聚合反应
链节:聚合物中重复的结构单元。
聚合度:链节的数目。
单体:能合成高分子的小分子物质。
任务三:探究乙烯的化学性质
活动8:探究乙烯的聚合反应
思考:结合教材信息归纳链节、聚合度、单体的概念并在乙烯的聚合反应中指出以上概念。
n CH2 = CH2 —CH2—CH2—
催化剂
n
单体
聚合度
链节
任务三:探究乙烯的化学性质
活动8:探究乙烯的聚合反应
课堂练习:指出以下聚合物的单体。
—CH—CH2—
n
Cl
—CH2—CH—
n
CH3
CH—CH2
Cl
CH2—CH
CH3
任务三:探究乙烯的化学性质
活动9:搜集资料,归纳整理乙烯的用途。
(1)石油化学工业重要的基本原料
用于制造塑料,生产药物,合成乙醇、乙醛、合成纤维、合成橡胶、合成树脂等有机产品;
(2)植物生长调节剂。
任务四:了解乙烯的用途
聚乙烯塑料
乙醇
药物
催熟水果
4 乙烯的应用价值
1 乙烯的结构特征
3 乙烯的化学性质
乙烯的氧化反应
乙烯的加成反应
乙烯的聚合反应
2 乙烯的物理性质
课堂小结
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
