化学人教版(2019)必修第一册4.1.2元素周期表 课件(共44张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.1.2元素周期表 课件(共44张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-28 08:04:18 | ||
图片预览









文档简介
(共44张PPT)
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第2课时 元素周期表
1869年门捷列夫在继承和分析了前人工作的基础上,对大量实验事实进行了订正、分析和概括,成功地对元素进行了科学分类。他总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着相对原子质量的递增而呈现周期性的变化。这就是元素周期律。
他还预言了一些未知元素的性质都得到了证实。但是由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的,他未能认识到形成元素性质周期性变化的根本原因。
元素周期表的历史
第一张元素周期表
(1)时间:
(2)绘制者:
(3)排序依据:
(4)结构特点:
(5)意义:
俄国化学家——门捷列夫
1869年
将元素按照相对原子质量由小到大依次排列
揭示了化学元素的内在联系——里程碑
将化学性质相似的元素放在一个纵行
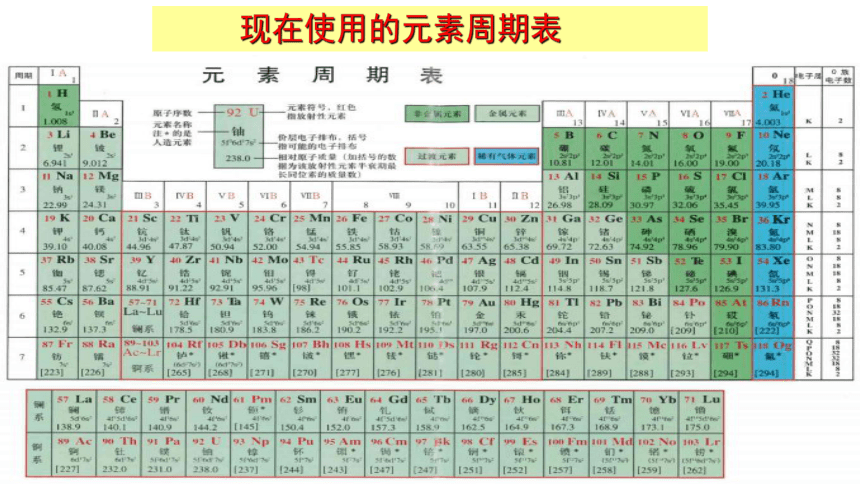
现在使用的元素周期表
问题讨论
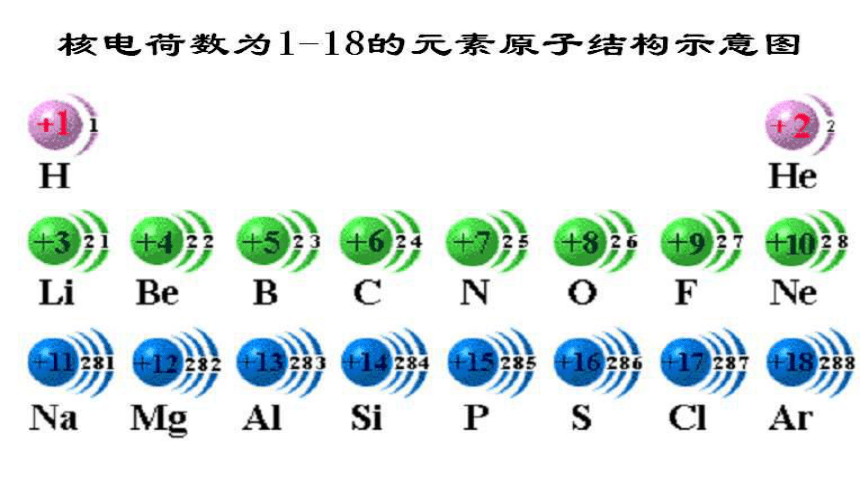
由1—18号元素的原子结构分析
1.每一横行有什么相同点?
2.每一纵行有什么相同点?
问题讨论
由1—18号元素的原子结构分析
1.每一横行有什么相同点?
2.每一纵行有什么相同点?
每一横行的电子层数相同
每一纵行的最外层电子数相同
(稀有气体He元素除外)
1.按______________递增的顺序从左到右排列
2.将_____________的元素排成一个横行——
3.把__________________的元素排成一个纵列——
原子序数
电子层数相同
最外层电子数相同
【学习任务二】认识元素周期表
一.周期表的编排原则
原子序数=质子数=核电荷数=核外电子数
周期
族
结论: 周期序数=电子层数
短周期
长周期
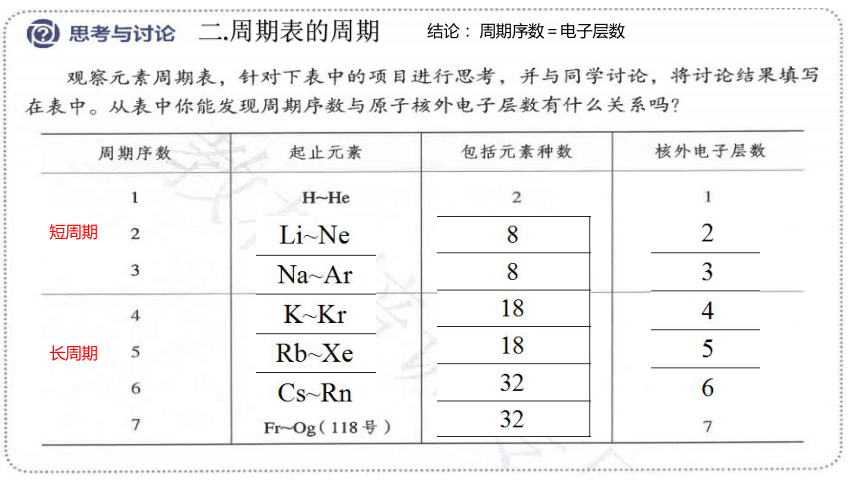
二.周期表的周期
认真观察元素周期表,回答下列问题:
1. 在元素周期表中有多少个纵列,多少个族
2. 族分几种,分别用什么符号表示?
族序数用什么数字表示?
每一纵行对应哪一族?
3. 周期表中所含元素种类最多的族是哪一族?
每一个纵列叫做一个族(18纵列,16个族)
1.主族:(7个)
由短周期元素和长周期元素共同构成的族。
表示方法:在族序数(罗马数字)后标一“A”字。
ⅠA、ⅡA、ⅢA、IVA、VA、VIA、VIIA
三.周期表的族
主族序数=最外层电子数
2. 副族:(7个)
完全由长周期元素构成的族。
表示方法:在族序数后标“B”字。
ⅠB、ⅡB、ⅢB、IVB、VB、VIB、VIIB
3. 第VⅢ族:(第8到10纵列)
4. 0族:(稀有气体)
三.周期表的族
常见族名
ⅠA(除H外)称为碱金属元素 ⅡA称为碱土金属元素
ⅣA称为碳族元素 ⅤA称为氮族元素
ⅥA称为氧族元素 ⅦA称为卤族元素
副族和第Ⅷ族全部是金属元素;又称为过渡金属元素
小结:元素周期表的结构
碱
金
属
元
素
卤
族
元
素
稀
有
气
体
元
素
过渡元素
IA
IIA
IIIB~VIIB
VIII
IB~IIB
IIIA~VIIA
0
镧系
锕系
1.周期
(1)数目:元素周期表有 个横行,即有 个周期。
(2)分类
①短周期:第一、二、三周期,每周期所含元素的种类数分别为
、 、 。
②长周期:第四、五、六、七周期,每周期所含元素的种类数分别为 、 、 、 。
2.族
(1)数目:元素周期表有 个纵列,但只有 个族。
7
7
2
8
8
18
18
32
32
18
16
3.注意事项
(1)元素位置与原子结构的关系
周期序数= ,主族序数= 。
(2)常见族的特别名称
第ⅠA族(H除外): 元素。
第ⅦA族: 元素。
0族: 元素。
电子层数
最外层电子数
碱金属
卤族
稀有气体
1.为什么将Li、Na、K等元素编在元素周期表的同一个主族?
最外层电子数相同的主族元素属于同一主族
2.元素周期表中所含元素种类最多的是哪一个族?
ⅢB族 (含有镧系和锕系元素)
三、元素在周期表中位置的表示
【思考】如何描述Cl在元素周期表中的位置?
第3周期 第VIIA族
(或第三周期)
主族序数=最外层电子数
周期序数=电子层数
练1.写出原子序数为6、15的元素在周期表中的位置
练习
2.已知某主族元素的原子结构示意图如下,判断其在元素周期表中的位置?
3. 某元素位于第2周期,第ⅦA 族,它是___元素。
X是第4周期,第ⅠA族
Y是第5周期,第ⅦA族
氟
练4.写出原子序数为34、53、88、82三种元素在周期表中的位置
第34号元素: 第四周期第ⅥA 族。
第53号元素: 第五周期第ⅦA 族。
第88号元素: 第七周期第ⅡA 族。
第82号元素:
第六周期第ⅣA 族。
5. 所含元素种类最多的族是______族,
含有元素种类最多的周期是______周期。
6. 某第IIA族元素的序号为n,则与其同周期的
第IIIA族元素的序号可能为:
————————
n+1, n+11, n+25
第IIIB
第六
7.某第三周期VIIA族元素的序号为n,则下周期的第VIIA族元素的序号可能为:
8.某第三周期IIA族元素的序号为m,则下周期的IIA族元素的序号可能为:
m+8
n+18
例2.下列各表中数字(表示原子序数)所表示的元素与它们在周期表中位置相符的一组是( )
D
练9.已知a为ⅡA族元素,b为ⅢA族元素,它们的原子序数分别为m和n,且a、b为同一周期元素,下列关系错误的是( )
A.n=m+1 B.n=m+11
C.n=m+25 D.n=m+10
D
例3. A、B、C均为短周期元素,A、B同周期,B、C同主族,三种元素最外层电子数之和为17,质子数之和为31,则A、B、C分别是( )
A.Be、Na、Al B.B、Mg、Si
C.C、Al、P D.N、O、S
D
练习:写出下列短周期元素名称并分析该元素在周期表中的位置。
(1)A元素原子核外最外层电子数是次外层电子数的二倍:____________________
(2)B元素原子的最外层电子数是内层电子数的1.5倍:____________________
(3)C元素的单质在常温下可与水剧烈反应,原子最外层只有一个电子____________________ 。
(4)D元素的次外层电子数是最外层电子数的4倍:____________________ 。
碳: 第二周期第ⅥA 族。
硼: 第二周期第ⅲA 族。
钠: 第三周期第ⅰA 族。
镁: 第三周期第ⅱA 族。
【思考】元素周期表中的每个方格中,一般都标有元素的基本信息,你知道这些信息的含义吗?
【思考】为什么H的相对原子质量1.008,这个数值是怎么来的?
【学习任务三】认识核素与同位素
【思考】比较三种原子结构的异同,它们是不是同一种元素?
没有中子
1个中子
2个中子
元素:
具有相同核电荷数(或质子数)的同一 类原子的总称。
核素:
具有一定数目的质子和一定数目的中子的一种原子。
【思考】它们是不是同一种原子?
不是,它们是三种不同的原子,或者说是三种不同的核素。
同位素:
质子数相同而中子数不同的同一种元素的不同原子互称为同位素。即同一元素的不同核素之间互称为同位素。
核素1
核素n
同位素
元 素
…
【拓展】如图H的三种核素可以在周期表的同一小方格中表示出来。
【思考】除了用名称区分同一元素的同位素外,还可以怎样区分?
U: 92U 92U 92U
H: 1H 1H 1H
C: 6C 6C 6C
O: 8O 8O 8O
Cl: 17Cl 17Cl
1
2
3
12
13
14
16
17
18
35
37
234
235
238
原子符号
【思考】每个原子的左上角和左下角分别表示什么?你能表示出某核素X的原子符号吗?
ZX
A
左上角代表质量数A,左下角代表质子数Z
【思考】在周期表中收入了118种元素,是不是就只有 118种原子呢?
一种元素可有几种原子,故元素种类118种,而原子1800多种。其中,除了天然存在的同位素外,科学家还利用核反应制造出很多种同位素。
元素的相对原子质量
元素的相对原子质量是其各种核素的相对原子质量分别与各种核素在自然界里的丰度(某种核素在这种元素的所有天然核素中所占的比例)的乘积之和。
【问题解决】为什么H的相对原子质量1.008,这个数值是怎么来的?
质量数不等于相对原子质量
【拓展2】各种同位素原子的物理性质有所不同,但它们的化学性质基本相同。
【拓展3】同位素在生活、生产和科学研究中有着重要作用。
【拓展1】同位素中,有些具有放射性,称为放射性同位素。
1.作核燃料:作制造核武器的动力性材料(235U)
2.金属探伤:利用γ射线的贯穿本领,可以检查金属内部有没有沙眼和裂纹。
3.辐射育种:利用放射性同位素的射线对遗传物质产生影响,提高基因突变频率,从而选育出优良品种。
4.临床治癌:利用放射性同位素的射线杀伤癌细胞或阻止癌细胞分裂。
5.环保治污:利用放射性同位素的射线可消毒灭菌,杀死各种病原体从而能保护环境使其少受污染。
……
同位素的应用
CT(Computed Tomography),即电子计算机断层扫描,它是利用精确准直的X线束、γ射线、超声波等,与灵敏度极高的探测器一同围绕人体的某一部位作一个接一个的断面扫描,具有扫描时间快,图像清晰等特点,可用于多种疾病的检查;根据所采用的射线不同可分为:X射线CT(X-CT)以及γ射线CT(γ-CT)等。
质子治疗最早于1946年首次被提出,1954年,美国劳伦斯伯克利国家实验室的研究团队进行了世界首例肿瘤患者的质子治疗。此后,美国、欧洲、日本等相继开始了质子在医学领域的研究,但直到1988年,质子治疗才获得了美国FDA的批准,质子治疗从此开始在肿瘤治疗领域大放异彩。
质子治疗最大的优势就是比常规放疗更加精准地杀伤肿瘤组织。质子束使其具有手术刀般的精确性。与X射线的光子不同,质子以极高速度进入患者体内后质子减慢,它们与人体组织相互作用,这样一来,大部分光束能量沉积在一个点上(称为布拉格峰),故而拥有绝佳的精准性、对周围正常组织器官损伤微小,这对大多数需要接受放疗的患者来讲,质子治疗可能是最好的治疗方法之一。
考古断代
元素、核素、同位素、同素异形体的比较
元素 核素 同位素 同素异形体
本质 质子数(核电荷数)相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素 同种元素组成的不同单质
范畴 同类原子 原子 原子 单质
特性 只有种类,没有个数 化学反应中的最小微粒 化学性质几乎完全相同,因质量数不同,物理性质不同 组成元素相同,性质不同
举例 H、C、O三种元素 O2与O3互为同素异形体
练习
10.金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生长在一起,故有“生命金属”之称。下列有关 和 的说法正确的是( )
A.质量数相同,互为同位素
B.质子数相同,互为同位素
C.中子数相同,属同一种元素的不同核素
D.核外电子数相同,中子数不同,不能互称为同位素
B
例4. 最近医学界通过用放射性14C标记的C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病病毒。则有关14C的下列说法中正确的是( )
A. 14C原子与C60中普通碳原子的化学性质不同
B. 14C原子与14N原子中所含中子数相同
C. 14C与C60互为同素异形体
D. 14C与12C、13C互为同位素
D
【思考】原子形成离子之后构成原子的微粒哪些发生了变化?
和
电子数变了
原子:核电荷数=质子数=核外电子数
阳离子:核外电子数=质子数-所带的电荷数。
阴离子:核外电子数=质子数+所带的电荷数。
【思考】请用原子符号表示出某核素在得到或失去n个电子后的情况。你能总结出原子、阳离子和阴离子核外电子数与质子数的关系吗?
在元素周期表中找到以下元素,并写出它的原子结构示意图和在元素周期表中的位置。
元素符号 原子结构示意图 周期表中的位置
O
Ca
S
He
【评价任务一】
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,请回答:
(1)写出下列元素符号:
甲:____乙:____丙:____丁:____戊:____己:____
(2) 丙与庚的原子核外电子数相差_________
(3)乙与丙的原子核外电子数相差_________
己与庚的原子核外电子数相差_________
【评价任务二】
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
第2课时 元素周期表
1869年门捷列夫在继承和分析了前人工作的基础上,对大量实验事实进行了订正、分析和概括,成功地对元素进行了科学分类。他总结出一条规律:元素(以及由它所形成的单质和化合物)的性质随着相对原子质量的递增而呈现周期性的变化。这就是元素周期律。
他还预言了一些未知元素的性质都得到了证实。但是由于时代的局限,门捷列夫揭示的元素内在联系的规律还是初步的,他未能认识到形成元素性质周期性变化的根本原因。
元素周期表的历史
第一张元素周期表
(1)时间:
(2)绘制者:
(3)排序依据:
(4)结构特点:
(5)意义:
俄国化学家——门捷列夫
1869年
将元素按照相对原子质量由小到大依次排列
揭示了化学元素的内在联系——里程碑
将化学性质相似的元素放在一个纵行
现在使用的元素周期表
问题讨论
由1—18号元素的原子结构分析
1.每一横行有什么相同点?
2.每一纵行有什么相同点?
问题讨论
由1—18号元素的原子结构分析
1.每一横行有什么相同点?
2.每一纵行有什么相同点?
每一横行的电子层数相同
每一纵行的最外层电子数相同
(稀有气体He元素除外)
1.按______________递增的顺序从左到右排列
2.将_____________的元素排成一个横行——
3.把__________________的元素排成一个纵列——
原子序数
电子层数相同
最外层电子数相同
【学习任务二】认识元素周期表
一.周期表的编排原则
原子序数=质子数=核电荷数=核外电子数
周期
族
结论: 周期序数=电子层数
短周期
长周期
二.周期表的周期
认真观察元素周期表,回答下列问题:
1. 在元素周期表中有多少个纵列,多少个族
2. 族分几种,分别用什么符号表示?
族序数用什么数字表示?
每一纵行对应哪一族?
3. 周期表中所含元素种类最多的族是哪一族?
每一个纵列叫做一个族(18纵列,16个族)
1.主族:(7个)
由短周期元素和长周期元素共同构成的族。
表示方法:在族序数(罗马数字)后标一“A”字。
ⅠA、ⅡA、ⅢA、IVA、VA、VIA、VIIA
三.周期表的族
主族序数=最外层电子数
2. 副族:(7个)
完全由长周期元素构成的族。
表示方法:在族序数后标“B”字。
ⅠB、ⅡB、ⅢB、IVB、VB、VIB、VIIB
3. 第VⅢ族:(第8到10纵列)
4. 0族:(稀有气体)
三.周期表的族
常见族名
ⅠA(除H外)称为碱金属元素 ⅡA称为碱土金属元素
ⅣA称为碳族元素 ⅤA称为氮族元素
ⅥA称为氧族元素 ⅦA称为卤族元素
副族和第Ⅷ族全部是金属元素;又称为过渡金属元素
小结:元素周期表的结构
碱
金
属
元
素
卤
族
元
素
稀
有
气
体
元
素
过渡元素
IA
IIA
IIIB~VIIB
VIII
IB~IIB
IIIA~VIIA
0
镧系
锕系
1.周期
(1)数目:元素周期表有 个横行,即有 个周期。
(2)分类
①短周期:第一、二、三周期,每周期所含元素的种类数分别为
、 、 。
②长周期:第四、五、六、七周期,每周期所含元素的种类数分别为 、 、 、 。
2.族
(1)数目:元素周期表有 个纵列,但只有 个族。
7
7
2
8
8
18
18
32
32
18
16
3.注意事项
(1)元素位置与原子结构的关系
周期序数= ,主族序数= 。
(2)常见族的特别名称
第ⅠA族(H除外): 元素。
第ⅦA族: 元素。
0族: 元素。
电子层数
最外层电子数
碱金属
卤族
稀有气体
1.为什么将Li、Na、K等元素编在元素周期表的同一个主族?
最外层电子数相同的主族元素属于同一主族
2.元素周期表中所含元素种类最多的是哪一个族?
ⅢB族 (含有镧系和锕系元素)
三、元素在周期表中位置的表示
【思考】如何描述Cl在元素周期表中的位置?
第3周期 第VIIA族
(或第三周期)
主族序数=最外层电子数
周期序数=电子层数
练1.写出原子序数为6、15的元素在周期表中的位置
练习
2.已知某主族元素的原子结构示意图如下,判断其在元素周期表中的位置?
3. 某元素位于第2周期,第ⅦA 族,它是___元素。
X是第4周期,第ⅠA族
Y是第5周期,第ⅦA族
氟
练4.写出原子序数为34、53、88、82三种元素在周期表中的位置
第34号元素: 第四周期第ⅥA 族。
第53号元素: 第五周期第ⅦA 族。
第88号元素: 第七周期第ⅡA 族。
第82号元素:
第六周期第ⅣA 族。
5. 所含元素种类最多的族是______族,
含有元素种类最多的周期是______周期。
6. 某第IIA族元素的序号为n,则与其同周期的
第IIIA族元素的序号可能为:
————————
n+1, n+11, n+25
第IIIB
第六
7.某第三周期VIIA族元素的序号为n,则下周期的第VIIA族元素的序号可能为:
8.某第三周期IIA族元素的序号为m,则下周期的IIA族元素的序号可能为:
m+8
n+18
例2.下列各表中数字(表示原子序数)所表示的元素与它们在周期表中位置相符的一组是( )
D
练9.已知a为ⅡA族元素,b为ⅢA族元素,它们的原子序数分别为m和n,且a、b为同一周期元素,下列关系错误的是( )
A.n=m+1 B.n=m+11
C.n=m+25 D.n=m+10
D
例3. A、B、C均为短周期元素,A、B同周期,B、C同主族,三种元素最外层电子数之和为17,质子数之和为31,则A、B、C分别是( )
A.Be、Na、Al B.B、Mg、Si
C.C、Al、P D.N、O、S
D
练习:写出下列短周期元素名称并分析该元素在周期表中的位置。
(1)A元素原子核外最外层电子数是次外层电子数的二倍:____________________
(2)B元素原子的最外层电子数是内层电子数的1.5倍:____________________
(3)C元素的单质在常温下可与水剧烈反应,原子最外层只有一个电子____________________ 。
(4)D元素的次外层电子数是最外层电子数的4倍:____________________ 。
碳: 第二周期第ⅥA 族。
硼: 第二周期第ⅲA 族。
钠: 第三周期第ⅰA 族。
镁: 第三周期第ⅱA 族。
【思考】元素周期表中的每个方格中,一般都标有元素的基本信息,你知道这些信息的含义吗?
【思考】为什么H的相对原子质量1.008,这个数值是怎么来的?
【学习任务三】认识核素与同位素
【思考】比较三种原子结构的异同,它们是不是同一种元素?
没有中子
1个中子
2个中子
元素:
具有相同核电荷数(或质子数)的同一 类原子的总称。
核素:
具有一定数目的质子和一定数目的中子的一种原子。
【思考】它们是不是同一种原子?
不是,它们是三种不同的原子,或者说是三种不同的核素。
同位素:
质子数相同而中子数不同的同一种元素的不同原子互称为同位素。即同一元素的不同核素之间互称为同位素。
核素1
核素n
同位素
元 素
…
【拓展】如图H的三种核素可以在周期表的同一小方格中表示出来。
【思考】除了用名称区分同一元素的同位素外,还可以怎样区分?
U: 92U 92U 92U
H: 1H 1H 1H
C: 6C 6C 6C
O: 8O 8O 8O
Cl: 17Cl 17Cl
1
2
3
12
13
14
16
17
18
35
37
234
235
238
原子符号
【思考】每个原子的左上角和左下角分别表示什么?你能表示出某核素X的原子符号吗?
ZX
A
左上角代表质量数A,左下角代表质子数Z
【思考】在周期表中收入了118种元素,是不是就只有 118种原子呢?
一种元素可有几种原子,故元素种类118种,而原子1800多种。其中,除了天然存在的同位素外,科学家还利用核反应制造出很多种同位素。
元素的相对原子质量
元素的相对原子质量是其各种核素的相对原子质量分别与各种核素在自然界里的丰度(某种核素在这种元素的所有天然核素中所占的比例)的乘积之和。
【问题解决】为什么H的相对原子质量1.008,这个数值是怎么来的?
质量数不等于相对原子质量
【拓展2】各种同位素原子的物理性质有所不同,但它们的化学性质基本相同。
【拓展3】同位素在生活、生产和科学研究中有着重要作用。
【拓展1】同位素中,有些具有放射性,称为放射性同位素。
1.作核燃料:作制造核武器的动力性材料(235U)
2.金属探伤:利用γ射线的贯穿本领,可以检查金属内部有没有沙眼和裂纹。
3.辐射育种:利用放射性同位素的射线对遗传物质产生影响,提高基因突变频率,从而选育出优良品种。
4.临床治癌:利用放射性同位素的射线杀伤癌细胞或阻止癌细胞分裂。
5.环保治污:利用放射性同位素的射线可消毒灭菌,杀死各种病原体从而能保护环境使其少受污染。
……
同位素的应用
CT(Computed Tomography),即电子计算机断层扫描,它是利用精确准直的X线束、γ射线、超声波等,与灵敏度极高的探测器一同围绕人体的某一部位作一个接一个的断面扫描,具有扫描时间快,图像清晰等特点,可用于多种疾病的检查;根据所采用的射线不同可分为:X射线CT(X-CT)以及γ射线CT(γ-CT)等。
质子治疗最早于1946年首次被提出,1954年,美国劳伦斯伯克利国家实验室的研究团队进行了世界首例肿瘤患者的质子治疗。此后,美国、欧洲、日本等相继开始了质子在医学领域的研究,但直到1988年,质子治疗才获得了美国FDA的批准,质子治疗从此开始在肿瘤治疗领域大放异彩。
质子治疗最大的优势就是比常规放疗更加精准地杀伤肿瘤组织。质子束使其具有手术刀般的精确性。与X射线的光子不同,质子以极高速度进入患者体内后质子减慢,它们与人体组织相互作用,这样一来,大部分光束能量沉积在一个点上(称为布拉格峰),故而拥有绝佳的精准性、对周围正常组织器官损伤微小,这对大多数需要接受放疗的患者来讲,质子治疗可能是最好的治疗方法之一。
考古断代
元素、核素、同位素、同素异形体的比较
元素 核素 同位素 同素异形体
本质 质子数(核电荷数)相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素 同种元素组成的不同单质
范畴 同类原子 原子 原子 单质
特性 只有种类,没有个数 化学反应中的最小微粒 化学性质几乎完全相同,因质量数不同,物理性质不同 组成元素相同,性质不同
举例 H、C、O三种元素 O2与O3互为同素异形体
练习
10.金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生长在一起,故有“生命金属”之称。下列有关 和 的说法正确的是( )
A.质量数相同,互为同位素
B.质子数相同,互为同位素
C.中子数相同,属同一种元素的不同核素
D.核外电子数相同,中子数不同,不能互称为同位素
B
例4. 最近医学界通过用放射性14C标记的C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病病毒。则有关14C的下列说法中正确的是( )
A. 14C原子与C60中普通碳原子的化学性质不同
B. 14C原子与14N原子中所含中子数相同
C. 14C与C60互为同素异形体
D. 14C与12C、13C互为同位素
D
【思考】原子形成离子之后构成原子的微粒哪些发生了变化?
和
电子数变了
原子:核电荷数=质子数=核外电子数
阳离子:核外电子数=质子数-所带的电荷数。
阴离子:核外电子数=质子数+所带的电荷数。
【思考】请用原子符号表示出某核素在得到或失去n个电子后的情况。你能总结出原子、阳离子和阴离子核外电子数与质子数的关系吗?
在元素周期表中找到以下元素,并写出它的原子结构示意图和在元素周期表中的位置。
元素符号 原子结构示意图 周期表中的位置
O
Ca
S
He
【评价任务一】
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,请回答:
(1)写出下列元素符号:
甲:____乙:____丙:____丁:____戊:____己:____
(2) 丙与庚的原子核外电子数相差_________
(3)乙与丙的原子核外电子数相差_________
己与庚的原子核外电子数相差_________
【评价任务二】
