2024新高考化学高考专题复习--专题八化学键分子和晶体的结构与性质(含答案)
文档属性
| 名称 | 2024新高考化学高考专题复习--专题八化学键分子和晶体的结构与性质(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-28 09:55:49 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
2024新高考化学高考专题复习
专题八 化学键 分子和晶体的结构与性质
拓展训练
1.下列说法错误的是( )
A.酸性:FCH2COOH>ClCH2COOH>CH3COOH
B.1,4-环己二烯()分子中σ键与π键的数目之比为6∶1
C.向[TiBr(H2O)5]Br2的溶液中滴加足量AgNO3溶液,只有的Br-形成AgBr沉淀
D.HF气体的摩尔质量测定值大于实际值,与HF分子间形成氢键有关
答案 B
2.下列符号表征错误的是( )
A.HC的水解方程式为HC+H2O H3O++C
B.H2分子中σ键的电子云轮廓图:
C.H2S的VSEPR模型:
D.MgCl2的形成过程:
答案 A
3. 硒(Se)是人体必需微量元素之一,已知Se与S同族,一种含硒的功能分子的合成路线如下,下列说法不正确的是 ( )
A.沸点:H2O>H2Se>H2S
B.Ⅰ中S原子的杂化轨道类型为sp3
C.Ⅱ中含有极性共价键和非极性共价键
D.Ⅲ含有的元素中O的第一电离能最大
答案 D
4.铬离子能形成多种配位化合物,下列关于说法正确的是( )
A.[Cr(NH3)3(H2O)2Cl]2+中Cr的化合价为+2
B.[Cr(NH3)3(H2O)2Cl]2+中铬离子的配位数是5
C.NH3的沸点比H2O的低
D.NH3与H2O的键角相同
答案 C
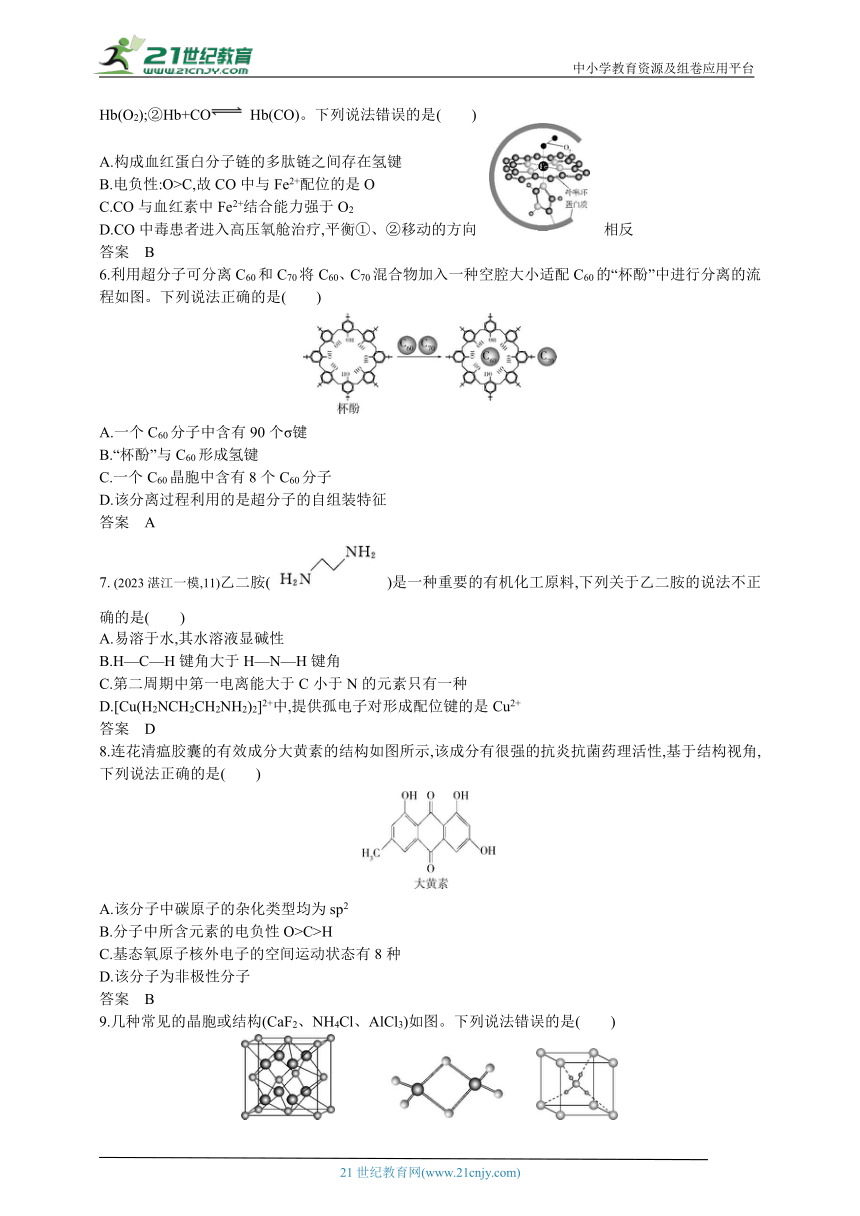
5.生物大分子血红蛋白分子链的部分结构及载氧示意如图,Fe2+与周围的6个原子均以配位键结合。CO也可与血红蛋白配位,使人体中毒。二者与血红蛋白(Hb)结合的反应可表示为①Hb+O2 Hb(O2);②Hb+CO Hb(CO)。下列说法错误的是( )
A.构成血红蛋白分子链的多肽链之间存在氢键
B.电负性:O>C,故CO中与Fe2+配位的是O
C.CO与血红素中Fe2+结合能力强于O2
D.CO中毒患者进入高压氧舱治疗,平衡①、②移动的方向相反
答案 B
6.利用超分子可分离C60和C70将C60、C70混合物加入一种空腔大小适配C60的“杯酚”中进行分离的流程如图。下列说法正确的是( )
A.一个C60分子中含有90个σ键
B.“杯酚”与C60形成氢键
C.一个C60晶胞中含有8个C60分子
D.该分离过程利用的是超分子的自组装特征
答案 A
7. (2023湛江一模,11)乙二胺()是一种重要的有机化工原料,下列关于乙二胺的说法不正确的是( )
A.易溶于水,其水溶液显碱性
B.H—C—H键角大于H—N—H键角
C.第二周期中第一电离能大于C小于N的元素只有一种
D.[Cu(H2NCH2CH2NH2)2]2+中,提供孤电子对形成配位键的是Cu2+
答案 D
8.连花清瘟胶囊的有效成分大黄素的结构如图所示,该成分有很强的抗炎抗菌药理活性,基于结构视角,下列说法正确的是( )
A.该分子中碳原子的杂化类型均为sp2
B.分子中所含元素的电负性O>C>H
C.基态氧原子核外电子的空间运动状态有8种
D.该分子为非极性分子
答案 B
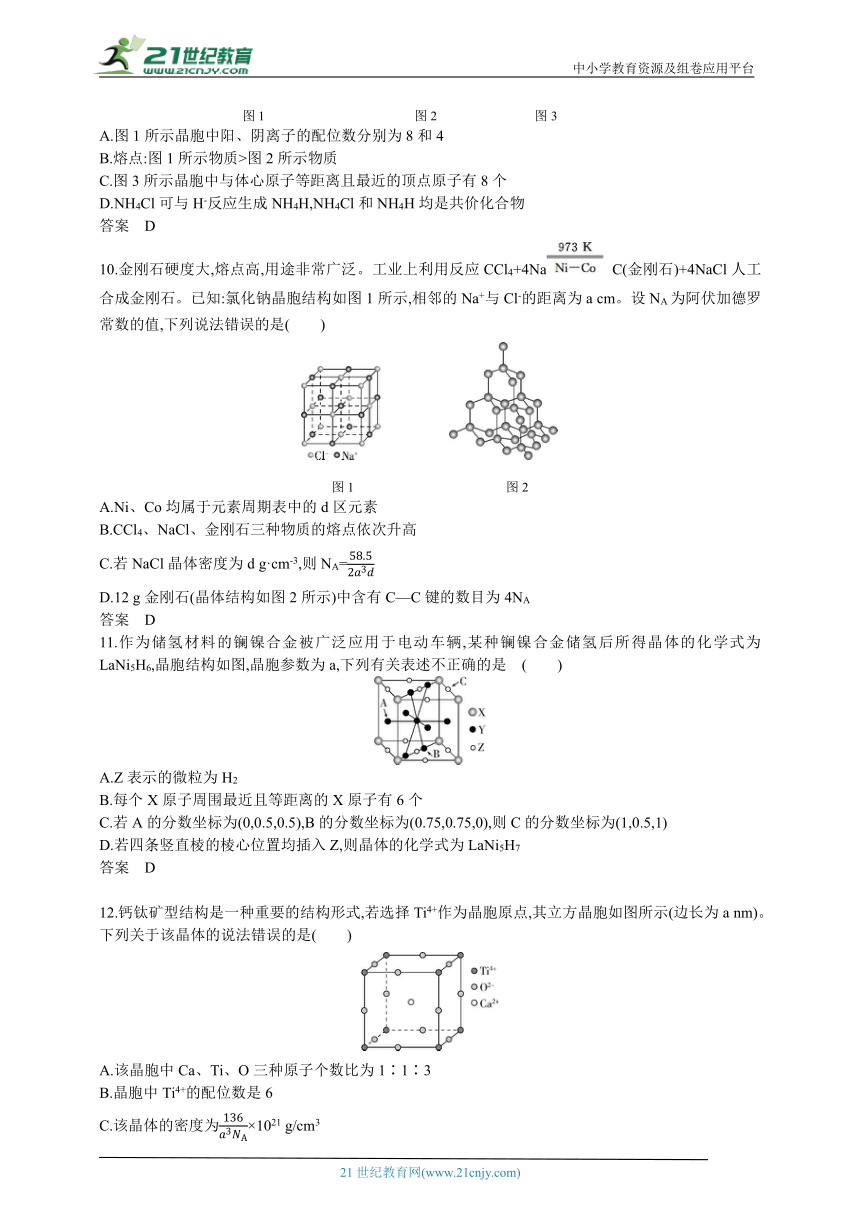
9.几种常见的晶胞或结构(CaF2、NH4Cl、AlCl3)如图。下列说法错误的是( )
图1 图2 图3
A.图1所示晶胞中阳、阴离子的配位数分别为8和4
B.熔点:图1所示物质>图2所示物质
C.图3所示晶胞中与体心原子等距离且最近的顶点原子有8个
D.NH4Cl可与H-反应生成NH4H,NH4Cl和NH4H均是共价化合物
答案 D
10.金刚石硬度大,熔点高,用途非常广泛。工业上利用反应CCl4+4Na C(金刚石)+4NaCl人工合成金刚石。已知:氯化钠晶胞结构如图1所示,相邻的Na+与Cl-的距离为a cm。设NA为阿伏加德罗常数的值,下列说法错误的是( )
图1 图2
A.Ni、Co均属于元素周期表中的d区元素
B.CCl4、NaCl、金刚石三种物质的熔点依次升高
C.若NaCl晶体密度为d g·cm-3,则NA=
D.12 g金刚石(晶体结构如图2所示)中含有C—C键的数目为4NA
答案 D
11.作为储氢材料的镧镍合金被广泛应用于电动车辆,某种镧镍合金储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图,晶胞参数为a,下列有关表述不正确的是 ( )
A.Z表示的微粒为H2
B.每个X原子周围最近且等距离的X原子有6个
C.若A的分数坐标为(0,0.5,0.5),B的分数坐标为(0.75,0.75,0),则C的分数坐标为(1,0.5,1)
D.若四条竖直棱的棱心位置均插入Z,则晶体的化学式为LaNi5H7
答案 D
12.钙钛矿型结构是一种重要的结构形式,若选择Ti4+作为晶胞原点,其立方晶胞如图所示(边长为a nm)。下列关于该晶体的说法错误的是( )
A.该晶胞中Ca、Ti、O三种原子个数比为1∶1∶3
B.晶胞中Ti4+的配位数是6
C.该晶体的密度为×1021 g/cm3
D.若选择Ca2+作为晶胞顶点画出晶胞,则晶胞中的O2-位于体心的位置
答案 D
13.一种钙镁矿的四方晶胞结构如图所示。已知该晶胞的参数为a pm、a pm、b pm,1号原子的坐标为(,,),下列说法错误的是( )
A.2号原子的坐标为(,,)
B.距离硫原子最近的硫原子数目为4
C.硫原子的配位数为4
D.该晶体的密度为 g/cm3
答案 B
14.一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为a pm、a pm和2a pm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为(,,),Ag2HgI4的摩尔质量为M g·mol-1,设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.C表示的是Ag原子
B.距离Hg最近的Ag有8个
C.m原子的分数坐标为(,,)
D.该晶体的密度为×1030 g·cm-3
答案 D
15.某水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,其立方晶胞嵌入和嵌出Na+过程中,Fe2+与Fe3+含量发生变化,其过程如图所示。下列说法错误的是( )
A.普鲁士蓝晶胞中Fe2+与Fe3+个数比为1∶2
B.格林绿晶胞中Fe3+周围等距且最近的Fe3+数为6
C.基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+
D.若普鲁士白的晶胞棱长为a pm,则其晶体的密度为×1030 g·cm-3
答案 A
16.有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。回答下列问题:
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是 。
(3)A的最简单氢化物分子的空间结构为 ,其中A原子的杂化类型是 。
(4)向E的硫酸盐溶液中通入A的气态氢化物至过量,先产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。
①该蓝色晶体的化学式为 ,加入乙醇的目的是 。
②写出该配合物中配离子的结构简式 。
答案 (2)水分子间存在氢键,氢键比范德华力更强 (3)三角锥形 sp3 (4)①[Cu(NH3)4]SO4·H2O 降低[Cu(NH3)4]SO4·H2O的溶解度 ②
17.我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展。硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为a pm、a pm、b pm。
①该晶胞沿z轴方向的投影图为 (填标号)。
②该晶体中,每个O2-周围紧邻的Bi3+共有 个。
③该晶体的密度为 g·cm-3(列出计算式,NA为阿伏加德罗常数的值)。
答案 (7)①B ②4 ③
18.氧铬酸钙是一种常见含铬矿石,其立方晶胞如图所示。
①氧铬酸钙的化学式为 。
②1个钙原子与 个氧原子最近且等距离。
③该晶体密度为 g·cm-3(列出计算式即可,已知Ca和O的最近距离为a nm,NA代表阿伏加德罗常数的值)。
①CaCrO3 ②12 ③
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024新高考化学高考专题复习
专题八 化学键 分子和晶体的结构与性质
拓展训练
1.下列说法错误的是( )
A.酸性:FCH2COOH>ClCH2COOH>CH3COOH
B.1,4-环己二烯()分子中σ键与π键的数目之比为6∶1
C.向[TiBr(H2O)5]Br2的溶液中滴加足量AgNO3溶液,只有的Br-形成AgBr沉淀
D.HF气体的摩尔质量测定值大于实际值,与HF分子间形成氢键有关
答案 B
2.下列符号表征错误的是( )
A.HC的水解方程式为HC+H2O H3O++C
B.H2分子中σ键的电子云轮廓图:
C.H2S的VSEPR模型:
D.MgCl2的形成过程:
答案 A
3. 硒(Se)是人体必需微量元素之一,已知Se与S同族,一种含硒的功能分子的合成路线如下,下列说法不正确的是 ( )
A.沸点:H2O>H2Se>H2S
B.Ⅰ中S原子的杂化轨道类型为sp3
C.Ⅱ中含有极性共价键和非极性共价键
D.Ⅲ含有的元素中O的第一电离能最大
答案 D
4.铬离子能形成多种配位化合物,下列关于说法正确的是( )
A.[Cr(NH3)3(H2O)2Cl]2+中Cr的化合价为+2
B.[Cr(NH3)3(H2O)2Cl]2+中铬离子的配位数是5
C.NH3的沸点比H2O的低
D.NH3与H2O的键角相同
答案 C
5.生物大分子血红蛋白分子链的部分结构及载氧示意如图,Fe2+与周围的6个原子均以配位键结合。CO也可与血红蛋白配位,使人体中毒。二者与血红蛋白(Hb)结合的反应可表示为①Hb+O2 Hb(O2);②Hb+CO Hb(CO)。下列说法错误的是( )
A.构成血红蛋白分子链的多肽链之间存在氢键
B.电负性:O>C,故CO中与Fe2+配位的是O
C.CO与血红素中Fe2+结合能力强于O2
D.CO中毒患者进入高压氧舱治疗,平衡①、②移动的方向相反
答案 B
6.利用超分子可分离C60和C70将C60、C70混合物加入一种空腔大小适配C60的“杯酚”中进行分离的流程如图。下列说法正确的是( )
A.一个C60分子中含有90个σ键
B.“杯酚”与C60形成氢键
C.一个C60晶胞中含有8个C60分子
D.该分离过程利用的是超分子的自组装特征
答案 A
7. (2023湛江一模,11)乙二胺()是一种重要的有机化工原料,下列关于乙二胺的说法不正确的是( )
A.易溶于水,其水溶液显碱性
B.H—C—H键角大于H—N—H键角
C.第二周期中第一电离能大于C小于N的元素只有一种
D.[Cu(H2NCH2CH2NH2)2]2+中,提供孤电子对形成配位键的是Cu2+
答案 D
8.连花清瘟胶囊的有效成分大黄素的结构如图所示,该成分有很强的抗炎抗菌药理活性,基于结构视角,下列说法正确的是( )
A.该分子中碳原子的杂化类型均为sp2
B.分子中所含元素的电负性O>C>H
C.基态氧原子核外电子的空间运动状态有8种
D.该分子为非极性分子
答案 B
9.几种常见的晶胞或结构(CaF2、NH4Cl、AlCl3)如图。下列说法错误的是( )
图1 图2 图3
A.图1所示晶胞中阳、阴离子的配位数分别为8和4
B.熔点:图1所示物质>图2所示物质
C.图3所示晶胞中与体心原子等距离且最近的顶点原子有8个
D.NH4Cl可与H-反应生成NH4H,NH4Cl和NH4H均是共价化合物
答案 D
10.金刚石硬度大,熔点高,用途非常广泛。工业上利用反应CCl4+4Na C(金刚石)+4NaCl人工合成金刚石。已知:氯化钠晶胞结构如图1所示,相邻的Na+与Cl-的距离为a cm。设NA为阿伏加德罗常数的值,下列说法错误的是( )
图1 图2
A.Ni、Co均属于元素周期表中的d区元素
B.CCl4、NaCl、金刚石三种物质的熔点依次升高
C.若NaCl晶体密度为d g·cm-3,则NA=
D.12 g金刚石(晶体结构如图2所示)中含有C—C键的数目为4NA
答案 D
11.作为储氢材料的镧镍合金被广泛应用于电动车辆,某种镧镍合金储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图,晶胞参数为a,下列有关表述不正确的是 ( )
A.Z表示的微粒为H2
B.每个X原子周围最近且等距离的X原子有6个
C.若A的分数坐标为(0,0.5,0.5),B的分数坐标为(0.75,0.75,0),则C的分数坐标为(1,0.5,1)
D.若四条竖直棱的棱心位置均插入Z,则晶体的化学式为LaNi5H7
答案 D
12.钙钛矿型结构是一种重要的结构形式,若选择Ti4+作为晶胞原点,其立方晶胞如图所示(边长为a nm)。下列关于该晶体的说法错误的是( )
A.该晶胞中Ca、Ti、O三种原子个数比为1∶1∶3
B.晶胞中Ti4+的配位数是6
C.该晶体的密度为×1021 g/cm3
D.若选择Ca2+作为晶胞顶点画出晶胞,则晶胞中的O2-位于体心的位置
答案 D
13.一种钙镁矿的四方晶胞结构如图所示。已知该晶胞的参数为a pm、a pm、b pm,1号原子的坐标为(,,),下列说法错误的是( )
A.2号原子的坐标为(,,)
B.距离硫原子最近的硫原子数目为4
C.硫原子的配位数为4
D.该晶体的密度为 g/cm3
答案 B
14.一种Ag2HgI4固体导电材料为四方晶系,其晶胞参数为a pm、a pm和2a pm,晶胞沿x、y、z的方向投影(如图所示),A、B、C表示三种不同原子的投影,标记为n的原子分数坐标为(,,),Ag2HgI4的摩尔质量为M g·mol-1,设NA为阿伏加德罗常数的值。下列说法错误的是( )
A.C表示的是Ag原子
B.距离Hg最近的Ag有8个
C.m原子的分数坐标为(,,)
D.该晶体的密度为×1030 g·cm-3
答案 D
15.某水性钠离子电池电极材料由Na+、Fe2+、Fe3+、CN-组成,其立方晶胞嵌入和嵌出Na+过程中,Fe2+与Fe3+含量发生变化,其过程如图所示。下列说法错误的是( )
A.普鲁士蓝晶胞中Fe2+与Fe3+个数比为1∶2
B.格林绿晶胞中Fe3+周围等距且最近的Fe3+数为6
C.基态Fe原子的价电子排布式为3d64s2,失去4s电子转化为Fe2+
D.若普鲁士白的晶胞棱长为a pm,则其晶体的密度为×1030 g·cm-3
答案 A
16.有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30)。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2。回答下列问题:
(2)B元素的氢化物的沸点是同族元素氢化物中最高的,原因是 。
(3)A的最简单氢化物分子的空间结构为 ,其中A原子的杂化类型是 。
(4)向E的硫酸盐溶液中通入A的气态氢化物至过量,先产生蓝色沉淀,随后沉淀溶解得到深蓝色溶液,向溶液中加入适量乙醇,析出蓝色晶体。
①该蓝色晶体的化学式为 ,加入乙醇的目的是 。
②写出该配合物中配离子的结构简式 。
答案 (2)水分子间存在氢键,氢键比范德华力更强 (3)三角锥形 sp3 (4)①[Cu(NH3)4]SO4·H2O 降低[Cu(NH3)4]SO4·H2O的溶解度 ②
17.我国科学家在新型二维半导体芯片材料——硒氧化铋的研究中取得突破性进展。硒氧化铋的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞参数为a pm、a pm、b pm。
①该晶胞沿z轴方向的投影图为 (填标号)。
②该晶体中,每个O2-周围紧邻的Bi3+共有 个。
③该晶体的密度为 g·cm-3(列出计算式,NA为阿伏加德罗常数的值)。
答案 (7)①B ②4 ③
18.氧铬酸钙是一种常见含铬矿石,其立方晶胞如图所示。
①氧铬酸钙的化学式为 。
②1个钙原子与 个氧原子最近且等距离。
③该晶体密度为 g·cm-3(列出计算式即可,已知Ca和O的最近距离为a nm,NA代表阿伏加德罗常数的值)。
①CaCrO3 ②12 ③
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
