2024新高考化学高考专题复习--专题六非金属及其化合物(含答案)
文档属性
| 名称 | 2024新高考化学高考专题复习--专题六非金属及其化合物(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-28 09:59:59 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024新高考化学高考专题复习
专题六 非金属及其化合物
拓展训练
1.下列说法错误的是( )
A.石墨烯液冷散热技术是华为公司首创,石墨烯是一种有机高分子材料
B.“天和”核心舱腔体使用的材料中有氮化硼陶瓷,它属于无机非金属材料
C.北京冬奥会采用光伏发电有利于实现“碳中和”
D.疫苗一般冷藏存放以避免蛋白质变性
答案 A
2.下列有关材料的结构或性质与用途不具有对应关系的是( )
A.硅橡胶具有无毒、无味、耐高温的性质,用作压力锅的密封圈
B.分子筛(铝硅酸盐)具有微孔结构,用作计算机芯片
C.Ti-Fe合金储氢量大、吸放氢速率快,用于氢燃料汽车
D.高温结构陶瓷具有耐高温、耐氧化、耐磨蚀的特性,可用于火箭发动机
答案 B
3.下列生活应用或生产活动,没有运用相应化学知识的是( )
选项 生活应用或生产活动 化学知识
A 用SO2漂白纸张 SO2具有氧化性
B 用铝槽车运输浓硝酸 Al在冷的浓硝酸中发生钝化
C 用生石灰作食品干燥剂 CaO易与水反应
D 用Si制作芯片 Si是良好的半导体材料
4.三氟化氯(ClF3)可应用于航天工业,是一种很强的氧化剂和氟化剂,它能与大多数有机和无机材料反应,可以使许多材料不接触火源就燃烧。下列分析错误的是 ( )
A.可以代替H2O2充当火箭推进剂中的氧化剂
B.能与一些金属反应生成氯化物和氟化物
C.三氟化氯可用于清洁化学气相沉积的反应舱附着的半导体物质
D.ClF3与水按物质的量之比为1∶2反应生成两种强酸
答案 D
5.四氯化钛是无色液体,沸点为136 ℃,极易水解。在650~850 ℃高温下,将Cl2通入TiO2和炭粉的混合物可得到TiCl4和一种有毒气体。实验室制备TiCl4的部分装置如图所示。下列说法正确的是 ( )
A.装置A同样适合实验室制备氨气
B.装置B中试剂是饱和食盐水,其作用是除HCl气体
C.装置C中发生反应的化学方程式为2Cl2+C+TiO2TiCl4+CO2
D.装置D中的直形冷凝管可更换为球形冷凝管
答案 A
6.物质分类和转化是学习化学的重要思想方法。部分含氯物质的分类与相应化合价关系如图所示,下列推断不合理的是( )
A.①的水溶液能与④反应生成②
B.用③代替②进行自来水消毒更安全
C.②与SO2按物质的量比1∶1通入水中,再滴入品红溶液,溶液呈无色
D.由ClONO2在图中的位置可推测其可能具有强氧化性,能水解生成两种酸
答案 C
7.根据下列实验操作和现象,所得到的实验结论正确的是( )
选项 实验操作和现象 实验结论
A 将浓硫酸滴到蔗糖表面,固体变黑膨胀 浓硫酸具有吸水性和强氧化性
B 向NaI溶液中滴加少量氯水和CCl4,振荡、静置,下层溶液显紫色 还原性:I->Cl-
C 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体出现 NH4Cl固体可以升华
D 向某溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色 该溶液中一定含有Fe2+
8.部分含硫物质的类别与相应化合价及部分物质间转化关系如图。下列说法错误的是( )
A.a溶液放置在空气中一段时间会出现浑浊现象
B.空气中燃烧b可以得到大量的d
C.e的浓溶液可以用铁槽车运输是利用其强氧化性
D.b附着在试管壁上可以用二硫化碳或热的浓NaOH溶液洗涤
答案 B
9.某化学兴趣小组设计一种从硫矿石(主要成分为硫黄及少量FeS2)中提取硫黄的方法如下:
硫矿石 混合物2 纯硫
查阅资料:S的熔点为115.2 ℃;CS2的沸点为46.2 ℃。
下列说法错误的是( )
A.单质硫是分子晶体
B.过程①中CS2可用乙醇代替
C.过程③的目的是使CS2挥发,同时使硫从水中析出
D.将趁热过滤所得滤渣煅烧:4FeS2+11O2 2Fe2O3+8SO2,反应中每生成1 mol SO2,转移电子的物质的量为5.5 mol
答案 B
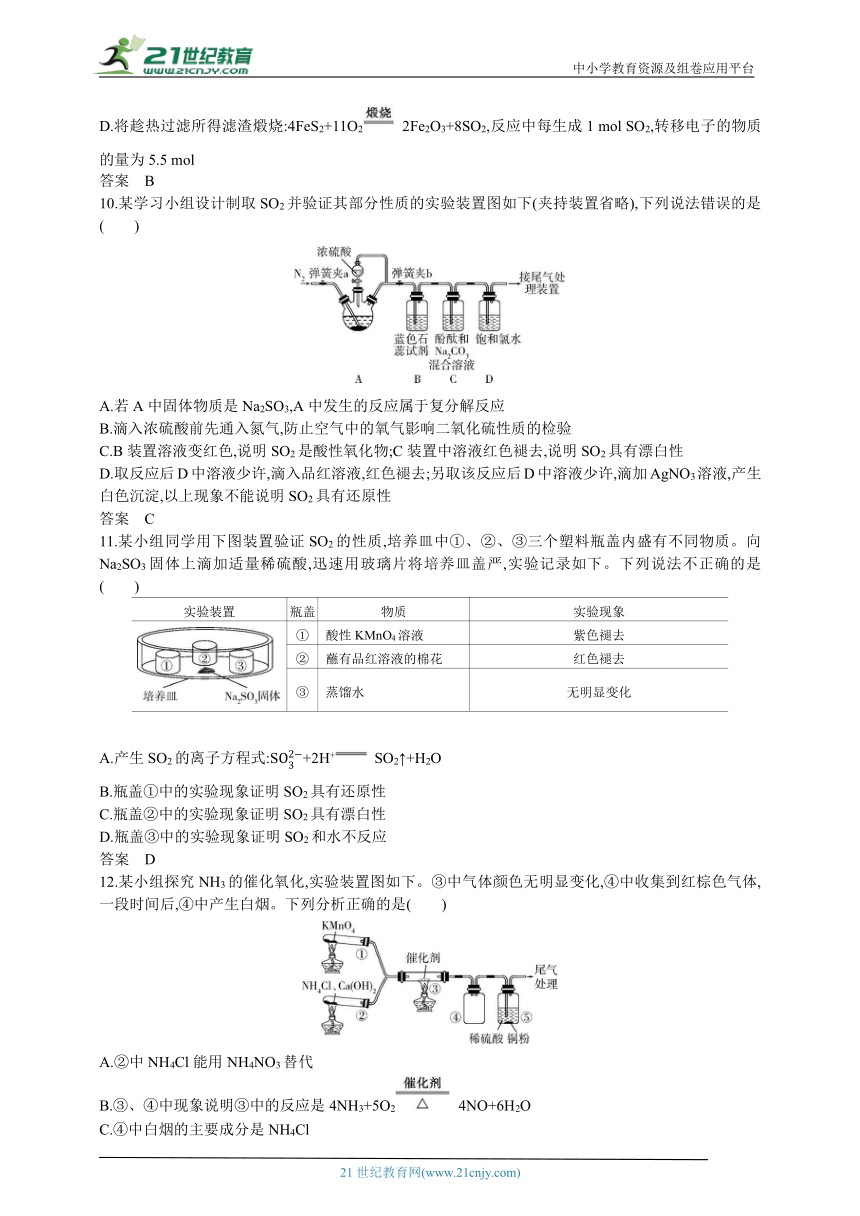
10.某学习小组设计制取SO2并验证其部分性质的实验装置图如下(夹持装置省略),下列说法错误的是( )
A.若A中固体物质是Na2SO3,A中发生的反应属于复分解反应
B.滴入浓硫酸前先通入氮气,防止空气中的氧气影响二氧化硫性质的检验
C.B装置溶液变红色,说明SO2是酸性氧化物;C装置中溶液红色褪去,说明SO2具有漂白性
D.取反应后D中溶液少许,滴入品红溶液,红色褪去;另取该反应后D中溶液少许,滴加AgNO3溶液,产生白色沉淀,以上现象不能说明SO2具有还原性
答案 C
11.某小组同学用下图装置验证SO2的性质,培养皿中①、②、③三个塑料瓶盖内盛有不同物质。向Na2SO3固体上滴加适量稀硫酸,迅速用玻璃片将培养皿盖严,实验记录如下。下列说法不正确的是( )
实验装置 瓶盖 物质 实验现象
① 酸性KMnO4溶液 紫色褪去
② 蘸有品红溶液的棉花 红色褪去
③ 蒸馏水 无明显变化
A.产生SO2的离子方程式:S+2H+ SO2↑+H2O
B.瓶盖①中的实验现象证明SO2具有还原性
C.瓶盖②中的实验现象证明SO2具有漂白性
D.瓶盖③中的实验现象证明SO2和水不反应
答案 D
12.某小组探究NH3的催化氧化,实验装置图如下。③中气体颜色无明显变化,④中收集到红棕色气体,一段时间后,④中产生白烟。下列分析正确的是( )
A.②中NH4Cl能用NH4NO3替代
B.③、④中现象说明③中的反应是4NH3+5O2 4NO+6H2O
C.④中白烟的主要成分是NH4Cl
D.反应结束后若⑤中溶液变蓝,则溶液中一定只含有Cu(NO3)2
答案 B
13.联氨(N2H4)可用于处理水中的溶解氧,其反应机理如下图所示。
下列说法错误的是( )
A.N2H4分子的共价键只有s-p σ键
B.N2H4具有还原性,在一定条件下可被O2氧化
C.过程②发生的是非氧化还原反应
D.③中发生反应:4[Cu(NH3)2]++O2+8NH3·H2O 4[Cu(NH3)4]2++4OH-+6H2O
答案 A
14.陶土网是由两片铁丝网夹着一张浸泡过陶土水后晾干的棉布制成,其功能和石棉网一样,但安全性更高,对人体的危害性更小。下列说法错误的是( )
A.陶土和石棉都是硅酸盐材料
B.陶土性质稳定,在高温下不易分解
C.蒸发实验中,蒸发皿需垫上陶土网再加热
D.一种石棉化学式为Mg6Si4O10(OH)8,其氧化物形式可写为3MgO·2SiO2·2H2O
答案 C
15.中科院发现深海处在微生物作用下的含硫物质的变化过程如图所示(已略去部分不含硫物质)。有关转化过程说法错误的是( )
A.CN-中含有的σ键与π键的数目之比为1∶2
B.x=21,y=24
C.SCN-既被氧化又被还原
D.理论上每产生1 mol HS-,转移44 mol e-
答案 D
16.利用空气催化氧化法除掉电石渣浆(含CaO)上层清液中的S2-并制取石膏(CaSO4·2H2O)的过程如下:
下列说法错误的是( )
A.CaSO4·2H2O属于盐类和纯净物
B.过程Ⅰ中氧化剂与还原剂的物质的量之比为1∶2
C.过程Ⅱ中,反应的离子方程式为4Mn+2S2-+9H2O S2+4Mn(OH)2↓+10OH-
D.将10 L上层清液中的S2-(S2-浓度为480 mg·L-1)转化为S理论上共需要0.15 mol O2
答案 D
17.从海水中提取溴的工业流程如图,下列说法正确的是( )
A.海水晒盐的原理是氯化钠的溶解度随温度的变化较大
B.氯碱工业中的Cl2从电解池的阴极室产生
C.步骤Ⅱ中溴与碳酸钠反应中氧化剂与还原剂物质的量之比为1∶1
D.实验室分离溴还可以用溶剂萃取法,四氯化碳可用作溴的萃取剂
答案 D
18.二氧化硫广泛用于葡萄酒的酿造工艺中,具有抗氧化和杀菌的作用。
(1)实验室常用亚硫酸钠固体和浓硫酸反应制备SO2,其化学方程式为
。
(2)如图是探究二氧化硫部分性质的实验装置:
A装置中的现象证明SO2有 (填序号),B装置中的现象证明SO2有 (填序号)。
a.漂白性 b.酸性氧化物性质
c.还原性 d.氧化性
(3)一段时间后C装置中会出现白色沉淀,为确定其成分,某学习小组进行了以下实验探究。
①查阅资料:25 ℃时,H2SO3的电离常数=1.54×10-2,=1.02×10-7;Ksp(BaSO3)=5.3×10-7;饱和亚硫酸溶液的pH约为1,其中c(H2SO3)约为1.25 mol/L。
小组同学通过计算排除了白色沉淀为BaSO3的可能性,计算过程的关键数据如下:
饱和亚硫酸溶液中c(S)= (保留2位有效数字);Q(BaSO3) Ksp(BaSO3)(填“>”“<”或“=”)。
②判断并检验,确定该沉淀为BaSO4。
③为进一步探究C装置的溶液中什么微粒将SO2氧化,小组同学提出以下猜想。
猜想a:溶液中有氧气,将SO2氧化,继而生成BaSO4。
猜想b: (用离子方程式表示)。
设计实验,验证猜想。
实验过程:
编号 实验1 实验2 实验3 实验4
步骤 在a烧杯中加入煮沸的25 mL 0.1 mol/L BaCl2溶液,再加入食用油覆盖,冷却至室温 在b烧杯中加入煮沸的25 mL 0.1 mol/L Ba(NO3)2溶液,再加入食用油覆盖,冷却至室温 在c烧杯中加入未煮沸的25 mL 0.1 mol/L BaCl2溶液 在d烧杯中加入未煮沸的25 mL 0.1 mol/L Ba(NO3)2溶液
在a、b、c、d四个烧杯中均放入pH传感器,然后通入纯净的SO2气体
实验1、实验2中煮沸、油覆的目的是 。
④实验数据如下:
小组同学通过对比实验1、2、4三组实验的pH变化图像,得出结论: 。综合以上pH变化数据,你还可得出什么结论 。
4.答案 (1)Na2SO3+H2SO4(浓) Na2SO4+SO2↑+H2O
(2)b c (3)①2.0×10-7 mol/L <
③3SO2+2N+2H2O 3S+2NO+4H+ 防止氧气干扰实验
④O2和N都能氧化SO2,从而生成BaSO4 O2的氧化作用是生成BaSO4的主要因素
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024新高考化学高考专题复习
专题六 非金属及其化合物
拓展训练
1.下列说法错误的是( )
A.石墨烯液冷散热技术是华为公司首创,石墨烯是一种有机高分子材料
B.“天和”核心舱腔体使用的材料中有氮化硼陶瓷,它属于无机非金属材料
C.北京冬奥会采用光伏发电有利于实现“碳中和”
D.疫苗一般冷藏存放以避免蛋白质变性
答案 A
2.下列有关材料的结构或性质与用途不具有对应关系的是( )
A.硅橡胶具有无毒、无味、耐高温的性质,用作压力锅的密封圈
B.分子筛(铝硅酸盐)具有微孔结构,用作计算机芯片
C.Ti-Fe合金储氢量大、吸放氢速率快,用于氢燃料汽车
D.高温结构陶瓷具有耐高温、耐氧化、耐磨蚀的特性,可用于火箭发动机
答案 B
3.下列生活应用或生产活动,没有运用相应化学知识的是( )
选项 生活应用或生产活动 化学知识
A 用SO2漂白纸张 SO2具有氧化性
B 用铝槽车运输浓硝酸 Al在冷的浓硝酸中发生钝化
C 用生石灰作食品干燥剂 CaO易与水反应
D 用Si制作芯片 Si是良好的半导体材料
4.三氟化氯(ClF3)可应用于航天工业,是一种很强的氧化剂和氟化剂,它能与大多数有机和无机材料反应,可以使许多材料不接触火源就燃烧。下列分析错误的是 ( )
A.可以代替H2O2充当火箭推进剂中的氧化剂
B.能与一些金属反应生成氯化物和氟化物
C.三氟化氯可用于清洁化学气相沉积的反应舱附着的半导体物质
D.ClF3与水按物质的量之比为1∶2反应生成两种强酸
答案 D
5.四氯化钛是无色液体,沸点为136 ℃,极易水解。在650~850 ℃高温下,将Cl2通入TiO2和炭粉的混合物可得到TiCl4和一种有毒气体。实验室制备TiCl4的部分装置如图所示。下列说法正确的是 ( )
A.装置A同样适合实验室制备氨气
B.装置B中试剂是饱和食盐水,其作用是除HCl气体
C.装置C中发生反应的化学方程式为2Cl2+C+TiO2TiCl4+CO2
D.装置D中的直形冷凝管可更换为球形冷凝管
答案 A
6.物质分类和转化是学习化学的重要思想方法。部分含氯物质的分类与相应化合价关系如图所示,下列推断不合理的是( )
A.①的水溶液能与④反应生成②
B.用③代替②进行自来水消毒更安全
C.②与SO2按物质的量比1∶1通入水中,再滴入品红溶液,溶液呈无色
D.由ClONO2在图中的位置可推测其可能具有强氧化性,能水解生成两种酸
答案 C
7.根据下列实验操作和现象,所得到的实验结论正确的是( )
选项 实验操作和现象 实验结论
A 将浓硫酸滴到蔗糖表面,固体变黑膨胀 浓硫酸具有吸水性和强氧化性
B 向NaI溶液中滴加少量氯水和CCl4,振荡、静置,下层溶液显紫色 还原性:I->Cl-
C 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体出现 NH4Cl固体可以升华
D 向某溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色 该溶液中一定含有Fe2+
8.部分含硫物质的类别与相应化合价及部分物质间转化关系如图。下列说法错误的是( )
A.a溶液放置在空气中一段时间会出现浑浊现象
B.空气中燃烧b可以得到大量的d
C.e的浓溶液可以用铁槽车运输是利用其强氧化性
D.b附着在试管壁上可以用二硫化碳或热的浓NaOH溶液洗涤
答案 B
9.某化学兴趣小组设计一种从硫矿石(主要成分为硫黄及少量FeS2)中提取硫黄的方法如下:
硫矿石 混合物2 纯硫
查阅资料:S的熔点为115.2 ℃;CS2的沸点为46.2 ℃。
下列说法错误的是( )
A.单质硫是分子晶体
B.过程①中CS2可用乙醇代替
C.过程③的目的是使CS2挥发,同时使硫从水中析出
D.将趁热过滤所得滤渣煅烧:4FeS2+11O2 2Fe2O3+8SO2,反应中每生成1 mol SO2,转移电子的物质的量为5.5 mol
答案 B
10.某学习小组设计制取SO2并验证其部分性质的实验装置图如下(夹持装置省略),下列说法错误的是( )
A.若A中固体物质是Na2SO3,A中发生的反应属于复分解反应
B.滴入浓硫酸前先通入氮气,防止空气中的氧气影响二氧化硫性质的检验
C.B装置溶液变红色,说明SO2是酸性氧化物;C装置中溶液红色褪去,说明SO2具有漂白性
D.取反应后D中溶液少许,滴入品红溶液,红色褪去;另取该反应后D中溶液少许,滴加AgNO3溶液,产生白色沉淀,以上现象不能说明SO2具有还原性
答案 C
11.某小组同学用下图装置验证SO2的性质,培养皿中①、②、③三个塑料瓶盖内盛有不同物质。向Na2SO3固体上滴加适量稀硫酸,迅速用玻璃片将培养皿盖严,实验记录如下。下列说法不正确的是( )
实验装置 瓶盖 物质 实验现象
① 酸性KMnO4溶液 紫色褪去
② 蘸有品红溶液的棉花 红色褪去
③ 蒸馏水 无明显变化
A.产生SO2的离子方程式:S+2H+ SO2↑+H2O
B.瓶盖①中的实验现象证明SO2具有还原性
C.瓶盖②中的实验现象证明SO2具有漂白性
D.瓶盖③中的实验现象证明SO2和水不反应
答案 D
12.某小组探究NH3的催化氧化,实验装置图如下。③中气体颜色无明显变化,④中收集到红棕色气体,一段时间后,④中产生白烟。下列分析正确的是( )
A.②中NH4Cl能用NH4NO3替代
B.③、④中现象说明③中的反应是4NH3+5O2 4NO+6H2O
C.④中白烟的主要成分是NH4Cl
D.反应结束后若⑤中溶液变蓝,则溶液中一定只含有Cu(NO3)2
答案 B
13.联氨(N2H4)可用于处理水中的溶解氧,其反应机理如下图所示。
下列说法错误的是( )
A.N2H4分子的共价键只有s-p σ键
B.N2H4具有还原性,在一定条件下可被O2氧化
C.过程②发生的是非氧化还原反应
D.③中发生反应:4[Cu(NH3)2]++O2+8NH3·H2O 4[Cu(NH3)4]2++4OH-+6H2O
答案 A
14.陶土网是由两片铁丝网夹着一张浸泡过陶土水后晾干的棉布制成,其功能和石棉网一样,但安全性更高,对人体的危害性更小。下列说法错误的是( )
A.陶土和石棉都是硅酸盐材料
B.陶土性质稳定,在高温下不易分解
C.蒸发实验中,蒸发皿需垫上陶土网再加热
D.一种石棉化学式为Mg6Si4O10(OH)8,其氧化物形式可写为3MgO·2SiO2·2H2O
答案 C
15.中科院发现深海处在微生物作用下的含硫物质的变化过程如图所示(已略去部分不含硫物质)。有关转化过程说法错误的是( )
A.CN-中含有的σ键与π键的数目之比为1∶2
B.x=21,y=24
C.SCN-既被氧化又被还原
D.理论上每产生1 mol HS-,转移44 mol e-
答案 D
16.利用空气催化氧化法除掉电石渣浆(含CaO)上层清液中的S2-并制取石膏(CaSO4·2H2O)的过程如下:
下列说法错误的是( )
A.CaSO4·2H2O属于盐类和纯净物
B.过程Ⅰ中氧化剂与还原剂的物质的量之比为1∶2
C.过程Ⅱ中,反应的离子方程式为4Mn+2S2-+9H2O S2+4Mn(OH)2↓+10OH-
D.将10 L上层清液中的S2-(S2-浓度为480 mg·L-1)转化为S理论上共需要0.15 mol O2
答案 D
17.从海水中提取溴的工业流程如图,下列说法正确的是( )
A.海水晒盐的原理是氯化钠的溶解度随温度的变化较大
B.氯碱工业中的Cl2从电解池的阴极室产生
C.步骤Ⅱ中溴与碳酸钠反应中氧化剂与还原剂物质的量之比为1∶1
D.实验室分离溴还可以用溶剂萃取法,四氯化碳可用作溴的萃取剂
答案 D
18.二氧化硫广泛用于葡萄酒的酿造工艺中,具有抗氧化和杀菌的作用。
(1)实验室常用亚硫酸钠固体和浓硫酸反应制备SO2,其化学方程式为
。
(2)如图是探究二氧化硫部分性质的实验装置:
A装置中的现象证明SO2有 (填序号),B装置中的现象证明SO2有 (填序号)。
a.漂白性 b.酸性氧化物性质
c.还原性 d.氧化性
(3)一段时间后C装置中会出现白色沉淀,为确定其成分,某学习小组进行了以下实验探究。
①查阅资料:25 ℃时,H2SO3的电离常数=1.54×10-2,=1.02×10-7;Ksp(BaSO3)=5.3×10-7;饱和亚硫酸溶液的pH约为1,其中c(H2SO3)约为1.25 mol/L。
小组同学通过计算排除了白色沉淀为BaSO3的可能性,计算过程的关键数据如下:
饱和亚硫酸溶液中c(S)= (保留2位有效数字);Q(BaSO3) Ksp(BaSO3)(填“>”“<”或“=”)。
②判断并检验,确定该沉淀为BaSO4。
③为进一步探究C装置的溶液中什么微粒将SO2氧化,小组同学提出以下猜想。
猜想a:溶液中有氧气,将SO2氧化,继而生成BaSO4。
猜想b: (用离子方程式表示)。
设计实验,验证猜想。
实验过程:
编号 实验1 实验2 实验3 实验4
步骤 在a烧杯中加入煮沸的25 mL 0.1 mol/L BaCl2溶液,再加入食用油覆盖,冷却至室温 在b烧杯中加入煮沸的25 mL 0.1 mol/L Ba(NO3)2溶液,再加入食用油覆盖,冷却至室温 在c烧杯中加入未煮沸的25 mL 0.1 mol/L BaCl2溶液 在d烧杯中加入未煮沸的25 mL 0.1 mol/L Ba(NO3)2溶液
在a、b、c、d四个烧杯中均放入pH传感器,然后通入纯净的SO2气体
实验1、实验2中煮沸、油覆的目的是 。
④实验数据如下:
小组同学通过对比实验1、2、4三组实验的pH变化图像,得出结论: 。综合以上pH变化数据,你还可得出什么结论 。
4.答案 (1)Na2SO3+H2SO4(浓) Na2SO4+SO2↑+H2O
(2)b c (3)①2.0×10-7 mol/L <
③3SO2+2N+2H2O 3S+2NO+4H+ 防止氧气干扰实验
④O2和N都能氧化SO2,从而生成BaSO4 O2的氧化作用是生成BaSO4的主要因素
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
