2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第一章 化学反应与能量转化 跟踪选题(含答案)
文档属性
| 名称 | 2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第一章 化学反应与能量转化 跟踪选题(含答案) | 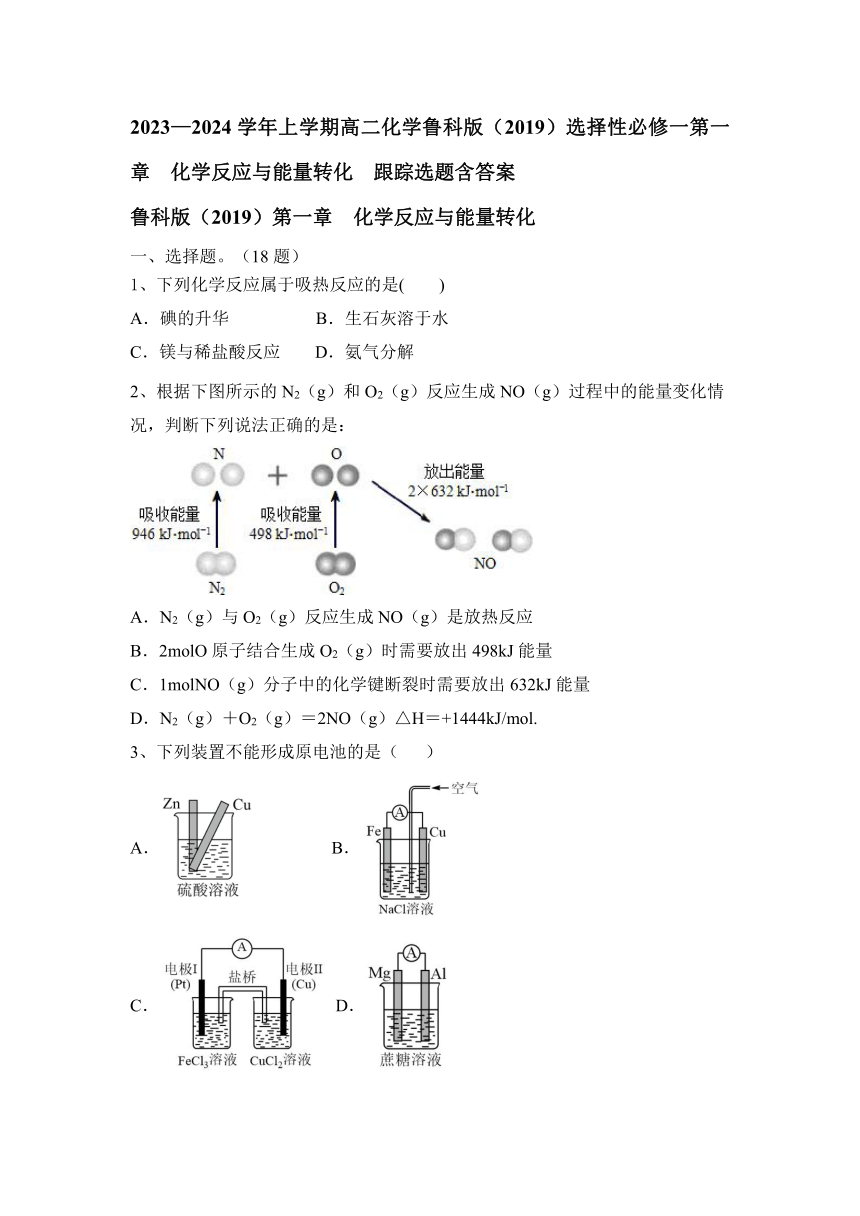 | |
| 格式 | doc | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-28 08:42:43 | ||
图片预览




文档简介
2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第一章 化学反应与能量转化 跟踪选题含答案
鲁科版(2019)第一章 化学反应与能量转化
一、选择题。(18题)
1、下列化学反应属于吸热反应的是( )
A.碘的升华 B.生石灰溶于水
C.镁与稀盐酸反应 D.氨气分解
2、根据下图所示的N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是:
A.N2(g)与O2(g)反应生成NO(g)是放热反应
B.2molO原子结合生成O2(g)时需要放出498kJ能量
C.1molNO(g)分子中的化学键断裂时需要放出632kJ能量
D.N2(g)+O2(g)=2NO(g)△H=+1444kJ/mol.
3、下列装置不能形成原电池的是( )
A. B.
C. D.
4、锌-空气燃料电池有比能量高、容量大、使用寿命长等优点,可用作电动车动力电源,电池的电解质溶液为KOH溶液,放电时发生反应:2Zn+O2+4OH-+2H2O=2[Zn(OH)4]2-。下列说法正确的是( )
A.放电时,负极反应为Zn-2e-=Zn2+
B.充电时,电解质溶液中c(OH)-逐渐减小
C.放电时,当0.1 mol Zn完全溶解时,流经电解质溶液的电子个数约为1.204×1023
D.采用多孔炭的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
5、(双选)在一定温度下,用铂电极电解饱和硫酸钠溶液,对电解质溶液的判断正确的是( )
A.有晶体析出 B.浓度变大 C.浓度变小 D.pH不变
6、下列关于用惰性电极电解NaCl溶液的叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若向阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若向阴极附近的溶液中滴入酚酞溶液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
7、在潮湿的空气中,钢铁很快发生电化学腐蚀,在此过程中一定不存在的电极反应是( )
A.2H++2e-=H2↑ B.Fe-3e-=Fe3+
C.Fe-2e-=Fe2+ D.O2+2H2O+4e-=4OH-
8、下列事实能用勒夏特列原理解释的是( )
A. 铜与浓硫酸反应需要加热
B. 加热蒸干FeCl3溶液最终得到Fe(OH)3
C. 使用催化剂提高合成氨的生产效率
D. 钢管与铜管堆放一处,钢管更易腐蚀
9、下列有关铝热反应的说法中,不正确的是( )
A.利用了铝的还原性
B.可用于焊接铁轨,反应为 2Al + Fe2O3Al2O3 + 2Fe
C.可用于冶炼某些高熔点金属
D.能量变化可用如图表示:
10、某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为2H2+O2=2H2O,下列有关说法正确的是( )
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-=4OH-
C.每转移0.1mol电子,便消耗1.12L的O2
D.H+由a极通过固体酸电解质传递到b极
11、硼酸为一元弱酸,已知与足量溶液反应的离子方程式为可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是( )
A.当电路中通过电子时,可得到
B.将电源的正、负极反接,工作原理不变
C.阴极室的电极反应式为
D.穿过阴膜进入阴极室,穿过阳膜进入产品室
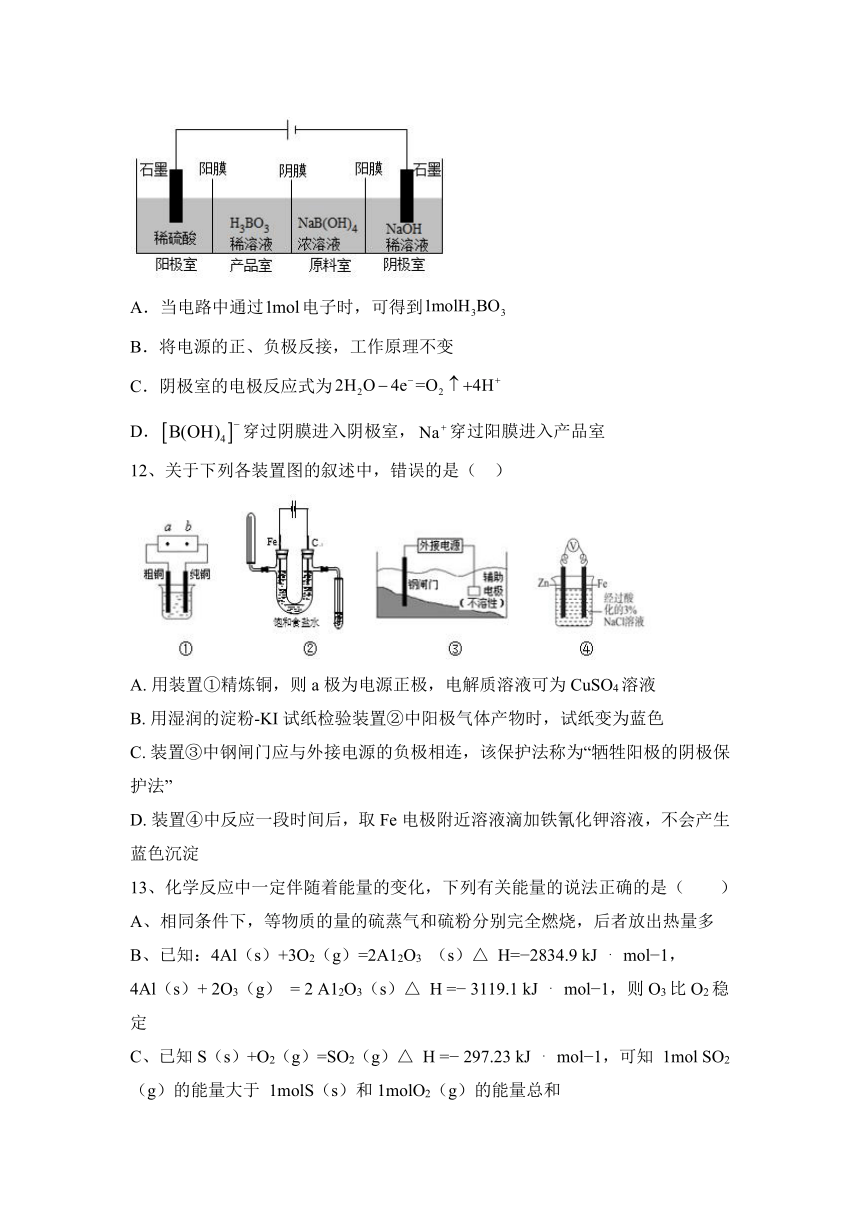
12、关于下列各装置图的叙述中,错误的是( )
A. 用装置①精炼铜,则a极为电源正极,电解质溶液可为CuSO4溶液
B. 用湿润的淀粉-KI试纸检验装置②中阳极气体产物时,试纸变为蓝色
C. 装置③中钢闸门应与外接电源的负极相连,该保护法称为“牺牲阳极的阴极保护法”
D. 装置④中反应一段时间后,取Fe电极附近溶液滴加铁氰化钾溶液,不会产生蓝色沉淀
13、化学反应中一定伴随着能量的变化,下列有关能量的说法正确的是( )
A、相同条件下,等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多
B、已知:4Al(s)+3O2(g)=2A12O3 (s)△ H= 2834.9 kJ mol 1,
4Al(s)+ 2O3(g) = 2 A12O3(s)△ H = 3119.1 kJ mol 1,则O3比O2稳定
C、已知S(s)+O2(g)=SO2(g)△ H = 297.23 kJ mol 1,可知 1mol SO2(g)的能量大于 1molS(s)和1molO2(g)的能量总和
D、在稀水溶液中 H+(aq)+OH (aq)=H2O(l)△H = 57.3 kJ mol 1,将含 0.5mol H2SO4的浓硫酸与含 1 mol NaOH 的溶液混合时,放出的热量大于 57.3 kJ
14、下列说法正确的是( )
A.酸性锌锰干电池是一次电池,碱性锌锰干电池是二次电池
B.铅蓄电池是一次电池,锂离子电池是二次电池
C.燃料电池的能量转化率可达100%
D.废旧电池集中处理的主要目的是防止电池中的重金属污染水源及土壤
15、只在强碱性条件下稳定,易被还原。以溶液为电解质,制备的原理如图所示,在制备过程中需防止的渗透。下列说法不正确的是( )
A.电解过程中,需将阴极产生的气体及时排出
B.铁电极上的主要反应为
C.电解一段时间后,电极附近溶液的减小
D.图中的离子交换膜为阴离子交换膜
16、宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法错误的是( )
A. 青铜器发生电化学腐蚀,图中c作负极
B. 潮湿环境中Cl-浓度大有利于多孔粉状锈的生成
C. 若生成0.2 mol Cu2(OH)3Cl,则消耗的O2体积为4.48L
D. 环境中的Cl 与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH +Cl =Cu2 (OH)3Cl↓
17、已知:完全燃烧生成一氧化碳放出的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是( )
A.碳的燃烧热为
B.分解生成时放出的热量
C.反应的为
D.足量炭粉与反应生成的热化学方程式为
18、利用微生物电池原理可处理某些污水,其原理是通过微生物的作用,将废水中的有机物氧化,使其中的化学能转化为电能。图是处理含乙酸废水的电池装置原理图,a为石墨电极,b为铂碳电极。
该装置工作时,下列叙述错误的是( )
A.电池总反应:
B.负极的电极反应:
C.质子通过质子交换膜从甲室进入乙室
D.b电极为电源正极,c口流出的水中含大量
二、填空题。(2题)
19、写出或完成下列热化学方程式。
(1)已知:①2Fe(s)+O2(g)=2 FeO(s) △H1=﹣544.0kJ mol﹣1;
②4Al(s)+3O2(g)═2Al2O3(s) △H2=﹣3351.4kJ mol﹣1。
Al和FeO发生铝热反应的热化学方程式是_____________________
(2)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能。
化学键 C-H C-F H-F F-F
键能kJ/mol 414 489 565 155
根据键能数据估算下列反应:CH4(g) + 4F2(g)=CF4(g) + 4HF(g)的反应热△H为_____。
(3)在恒温(500 K)、体积为1.0 L 的密闭容器中通入1.0 mol N2和1.0 mol H2发生合成氨反应N2 +3H22NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为_____。
20、钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀________________。
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
①A电极对应的金属是________(写元素名称),
B电极的电极反应式是___________________________________。
②若电镀前A、B两金属片质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为________mol。
③镀层破损后,不易被腐蚀的是___________(填A或B)。
A.镀铜铁 B.镀锌铁 C.镀锡铁
三、实验题。(2题)
21、当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
物质 (g) C(石墨,s)
燃烧热 285.8 393.5 3267.5
则25℃时和C(石墨,s)生成的热化学方程式为___________ 。
(2)某科研小组用电化学方法将转化为CO实现再利用,转化的基本原理如图所示。M极的电极反应式___________ ,图中箭头所示为___________离子(填“”或“”)的迁移方向。当转化2mol时,外电路转移电子的电量为___________。(已知)
(3)我国科学家研究电池,取得了重大科研成果,该电池中,为单质锂片,则该电池中的在___________(填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.Ⅱ.
Ⅲ.___________Ⅳ.
22、新冠肺炎疫情期间,多种含氯消毒剂如84消毒液、Cl2、NaClO2等对病毒均具有很好的消杀作用,其中亚氯酸钠(NaClO2)在工业上常以ClO2气体为原料制备,实验室制备亚氯酸钠的装置如图所示(夹持装置已略)。
已知:①控制电压电解饱和食盐水可得到ClO2;
②Cl2易溶于CCl4;
③亚氯酸钠在不同温度下的溶解度如下表所示:
温度℃ 20 40 60
溶解度/g 6.2 23.4 48.3
回答下列问题:
(1)装置甲中产生ClO2的电极反应式为_____________________。
(2)装置乙中CCl4的作用为________________________________。
(3)装置丙中生成NaClO2的化学方程式为____________________________。
(4)从装置丙反应后的溶液中获得NaClO2晶体的步骤如下:
其中步骤①加热到_________________(填现象)时停止加热,步骤②是__________________。
(5)准确称取2.26gNaClO2粗品,加入盛有20.00mL刚煮沸并冷却过的水、足量10%的稀硫酸和30.00mL质量分数为40%的KI溶液(足量)的碘量瓶中,立即密封并摇晃碘量瓶至试样完全反应,再加入淀粉作指示剂用浓度为3.00mol/L的Na2S2O3溶液滴定(已知整个过程中发生的反应依次为+4I-+4H+=2I2+Cl-+2H2O,),
①若三次平行实验测得消耗的Na2S2O3溶液的平均体积为30.00mL,则粗品的纯度为_________________%(保留三位有效数字),
②若使用的水未煮沸,则测定结果会___________________(填“偏高”“偏低”或“无影响”)。
2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第一章 化学反应与能量转化 跟踪选题含答案
鲁科版(2019)第一章 化学反应与能量转化
一、选择题。(18题)
1、下列化学反应属于吸热反应的是( )
A.碘的升华 B.生石灰溶于水
C.镁与稀盐酸反应 D.氨气分解
【答案】D
2、根据下图所示的N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是:
A.N2(g)与O2(g)反应生成NO(g)是放热反应
B.2molO原子结合生成O2(g)时需要放出498kJ能量
C.1molNO(g)分子中的化学键断裂时需要放出632kJ能量
D.N2(g)+O2(g)=2NO(g)△H=+1444kJ/mol.
【答案】B
3、下列装置不能形成原电池的是( )
A. B.
C. D.
【答案】D
4、锌-空气燃料电池有比能量高、容量大、使用寿命长等优点,可用作电动车动力电源,电池的电解质溶液为KOH溶液,放电时发生反应:2Zn+O2+4OH-+2H2O=2[Zn(OH)4]2-。下列说法正确的是( )
A.放电时,负极反应为Zn-2e-=Zn2+
B.充电时,电解质溶液中c(OH)-逐渐减小
C.放电时,当0.1 mol Zn完全溶解时,流经电解质溶液的电子个数约为1.204×1023
D.采用多孔炭的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
【答案】D
5、(双选)在一定温度下,用铂电极电解饱和硫酸钠溶液,对电解质溶液的判断正确的是( )
A.有晶体析出 B.浓度变大 C.浓度变小 D.pH不变
【答案】AD
6、下列关于用惰性电极电解NaCl溶液的叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若向阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若向阴极附近的溶液中滴入酚酞溶液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
【答案】B
7、在潮湿的空气中,钢铁很快发生电化学腐蚀,在此过程中一定不存在的电极反应是( )
A.2H++2e-=H2↑ B.Fe-3e-=Fe3+
C.Fe-2e-=Fe2+ D.O2+2H2O+4e-=4OH-
【答案】B
8、下列事实能用勒夏特列原理解释的是( )
A. 铜与浓硫酸反应需要加热
B. 加热蒸干FeCl3溶液最终得到Fe(OH)3
C. 使用催化剂提高合成氨的生产效率
D. 钢管与铜管堆放一处,钢管更易腐蚀
【答案】B
9、下列有关铝热反应的说法中,不正确的是( )
A.利用了铝的还原性
B.可用于焊接铁轨,反应为 2Al + Fe2O3Al2O3 + 2Fe
C.可用于冶炼某些高熔点金属
D.能量变化可用如图表示:
【答案】D
10、某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为2H2+O2=2H2O,下列有关说法正确的是( )
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-=4OH-
C.每转移0.1mol电子,便消耗1.12L的O2
D.H+由a极通过固体酸电解质传递到b极
【答案】D
11、硼酸为一元弱酸,已知与足量溶液反应的离子方程式为可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是( )
A.当电路中通过电子时,可得到
B.将电源的正、负极反接,工作原理不变
C.阴极室的电极反应式为
D.穿过阴膜进入阴极室,穿过阳膜进入产品室
【答案】A
12、关于下列各装置图的叙述中,错误的是( )
A. 用装置①精炼铜,则a极为电源正极,电解质溶液可为CuSO4溶液
B. 用湿润的淀粉-KI试纸检验装置②中阳极气体产物时,试纸变为蓝色
C. 装置③中钢闸门应与外接电源的负极相连,该保护法称为“牺牲阳极的阴极保护法”
D. 装置④中反应一段时间后,取Fe电极附近溶液滴加铁氰化钾溶液,不会产生蓝色沉淀
【答案】C
13、化学反应中一定伴随着能量的变化,下列有关能量的说法正确的是( )
A、相同条件下,等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多
B、已知:4Al(s)+3O2(g)=2A12O3 (s)△ H= 2834.9 kJ mol 1,
4Al(s)+ 2O3(g) = 2 A12O3(s)△ H = 3119.1 kJ mol 1,则O3比O2稳定
C、已知S(s)+O2(g)=SO2(g)△ H = 297.23 kJ mol 1,可知 1mol SO2(g)的能量大于 1molS(s)和1molO2(g)的能量总和
D、在稀水溶液中 H+(aq)+OH (aq)=H2O(l)△H = 57.3 kJ mol 1,将含 0.5mol H2SO4的浓硫酸与含 1 mol NaOH 的溶液混合时,放出的热量大于 57.3 kJ
【答案】D
14、下列说法正确的是( )
A.酸性锌锰干电池是一次电池,碱性锌锰干电池是二次电池
B.铅蓄电池是一次电池,锂离子电池是二次电池
C.燃料电池的能量转化率可达100%
D.废旧电池集中处理的主要目的是防止电池中的重金属污染水源及土壤
【答案】D
15、只在强碱性条件下稳定,易被还原。以溶液为电解质,制备的原理如图所示,在制备过程中需防止的渗透。下列说法不正确的是( )
A.电解过程中,需将阴极产生的气体及时排出
B.铁电极上的主要反应为
C.电解一段时间后,电极附近溶液的减小
D.图中的离子交换膜为阴离子交换膜
【答案】C
16、宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法错误的是( )
A. 青铜器发生电化学腐蚀,图中c作负极
B. 潮湿环境中Cl-浓度大有利于多孔粉状锈的生成
C. 若生成0.2 mol Cu2(OH)3Cl,则消耗的O2体积为4.48L
D. 环境中的Cl 与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH +Cl =Cu2 (OH)3Cl↓
【答案】C
17、已知:完全燃烧生成一氧化碳放出的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是( )
A.碳的燃烧热为
B.分解生成时放出的热量
C.反应的为
D.足量炭粉与反应生成的热化学方程式为
【答案】D
18、利用微生物电池原理可处理某些污水,其原理是通过微生物的作用,将废水中的有机物氧化,使其中的化学能转化为电能。图是处理含乙酸废水的电池装置原理图,a为石墨电极,b为铂碳电极。
该装置工作时,下列叙述错误的是( )
A.电池总反应:
B.负极的电极反应:
C.质子通过质子交换膜从甲室进入乙室
D.b电极为电源正极,c口流出的水中含大量
【答案】D
二、填空题。(2题)
19、写出或完成下列热化学方程式。
(1)已知:①2Fe(s)+O2(g)=2 FeO(s) △H1=﹣544.0kJ mol﹣1;
②4Al(s)+3O2(g)═2Al2O3(s) △H2=﹣3351.4kJ mol﹣1。
Al和FeO发生铝热反应的热化学方程式是_____________________
(2)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能。
化学键 C-H C-F H-F F-F
键能kJ/mol 414 489 565 155
根据键能数据估算下列反应:CH4(g) + 4F2(g)=CF4(g) + 4HF(g)的反应热△H为_____。
(3)在恒温(500 K)、体积为1.0 L 的密闭容器中通入1.0 mol N2和1.0 mol H2发生合成氨反应N2 +3H22NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为_____。
【答案】2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s) △H=﹣859.7 kJ mol﹣1 -1940 kJ/mol N2(g)+3H2(g)2NH3(g) △H=-92kJ/mol
20、钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀________________。
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
①A电极对应的金属是________(写元素名称),
B电极的电极反应式是___________________________________。
②若电镀前A、B两金属片质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为________mol。
③镀层破损后,不易被腐蚀的是___________(填A或B)。
A.镀铜铁 B.镀锌铁 C.镀锡铁
【答案】(1)BD (2)铜 Cu2+ + 2e-=== Cu 0.08 B
三、实验题。(2题)
21、当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
物质 (g) C(石墨,s)
燃烧热 285.8 393.5 3267.5
则25℃时和C(石墨,s)生成的热化学方程式为___________ 。
(2)某科研小组用电化学方法将转化为CO实现再利用,转化的基本原理如图所示。M极的电极反应式___________ ,图中箭头所示为___________离子(填“”或“”)的迁移方向。当转化2mol时,外电路转移电子的电量为___________。(已知)
(3)我国科学家研究电池,取得了重大科研成果,该电池中,为单质锂片,则该电池中的在___________(填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.Ⅱ.
Ⅲ.___________Ⅳ.
【答案】(1)6C(石墨,s)+3H2(g)=C6H6(l)△H=+49.1kJmol-1
(2) 2H2O-4e-=O2↑+4H+
(3) 正极 2CO+CO2=2CO+C
22、新冠肺炎疫情期间,多种含氯消毒剂如84消毒液、Cl2、NaClO2等对病毒均具有很好的消杀作用,其中亚氯酸钠(NaClO2)在工业上常以ClO2气体为原料制备,实验室制备亚氯酸钠的装置如图所示(夹持装置已略)。
已知:①控制电压电解饱和食盐水可得到ClO2;
②Cl2易溶于CCl4;
③亚氯酸钠在不同温度下的溶解度如下表所示:
温度℃ 20 40 60
溶解度/g 6.2 23.4 48.3
回答下列问题:
(1)装置甲中产生ClO2的电极反应式为_____________________。
(2)装置乙中CCl4的作用为________________________________。
(3)装置丙中生成NaClO2的化学方程式为____________________________。
(4)从装置丙反应后的溶液中获得NaClO2晶体的步骤如下:
其中步骤①加热到_________________(填现象)时停止加热,步骤②是__________________。
(5)准确称取2.26gNaClO2粗品,加入盛有20.00mL刚煮沸并冷却过的水、足量10%的稀硫酸和30.00mL质量分数为40%的KI溶液(足量)的碘量瓶中,立即密封并摇晃碘量瓶至试样完全反应,再加入淀粉作指示剂用浓度为3.00mol/L的Na2S2O3溶液滴定(已知整个过程中发生的反应依次为+4I-+4H+=2I2+Cl-+2H2O,),
①若三次平行实验测得消耗的Na2S2O3溶液的平均体积为30.00mL,则粗品的纯度为_________________%(保留三位有效数字),
②若使用的水未煮沸,则测定结果会___________________(填“偏高”“偏低”或“无影响”)。
【答案】Cl- -5e- + 2H2O = ClO2↑+ 4H+ 除去ClO2中可能含有的Cl2 2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2 溶液表面出现晶膜 冷却结晶 90.1 偏高
鲁科版(2019)第一章 化学反应与能量转化
一、选择题。(18题)
1、下列化学反应属于吸热反应的是( )
A.碘的升华 B.生石灰溶于水
C.镁与稀盐酸反应 D.氨气分解
2、根据下图所示的N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是:
A.N2(g)与O2(g)反应生成NO(g)是放热反应
B.2molO原子结合生成O2(g)时需要放出498kJ能量
C.1molNO(g)分子中的化学键断裂时需要放出632kJ能量
D.N2(g)+O2(g)=2NO(g)△H=+1444kJ/mol.
3、下列装置不能形成原电池的是( )
A. B.
C. D.
4、锌-空气燃料电池有比能量高、容量大、使用寿命长等优点,可用作电动车动力电源,电池的电解质溶液为KOH溶液,放电时发生反应:2Zn+O2+4OH-+2H2O=2[Zn(OH)4]2-。下列说法正确的是( )
A.放电时,负极反应为Zn-2e-=Zn2+
B.充电时,电解质溶液中c(OH)-逐渐减小
C.放电时,当0.1 mol Zn完全溶解时,流经电解质溶液的电子个数约为1.204×1023
D.采用多孔炭的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
5、(双选)在一定温度下,用铂电极电解饱和硫酸钠溶液,对电解质溶液的判断正确的是( )
A.有晶体析出 B.浓度变大 C.浓度变小 D.pH不变
6、下列关于用惰性电极电解NaCl溶液的叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若向阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若向阴极附近的溶液中滴入酚酞溶液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
7、在潮湿的空气中,钢铁很快发生电化学腐蚀,在此过程中一定不存在的电极反应是( )
A.2H++2e-=H2↑ B.Fe-3e-=Fe3+
C.Fe-2e-=Fe2+ D.O2+2H2O+4e-=4OH-
8、下列事实能用勒夏特列原理解释的是( )
A. 铜与浓硫酸反应需要加热
B. 加热蒸干FeCl3溶液最终得到Fe(OH)3
C. 使用催化剂提高合成氨的生产效率
D. 钢管与铜管堆放一处,钢管更易腐蚀
9、下列有关铝热反应的说法中,不正确的是( )
A.利用了铝的还原性
B.可用于焊接铁轨,反应为 2Al + Fe2O3Al2O3 + 2Fe
C.可用于冶炼某些高熔点金属
D.能量变化可用如图表示:
10、某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为2H2+O2=2H2O,下列有关说法正确的是( )
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-=4OH-
C.每转移0.1mol电子,便消耗1.12L的O2
D.H+由a极通过固体酸电解质传递到b极
11、硼酸为一元弱酸,已知与足量溶液反应的离子方程式为可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是( )
A.当电路中通过电子时,可得到
B.将电源的正、负极反接,工作原理不变
C.阴极室的电极反应式为
D.穿过阴膜进入阴极室,穿过阳膜进入产品室
12、关于下列各装置图的叙述中,错误的是( )
A. 用装置①精炼铜,则a极为电源正极,电解质溶液可为CuSO4溶液
B. 用湿润的淀粉-KI试纸检验装置②中阳极气体产物时,试纸变为蓝色
C. 装置③中钢闸门应与外接电源的负极相连,该保护法称为“牺牲阳极的阴极保护法”
D. 装置④中反应一段时间后,取Fe电极附近溶液滴加铁氰化钾溶液,不会产生蓝色沉淀
13、化学反应中一定伴随着能量的变化,下列有关能量的说法正确的是( )
A、相同条件下,等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多
B、已知:4Al(s)+3O2(g)=2A12O3 (s)△ H= 2834.9 kJ mol 1,
4Al(s)+ 2O3(g) = 2 A12O3(s)△ H = 3119.1 kJ mol 1,则O3比O2稳定
C、已知S(s)+O2(g)=SO2(g)△ H = 297.23 kJ mol 1,可知 1mol SO2(g)的能量大于 1molS(s)和1molO2(g)的能量总和
D、在稀水溶液中 H+(aq)+OH (aq)=H2O(l)△H = 57.3 kJ mol 1,将含 0.5mol H2SO4的浓硫酸与含 1 mol NaOH 的溶液混合时,放出的热量大于 57.3 kJ
14、下列说法正确的是( )
A.酸性锌锰干电池是一次电池,碱性锌锰干电池是二次电池
B.铅蓄电池是一次电池,锂离子电池是二次电池
C.燃料电池的能量转化率可达100%
D.废旧电池集中处理的主要目的是防止电池中的重金属污染水源及土壤
15、只在强碱性条件下稳定,易被还原。以溶液为电解质,制备的原理如图所示,在制备过程中需防止的渗透。下列说法不正确的是( )
A.电解过程中,需将阴极产生的气体及时排出
B.铁电极上的主要反应为
C.电解一段时间后,电极附近溶液的减小
D.图中的离子交换膜为阴离子交换膜
16、宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法错误的是( )
A. 青铜器发生电化学腐蚀,图中c作负极
B. 潮湿环境中Cl-浓度大有利于多孔粉状锈的生成
C. 若生成0.2 mol Cu2(OH)3Cl,则消耗的O2体积为4.48L
D. 环境中的Cl 与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH +Cl =Cu2 (OH)3Cl↓
17、已知:完全燃烧生成一氧化碳放出的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是( )
A.碳的燃烧热为
B.分解生成时放出的热量
C.反应的为
D.足量炭粉与反应生成的热化学方程式为
18、利用微生物电池原理可处理某些污水,其原理是通过微生物的作用,将废水中的有机物氧化,使其中的化学能转化为电能。图是处理含乙酸废水的电池装置原理图,a为石墨电极,b为铂碳电极。
该装置工作时,下列叙述错误的是( )
A.电池总反应:
B.负极的电极反应:
C.质子通过质子交换膜从甲室进入乙室
D.b电极为电源正极,c口流出的水中含大量
二、填空题。(2题)
19、写出或完成下列热化学方程式。
(1)已知:①2Fe(s)+O2(g)=2 FeO(s) △H1=﹣544.0kJ mol﹣1;
②4Al(s)+3O2(g)═2Al2O3(s) △H2=﹣3351.4kJ mol﹣1。
Al和FeO发生铝热反应的热化学方程式是_____________________
(2)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能。
化学键 C-H C-F H-F F-F
键能kJ/mol 414 489 565 155
根据键能数据估算下列反应:CH4(g) + 4F2(g)=CF4(g) + 4HF(g)的反应热△H为_____。
(3)在恒温(500 K)、体积为1.0 L 的密闭容器中通入1.0 mol N2和1.0 mol H2发生合成氨反应N2 +3H22NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为_____。
20、钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀________________。
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
①A电极对应的金属是________(写元素名称),
B电极的电极反应式是___________________________________。
②若电镀前A、B两金属片质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为________mol。
③镀层破损后,不易被腐蚀的是___________(填A或B)。
A.镀铜铁 B.镀锌铁 C.镀锡铁
三、实验题。(2题)
21、当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
物质 (g) C(石墨,s)
燃烧热 285.8 393.5 3267.5
则25℃时和C(石墨,s)生成的热化学方程式为___________ 。
(2)某科研小组用电化学方法将转化为CO实现再利用,转化的基本原理如图所示。M极的电极反应式___________ ,图中箭头所示为___________离子(填“”或“”)的迁移方向。当转化2mol时,外电路转移电子的电量为___________。(已知)
(3)我国科学家研究电池,取得了重大科研成果,该电池中,为单质锂片,则该电池中的在___________(填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.Ⅱ.
Ⅲ.___________Ⅳ.
22、新冠肺炎疫情期间,多种含氯消毒剂如84消毒液、Cl2、NaClO2等对病毒均具有很好的消杀作用,其中亚氯酸钠(NaClO2)在工业上常以ClO2气体为原料制备,实验室制备亚氯酸钠的装置如图所示(夹持装置已略)。
已知:①控制电压电解饱和食盐水可得到ClO2;
②Cl2易溶于CCl4;
③亚氯酸钠在不同温度下的溶解度如下表所示:
温度℃ 20 40 60
溶解度/g 6.2 23.4 48.3
回答下列问题:
(1)装置甲中产生ClO2的电极反应式为_____________________。
(2)装置乙中CCl4的作用为________________________________。
(3)装置丙中生成NaClO2的化学方程式为____________________________。
(4)从装置丙反应后的溶液中获得NaClO2晶体的步骤如下:
其中步骤①加热到_________________(填现象)时停止加热,步骤②是__________________。
(5)准确称取2.26gNaClO2粗品,加入盛有20.00mL刚煮沸并冷却过的水、足量10%的稀硫酸和30.00mL质量分数为40%的KI溶液(足量)的碘量瓶中,立即密封并摇晃碘量瓶至试样完全反应,再加入淀粉作指示剂用浓度为3.00mol/L的Na2S2O3溶液滴定(已知整个过程中发生的反应依次为+4I-+4H+=2I2+Cl-+2H2O,),
①若三次平行实验测得消耗的Na2S2O3溶液的平均体积为30.00mL,则粗品的纯度为_________________%(保留三位有效数字),
②若使用的水未煮沸,则测定结果会___________________(填“偏高”“偏低”或“无影响”)。
2023—2024学年上学期高二化学鲁科版(2019)选择性必修一第一章 化学反应与能量转化 跟踪选题含答案
鲁科版(2019)第一章 化学反应与能量转化
一、选择题。(18题)
1、下列化学反应属于吸热反应的是( )
A.碘的升华 B.生石灰溶于水
C.镁与稀盐酸反应 D.氨气分解
【答案】D
2、根据下图所示的N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况,判断下列说法正确的是:
A.N2(g)与O2(g)反应生成NO(g)是放热反应
B.2molO原子结合生成O2(g)时需要放出498kJ能量
C.1molNO(g)分子中的化学键断裂时需要放出632kJ能量
D.N2(g)+O2(g)=2NO(g)△H=+1444kJ/mol.
【答案】B
3、下列装置不能形成原电池的是( )
A. B.
C. D.
【答案】D
4、锌-空气燃料电池有比能量高、容量大、使用寿命长等优点,可用作电动车动力电源,电池的电解质溶液为KOH溶液,放电时发生反应:2Zn+O2+4OH-+2H2O=2[Zn(OH)4]2-。下列说法正确的是( )
A.放电时,负极反应为Zn-2e-=Zn2+
B.充电时,电解质溶液中c(OH)-逐渐减小
C.放电时,当0.1 mol Zn完全溶解时,流经电解质溶液的电子个数约为1.204×1023
D.采用多孔炭的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
【答案】D
5、(双选)在一定温度下,用铂电极电解饱和硫酸钠溶液,对电解质溶液的判断正确的是( )
A.有晶体析出 B.浓度变大 C.浓度变小 D.pH不变
【答案】AD
6、下列关于用惰性电极电解NaCl溶液的叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若向阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若向阴极附近的溶液中滴入酚酞溶液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
【答案】B
7、在潮湿的空气中,钢铁很快发生电化学腐蚀,在此过程中一定不存在的电极反应是( )
A.2H++2e-=H2↑ B.Fe-3e-=Fe3+
C.Fe-2e-=Fe2+ D.O2+2H2O+4e-=4OH-
【答案】B
8、下列事实能用勒夏特列原理解释的是( )
A. 铜与浓硫酸反应需要加热
B. 加热蒸干FeCl3溶液最终得到Fe(OH)3
C. 使用催化剂提高合成氨的生产效率
D. 钢管与铜管堆放一处,钢管更易腐蚀
【答案】B
9、下列有关铝热反应的说法中,不正确的是( )
A.利用了铝的还原性
B.可用于焊接铁轨,反应为 2Al + Fe2O3Al2O3 + 2Fe
C.可用于冶炼某些高熔点金属
D.能量变化可用如图表示:
【答案】D
10、某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为2H2+O2=2H2O,下列有关说法正确的是( )
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-=4OH-
C.每转移0.1mol电子,便消耗1.12L的O2
D.H+由a极通过固体酸电解质传递到b极
【答案】D
11、硼酸为一元弱酸,已知与足量溶液反应的离子方程式为可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是( )
A.当电路中通过电子时,可得到
B.将电源的正、负极反接,工作原理不变
C.阴极室的电极反应式为
D.穿过阴膜进入阴极室,穿过阳膜进入产品室
【答案】A
12、关于下列各装置图的叙述中,错误的是( )
A. 用装置①精炼铜,则a极为电源正极,电解质溶液可为CuSO4溶液
B. 用湿润的淀粉-KI试纸检验装置②中阳极气体产物时,试纸变为蓝色
C. 装置③中钢闸门应与外接电源的负极相连,该保护法称为“牺牲阳极的阴极保护法”
D. 装置④中反应一段时间后,取Fe电极附近溶液滴加铁氰化钾溶液,不会产生蓝色沉淀
【答案】C
13、化学反应中一定伴随着能量的变化,下列有关能量的说法正确的是( )
A、相同条件下,等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多
B、已知:4Al(s)+3O2(g)=2A12O3 (s)△ H= 2834.9 kJ mol 1,
4Al(s)+ 2O3(g) = 2 A12O3(s)△ H = 3119.1 kJ mol 1,则O3比O2稳定
C、已知S(s)+O2(g)=SO2(g)△ H = 297.23 kJ mol 1,可知 1mol SO2(g)的能量大于 1molS(s)和1molO2(g)的能量总和
D、在稀水溶液中 H+(aq)+OH (aq)=H2O(l)△H = 57.3 kJ mol 1,将含 0.5mol H2SO4的浓硫酸与含 1 mol NaOH 的溶液混合时,放出的热量大于 57.3 kJ
【答案】D
14、下列说法正确的是( )
A.酸性锌锰干电池是一次电池,碱性锌锰干电池是二次电池
B.铅蓄电池是一次电池,锂离子电池是二次电池
C.燃料电池的能量转化率可达100%
D.废旧电池集中处理的主要目的是防止电池中的重金属污染水源及土壤
【答案】D
15、只在强碱性条件下稳定,易被还原。以溶液为电解质,制备的原理如图所示,在制备过程中需防止的渗透。下列说法不正确的是( )
A.电解过程中,需将阴极产生的气体及时排出
B.铁电极上的主要反应为
C.电解一段时间后,电极附近溶液的减小
D.图中的离子交换膜为阴离子交换膜
【答案】C
16、宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法错误的是( )
A. 青铜器发生电化学腐蚀,图中c作负极
B. 潮湿环境中Cl-浓度大有利于多孔粉状锈的生成
C. 若生成0.2 mol Cu2(OH)3Cl,则消耗的O2体积为4.48L
D. 环境中的Cl 与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH +Cl =Cu2 (OH)3Cl↓
【答案】C
17、已知:完全燃烧生成一氧化碳放出的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是( )
A.碳的燃烧热为
B.分解生成时放出的热量
C.反应的为
D.足量炭粉与反应生成的热化学方程式为
【答案】D
18、利用微生物电池原理可处理某些污水,其原理是通过微生物的作用,将废水中的有机物氧化,使其中的化学能转化为电能。图是处理含乙酸废水的电池装置原理图,a为石墨电极,b为铂碳电极。
该装置工作时,下列叙述错误的是( )
A.电池总反应:
B.负极的电极反应:
C.质子通过质子交换膜从甲室进入乙室
D.b电极为电源正极,c口流出的水中含大量
【答案】D
二、填空题。(2题)
19、写出或完成下列热化学方程式。
(1)已知:①2Fe(s)+O2(g)=2 FeO(s) △H1=﹣544.0kJ mol﹣1;
②4Al(s)+3O2(g)═2Al2O3(s) △H2=﹣3351.4kJ mol﹣1。
Al和FeO发生铝热反应的热化学方程式是_____________________
(2)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。下表是一些化学键的键能。
化学键 C-H C-F H-F F-F
键能kJ/mol 414 489 565 155
根据键能数据估算下列反应:CH4(g) + 4F2(g)=CF4(g) + 4HF(g)的反应热△H为_____。
(3)在恒温(500 K)、体积为1.0 L 的密闭容器中通入1.0 mol N2和1.0 mol H2发生合成氨反应N2 +3H22NH3,20 min 后达到平衡,测得反应放出的热量为18.4 kJ,混合气体的物质的量为1.6 mol,该反应的热化学方程式为_____。
【答案】2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s) △H=﹣859.7 kJ mol﹣1 -1940 kJ/mol N2(g)+3H2(g)2NH3(g) △H=-92kJ/mol
20、钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀________________。
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:
①A电极对应的金属是________(写元素名称),
B电极的电极反应式是___________________________________。
②若电镀前A、B两金属片质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为________mol。
③镀层破损后,不易被腐蚀的是___________(填A或B)。
A.镀铜铁 B.镀锌铁 C.镀锡铁
【答案】(1)BD (2)铜 Cu2+ + 2e-=== Cu 0.08 B
三、实验题。(2题)
21、当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
物质 (g) C(石墨,s)
燃烧热 285.8 393.5 3267.5
则25℃时和C(石墨,s)生成的热化学方程式为___________ 。
(2)某科研小组用电化学方法将转化为CO实现再利用,转化的基本原理如图所示。M极的电极反应式___________ ,图中箭头所示为___________离子(填“”或“”)的迁移方向。当转化2mol时,外电路转移电子的电量为___________。(已知)
(3)我国科学家研究电池,取得了重大科研成果,该电池中,为单质锂片,则该电池中的在___________(填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.Ⅱ.
Ⅲ.___________Ⅳ.
【答案】(1)6C(石墨,s)+3H2(g)=C6H6(l)△H=+49.1kJmol-1
(2) 2H2O-4e-=O2↑+4H+
(3) 正极 2CO+CO2=2CO+C
22、新冠肺炎疫情期间,多种含氯消毒剂如84消毒液、Cl2、NaClO2等对病毒均具有很好的消杀作用,其中亚氯酸钠(NaClO2)在工业上常以ClO2气体为原料制备,实验室制备亚氯酸钠的装置如图所示(夹持装置已略)。
已知:①控制电压电解饱和食盐水可得到ClO2;
②Cl2易溶于CCl4;
③亚氯酸钠在不同温度下的溶解度如下表所示:
温度℃ 20 40 60
溶解度/g 6.2 23.4 48.3
回答下列问题:
(1)装置甲中产生ClO2的电极反应式为_____________________。
(2)装置乙中CCl4的作用为________________________________。
(3)装置丙中生成NaClO2的化学方程式为____________________________。
(4)从装置丙反应后的溶液中获得NaClO2晶体的步骤如下:
其中步骤①加热到_________________(填现象)时停止加热,步骤②是__________________。
(5)准确称取2.26gNaClO2粗品,加入盛有20.00mL刚煮沸并冷却过的水、足量10%的稀硫酸和30.00mL质量分数为40%的KI溶液(足量)的碘量瓶中,立即密封并摇晃碘量瓶至试样完全反应,再加入淀粉作指示剂用浓度为3.00mol/L的Na2S2O3溶液滴定(已知整个过程中发生的反应依次为+4I-+4H+=2I2+Cl-+2H2O,),
①若三次平行实验测得消耗的Na2S2O3溶液的平均体积为30.00mL,则粗品的纯度为_________________%(保留三位有效数字),
②若使用的水未煮沸,则测定结果会___________________(填“偏高”“偏低”或“无影响”)。
【答案】Cl- -5e- + 2H2O = ClO2↑+ 4H+ 除去ClO2中可能含有的Cl2 2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2 溶液表面出现晶膜 冷却结晶 90.1 偏高
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
