3.3.2 从海水中提取溴、从海带中提取碘 课件 (共40张ppt) 2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.3.2 从海水中提取溴、从海带中提取碘 课件 (共40张ppt) 2023-2024学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-28 21:18:22 | ||
图片预览











文档简介
(共40张PPT)
新苏教版 必修一 从海水中提取溴、从海带中提取碘
2.氯、溴、碘单质间的置换反应
实验操作 实验现象 反应的化学方程式
①溶液______ ②下层溶液显________色 _____________________
①溶液______ ②下层溶液显________色 _____________________
①溶液______ ②下层溶液显________色 _____________________
分层
橙红
Cl2+2KBr===2KCl+Br2
分层
紫红
Cl2+2KI===2KCl+I2
分层
紫红
Br2+2KI===2KBr+I2
二、溴、碘的提取及应用
(一)溴的提取及应用
1.海水提溴常选用氯气作氧化剂,一般要经历浓缩、氧化、提取等步骤
涉及的主要化学反应如下:
Cl2+2Br-===2Cl-+Br2(制粗溴)
SO2+Br2+2H2O===H2SO4+2HBr
Cl2+2HBr===2HCl+Br2
2.溴及其化合物的应用
溴多用于制备药物、感光剂等。如过去常用的消毒药剂“红药水”中就含有溴元素;溴化钾、溴化钠、溴化铵等可配成镇静剂,青霉素等药物生产也需要溴;溴还是制造农业杀虫剂、阻燃剂的原料;溴化银具有感光性,可被用作医疗X射线胶片上的感光剂。
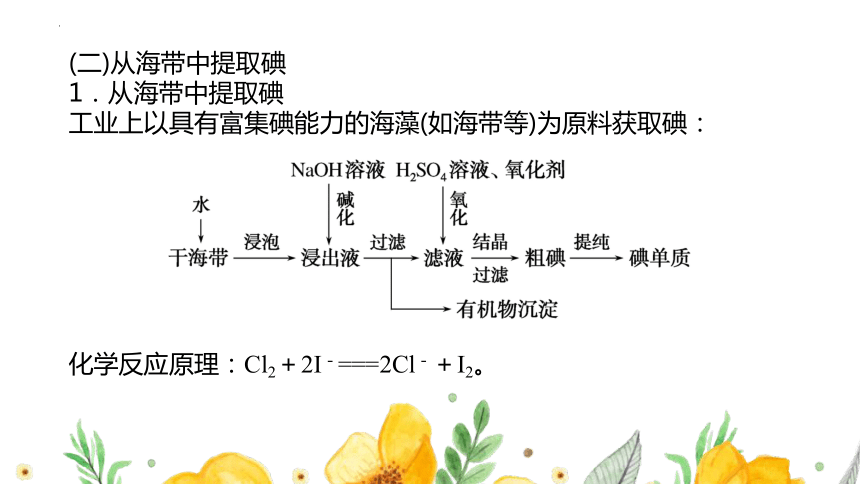
(二)从海带中提取碘
1.从海带中提取碘
工业上以具有富集碘能力的海藻(如海带等)为原料获取碘:
化学反应原理:Cl2+2I-===2Cl-+I2。
2.加碘盐中的碘元素
存在形式:食盐中加“碘”以________形式存在。
检验原理:________________________,淀粉遇碘单质变________。
3.碘及其化合物的重要应用
(1)碘是重要的药用元素,可以用来生产含碘食品。
(2)__________用于人工降雨。
+6H+===3I2+3H2O
蓝
AgI
特别提醒
碘是人体必需的微量元素,是维持人体甲状腺正常功能所必需的元素。当人体缺碘时就会患甲状腺肿大,人们主要从饮水、粮食、蔬菜和周围环境中获取碘。多食海带、海鱼等含碘丰富的食品,对于防治甲状腺肿大很有效。在我国缺碘地区,人们主要通过食用加碘盐来补充碘元素。
[即时自测]
1.判断正误,正确的打“√”,错误的打“×”
(1)海水中含有溴单质。( )
(2)海带中含有的碘为化合态。( )
(3)将碘和砂子分离开可用升华法。( )
(4)用淀粉溶液可以检验加碘食盐中的碘。( )
(5)将CCl4加入Br2水中,上层呈橙红色。( )
(6)在海水里通入氯气可生成Br2。( )
×
√
√
×
×
√
2.已知溴易挥发,碘易升华,向含有NaBr和KI的混合溶液中通入过量氯气充分反应后将溶液蒸干,并灼烧所得物质,最后剩余的固体是( )
A.NaCl和KI B.NaCl、KCl和I2
C.KCl和NaBr D.KCl和NaCl
答案:D
3.溴又称为海洋元素,主要用于制取溴化物,并作为普通分析试剂和有机合成试剂用于医药、农药、染料、香料、摄影材料、灭火剂、选矿、冶金、鞣革、净水等方面。从海水中可以提取溴,主要反应之一为2KBr+Cl2===2KCl+Br2,下列说法中正确的是( )
A.溴离子具有氧化性
B.氯气是还原剂
C.该反应属于复分解反应
D.氯气氧化性比溴单质强
答案:D
4.海带提碘的实验中涉及灼烧、浸取、过滤、氧化、萃取五个步骤,下列操作能达到实验目的的是( )
A.实验室用装置甲灼烧干海带
B.装置乙中为加速液体流下使用玻璃棒搅拌
C.用装置丙从碘水中萃取单质碘
D.用装置丁吸收该实验中的氯气尾气
答案:C
提升点1 海水中提取溴
例1 溴元素主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备Br2的操作步骤为:
①在一定条件下,将Cl2通入浓缩的海水中,生成Br2;
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收生成的NaBr、NaBrO3等;
③用硫酸酸化步骤②得到的混合物。
完成下列填空:
(1)Cl2氧化Br-应在__________条件下进行,目的是避免____________________。
(2)Br2可用热空气吹出,其原因是__________。
(3)写出步骤③所发生的化学反应方程式
________________________________________。用硫酸而不用盐酸酸化的原因可能是______________________。步骤②的产品有时运输到目的地后再酸化,主要是因为__________________________。
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中________。
a.通入HBr b.加入Na2CO3溶液
c.加入NaBr溶液 d.加入Na2SO3溶液
除去Cl2的同时不能引入新杂质。
酸性
Cl2歧化生成HClO和HCl
Br2易挥发
3H2SO4+5NaBr+NaBrO3===3Na2SO4+3Br2+3H2O
能将氯离子氧化成氯气
单质溴具有强氧化性(或强腐蚀性)
ac
【解析】 (1)Cl2能与水发生可逆反应生成HCl和HClO,故Cl2氧化Br-应在酸性条件下进行。(3)步骤③所发生的反应是归中反应;盐酸有还原性,NaBrO3有氧化性,二者可发生氧化还原反应。
[提升1] 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
(1)图中仪器B的名称为__________。
(2)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是___________。
(3)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?__________________________________。
(4)C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________。
(5)D装置的作用是_________________________________。
直形冷凝管
Br2腐蚀橡胶
控制温度计b的温度,并收集59 ℃时的馏分
深红棕色
分液
吸收少量有毒性的溴蒸气,防止污染空气
解析:题图中从工业溴中提纯溴的方法是蒸馏法,先将蒸馏烧瓶在热水浴中加热,此时液体溴变成溴蒸气,经过冷凝管冷凝得到液溴。因为溴有强腐蚀性,所以装置中仪器连接均不能用橡胶塞和橡胶管;因为溴易挥发而且有毒性,所以D装置是尾气吸收装置,目的是除去少量有毒性的溴蒸气,防止污染空气。向残留少量Cl2的液溴中加入NaBr溶液,发生反应:Cl2+2NaBr===2NaCl+Br2,然后分液。
关键能力
海水中提取溴的流程与反应
(1)流程
(2)发生反应的化学方程式
①2NaBr+Cl2===Br2+2NaCl
②Br2+SO2+2H2O===2HBr+H2SO4
③2HBr+Cl2===2HCl+Br2
提升点2 海带中提取碘
海带灼烧便于含碘物质溶解。
例2 海带中含有丰富的碘。资料显示:海带中碘元素以I-的形式存在;苯的沸点是80.1 ℃;单质碘在高于150 ℃时易升华。某兴趣小组同学根据查阅的资料,设计下列实验方案,欲从海带中提取碘。请回答下列问题:
(1)步骤①②的实验目的是_____________________。
(2)步骤③中实验操作的名称是________。
(3)步骤④中可供选用的试剂有Cl2、Br2和H2O2(含稀硫酸),你认为最合适的试剂是______________。
(4)步骤⑤中提取碘时使用的主要玻璃仪器是________。
(5)步骤⑥中从含碘的苯溶液中获得固态的单质碘,应采用的方法是________(填字母)。
a.过滤 b.冷却结晶
c.加热蒸发 d.水浴蒸馏
将海带中的I-溶解到水中
过滤
H2O2(含稀硫酸)
分液漏斗
d
【解析】 (1)操作①、②的目的是使海带中的I-溶于水,便于后续提取操作。(2)步骤③是为了从海带灰悬浊液中得到含I-的溶液,固体和溶液分离采用过滤操作。(4)步骤⑤中提取碘利用的是萃取分液的方法,使用的主要玻璃仪器是分液漏斗。(5)因苯的沸点低,易挥发,且碘升华的温度不高,故应用水浴蒸馏的方法分离碘和苯。
[提升2] 从海带中提取碘单质,成熟的工艺流程如下:
下列关于海带制碘的说法,不正确的是( )
A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B.含I-的滤液中加入稀硫酸和双氧水后,碘离子发生氧化反应
C.在碘水中加入几滴淀粉溶液,溶液变蓝色
D.碘水中加入CCl4得到I2的CCl4溶液,该操作为“萃取”
状元随笔 固体加热用坩埚;溶液蒸发用蒸发皿。
答案:A
解析:灼烧固体时一般选用坩埚,蒸发皿一般用于蒸发溶液。
关键能力
从海带中提取碘
1.工艺流程
2.工艺流程说明
(1)干海带的浸泡液中含I-;
(2)加入硫酸的目的是酸化,加入氯气的目的是氧化I-。
提升点3 溴、碘的性质及检验
例3 已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行卤素的性质实验。玻璃管内装有分别滴加不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
看清棉球为白色。
① ② ③ ④
A 黄绿色 橙色 蓝色 白色
B 无色 橙色 紫色 白色
C 黄绿色 橙色 蓝色 无色
D 黄绿色 无色 紫色 白色
【答案】 A
【解析】 常温下氯酸钾与浓盐酸反应放出Cl2,氯气的颜色是黄绿色①处充满黄绿色Cl2;氯气进入玻璃管后与②处NaBr溶液发生置换反应生成Br2,液溴的水溶液颜色为橙色,所以白色棉球变为橙色;氯气和③处KI溶液反应置换出I2,遇淀粉变蓝;④处利用氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠的水溶液,用来进行Cl2的尾气吸收,尽管反应生成的物质均为无色,但棉球本身是白色的,所以④处的颜色为白色。
[提升3] 只用一种试剂就能区别NaCl、NaBr、NaI三种溶液,该试剂可用( )
①AgNO3溶液 ②氯水 ③溴水 ④碘水
A.①② B.①③
C.②③ D.②④
答案:A
解析:①均与硝酸银反应,分别生成白色沉淀、浅黄色沉淀、黄色沉淀,现象不同,可鉴别,故选;②氯水与NaBr反应生成橙色溶液、氯水与NaI反应生成紫色溶液,NaCl与氯水不反应,现象不同,可鉴别,故选;③溴水不能鉴别NaCl、NaBr,故不选;④碘水与三种溶液均不反应,现象相同,不能鉴别,故不选。
关键能力
1.Cl2、Br2、I2在水及有机溶剂中的颜色
2.卤素离子的检验方法
(1)AgNO3溶液——沉淀法
水 CCl4 汽油
Cl2 黄绿色 黄绿色 黄绿色
Br2 黄→橙 橙→橙红 橙→橙红
I2 深黄→褐 紫→深紫 浅紫红→紫红
(2)置换——萃取法
(3)置换——淀粉法检验I-
1.稀的碘水和溴水的颜色非常浅,近乎无色。区分稀碘水和稀溴水时,所用的最佳试剂是( )
A.淀粉溶液 B.氯水
C.NaOH溶液 D.NaBr溶液
答案:A
解析:氯水、NaBr溶液与溴水、碘水都不反应,NaOH溶液与二者都反应,二者都褪色,现象相同,不能区分;淀粉遇I2变蓝色。
2.将氯水注入KI溶液中,用力振荡,再注入四氯化碳,振荡后静置,看到的现象是( )
A.液体为紫红色
B.液体为无色
C.液体分两层,上层为紫红色,下层接近无色
D.液体分两层,上层接近无色,下层为紫红色
答案:D
解析:Cl2将I-氧化生成I2,I2被CCl4萃取,所以上层接近无色,下层为紫红色。
3.下列物质与其用途相符的是( )
①Cl2——作消毒剂; ②AgBr——制胶卷、感光纸;
③AgI——人工降雨; ④加碘食盐——预防甲状腺肿大;
⑤淀粉——检验I2的存在; ⑥NaClO——漂白纺织物。
A.②③④⑤⑥ B.①②④⑤⑥
C.②③④⑤ D.全部
答案:D
解析:Cl2与水反应生成次氯酸,次氯酸可作消毒剂,用于杀菌消毒,①正确;AgBr不稳定,分解生成银,可用来制胶卷、感光纸,②正确;AgI易与空气中的水蒸气结合形成晶核,有利于水汽粒子的碰撞增大,从而形成雨,③正确;碘是预防甲状腺肿大的主要元素,④正确;淀粉遇碘变蓝,可用来检验碘单质,⑤正确;NaClO与二氧化碳、水反应生成次氯酸,次氯酸具有强氧化性,可用于漂白纺织物,⑥正确。故选D。
4.波力海苔以深海紫菜为原料,经烤熟之后质地脆嫩,入口即化,是一种富含碘的海洋食品。某化学兴趣小组从紫菜中提取碘的流程如下图:
(1)实验室灼烧紫菜,需要下列仪器中的________(填字母)。
a.试管 b.烧杯 c.坩埚
d.泥三角 e.铁三脚架 f.酒精灯
(2)实验操作②中若改用稀硫酸酸化的H2O2(少量)氧化NaI也能得到I2,同时有水和硫酸盐生成,写出该反应的化学方程式:__________________________________。
(3)提取碘的过程中实验操作③的名称是__________。
(4)实验操作③过程中,可选择的有机试剂是________。
A.酒精 B.苯
C.四氯化碳 D.食盐水
cdef
2NaI+H2SO4+H2O2===Na2SO4+I2+2H2O
萃取、分液
BC
解析:(1)灼烧在坩埚中进行,坩埚需放在泥三角上,而泥三角又要放在三脚架上,然后用酒精灯灼烧。(2)由题意知,反应物为NaI、H2SO4和H2O2,生成物为Na2SO4、I2和H2O,根据原子守恒、得失电子守恒配平反应方程式即可。(3)由流程图可知,操作③是将碘的水溶液变为碘的有机溶液,故应加入有机溶剂进行萃取,然后再进行分液。(4)萃取剂必须满足两个条件:一是与原溶剂不互溶、不反应;二是溶质在萃取剂中的溶解度比在原溶剂中大。A项,酒精易溶于水;D项,食盐水易溶于水。
(5)对含碘的有机溶液进行水浴加热,并通过蒸馏提取碘单质和回收有机溶剂,观察下面实验装置图指出其中的错误之处:
①_________________________________________________________
②_________________________________________________________
(6)碘单质在________(填仪器名称)中形成晶体。
温度计水银球未与蒸馏烧瓶支管口处相平
冷凝水方向应下进上出
蒸馏烧瓶
5.空气吹出法是目前海水提溴的主要方法之一。海水提溴的流程如图所示:
(1)海水提取粗盐的方法通常采用________(填字母)。
A.蒸发结晶 B.蒸发浓缩、冷却结晶
(2)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:__________________________________ _____________________________。
(3)步骤⑧中蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。所用主要仪器的名称是________。
(4)步骤①②之后并未直接用含Br2的海水进行蒸馏得到液溴,而是经过“空气吹出”“SO2水溶液吸收”“Cl2氧化”后再蒸馏,这样操作的原因是
____________________________________________________。
A
温度过高,产生大量水蒸气,溴蒸气中水蒸
气增多;温度过低,溴不能完全蒸发
分液漏斗
“空气吹出”“SO2水溶液吸收”“Cl2氧化”的过程实际上是Br2的浓缩富集过程,与直接蒸馏含Br2的海水相比,蒸馏含溴的溶液效率更高,消耗能量更少,成本降低
解析:(1)NaCl溶解度随温度变化不大,因此通常采用蒸发结晶的方法从海水中获得粗盐。(2)步骤⑥的蒸馏过程中,温度过高,会产生大量水蒸气,溴蒸气中水蒸气含量增加;温度过低,溴不能完全蒸出。(4)步骤③④⑤的过程实际上是Br2的浓缩富集过程,与直接蒸馏含Br2的海水相比,蒸馏含溴的溶液效率更高,消耗能量更少,成本降低,效益更高。
练后感悟
溴、碘提取流程
(1)海水提溴的工艺流程:
(2)从海带中提取碘的工艺流程:
新苏教版 必修一 从海水中提取溴、从海带中提取碘
2.氯、溴、碘单质间的置换反应
实验操作 实验现象 反应的化学方程式
①溶液______ ②下层溶液显________色 _____________________
①溶液______ ②下层溶液显________色 _____________________
①溶液______ ②下层溶液显________色 _____________________
分层
橙红
Cl2+2KBr===2KCl+Br2
分层
紫红
Cl2+2KI===2KCl+I2
分层
紫红
Br2+2KI===2KBr+I2
二、溴、碘的提取及应用
(一)溴的提取及应用
1.海水提溴常选用氯气作氧化剂,一般要经历浓缩、氧化、提取等步骤
涉及的主要化学反应如下:
Cl2+2Br-===2Cl-+Br2(制粗溴)
SO2+Br2+2H2O===H2SO4+2HBr
Cl2+2HBr===2HCl+Br2
2.溴及其化合物的应用
溴多用于制备药物、感光剂等。如过去常用的消毒药剂“红药水”中就含有溴元素;溴化钾、溴化钠、溴化铵等可配成镇静剂,青霉素等药物生产也需要溴;溴还是制造农业杀虫剂、阻燃剂的原料;溴化银具有感光性,可被用作医疗X射线胶片上的感光剂。
(二)从海带中提取碘
1.从海带中提取碘
工业上以具有富集碘能力的海藻(如海带等)为原料获取碘:
化学反应原理:Cl2+2I-===2Cl-+I2。
2.加碘盐中的碘元素
存在形式:食盐中加“碘”以________形式存在。
检验原理:________________________,淀粉遇碘单质变________。
3.碘及其化合物的重要应用
(1)碘是重要的药用元素,可以用来生产含碘食品。
(2)__________用于人工降雨。
+6H+===3I2+3H2O
蓝
AgI
特别提醒
碘是人体必需的微量元素,是维持人体甲状腺正常功能所必需的元素。当人体缺碘时就会患甲状腺肿大,人们主要从饮水、粮食、蔬菜和周围环境中获取碘。多食海带、海鱼等含碘丰富的食品,对于防治甲状腺肿大很有效。在我国缺碘地区,人们主要通过食用加碘盐来补充碘元素。
[即时自测]
1.判断正误,正确的打“√”,错误的打“×”
(1)海水中含有溴单质。( )
(2)海带中含有的碘为化合态。( )
(3)将碘和砂子分离开可用升华法。( )
(4)用淀粉溶液可以检验加碘食盐中的碘。( )
(5)将CCl4加入Br2水中,上层呈橙红色。( )
(6)在海水里通入氯气可生成Br2。( )
×
√
√
×
×
√
2.已知溴易挥发,碘易升华,向含有NaBr和KI的混合溶液中通入过量氯气充分反应后将溶液蒸干,并灼烧所得物质,最后剩余的固体是( )
A.NaCl和KI B.NaCl、KCl和I2
C.KCl和NaBr D.KCl和NaCl
答案:D
3.溴又称为海洋元素,主要用于制取溴化物,并作为普通分析试剂和有机合成试剂用于医药、农药、染料、香料、摄影材料、灭火剂、选矿、冶金、鞣革、净水等方面。从海水中可以提取溴,主要反应之一为2KBr+Cl2===2KCl+Br2,下列说法中正确的是( )
A.溴离子具有氧化性
B.氯气是还原剂
C.该反应属于复分解反应
D.氯气氧化性比溴单质强
答案:D
4.海带提碘的实验中涉及灼烧、浸取、过滤、氧化、萃取五个步骤,下列操作能达到实验目的的是( )
A.实验室用装置甲灼烧干海带
B.装置乙中为加速液体流下使用玻璃棒搅拌
C.用装置丙从碘水中萃取单质碘
D.用装置丁吸收该实验中的氯气尾气
答案:C
提升点1 海水中提取溴
例1 溴元素主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备Br2的操作步骤为:
①在一定条件下,将Cl2通入浓缩的海水中,生成Br2;
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收生成的NaBr、NaBrO3等;
③用硫酸酸化步骤②得到的混合物。
完成下列填空:
(1)Cl2氧化Br-应在__________条件下进行,目的是避免____________________。
(2)Br2可用热空气吹出,其原因是__________。
(3)写出步骤③所发生的化学反应方程式
________________________________________。用硫酸而不用盐酸酸化的原因可能是______________________。步骤②的产品有时运输到目的地后再酸化,主要是因为__________________________。
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中________。
a.通入HBr b.加入Na2CO3溶液
c.加入NaBr溶液 d.加入Na2SO3溶液
除去Cl2的同时不能引入新杂质。
酸性
Cl2歧化生成HClO和HCl
Br2易挥发
3H2SO4+5NaBr+NaBrO3===3Na2SO4+3Br2+3H2O
能将氯离子氧化成氯气
单质溴具有强氧化性(或强腐蚀性)
ac
【解析】 (1)Cl2能与水发生可逆反应生成HCl和HClO,故Cl2氧化Br-应在酸性条件下进行。(3)步骤③所发生的反应是归中反应;盐酸有还原性,NaBrO3有氧化性,二者可发生氧化还原反应。
[提升1] 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:
请你参与分析讨论:
(1)图中仪器B的名称为__________。
(2)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是___________。
(3)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?__________________________________。
(4)C中液体产物颜色为________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________。
(5)D装置的作用是_________________________________。
直形冷凝管
Br2腐蚀橡胶
控制温度计b的温度,并收集59 ℃时的馏分
深红棕色
分液
吸收少量有毒性的溴蒸气,防止污染空气
解析:题图中从工业溴中提纯溴的方法是蒸馏法,先将蒸馏烧瓶在热水浴中加热,此时液体溴变成溴蒸气,经过冷凝管冷凝得到液溴。因为溴有强腐蚀性,所以装置中仪器连接均不能用橡胶塞和橡胶管;因为溴易挥发而且有毒性,所以D装置是尾气吸收装置,目的是除去少量有毒性的溴蒸气,防止污染空气。向残留少量Cl2的液溴中加入NaBr溶液,发生反应:Cl2+2NaBr===2NaCl+Br2,然后分液。
关键能力
海水中提取溴的流程与反应
(1)流程
(2)发生反应的化学方程式
①2NaBr+Cl2===Br2+2NaCl
②Br2+SO2+2H2O===2HBr+H2SO4
③2HBr+Cl2===2HCl+Br2
提升点2 海带中提取碘
海带灼烧便于含碘物质溶解。
例2 海带中含有丰富的碘。资料显示:海带中碘元素以I-的形式存在;苯的沸点是80.1 ℃;单质碘在高于150 ℃时易升华。某兴趣小组同学根据查阅的资料,设计下列实验方案,欲从海带中提取碘。请回答下列问题:
(1)步骤①②的实验目的是_____________________。
(2)步骤③中实验操作的名称是________。
(3)步骤④中可供选用的试剂有Cl2、Br2和H2O2(含稀硫酸),你认为最合适的试剂是______________。
(4)步骤⑤中提取碘时使用的主要玻璃仪器是________。
(5)步骤⑥中从含碘的苯溶液中获得固态的单质碘,应采用的方法是________(填字母)。
a.过滤 b.冷却结晶
c.加热蒸发 d.水浴蒸馏
将海带中的I-溶解到水中
过滤
H2O2(含稀硫酸)
分液漏斗
d
【解析】 (1)操作①、②的目的是使海带中的I-溶于水,便于后续提取操作。(2)步骤③是为了从海带灰悬浊液中得到含I-的溶液,固体和溶液分离采用过滤操作。(4)步骤⑤中提取碘利用的是萃取分液的方法,使用的主要玻璃仪器是分液漏斗。(5)因苯的沸点低,易挥发,且碘升华的温度不高,故应用水浴蒸馏的方法分离碘和苯。
[提升2] 从海带中提取碘单质,成熟的工艺流程如下:
下列关于海带制碘的说法,不正确的是( )
A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B.含I-的滤液中加入稀硫酸和双氧水后,碘离子发生氧化反应
C.在碘水中加入几滴淀粉溶液,溶液变蓝色
D.碘水中加入CCl4得到I2的CCl4溶液,该操作为“萃取”
状元随笔 固体加热用坩埚;溶液蒸发用蒸发皿。
答案:A
解析:灼烧固体时一般选用坩埚,蒸发皿一般用于蒸发溶液。
关键能力
从海带中提取碘
1.工艺流程
2.工艺流程说明
(1)干海带的浸泡液中含I-;
(2)加入硫酸的目的是酸化,加入氯气的目的是氧化I-。
提升点3 溴、碘的性质及检验
例3 已知常温下氯酸钾与浓盐酸反应放出氯气,现按如图进行卤素的性质实验。玻璃管内装有分别滴加不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
看清棉球为白色。
① ② ③ ④
A 黄绿色 橙色 蓝色 白色
B 无色 橙色 紫色 白色
C 黄绿色 橙色 蓝色 无色
D 黄绿色 无色 紫色 白色
【答案】 A
【解析】 常温下氯酸钾与浓盐酸反应放出Cl2,氯气的颜色是黄绿色①处充满黄绿色Cl2;氯气进入玻璃管后与②处NaBr溶液发生置换反应生成Br2,液溴的水溶液颜色为橙色,所以白色棉球变为橙色;氯气和③处KI溶液反应置换出I2,遇淀粉变蓝;④处利用氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠的水溶液,用来进行Cl2的尾气吸收,尽管反应生成的物质均为无色,但棉球本身是白色的,所以④处的颜色为白色。
[提升3] 只用一种试剂就能区别NaCl、NaBr、NaI三种溶液,该试剂可用( )
①AgNO3溶液 ②氯水 ③溴水 ④碘水
A.①② B.①③
C.②③ D.②④
答案:A
解析:①均与硝酸银反应,分别生成白色沉淀、浅黄色沉淀、黄色沉淀,现象不同,可鉴别,故选;②氯水与NaBr反应生成橙色溶液、氯水与NaI反应生成紫色溶液,NaCl与氯水不反应,现象不同,可鉴别,故选;③溴水不能鉴别NaCl、NaBr,故不选;④碘水与三种溶液均不反应,现象相同,不能鉴别,故不选。
关键能力
1.Cl2、Br2、I2在水及有机溶剂中的颜色
2.卤素离子的检验方法
(1)AgNO3溶液——沉淀法
水 CCl4 汽油
Cl2 黄绿色 黄绿色 黄绿色
Br2 黄→橙 橙→橙红 橙→橙红
I2 深黄→褐 紫→深紫 浅紫红→紫红
(2)置换——萃取法
(3)置换——淀粉法检验I-
1.稀的碘水和溴水的颜色非常浅,近乎无色。区分稀碘水和稀溴水时,所用的最佳试剂是( )
A.淀粉溶液 B.氯水
C.NaOH溶液 D.NaBr溶液
答案:A
解析:氯水、NaBr溶液与溴水、碘水都不反应,NaOH溶液与二者都反应,二者都褪色,现象相同,不能区分;淀粉遇I2变蓝色。
2.将氯水注入KI溶液中,用力振荡,再注入四氯化碳,振荡后静置,看到的现象是( )
A.液体为紫红色
B.液体为无色
C.液体分两层,上层为紫红色,下层接近无色
D.液体分两层,上层接近无色,下层为紫红色
答案:D
解析:Cl2将I-氧化生成I2,I2被CCl4萃取,所以上层接近无色,下层为紫红色。
3.下列物质与其用途相符的是( )
①Cl2——作消毒剂; ②AgBr——制胶卷、感光纸;
③AgI——人工降雨; ④加碘食盐——预防甲状腺肿大;
⑤淀粉——检验I2的存在; ⑥NaClO——漂白纺织物。
A.②③④⑤⑥ B.①②④⑤⑥
C.②③④⑤ D.全部
答案:D
解析:Cl2与水反应生成次氯酸,次氯酸可作消毒剂,用于杀菌消毒,①正确;AgBr不稳定,分解生成银,可用来制胶卷、感光纸,②正确;AgI易与空气中的水蒸气结合形成晶核,有利于水汽粒子的碰撞增大,从而形成雨,③正确;碘是预防甲状腺肿大的主要元素,④正确;淀粉遇碘变蓝,可用来检验碘单质,⑤正确;NaClO与二氧化碳、水反应生成次氯酸,次氯酸具有强氧化性,可用于漂白纺织物,⑥正确。故选D。
4.波力海苔以深海紫菜为原料,经烤熟之后质地脆嫩,入口即化,是一种富含碘的海洋食品。某化学兴趣小组从紫菜中提取碘的流程如下图:
(1)实验室灼烧紫菜,需要下列仪器中的________(填字母)。
a.试管 b.烧杯 c.坩埚
d.泥三角 e.铁三脚架 f.酒精灯
(2)实验操作②中若改用稀硫酸酸化的H2O2(少量)氧化NaI也能得到I2,同时有水和硫酸盐生成,写出该反应的化学方程式:__________________________________。
(3)提取碘的过程中实验操作③的名称是__________。
(4)实验操作③过程中,可选择的有机试剂是________。
A.酒精 B.苯
C.四氯化碳 D.食盐水
cdef
2NaI+H2SO4+H2O2===Na2SO4+I2+2H2O
萃取、分液
BC
解析:(1)灼烧在坩埚中进行,坩埚需放在泥三角上,而泥三角又要放在三脚架上,然后用酒精灯灼烧。(2)由题意知,反应物为NaI、H2SO4和H2O2,生成物为Na2SO4、I2和H2O,根据原子守恒、得失电子守恒配平反应方程式即可。(3)由流程图可知,操作③是将碘的水溶液变为碘的有机溶液,故应加入有机溶剂进行萃取,然后再进行分液。(4)萃取剂必须满足两个条件:一是与原溶剂不互溶、不反应;二是溶质在萃取剂中的溶解度比在原溶剂中大。A项,酒精易溶于水;D项,食盐水易溶于水。
(5)对含碘的有机溶液进行水浴加热,并通过蒸馏提取碘单质和回收有机溶剂,观察下面实验装置图指出其中的错误之处:
①_________________________________________________________
②_________________________________________________________
(6)碘单质在________(填仪器名称)中形成晶体。
温度计水银球未与蒸馏烧瓶支管口处相平
冷凝水方向应下进上出
蒸馏烧瓶
5.空气吹出法是目前海水提溴的主要方法之一。海水提溴的流程如图所示:
(1)海水提取粗盐的方法通常采用________(填字母)。
A.蒸发结晶 B.蒸发浓缩、冷却结晶
(2)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因:__________________________________ _____________________________。
(3)步骤⑧中蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。所用主要仪器的名称是________。
(4)步骤①②之后并未直接用含Br2的海水进行蒸馏得到液溴,而是经过“空气吹出”“SO2水溶液吸收”“Cl2氧化”后再蒸馏,这样操作的原因是
____________________________________________________。
A
温度过高,产生大量水蒸气,溴蒸气中水蒸
气增多;温度过低,溴不能完全蒸发
分液漏斗
“空气吹出”“SO2水溶液吸收”“Cl2氧化”的过程实际上是Br2的浓缩富集过程,与直接蒸馏含Br2的海水相比,蒸馏含溴的溶液效率更高,消耗能量更少,成本降低
解析:(1)NaCl溶解度随温度变化不大,因此通常采用蒸发结晶的方法从海水中获得粗盐。(2)步骤⑥的蒸馏过程中,温度过高,会产生大量水蒸气,溴蒸气中水蒸气含量增加;温度过低,溴不能完全蒸出。(4)步骤③④⑤的过程实际上是Br2的浓缩富集过程,与直接蒸馏含Br2的海水相比,蒸馏含溴的溶液效率更高,消耗能量更少,成本降低,效益更高。
练后感悟
溴、碘提取流程
(1)海水提溴的工艺流程:
(2)从海带中提取碘的工艺流程:
