化学人教版(2019)必修第一册1.1物质的分类及转化 课件(共34张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.1物质的分类及转化 课件(共34张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 10.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-29 17:48:48 | ||
图片预览








文档简介
(共34张PPT)
第一章 第一节
物质的分类及转化
如何在琳琅满目的货品中找到需要的商品?
活动一:将下列物质分类,并说明分类依据。
空气、乙醇、铜丝、铁、碘酒、氧气、水、盐酸、
小苏打、石墨、金刚石、臭氧。
根据物质的组成
混合物:空气、碘酒、盐酸
纯净物:乙醇、铜丝、铁、氧气、水、小苏打、石墨、金刚石、臭氧
根据物质的状态
气体:空气、氧气、臭氧 液体:乙醇、碘酒、盐酸
固体:铜丝、铁、小苏打 、石墨、金刚石
写出下列纯净物的化学式:
乙醇、铜丝、铁、氧气、水、小苏打、石墨、金刚石、臭氧
根据元素的组成
单质:由同种元素组成的纯净物。
铁、氧气、石墨、金刚石、臭氧
化合物:由两种或两种以上的元素组成的纯净物。
乙醇、水、小苏打
氧气:O2、臭氧:O3;石墨、金刚石:C
同素异形体:由同一种元素形成的几种性质不同的单质。
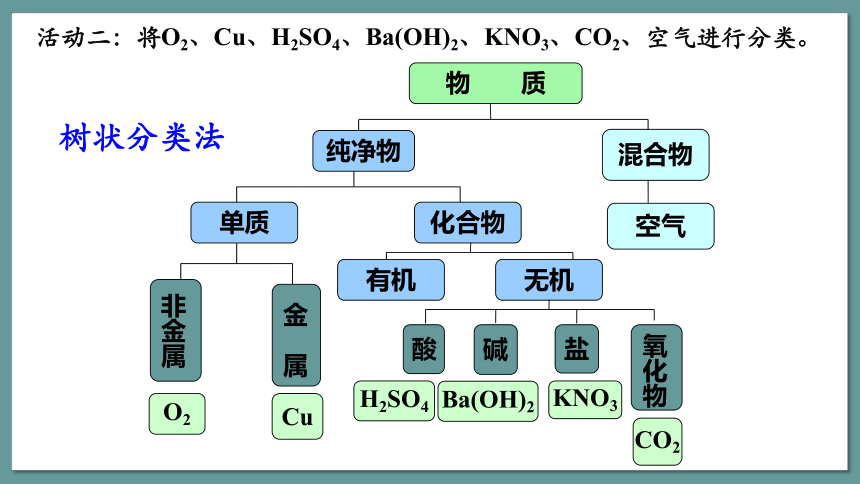
物 质
纯净物
混合物
空气
化合物
单质
盐
碱
酸
非金属
金 属
氧化物
活动二:将O2、Cu、H2SO4、Ba(OH)2、KNO3、CO2、空气进行分类。
有机
无机
O2
Cu
H2SO4
Ba(OH)2
KNO3
CO2
树状分类法
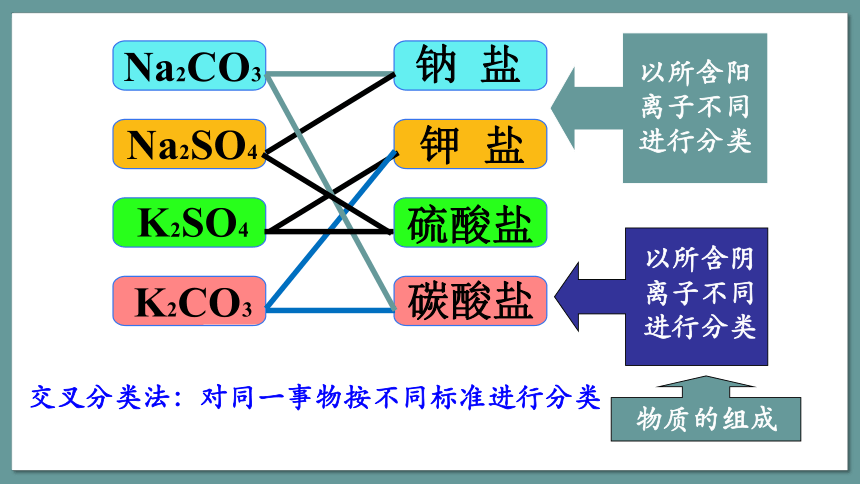
以所含阳离子不同进行分类
以所含阴离子不同进行分类
物质的组成
交叉分类法:对同一事物按不同标准进行分类
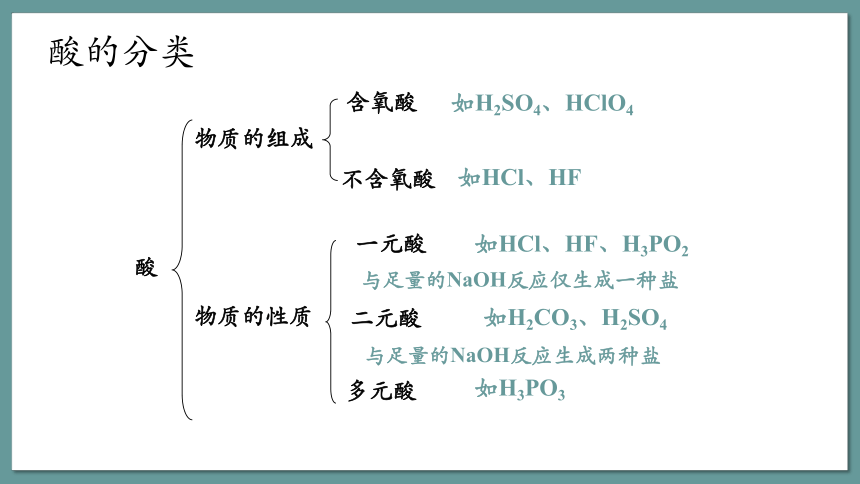
酸
物质的组成
含氧酸
如H2SO4、HClO4
不含氧酸
如HCl、HF
物质的性质
二元酸
一元酸
如HCl、HF、H3PO2
如H2CO3、H2SO4
多元酸
如H3PO3
与足量的NaOH反应仅生成一种盐
与足量的NaOH反应生成两种盐
酸的分类
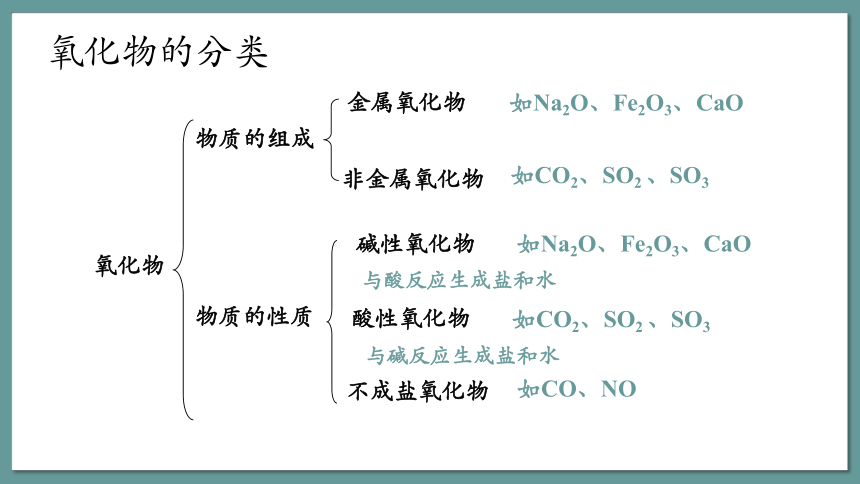
氧化物
物质的组成
金属氧化物
如Na2O、Fe2O3、CaO
非金属氧化物
如CO2、SO2 、SO3
物质的性质
酸性氧化物
碱性氧化物
如Na2O、Fe2O3、CaO
如CO2、SO2 、SO3
不成盐氧化物
如CO、NO
与酸反应生成盐和水
与碱反应生成盐和水
氧化物的分类
氧化物的分类
金属氧化物是否都是碱性氧化物?
碱性氧化物是否都是金属氧化物?
酸性氧化物是否都是非金属氧化物?
特例:
Mn2O7+2NaOH==2NaMnO4+H2O
Mn2O7 ——酸性氧化物
错
错
对
(1)CuSO4·5H2O属于混合物。
(2)只由一种元素组成的物质一定是纯净物。
(3)非金属氧化物一定是酸性氧化物。
(4)金属氧化物一定是碱性氧化物。
(5)酸性氧化物都能与水化合生成酸。
判断正误
1、树状分类法、交叉分类法
2、标准:物质的组成 or 物质的性质
以氧化物为例:
组成——金属氧化物、非金属氧化物
性质——酸性氧化物、碱性氧化物、不成盐氧化物
总结
是否能够再分类?
常见的混合物有哪些?
溶液、悬浊液、乳浊液
分散系及其分类
1.分散系:分散系是将一种(或多种)物质分散到另一种(或多种)物质形成的混合物。
2. 组成:
(1)分散质:被分散成粒子的物质;
(2)分散剂:容纳分散质的物质。
举例 分散系
分散质
分散剂
CuSO4溶液
NaOH乙醇溶液
CuSO4晶体
NaOH
水
乙醇
分散系及其分类
3.分类:
按分散质微粒直径大小
0 1nm 100nm
溶液
胶体
浊液
分散质
粒子直径
(1nm = 10-9m)
分散系
胶体
浊液
溶液
悬浊液
乳浊液
分散系及其分类
4. 常见的胶体(根据分散剂的状态分类):
(1)气溶胶:______________________________________。
(2)液溶胶:______________________________________。
(3)固溶胶:______________________________________。
烟、云、雾
牛奶、豆浆、淀粉溶液
有色玻璃、土壤胶体
分散系及其分类
5、实验:Fe(OH)3胶体的制备
(1)原理:____________________________________;(2)步骤:往______中加入5~6滴______________溶液,继续加热直到溶液呈现________,停止加热。
(3)注:不能用稀FeCl3溶液、NaOH溶液及氨水制备胶体,且制备胶体时不能搅拌,不能加热过度。
FeCl3+ 3H2O Fe(OH)3(胶体)+ 3HCl
沸水
饱和FeCl3
红褐色
[实验1+1]
分散系及其分类
6、丁达尔效应
(1)概念:当光束通过胶体时,可以看到“一条光亮的通路”
(2)应用:区别溶液与胶体。
注意:
丁达尔效应是区别溶液与胶体的物理方法,但不是溶液与
胶体的本质区别。
晨光穿过森林,梦幻般的光线
夜市中美丽的霓虹灯
分散系 溶液 浊液 胶体
分散质微粒直径
分散质微粒组成
外观特征 稳定性
能否透过滤纸 (孔径100nm)
能否透过半透膜(孔径1nm)
<1nm
>100nm
1nm~100nm
分子、离子
大量粒子聚集体
大量分子聚集体
均一 透明
稳定
不均一 不稳定
较均一 透明
介稳性
能
不能
能
能
不能
不能
总结:分散系的比较
丁达尔效应
(1)所有分散系均属于混合物。
(2)直径在1-100nm的粒子称为胶体。
(3)溶液、胶体、浊液的本质区别是分散质粒子的直径大小。
(4)根据丁达尔效应将分散系分为溶液、胶体、浊液。
(5)将稀FeCl3溶液滴加到沸水中即可得到氢氧化铁胶体。
判断正误
同类物质具有相似的性质
酸的主要化学性质 反应实例(化学方程式 ) 反应类型
酸与活泼金属反应
酸与碱性氧化物反应
酸与碱反应
酸与某些盐反应
指示剂
Cu(OH)2 +H2SO4 =CuSO4 +2H2O
BaCl2 +H2SO4 =BaSO4 ↓+2HCl
Fe + H2SO4 =FeSO4 + H2↑
Fe2O3 + 3H2SO4 =Fe2(SO4)3 +3H2O
置换反应
复分解反应
复分解反应
复分解反应
使紫色石蕊试液变红色,无色酚酞试液不变色
1、酸、碱、盐的化学性质
活动四:参照酸的化学性质,分别归纳碱与盐的化学性质。
碱的主要化学性质 反应实例(化学方程式 ) 反应类型
碱与酸性氧化物反应
碱与酸反应
碱与某些盐反应
指示剂
NaOH+HCl=NaCl+H2O
2NaOH+CuSO4 =Cu(OH)2 ↓+Na2SO4
CO2+2NaOH =Na2CO3+H2O
复分解反应
复分解反应
复分解反应
使紫色石蕊试液变蓝色,无色酚酞试液变红色
盐的主要化学性质 反应实例(化学方程式 ) 反应类型
与金属反应
与酸反应
与碱反应
与某些盐反应
Fe +CuSO4 =Cu+FeSO4
CaCO3+2HCl=CaCl2+H2O+CO2↑
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
NaCl+AgNO3=AgCl↓+NaNO3
置换反应
复分解反应
复分解反应
复分解反应
复分解反应
酸、碱、盐相互反应
为什么不同的酸 (或碱 )具有相似的化学性质
宏观辨识
组成相似
微观探析
H+
HCl
H2SO4
HNO3
NaOH
KOH
Ba(OH)2
Na2CO3
K2CO3
(NH4)2CO3
OH-
CO32-
结构
决定
性质
2.物质的转化
酸性氧化物→SO2 + H2O→H2SO3 (酸)
碱性氧化物→CaO + H2O→Ca(OH)2(碱)
H2SiO3,Fe(OH)3无法通过该方法制得
盐+酸/碱→新盐+新酸/新碱
Na2SiO3+H2SO4==H2SiO3↓+Na2SO4
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
可溶性
酸or碱
活动五:写出下列物质之间的转化的化学方程式。
Ca
CaO
Ca(OH)2
CaSO4
①
②
③
2Ca+O2=2CaO
①
CaO+H2O=Ca(OH)2
②
Ca(OH)2+H2SO4=CaSO4↓+2H2O
Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4↓
③
Ca(OH)2+SO3=CaSO4↓+H2O
CO2+H2O=H2CO3
⑤
Ca(OH)2+H2CO3=CaCO3↓+2H2O
⑥
C
CO2
H2CO3
CaCO3
④
⑤
⑥
④
C+O2====CO2
点燃
金属
碱性氧化物
碱
盐
O2
H2O
非金属单质
酸性氧化物
酸
盐
O2
H2O
酸或酸性氧化物
碱或碱性氧化物
(1)可用Fe2O3与H2O反应制取Fe(OH)3。
(2)非金属单质与氧气反应一定得到酸性氧化物。
(3)碱性氧化物都能与水化合生成碱,酸性氧化物都能与水化合生成酸。
(4)由硫酸可以与氯化钡反应,可类推盐酸也可与氯化钡反应。
(5)利用稀硫酸或盐酸与块状石灰石反应,都可制取CO2。
判断正误
思考:要制取氢氧化钠可以采用哪些方法
(1)碱性氧化物与水反应
Na2O + H2O = 2NaOH
(2)用盐与另一种碱反应
工业上如何制取氢氧化钠
Na2CO3 + Ca(OH)2 ═ CaCO3 + 2NaOH
2NaCl + 2H2O ==== 2NaOH + H2↑ + Cl2↑
通电
工业生产除要考虑反应进行的可能性外,还要考虑原料来源、成本高低和设备要求等因素。
一般不采用反应Na2O+H2O = 2NaOH,原因是Na2O来源少、成本高。
总结
物质的分类及转化
同类物质往往具有相似的性质
酸的化学性质:
①酸可以与活泼金属反应;②酸可以与碱性氧化物反应;③酸可以与碱反应;④酸可以与某些盐反应;⑤酸可以使紫色石蕊试剂变红
碱的化学性质:
①碱可以与非金属氧化物反应;②碱可以与酸反应;
③碱可以与某些盐反应;④碱可以使酚酞试剂变红,使紫色石蕊试剂变蓝
盐的化学性质:
①盐可以与金属反应;②盐可以与酸反应;
③盐可以与碱反应;④盐可以与某些盐反应
物质的转化:
根据物质的组成和性质,通过化学变化实现物质之间的转化。
第一章 第一节
物质的分类及转化
如何在琳琅满目的货品中找到需要的商品?
活动一:将下列物质分类,并说明分类依据。
空气、乙醇、铜丝、铁、碘酒、氧气、水、盐酸、
小苏打、石墨、金刚石、臭氧。
根据物质的组成
混合物:空气、碘酒、盐酸
纯净物:乙醇、铜丝、铁、氧气、水、小苏打、石墨、金刚石、臭氧
根据物质的状态
气体:空气、氧气、臭氧 液体:乙醇、碘酒、盐酸
固体:铜丝、铁、小苏打 、石墨、金刚石
写出下列纯净物的化学式:
乙醇、铜丝、铁、氧气、水、小苏打、石墨、金刚石、臭氧
根据元素的组成
单质:由同种元素组成的纯净物。
铁、氧气、石墨、金刚石、臭氧
化合物:由两种或两种以上的元素组成的纯净物。
乙醇、水、小苏打
氧气:O2、臭氧:O3;石墨、金刚石:C
同素异形体:由同一种元素形成的几种性质不同的单质。
物 质
纯净物
混合物
空气
化合物
单质
盐
碱
酸
非金属
金 属
氧化物
活动二:将O2、Cu、H2SO4、Ba(OH)2、KNO3、CO2、空气进行分类。
有机
无机
O2
Cu
H2SO4
Ba(OH)2
KNO3
CO2
树状分类法
以所含阳离子不同进行分类
以所含阴离子不同进行分类
物质的组成
交叉分类法:对同一事物按不同标准进行分类
酸
物质的组成
含氧酸
如H2SO4、HClO4
不含氧酸
如HCl、HF
物质的性质
二元酸
一元酸
如HCl、HF、H3PO2
如H2CO3、H2SO4
多元酸
如H3PO3
与足量的NaOH反应仅生成一种盐
与足量的NaOH反应生成两种盐
酸的分类
氧化物
物质的组成
金属氧化物
如Na2O、Fe2O3、CaO
非金属氧化物
如CO2、SO2 、SO3
物质的性质
酸性氧化物
碱性氧化物
如Na2O、Fe2O3、CaO
如CO2、SO2 、SO3
不成盐氧化物
如CO、NO
与酸反应生成盐和水
与碱反应生成盐和水
氧化物的分类
氧化物的分类
金属氧化物是否都是碱性氧化物?
碱性氧化物是否都是金属氧化物?
酸性氧化物是否都是非金属氧化物?
特例:
Mn2O7+2NaOH==2NaMnO4+H2O
Mn2O7 ——酸性氧化物
错
错
对
(1)CuSO4·5H2O属于混合物。
(2)只由一种元素组成的物质一定是纯净物。
(3)非金属氧化物一定是酸性氧化物。
(4)金属氧化物一定是碱性氧化物。
(5)酸性氧化物都能与水化合生成酸。
判断正误
1、树状分类法、交叉分类法
2、标准:物质的组成 or 物质的性质
以氧化物为例:
组成——金属氧化物、非金属氧化物
性质——酸性氧化物、碱性氧化物、不成盐氧化物
总结
是否能够再分类?
常见的混合物有哪些?
溶液、悬浊液、乳浊液
分散系及其分类
1.分散系:分散系是将一种(或多种)物质分散到另一种(或多种)物质形成的混合物。
2. 组成:
(1)分散质:被分散成粒子的物质;
(2)分散剂:容纳分散质的物质。
举例 分散系
分散质
分散剂
CuSO4溶液
NaOH乙醇溶液
CuSO4晶体
NaOH
水
乙醇
分散系及其分类
3.分类:
按分散质微粒直径大小
0 1nm 100nm
溶液
胶体
浊液
分散质
粒子直径
(1nm = 10-9m)
分散系
胶体
浊液
溶液
悬浊液
乳浊液
分散系及其分类
4. 常见的胶体(根据分散剂的状态分类):
(1)气溶胶:______________________________________。
(2)液溶胶:______________________________________。
(3)固溶胶:______________________________________。
烟、云、雾
牛奶、豆浆、淀粉溶液
有色玻璃、土壤胶体
分散系及其分类
5、实验:Fe(OH)3胶体的制备
(1)原理:____________________________________;(2)步骤:往______中加入5~6滴______________溶液,继续加热直到溶液呈现________,停止加热。
(3)注:不能用稀FeCl3溶液、NaOH溶液及氨水制备胶体,且制备胶体时不能搅拌,不能加热过度。
FeCl3+ 3H2O Fe(OH)3(胶体)+ 3HCl
沸水
饱和FeCl3
红褐色
[实验1+1]
分散系及其分类
6、丁达尔效应
(1)概念:当光束通过胶体时,可以看到“一条光亮的通路”
(2)应用:区别溶液与胶体。
注意:
丁达尔效应是区别溶液与胶体的物理方法,但不是溶液与
胶体的本质区别。
晨光穿过森林,梦幻般的光线
夜市中美丽的霓虹灯
分散系 溶液 浊液 胶体
分散质微粒直径
分散质微粒组成
外观特征 稳定性
能否透过滤纸 (孔径100nm)
能否透过半透膜(孔径1nm)
<1nm
>100nm
1nm~100nm
分子、离子
大量粒子聚集体
大量分子聚集体
均一 透明
稳定
不均一 不稳定
较均一 透明
介稳性
能
不能
能
能
不能
不能
总结:分散系的比较
丁达尔效应
(1)所有分散系均属于混合物。
(2)直径在1-100nm的粒子称为胶体。
(3)溶液、胶体、浊液的本质区别是分散质粒子的直径大小。
(4)根据丁达尔效应将分散系分为溶液、胶体、浊液。
(5)将稀FeCl3溶液滴加到沸水中即可得到氢氧化铁胶体。
判断正误
同类物质具有相似的性质
酸的主要化学性质 反应实例(化学方程式 ) 反应类型
酸与活泼金属反应
酸与碱性氧化物反应
酸与碱反应
酸与某些盐反应
指示剂
Cu(OH)2 +H2SO4 =CuSO4 +2H2O
BaCl2 +H2SO4 =BaSO4 ↓+2HCl
Fe + H2SO4 =FeSO4 + H2↑
Fe2O3 + 3H2SO4 =Fe2(SO4)3 +3H2O
置换反应
复分解反应
复分解反应
复分解反应
使紫色石蕊试液变红色,无色酚酞试液不变色
1、酸、碱、盐的化学性质
活动四:参照酸的化学性质,分别归纳碱与盐的化学性质。
碱的主要化学性质 反应实例(化学方程式 ) 反应类型
碱与酸性氧化物反应
碱与酸反应
碱与某些盐反应
指示剂
NaOH+HCl=NaCl+H2O
2NaOH+CuSO4 =Cu(OH)2 ↓+Na2SO4
CO2+2NaOH =Na2CO3+H2O
复分解反应
复分解反应
复分解反应
使紫色石蕊试液变蓝色,无色酚酞试液变红色
盐的主要化学性质 反应实例(化学方程式 ) 反应类型
与金属反应
与酸反应
与碱反应
与某些盐反应
Fe +CuSO4 =Cu+FeSO4
CaCO3+2HCl=CaCl2+H2O+CO2↑
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
NaCl+AgNO3=AgCl↓+NaNO3
置换反应
复分解反应
复分解反应
复分解反应
复分解反应
酸、碱、盐相互反应
为什么不同的酸 (或碱 )具有相似的化学性质
宏观辨识
组成相似
微观探析
H+
HCl
H2SO4
HNO3
NaOH
KOH
Ba(OH)2
Na2CO3
K2CO3
(NH4)2CO3
OH-
CO32-
结构
决定
性质
2.物质的转化
酸性氧化物→SO2 + H2O→H2SO3 (酸)
碱性氧化物→CaO + H2O→Ca(OH)2(碱)
H2SiO3,Fe(OH)3无法通过该方法制得
盐+酸/碱→新盐+新酸/新碱
Na2SiO3+H2SO4==H2SiO3↓+Na2SO4
FeCl3+3NaOH==Fe(OH)3↓+3NaCl
可溶性
酸or碱
活动五:写出下列物质之间的转化的化学方程式。
Ca
CaO
Ca(OH)2
CaSO4
①
②
③
2Ca+O2=2CaO
①
CaO+H2O=Ca(OH)2
②
Ca(OH)2+H2SO4=CaSO4↓+2H2O
Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4↓
③
Ca(OH)2+SO3=CaSO4↓+H2O
CO2+H2O=H2CO3
⑤
Ca(OH)2+H2CO3=CaCO3↓+2H2O
⑥
C
CO2
H2CO3
CaCO3
④
⑤
⑥
④
C+O2====CO2
点燃
金属
碱性氧化物
碱
盐
O2
H2O
非金属单质
酸性氧化物
酸
盐
O2
H2O
酸或酸性氧化物
碱或碱性氧化物
(1)可用Fe2O3与H2O反应制取Fe(OH)3。
(2)非金属单质与氧气反应一定得到酸性氧化物。
(3)碱性氧化物都能与水化合生成碱,酸性氧化物都能与水化合生成酸。
(4)由硫酸可以与氯化钡反应,可类推盐酸也可与氯化钡反应。
(5)利用稀硫酸或盐酸与块状石灰石反应,都可制取CO2。
判断正误
思考:要制取氢氧化钠可以采用哪些方法
(1)碱性氧化物与水反应
Na2O + H2O = 2NaOH
(2)用盐与另一种碱反应
工业上如何制取氢氧化钠
Na2CO3 + Ca(OH)2 ═ CaCO3 + 2NaOH
2NaCl + 2H2O ==== 2NaOH + H2↑ + Cl2↑
通电
工业生产除要考虑反应进行的可能性外,还要考虑原料来源、成本高低和设备要求等因素。
一般不采用反应Na2O+H2O = 2NaOH,原因是Na2O来源少、成本高。
总结
物质的分类及转化
同类物质往往具有相似的性质
酸的化学性质:
①酸可以与活泼金属反应;②酸可以与碱性氧化物反应;③酸可以与碱反应;④酸可以与某些盐反应;⑤酸可以使紫色石蕊试剂变红
碱的化学性质:
①碱可以与非金属氧化物反应;②碱可以与酸反应;
③碱可以与某些盐反应;④碱可以使酚酞试剂变红,使紫色石蕊试剂变蓝
盐的化学性质:
①盐可以与金属反应;②盐可以与酸反应;
③盐可以与碱反应;④盐可以与某些盐反应
物质的转化:
根据物质的组成和性质,通过化学变化实现物质之间的转化。
