化学人教版(2019)选择性必修2 1.2原子结构与元素的性质 课件(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 1.2原子结构与元素的性质 课件(共21张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 17.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-29 00:00:00 | ||
图片预览






文档简介
(共21张PPT)
第一章 原子结构与性质
第二节 原子结构与元素的性质
一、原子结构与元素周期表——复习元素周期表
(1)完成周期表的轮廓图,画出金属与非金属的分界线
(2)在最上方从左到右标出族名,并写出第IA族和0族所有元素的原子序数
(3)标出所有主族元素和0族元素的元素符号
*要求熟记前36号元素的原子序数、元素名称及元素符号;所有主族元素、0族元素的名称和元素符号,能够通过推导得出原子序数
IA IIA IIIB IVB VB VIB VIIB VIII IB IIB IIIA IVA VA VIA VIIA 0
H
Li
Na
K
Rb
Cs
F
1
3
11
19
37
55
87
He
Ne
Ar
Kr
Xe
Rn
2
10
18
36
54
86
118
B
Al
Ga
In
Tl
C
Si
Ge
Sn
Pb
N
P
As
Sb
Bi
O
S
Se
Te
Po
F
Cl
Br
I
At
Be
Mg
Ca
Sr
Ba
Ra
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
锕系
镧系
(1)用简化电子排布式表示出19~36号元素原子
一、原子结构与元素周期表——重新认识元素周期表
K
Ca Cu
Sc Zn
Ti Ga
V Ge
Cr As
Mn Xe
Fe Br
Co Kr
Ni
[Ar]4s1
[Ar]4s2
[Ar]3d14s2
[Ar]3d24s2
[Ar]3d34s2
[Ar]3d54s1
[Ar]3d54s2
[Ar]3d64s2
[Ar]3d74s2
[Ar]3d84s2
[Ar]3d104s1
[Ar]3d104s2
[Ar]3d104s24p1
[Ar]3d104s24p2
[Ar]3d104s24p3
[Ar]3d104s24p4
[Ar]3d104s24p5
[Ar]3d104s24p6
最后填充的电子进入4s轨道
最后填充的电子进入3d轨道(Cr除外)
最后填充的电子进入4p轨道
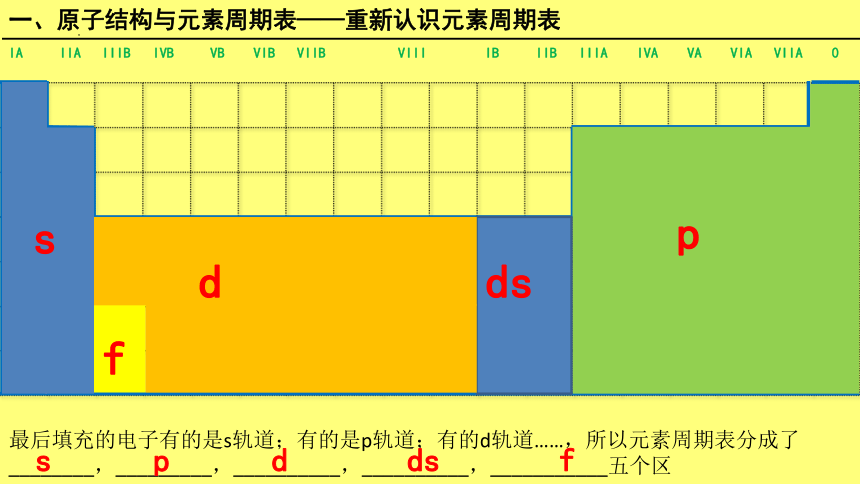
最后填充的电子有的是s轨道;有的是p轨道;有的d轨道……,所以元素周期表分成了
________,_________,__________,__________,___________五个区
s p d ds f
一、原子结构与元素周期表——重新认识元素周期表
最后填充的电子有的是s轨道;有的是p轨道;有的d轨道……,所以元素周期表分成了
________,_________,__________,__________,___________五个区
s p d ds f
IA IIA IIIB IVB VB VIB VIIB VIII IB IIB IIIA IVA VA VIA VIIA 0
s
p
d
ds
f
一、原子结构与元素周期表——重新认识元素周期表
(2)价电子数与族名的关系
1 2 3 4 5 6 7 8 9 10 11 12 3 4 5 6 7 8
价电子数为1或2; 价电子数为3~8; 价电子数为9~12;
一、原子结构与元素周期表——重新认识元素周期表
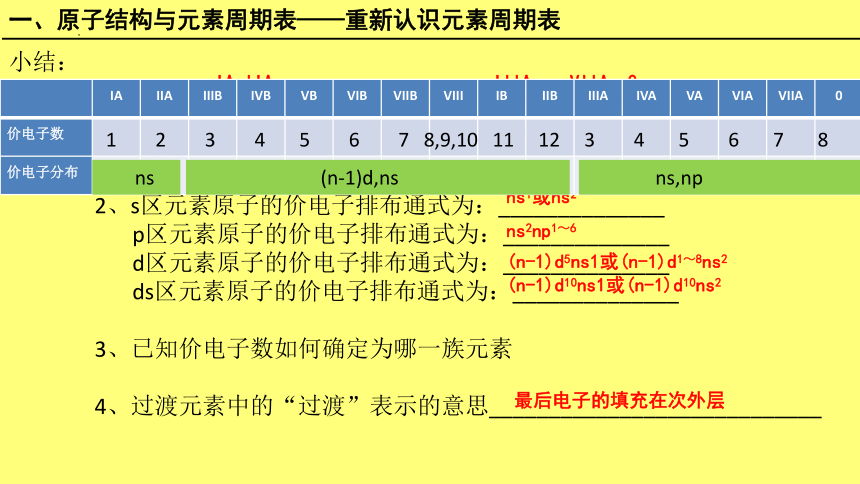
小结:
1、s区包括________族;p区包括____________________族;
d区包括_____________族; ds区包括____________族;
f区为________________。
2、s区元素原子的价电子排布通式为:______________
p区元素原子的价电子排布通式为:______________
d区元素原子的价电子排布通式为:______________
ds区元素原子的价电子排布通式为:______________
3、已知价电子数如何确定为哪一族元素
4、过渡元素中的“过渡”表示的意思____________________________
IA,IIA
IIIA——VIIA,0
IIIB——VIII
IB,IIB
镧系,锕系元素
ns1或ns2
ns2np1~6
(n-1)d5ns1或(n-1)d1~8ns2
(n-1)d10ns1或(n-1)d10ns2
IA IIA IIIB IVB VB VIB VIIB VIII IB IIB IIIA IVA VA VIA VIIA 0
价电子数
价电子分布
1 2 3 4 5 6 7 8,9,10 11 12 3 4 5 6 7 8
ns
(n-1)d,ns
ns,np
最后电子的填充在次外层
课后练习1
1、根据前四周期元素原子核外电子排布特点,回答下列问题:
(1)价电子层有2个未成对电子的有_______________________;
有3个未成对电子的有___________________________________________________。
(2)未成对电子数与周期数相等的元素有_________________。
2、第四周期中,未成对电子数最多的元素是________(填名称)。
(1)它位于________族。
(2)核外电子排布式是________。
(3)它有________个能层,________个能级,________种运动状态不同的电子。
(4)价电子排布式________,价电子排布图_________________________________。
(5)属于________区。
3、根据4s24p4回答问题:该元素位于________区,为第________周期________族,
是________元素(填名称)。
课后作业:《点金训练》第二节第一课时
二、元素周期律——复习元素周期律
(1)元素周期律的内容——元素性质随着原子序数的递增而呈现周期性的变化
(2)具体表现
同周期从左到右:原子半径逐渐减小,
元素化合价最高正价重复出现+1~+7(O、F除外),最低负价重复出现-4 ~ -1,
元素的金属性逐渐减弱,元素的非金属性逐渐增强
同主族从上到下:原子半径逐渐增大,
元素化合价最高正价相同(O、F除外),最低负价相同(金属除外),
元素的金属性逐渐增强,元素的非金属性逐渐减弱
(3)元素周期律的实质:是元素原子的核外电子排布呈现周期性变化的结果
金属性可理解为原子失电子的性质;非金属性可理解为原子得电子的性质
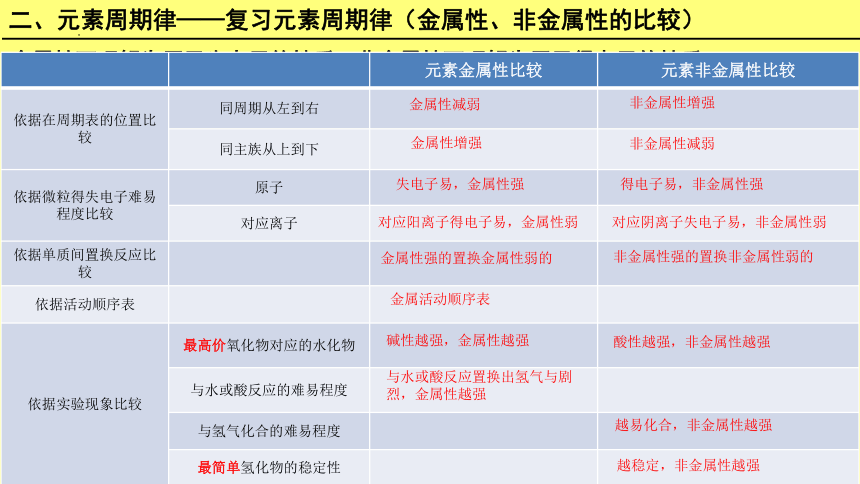
二、元素周期律——复习元素周期律(金属性、非金属性的比较)
元素金属性比较 元素非金属性比较
依据在周期表的位置比较 同周期从左到右
同主族从上到下
依据微粒得失电子难易程度比较 原子
对应离子
依据单质间置换反应比较
依据活动顺序表
依据实验现象比较 最高价氧化物对应的水化物
与水或酸反应的难易程度
与氢气化合的难易程度
最简单氢化物的稳定性
金属性减弱
非金属性增强
金属性增强
非金属性减弱
失电子易,金属性强
得电子易,非金属性强
对应阴离子失电子易,非金属性弱
对应阳离子得电子易,金属性弱
金属性强的置换金属性弱的
非金属性强的置换非金属性弱的
金属活动顺序表
碱性越强,金属性越强
酸性越强,非金属性越强
越易化合,非金属性越强
越稳定,非金属性越强
与水或酸反应置换出氢气与剧烈,金属性越强
二、元素周期律——复习元素周期律(微粒半径大小比较)
(1)原子半径比较——在周期表中比较
(2)离子半径比较:
(3)同种元素的原子与离子半径比较
A …… B
C …… D
半径: A > B C > D (横比)
A < C B < D (竖比)
C > D (斜比)
半径:Li+ < Na+ < K+ < Rb+ F- < Cl- < Br- < I- (竖比)
Ca2+ < K+ < Cl- < S2- Al3+ < Mg2+ < Na+ < F- < O2-(等电子离子比)
Fe3+ < Fe2+ (同种元素的离子比)
半径:Na+ < Na Cl < Cl-
二、元素周期律——电离能
理解:元素金属性的量化
气态电中性基态原子失去电子所需能量越高,表明越不易失去电子(金属性弱,非金属性强);反之则越易失去电子(金属性强,非金属性弱)
有第一电离能,有第二电离能,第三电离能……
二、元素周期律——电离能
1、每个周期的第一种元素(氢和碱金属)第一电离能最小,
最后一种元素(稀有气体)的第一电离能最大;
2、同族元素从上到下第一电离能变小(如He、Ne、Ar、Kr、
Xe、Rn的第一电离能依次下降,H、Li、Na、K、Rb、Cs
第一电离能也依次下降)
3、第一电离能最大的是He
4、同周期元素的第一电离能由低到高顺序为:
IA < IIIA < IIA < IVA < VIA < V < VIIA < 0
族名 IA IIA IIIA IVA VA VIA VIIA 0
价电子排布式 ns1 ns2 ns2np1 ns2np2 ns2np3 ns2np4 ns2np5 ns2np6
特点 ns轨道全满 np轨道半满
5、电离能与金属活动顺序表并不一致;原因为衡量标准不同
金属活动性为:在水溶液中金属原子失去电子的难易程度
二、元素周期律——电离能
同种元素逐级电离能的比较可得出的结论
1、Na、Mg、Al原子的最外层电子数分别为:1、2、3
2、Na、Mg、Al原子的次外层电子数大于2,电子层不止两层
二、元素周期律——电离能
1、原子失去电子是(由外而内)由最外层到最内层
2、最外层的电子离核远、能量高、不稳定、易失去,所需
电离能小;最内层电子离核近、能量低、较稳定、难失
去,所需电离能较大
3、同一个原子的电子越少,再失去电子所需能量就越高。
因为内层电子对外层电子存在斥力,使得原子核对外层
电子的引力越强。
4、失去同一层的电子,电离能差异不明显,而失去不同电
子层的电子,电离能会显著不同(跨能层失电子,电离
能发生突变)
Mg(OH)2
小
大
3
1
二、元素周期律——电离能
金属易失电子,选第一电离能小的
稀有气体原子为每一周期第一电离能最大的元素
第一电离能最小的为最活泼金属元素
失去第三个电子困难
二、元素周期律——电离能
都是失去的4s的电子
>
二、元素周期律——电负性
1、不同元素的原子对键合电子吸引力的大小——个人理解为:非金属性的量化
2、电负性最强的元素为F
二、元素周期律——电负性
总体趋势
1、电负性大于1.8一般为非金属,越大非金属性越强
电负性小于1.8一般为金属,越小金属性越强
电负性在1.8左右,既具有金属性,又具有非金属性
2、一般来说:
如果两个成键元素间的电负性差值大于1.7,
它们通常形成离子键(形成离子化合物);
如果差值小于1.7,通常形成共价键
如:AlCl3为共价化合物
3、电负性最大的元素在周期表右上方(除0族元素)
电负性最小的元素在周期表左下方
4、电负性最大的是F,第一电离能最大的是He
二、元素周期律——电负性
同周期从左到右电负性增强;同主族从上到下电负性减弱
F
Na
离子
N
二、元素周期律——补充内容
1、电离能的对立面——电子亲和能
电负性是通过电离能和亲和能综合计算得到
二、元素周期律——对角线规则
电负性接近
第一章 原子结构与性质
第二节 原子结构与元素的性质
一、原子结构与元素周期表——复习元素周期表
(1)完成周期表的轮廓图,画出金属与非金属的分界线
(2)在最上方从左到右标出族名,并写出第IA族和0族所有元素的原子序数
(3)标出所有主族元素和0族元素的元素符号
*要求熟记前36号元素的原子序数、元素名称及元素符号;所有主族元素、0族元素的名称和元素符号,能够通过推导得出原子序数
IA IIA IIIB IVB VB VIB VIIB VIII IB IIB IIIA IVA VA VIA VIIA 0
H
Li
Na
K
Rb
Cs
F
1
3
11
19
37
55
87
He
Ne
Ar
Kr
Xe
Rn
2
10
18
36
54
86
118
B
Al
Ga
In
Tl
C
Si
Ge
Sn
Pb
N
P
As
Sb
Bi
O
S
Se
Te
Po
F
Cl
Br
I
At
Be
Mg
Ca
Sr
Ba
Ra
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
锕系
镧系
(1)用简化电子排布式表示出19~36号元素原子
一、原子结构与元素周期表——重新认识元素周期表
K
Ca Cu
Sc Zn
Ti Ga
V Ge
Cr As
Mn Xe
Fe Br
Co Kr
Ni
[Ar]4s1
[Ar]4s2
[Ar]3d14s2
[Ar]3d24s2
[Ar]3d34s2
[Ar]3d54s1
[Ar]3d54s2
[Ar]3d64s2
[Ar]3d74s2
[Ar]3d84s2
[Ar]3d104s1
[Ar]3d104s2
[Ar]3d104s24p1
[Ar]3d104s24p2
[Ar]3d104s24p3
[Ar]3d104s24p4
[Ar]3d104s24p5
[Ar]3d104s24p6
最后填充的电子进入4s轨道
最后填充的电子进入3d轨道(Cr除外)
最后填充的电子进入4p轨道
最后填充的电子有的是s轨道;有的是p轨道;有的d轨道……,所以元素周期表分成了
________,_________,__________,__________,___________五个区
s p d ds f
一、原子结构与元素周期表——重新认识元素周期表
最后填充的电子有的是s轨道;有的是p轨道;有的d轨道……,所以元素周期表分成了
________,_________,__________,__________,___________五个区
s p d ds f
IA IIA IIIB IVB VB VIB VIIB VIII IB IIB IIIA IVA VA VIA VIIA 0
s
p
d
ds
f
一、原子结构与元素周期表——重新认识元素周期表
(2)价电子数与族名的关系
1 2 3 4 5 6 7 8 9 10 11 12 3 4 5 6 7 8
价电子数为1或2; 价电子数为3~8; 价电子数为9~12;
一、原子结构与元素周期表——重新认识元素周期表
小结:
1、s区包括________族;p区包括____________________族;
d区包括_____________族; ds区包括____________族;
f区为________________。
2、s区元素原子的价电子排布通式为:______________
p区元素原子的价电子排布通式为:______________
d区元素原子的价电子排布通式为:______________
ds区元素原子的价电子排布通式为:______________
3、已知价电子数如何确定为哪一族元素
4、过渡元素中的“过渡”表示的意思____________________________
IA,IIA
IIIA——VIIA,0
IIIB——VIII
IB,IIB
镧系,锕系元素
ns1或ns2
ns2np1~6
(n-1)d5ns1或(n-1)d1~8ns2
(n-1)d10ns1或(n-1)d10ns2
IA IIA IIIB IVB VB VIB VIIB VIII IB IIB IIIA IVA VA VIA VIIA 0
价电子数
价电子分布
1 2 3 4 5 6 7 8,9,10 11 12 3 4 5 6 7 8
ns
(n-1)d,ns
ns,np
最后电子的填充在次外层
课后练习1
1、根据前四周期元素原子核外电子排布特点,回答下列问题:
(1)价电子层有2个未成对电子的有_______________________;
有3个未成对电子的有___________________________________________________。
(2)未成对电子数与周期数相等的元素有_________________。
2、第四周期中,未成对电子数最多的元素是________(填名称)。
(1)它位于________族。
(2)核外电子排布式是________。
(3)它有________个能层,________个能级,________种运动状态不同的电子。
(4)价电子排布式________,价电子排布图_________________________________。
(5)属于________区。
3、根据4s24p4回答问题:该元素位于________区,为第________周期________族,
是________元素(填名称)。
课后作业:《点金训练》第二节第一课时
二、元素周期律——复习元素周期律
(1)元素周期律的内容——元素性质随着原子序数的递增而呈现周期性的变化
(2)具体表现
同周期从左到右:原子半径逐渐减小,
元素化合价最高正价重复出现+1~+7(O、F除外),最低负价重复出现-4 ~ -1,
元素的金属性逐渐减弱,元素的非金属性逐渐增强
同主族从上到下:原子半径逐渐增大,
元素化合价最高正价相同(O、F除外),最低负价相同(金属除外),
元素的金属性逐渐增强,元素的非金属性逐渐减弱
(3)元素周期律的实质:是元素原子的核外电子排布呈现周期性变化的结果
金属性可理解为原子失电子的性质;非金属性可理解为原子得电子的性质
二、元素周期律——复习元素周期律(金属性、非金属性的比较)
元素金属性比较 元素非金属性比较
依据在周期表的位置比较 同周期从左到右
同主族从上到下
依据微粒得失电子难易程度比较 原子
对应离子
依据单质间置换反应比较
依据活动顺序表
依据实验现象比较 最高价氧化物对应的水化物
与水或酸反应的难易程度
与氢气化合的难易程度
最简单氢化物的稳定性
金属性减弱
非金属性增强
金属性增强
非金属性减弱
失电子易,金属性强
得电子易,非金属性强
对应阴离子失电子易,非金属性弱
对应阳离子得电子易,金属性弱
金属性强的置换金属性弱的
非金属性强的置换非金属性弱的
金属活动顺序表
碱性越强,金属性越强
酸性越强,非金属性越强
越易化合,非金属性越强
越稳定,非金属性越强
与水或酸反应置换出氢气与剧烈,金属性越强
二、元素周期律——复习元素周期律(微粒半径大小比较)
(1)原子半径比较——在周期表中比较
(2)离子半径比较:
(3)同种元素的原子与离子半径比较
A …… B
C …… D
半径: A > B C > D (横比)
A < C B < D (竖比)
C > D (斜比)
半径:Li+ < Na+ < K+ < Rb+ F- < Cl- < Br- < I- (竖比)
Ca2+ < K+ < Cl- < S2- Al3+ < Mg2+ < Na+ < F- < O2-(等电子离子比)
Fe3+ < Fe2+ (同种元素的离子比)
半径:Na+ < Na Cl < Cl-
二、元素周期律——电离能
理解:元素金属性的量化
气态电中性基态原子失去电子所需能量越高,表明越不易失去电子(金属性弱,非金属性强);反之则越易失去电子(金属性强,非金属性弱)
有第一电离能,有第二电离能,第三电离能……
二、元素周期律——电离能
1、每个周期的第一种元素(氢和碱金属)第一电离能最小,
最后一种元素(稀有气体)的第一电离能最大;
2、同族元素从上到下第一电离能变小(如He、Ne、Ar、Kr、
Xe、Rn的第一电离能依次下降,H、Li、Na、K、Rb、Cs
第一电离能也依次下降)
3、第一电离能最大的是He
4、同周期元素的第一电离能由低到高顺序为:
IA < IIIA < IIA < IVA < VIA < V < VIIA < 0
族名 IA IIA IIIA IVA VA VIA VIIA 0
价电子排布式 ns1 ns2 ns2np1 ns2np2 ns2np3 ns2np4 ns2np5 ns2np6
特点 ns轨道全满 np轨道半满
5、电离能与金属活动顺序表并不一致;原因为衡量标准不同
金属活动性为:在水溶液中金属原子失去电子的难易程度
二、元素周期律——电离能
同种元素逐级电离能的比较可得出的结论
1、Na、Mg、Al原子的最外层电子数分别为:1、2、3
2、Na、Mg、Al原子的次外层电子数大于2,电子层不止两层
二、元素周期律——电离能
1、原子失去电子是(由外而内)由最外层到最内层
2、最外层的电子离核远、能量高、不稳定、易失去,所需
电离能小;最内层电子离核近、能量低、较稳定、难失
去,所需电离能较大
3、同一个原子的电子越少,再失去电子所需能量就越高。
因为内层电子对外层电子存在斥力,使得原子核对外层
电子的引力越强。
4、失去同一层的电子,电离能差异不明显,而失去不同电
子层的电子,电离能会显著不同(跨能层失电子,电离
能发生突变)
Mg(OH)2
小
大
3
1
二、元素周期律——电离能
金属易失电子,选第一电离能小的
稀有气体原子为每一周期第一电离能最大的元素
第一电离能最小的为最活泼金属元素
失去第三个电子困难
二、元素周期律——电离能
都是失去的4s的电子
>
二、元素周期律——电负性
1、不同元素的原子对键合电子吸引力的大小——个人理解为:非金属性的量化
2、电负性最强的元素为F
二、元素周期律——电负性
总体趋势
1、电负性大于1.8一般为非金属,越大非金属性越强
电负性小于1.8一般为金属,越小金属性越强
电负性在1.8左右,既具有金属性,又具有非金属性
2、一般来说:
如果两个成键元素间的电负性差值大于1.7,
它们通常形成离子键(形成离子化合物);
如果差值小于1.7,通常形成共价键
如:AlCl3为共价化合物
3、电负性最大的元素在周期表右上方(除0族元素)
电负性最小的元素在周期表左下方
4、电负性最大的是F,第一电离能最大的是He
二、元素周期律——电负性
同周期从左到右电负性增强;同主族从上到下电负性减弱
F
Na
离子
N
二、元素周期律——补充内容
1、电离能的对立面——电子亲和能
电负性是通过电离能和亲和能综合计算得到
二、元素周期律——对角线规则
电负性接近
