4.2.1 含硫物质之间的转化 课件(共34张PPT) 2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 4.2.1 含硫物质之间的转化 课件(共34张PPT) 2023-2024学年高一上学期化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-29 22:09:30 | ||
图片预览











文档简介
(共34张PPT)
新苏教版 含硫物质之间的转化
课程目标
1.了解硫单质的性质及应用。
2.理解不同价态硫元素间的转化。
3.学会归纳同种元素的物质间转化的思路方法。
图说考点
[新知预习]
一、硫的化学性质
(3)与浓H2SO4反应_____________________________________
Fe+SFeS
H2+SH2S
S+2H2SO4(浓)3SO2↑+2H2O
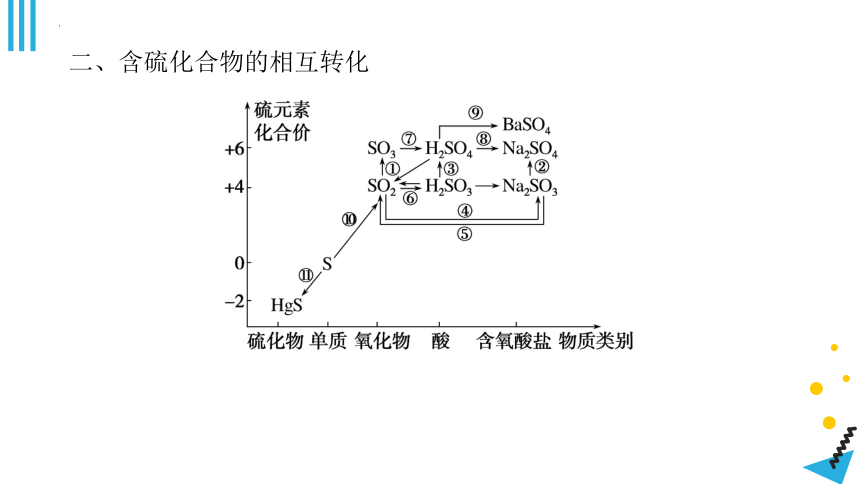
二、含硫化合物的相互转化
1.通过 反应可以实现不同价态含硫物质之间的转化。
2.通过非氧化还原反应可以实现相同价态含硫物质之间的转化。
氧化还原
3.写出上述转化反应的方程式:
①_______________________________________________________;
②2Na2SO3+O2===2Na2SO4;
③_______________________________________________________;
④_______________________________________________________;
⑤Na2SO3+H2SO4===Na2SO4+H2O+SO2↑;
⑥SO2+H2O H2SO3;
⑦_______________________________________________________;
⑧2NaOH+H2SO4===Na2SO4+2H2O;
⑨_______________________________________________________;
⑩S+O2SO2
________________________________________________________。
2H2SO3+O2===2H2SO4
2NaOH+SO2===Na2SO3+H2O
SO3+H2O===H2SO4
H2SO4+BaCl2===BaSO4↓+2HCl
S+Hg===HgS
[即时自测]
1.判断正误,正确的打“√”,错误的打“×”
(1)含硫物质之间的转化一定发生了氧化还原反应。( )
(2)硫单质与氢气反应时,硫单质体现了还原性。( )
(3)硫单质与铁反应不能直接生成硫化铁。( )
(4)若试管上沾有硫单质,可用水清洗干净。( )
(5)SO2还原性很强,极易与O2反应。( )
(6)Na2SO3在空气中久置转化为Na2SO4。( )
×
×
√
×
×
√
2.下列说法中,不正确的是( )
A.硫是一种淡黄色的难溶于水的固体
B.硫在自然界中仅以化合态存在
C.硫与铁反应生成硫化亚铁
D.硫在空气中的燃烧产物是二氧化硫
答案:B
解析:火山喷口附近有游离态的硫,金属矿石中的硫以化合态存在。
3.下列物质中的硫元素,既有氧化性,又有还原性的是( )
A.H2S B.SO2
C.SO3 D.H2SO4
答案:B
解析:SO2中S的化合价为+4价,处于中间价态,既有氧化性,又有还原性。
4.下列物质能与SO2在一定条件下发生反应的是( )
①NaOH ②氯气 ③空气
④氢硫酸 ⑤Na2SO3 ⑥Na2CO3
A.①②④⑤ B.②④⑤⑥
C.② D.①②③④⑤⑥
答案:D
解析:SO2与NaOH、O2、Cl2、Na2SO3、Na2CO3、H2S发生的反应分别为:
①SO2+2NaOH===Na2SO3+H2O
②SO2+Cl2+2H2O===H2SO4+2HCl
③
④SO2+2H2S===3S↓+2H2O
⑤SO2+Na2SO3+H2O===2NaHSO3
⑥SO2+Na2CO3===Na2SO3+CO2。
5.写出下列含硫物质发生转化的化学方程式。
(1)在一定条件下,硫单质能与许多金属单质化合。汞与硫黄在常温下化合生成硫化汞(HgS),因此,实验室常将硫黄撒在汞的表面,以除去不慎洒落的汞。
___________________________________________________________。
(2)工业上或实验室用亚硫酸钠与浓硫酸反应制备二氧化硫。
___________________________________________________________。
(3)长期暴露在空气中的亚硫酸钠会被空气中的氧气氧化成硫酸钠。
___________________________________________________________。
(4)实验室常用过量氢氧化钠溶液吸收二氧化硫尾气,生成亚硫酸钠。
___________________________________________________________。
Hg+S===HgS
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
2Na2SO3+O2===2Na2SO4
2NaOH+SO2===Na2SO3+H2O
提升点1 硫及含硫化合物的相互转化
例1 硫在空气中燃烧生成气体A,把A溶于水得溶液B,向B中滴加溴水,溴水褪色,B变成C,在C里加Na2S产生气体D,把D通入B溶液得浅黄色沉淀E,A、B、C、D、E都含同一种元素,则A、B、C、D、E依次是( )
A.SO2、H2SO4、H2SO3、H2S、S
B.SO2、H2SO3、H2SO4、H2S、S
C.SO2、H2SO3、H2SO4、SO3、Na2S2O3
D.SO3、H2SO4、H2SO3、SO2、Na2S2O3
S不能直接燃烧生成SO3。
【答案】 B
【解析】 硫在空气中燃烧生成气体A,A是SO2;把A溶于水得溶液B,B是H2SO3;向B中滴加溴水,溴水褪色,H2SO3被氧化为H2SO4,C是H2SO4;在C里加Na2S发生复分解反应产生气体D,D是H2S;把D通入B溶液得浅黄色沉淀E,E是单质S。B项正确。
[提升1] 已知A是一种不溶于水的淡黄色固体,在一定条件下有下列转化关系(部分产物及H2O省略)
试回答:
(1)写出物质的化学式:A ,E 。
(2)写出由B和C反应生成A,由F的浓溶液生成C的化学方程式:
B+C―→A______________________,
________________________________。
(3)写出D和F的稀溶液反应的离子方程式______________________。
S
SO3
2H2S+SO2===3S↓+2H2O
Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
FeS+2H+===Fe2++H2S↑
解析:由A+H2―→B,A+O2C知:A元素的化合价既能升高,也能降低,故A为非金属元素,B为氢化物,C为氧化物,且B+C―→A,则A为硫,进一步推知B为H2S、C为SO2,D为FeS,E为SO3、F为H2SO4。
关键能力
不同价态硫元素之间的转化规律
1.升降转化规律
硫的常见化合价有-2、0、+4、+6,在不太强的氧化剂或不太强的还原剂作用下,硫元素的化合价升高或降低只变化到相邻的价态值。例如-2价的硫通常的氧化产物是零价的硫(单质)。
2.互不换位规律
(1) 与 之间发生氧化还原反应时,只能变成中间价态,不可能变成互换位置。
例如:H2S+H2SO4(浓)===S↓+SO2↑+2H2O。
(2)硫元素相邻价态的微粒之间一般不发生氧化还原反应。
例如:S和H2S、S和SO2、SO2和浓H2SO4之间不发生氧化还原反应。
3.跳位转化规律
遇到很强的氧化剂时,低价态的硫可能被氧化到比邻位更高的价态,称为“跳位”。
提升点2 和的检验
例2 已知硝酸具有强氧化性,在某溶液中先滴加稀硝酸,再滴加氯化钡溶液,有白色沉淀产生,该溶液中( )
A.一定含有 B.一定含有和
C.一定含有 D.可能无和
极易被氧化为。
【答案】 D
【解析】 白色沉淀不溶于稀HNO3,该沉淀可能是Ba2+所引起而生成的BaSO4,也可能是Cl-所引起而生成的AgCl沉淀。
答案:甲:不严密,不能排除Ag+的干扰。乙:严密,加稀盐酸无沉淀排除Ag+、、的影响。丙:不严密,HNO3具有强氧化性,能把氧化成,所以不能排除的干扰。
解析:Ag+、、等对的检验存在干扰。方案甲,试液中如果含Ag+,现象相同;方案乙,试液中先加稀盐酸排除了Ag+、、等的干扰;方案丙,试液中若有会被HNO3氧化为,干扰对原溶液中的检验。
关键能力
、检验时的注意事项
1.检验时,注意:
(1)防止Ag+的干扰:
先用盐酸酸化,能防止Ag+干扰,因为Ag++Cl-===AgCl↓。
(2)防止、干扰:
因为BaCO3、BaSO3也是白色沉淀,与BaSO4白色沉淀所不同的是这些沉淀能溶于强酸中,因此检验时,必然用酸酸化(不能用HNO3酸化)。例如:BaCO3+2H+===H2O+CO2↑+Ba2+。
2.的检验:
加入氯化钡溶液生成白色沉淀,加入盐酸,沉淀溶解并产生具有刺激性气味的气体。发生的反应为+Ba2+===BaSO3↓,
BaSO3+2H+===Ba2++SO2↑+H2O。
1.下列说法中不正确的是( )
A.自然界中硫是一种淡黄色难溶于水的固体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫与金属反应,生成金属的低价态化合物
D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
答案:D
解析:硫的氧化性较弱,与变价金属化合时,只能将金属氧化为低价态,如与Fe、Cu反应,生成FeS、Cu2S。硫无论在空气中还是在纯氧中的燃烧产物都是SO2,而不是SO3,如果要使SO2转化为SO3,需在催化剂并加热的条件下与O2发生化合。
2.下列关于硫及化合物的叙述正确的是( )
A.SO2、SO3常温下均为易溶于水的气体
B.可用饱和NaHSO3溶液除去SO2中的SO3杂质
C.硫与金属或非金属反应均作为氧化剂
D.1.6 g硫与6.4 g铜反应能得到8.0 g纯净硫化铜
答案:B
解析:常温下SO3不是气体,A错误;饱和NaHSO3可与SO3反应并产生SO2,且SO2不与NaHSO3反应,B正确;硫与某些非金属反应时硫显还原性。硫与铜化合只能生成硫化亚铜,按2Cu+SCu2S计算恰好生成8.0 g Cu2S。
3.下列化合物不能用相应元素的单质直接化合而成的是( )
①CuS ②FeS ③Al2S3 ④Fe2S3
⑤Cu2S ⑥FeCl2 ⑦CS2 ⑧H2S
A.②⑤⑧ B.①④⑥
C.③④⑦ D.④⑥⑦
答案:B
解析:
4.部分含硫物质中的硫元素的价态及该物质的类别关系如图所示。下列说法错误的是( )
A.b微溶于酒精,易溶于CS2
B.向a的溶液中通入c,可产生淡黄色沉淀
C.滴加BaCl2溶液,即可鉴别e、f两种溶液
D.在一定条件下,可实现a→b→c的转化
答案:C
5.含S元素的某钠盐a能发生如图转化。下列说法错误的是( )
A.a可能为正盐,也可能为酸式盐
B.c为不溶于盐酸的白色沉淀
C.与酸性高锰酸钾溶液的反应中,d表现氧化性
D.反应②中还可能生成淡黄色沉淀
答案:C
解析:盐a与足量的稀盐酸产生刺激性气味气体d,d能使酸性KMnO4溶液褪色,d为SO2,则盐a为Na2SO3、NaHSO3或Na2S2O3。盐a溶液与足量Cl2反应后所得溶液中含,加入BaCl2溶液得到沉淀c,故c为BaSO4。由分析可知,A、B正确;d为SO2,能使酸性高锰酸钾溶液褪色,体现其还原性,C错误;当盐a为Na2S2O3时,反应②为Na2S2O3+2HCl===2NaCl+S↓+SO2↑+H2O,D正确。
6.在通常情况下,A为固体单质。根据如图所示转化关系,回答下列问题:
(1)写出A、C、E的化学式:
A ,C ,E 。
(2)写出下列反应的化学方程式:
①E―→C:________________________________;
②C―→D:___________________。
(3)室温时,B与E的浓溶液 (填“能”或“不能”)发生反应,若能反应,则反应的化学方程式为
_______________________________(若不能反应,此空可不填)。
(4)将C通入BaCl2溶液中,没有明显现象,但若加入H2O2,则有白色沉淀生成,请分析其原因,并写出有关的化学方程式:
___________________________________________________________。
S
SO2
H2SO4
Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
能
H2S+H2SO4(浓)===S↓+SO2↑+2H2O
H2O2具有强氧化性,能把SO2氧化为H2SO4,H2O2+SO2===H2SO4,H2SO4+BaCl2===BaSO4↓+2HCl
解析:因A为固态单质,则B为其氢化物,C为其氧化物,故A为固态非金属单质。由A→C→D→E知E为能与Cu反应的酸(浓硫酸或硝酸),且A为固态单质,推断A为S,B为H2S,C为SO2,D为SO3,E为H2SO4,E的浓溶液即浓硫酸,与H2S发生氧化还原反应,可生成单质S和SO2。H2O2有强氧化性,能把+4价的硫(SO2)氧化为+6价的硫(H2SO4),再按要求写出相关化学方程式即可。
7.“价—类”二维图是学习化学的一种重要工具。如图为硫元素的“价—类”二维图,回答下列问题:
(1)A的化学式为 。
(2)SO2与A溶液反应有淡黄色固体生成,该反应的化学方程式为 ,体现了A的 (填“氧化性”或“还原性”)。
(3)①将SO2通入品红溶液,观察到的现象为 ,体现了SO2的 性。
②将SO2通入新制氯水中,主要反应的离子方程式为______________________________。
(4)写出浓硫酸与Cu反应的化学方程式:
_________________________________,反应中消耗了64 g铜,则转移 mol电子。
H2S
2H2S+SO2===3S↓+2H2O
还原性
品红溶液褪色
漂白
SO2+Cl2+2H2O===+2Cl-+4H+
Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O
2
练后感悟
氧化还原反应中硫元素价态变化规律
(1)-2价是硫元素的最低价态,含有该价态硫元素的物质有还原性;0、+4价处于中间价态,含有该价态硫元素的物质既有氧化性,又有还原性;+6价是硫元素的最高价态,含有该价态硫元素的物质有氧化性。
(2)当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态。如:
(3)有时硫的化合价会发生跳位转化。如条件发生改变时:
(4)硫元素相邻价态的物质不发生氧化还原反应。如S和H2S、S和SO2、SO2和浓H2SO4之间不发生氧化还原反应。
感谢观看
新苏教版 含硫物质之间的转化
课程目标
1.了解硫单质的性质及应用。
2.理解不同价态硫元素间的转化。
3.学会归纳同种元素的物质间转化的思路方法。
图说考点
[新知预习]
一、硫的化学性质
(3)与浓H2SO4反应_____________________________________
Fe+SFeS
H2+SH2S
S+2H2SO4(浓)3SO2↑+2H2O
二、含硫化合物的相互转化
1.通过 反应可以实现不同价态含硫物质之间的转化。
2.通过非氧化还原反应可以实现相同价态含硫物质之间的转化。
氧化还原
3.写出上述转化反应的方程式:
①_______________________________________________________;
②2Na2SO3+O2===2Na2SO4;
③_______________________________________________________;
④_______________________________________________________;
⑤Na2SO3+H2SO4===Na2SO4+H2O+SO2↑;
⑥SO2+H2O H2SO3;
⑦_______________________________________________________;
⑧2NaOH+H2SO4===Na2SO4+2H2O;
⑨_______________________________________________________;
⑩S+O2SO2
________________________________________________________。
2H2SO3+O2===2H2SO4
2NaOH+SO2===Na2SO3+H2O
SO3+H2O===H2SO4
H2SO4+BaCl2===BaSO4↓+2HCl
S+Hg===HgS
[即时自测]
1.判断正误,正确的打“√”,错误的打“×”
(1)含硫物质之间的转化一定发生了氧化还原反应。( )
(2)硫单质与氢气反应时,硫单质体现了还原性。( )
(3)硫单质与铁反应不能直接生成硫化铁。( )
(4)若试管上沾有硫单质,可用水清洗干净。( )
(5)SO2还原性很强,极易与O2反应。( )
(6)Na2SO3在空气中久置转化为Na2SO4。( )
×
×
√
×
×
√
2.下列说法中,不正确的是( )
A.硫是一种淡黄色的难溶于水的固体
B.硫在自然界中仅以化合态存在
C.硫与铁反应生成硫化亚铁
D.硫在空气中的燃烧产物是二氧化硫
答案:B
解析:火山喷口附近有游离态的硫,金属矿石中的硫以化合态存在。
3.下列物质中的硫元素,既有氧化性,又有还原性的是( )
A.H2S B.SO2
C.SO3 D.H2SO4
答案:B
解析:SO2中S的化合价为+4价,处于中间价态,既有氧化性,又有还原性。
4.下列物质能与SO2在一定条件下发生反应的是( )
①NaOH ②氯气 ③空气
④氢硫酸 ⑤Na2SO3 ⑥Na2CO3
A.①②④⑤ B.②④⑤⑥
C.② D.①②③④⑤⑥
答案:D
解析:SO2与NaOH、O2、Cl2、Na2SO3、Na2CO3、H2S发生的反应分别为:
①SO2+2NaOH===Na2SO3+H2O
②SO2+Cl2+2H2O===H2SO4+2HCl
③
④SO2+2H2S===3S↓+2H2O
⑤SO2+Na2SO3+H2O===2NaHSO3
⑥SO2+Na2CO3===Na2SO3+CO2。
5.写出下列含硫物质发生转化的化学方程式。
(1)在一定条件下,硫单质能与许多金属单质化合。汞与硫黄在常温下化合生成硫化汞(HgS),因此,实验室常将硫黄撒在汞的表面,以除去不慎洒落的汞。
___________________________________________________________。
(2)工业上或实验室用亚硫酸钠与浓硫酸反应制备二氧化硫。
___________________________________________________________。
(3)长期暴露在空气中的亚硫酸钠会被空气中的氧气氧化成硫酸钠。
___________________________________________________________。
(4)实验室常用过量氢氧化钠溶液吸收二氧化硫尾气,生成亚硫酸钠。
___________________________________________________________。
Hg+S===HgS
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
2Na2SO3+O2===2Na2SO4
2NaOH+SO2===Na2SO3+H2O
提升点1 硫及含硫化合物的相互转化
例1 硫在空气中燃烧生成气体A,把A溶于水得溶液B,向B中滴加溴水,溴水褪色,B变成C,在C里加Na2S产生气体D,把D通入B溶液得浅黄色沉淀E,A、B、C、D、E都含同一种元素,则A、B、C、D、E依次是( )
A.SO2、H2SO4、H2SO3、H2S、S
B.SO2、H2SO3、H2SO4、H2S、S
C.SO2、H2SO3、H2SO4、SO3、Na2S2O3
D.SO3、H2SO4、H2SO3、SO2、Na2S2O3
S不能直接燃烧生成SO3。
【答案】 B
【解析】 硫在空气中燃烧生成气体A,A是SO2;把A溶于水得溶液B,B是H2SO3;向B中滴加溴水,溴水褪色,H2SO3被氧化为H2SO4,C是H2SO4;在C里加Na2S发生复分解反应产生气体D,D是H2S;把D通入B溶液得浅黄色沉淀E,E是单质S。B项正确。
[提升1] 已知A是一种不溶于水的淡黄色固体,在一定条件下有下列转化关系(部分产物及H2O省略)
试回答:
(1)写出物质的化学式:A ,E 。
(2)写出由B和C反应生成A,由F的浓溶液生成C的化学方程式:
B+C―→A______________________,
________________________________。
(3)写出D和F的稀溶液反应的离子方程式______________________。
S
SO3
2H2S+SO2===3S↓+2H2O
Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
FeS+2H+===Fe2++H2S↑
解析:由A+H2―→B,A+O2C知:A元素的化合价既能升高,也能降低,故A为非金属元素,B为氢化物,C为氧化物,且B+C―→A,则A为硫,进一步推知B为H2S、C为SO2,D为FeS,E为SO3、F为H2SO4。
关键能力
不同价态硫元素之间的转化规律
1.升降转化规律
硫的常见化合价有-2、0、+4、+6,在不太强的氧化剂或不太强的还原剂作用下,硫元素的化合价升高或降低只变化到相邻的价态值。例如-2价的硫通常的氧化产物是零价的硫(单质)。
2.互不换位规律
(1) 与 之间发生氧化还原反应时,只能变成中间价态,不可能变成互换位置。
例如:H2S+H2SO4(浓)===S↓+SO2↑+2H2O。
(2)硫元素相邻价态的微粒之间一般不发生氧化还原反应。
例如:S和H2S、S和SO2、SO2和浓H2SO4之间不发生氧化还原反应。
3.跳位转化规律
遇到很强的氧化剂时,低价态的硫可能被氧化到比邻位更高的价态,称为“跳位”。
提升点2 和的检验
例2 已知硝酸具有强氧化性,在某溶液中先滴加稀硝酸,再滴加氯化钡溶液,有白色沉淀产生,该溶液中( )
A.一定含有 B.一定含有和
C.一定含有 D.可能无和
极易被氧化为。
【答案】 D
【解析】 白色沉淀不溶于稀HNO3,该沉淀可能是Ba2+所引起而生成的BaSO4,也可能是Cl-所引起而生成的AgCl沉淀。
答案:甲:不严密,不能排除Ag+的干扰。乙:严密,加稀盐酸无沉淀排除Ag+、、的影响。丙:不严密,HNO3具有强氧化性,能把氧化成,所以不能排除的干扰。
解析:Ag+、、等对的检验存在干扰。方案甲,试液中如果含Ag+,现象相同;方案乙,试液中先加稀盐酸排除了Ag+、、等的干扰;方案丙,试液中若有会被HNO3氧化为,干扰对原溶液中的检验。
关键能力
、检验时的注意事项
1.检验时,注意:
(1)防止Ag+的干扰:
先用盐酸酸化,能防止Ag+干扰,因为Ag++Cl-===AgCl↓。
(2)防止、干扰:
因为BaCO3、BaSO3也是白色沉淀,与BaSO4白色沉淀所不同的是这些沉淀能溶于强酸中,因此检验时,必然用酸酸化(不能用HNO3酸化)。例如:BaCO3+2H+===H2O+CO2↑+Ba2+。
2.的检验:
加入氯化钡溶液生成白色沉淀,加入盐酸,沉淀溶解并产生具有刺激性气味的气体。发生的反应为+Ba2+===BaSO3↓,
BaSO3+2H+===Ba2++SO2↑+H2O。
1.下列说法中不正确的是( )
A.自然界中硫是一种淡黄色难溶于水的固体
B.硫的化合物常存在于火山喷出的气体中和矿泉水里
C.硫与金属反应,生成金属的低价态化合物
D.硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫
答案:D
解析:硫的氧化性较弱,与变价金属化合时,只能将金属氧化为低价态,如与Fe、Cu反应,生成FeS、Cu2S。硫无论在空气中还是在纯氧中的燃烧产物都是SO2,而不是SO3,如果要使SO2转化为SO3,需在催化剂并加热的条件下与O2发生化合。
2.下列关于硫及化合物的叙述正确的是( )
A.SO2、SO3常温下均为易溶于水的气体
B.可用饱和NaHSO3溶液除去SO2中的SO3杂质
C.硫与金属或非金属反应均作为氧化剂
D.1.6 g硫与6.4 g铜反应能得到8.0 g纯净硫化铜
答案:B
解析:常温下SO3不是气体,A错误;饱和NaHSO3可与SO3反应并产生SO2,且SO2不与NaHSO3反应,B正确;硫与某些非金属反应时硫显还原性。硫与铜化合只能生成硫化亚铜,按2Cu+SCu2S计算恰好生成8.0 g Cu2S。
3.下列化合物不能用相应元素的单质直接化合而成的是( )
①CuS ②FeS ③Al2S3 ④Fe2S3
⑤Cu2S ⑥FeCl2 ⑦CS2 ⑧H2S
A.②⑤⑧ B.①④⑥
C.③④⑦ D.④⑥⑦
答案:B
解析:
4.部分含硫物质中的硫元素的价态及该物质的类别关系如图所示。下列说法错误的是( )
A.b微溶于酒精,易溶于CS2
B.向a的溶液中通入c,可产生淡黄色沉淀
C.滴加BaCl2溶液,即可鉴别e、f两种溶液
D.在一定条件下,可实现a→b→c的转化
答案:C
5.含S元素的某钠盐a能发生如图转化。下列说法错误的是( )
A.a可能为正盐,也可能为酸式盐
B.c为不溶于盐酸的白色沉淀
C.与酸性高锰酸钾溶液的反应中,d表现氧化性
D.反应②中还可能生成淡黄色沉淀
答案:C
解析:盐a与足量的稀盐酸产生刺激性气味气体d,d能使酸性KMnO4溶液褪色,d为SO2,则盐a为Na2SO3、NaHSO3或Na2S2O3。盐a溶液与足量Cl2反应后所得溶液中含,加入BaCl2溶液得到沉淀c,故c为BaSO4。由分析可知,A、B正确;d为SO2,能使酸性高锰酸钾溶液褪色,体现其还原性,C错误;当盐a为Na2S2O3时,反应②为Na2S2O3+2HCl===2NaCl+S↓+SO2↑+H2O,D正确。
6.在通常情况下,A为固体单质。根据如图所示转化关系,回答下列问题:
(1)写出A、C、E的化学式:
A ,C ,E 。
(2)写出下列反应的化学方程式:
①E―→C:________________________________;
②C―→D:___________________。
(3)室温时,B与E的浓溶液 (填“能”或“不能”)发生反应,若能反应,则反应的化学方程式为
_______________________________(若不能反应,此空可不填)。
(4)将C通入BaCl2溶液中,没有明显现象,但若加入H2O2,则有白色沉淀生成,请分析其原因,并写出有关的化学方程式:
___________________________________________________________。
S
SO2
H2SO4
Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O
能
H2S+H2SO4(浓)===S↓+SO2↑+2H2O
H2O2具有强氧化性,能把SO2氧化为H2SO4,H2O2+SO2===H2SO4,H2SO4+BaCl2===BaSO4↓+2HCl
解析:因A为固态单质,则B为其氢化物,C为其氧化物,故A为固态非金属单质。由A→C→D→E知E为能与Cu反应的酸(浓硫酸或硝酸),且A为固态单质,推断A为S,B为H2S,C为SO2,D为SO3,E为H2SO4,E的浓溶液即浓硫酸,与H2S发生氧化还原反应,可生成单质S和SO2。H2O2有强氧化性,能把+4价的硫(SO2)氧化为+6价的硫(H2SO4),再按要求写出相关化学方程式即可。
7.“价—类”二维图是学习化学的一种重要工具。如图为硫元素的“价—类”二维图,回答下列问题:
(1)A的化学式为 。
(2)SO2与A溶液反应有淡黄色固体生成,该反应的化学方程式为 ,体现了A的 (填“氧化性”或“还原性”)。
(3)①将SO2通入品红溶液,观察到的现象为 ,体现了SO2的 性。
②将SO2通入新制氯水中,主要反应的离子方程式为______________________________。
(4)写出浓硫酸与Cu反应的化学方程式:
_________________________________,反应中消耗了64 g铜,则转移 mol电子。
H2S
2H2S+SO2===3S↓+2H2O
还原性
品红溶液褪色
漂白
SO2+Cl2+2H2O===+2Cl-+4H+
Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O
2
练后感悟
氧化还原反应中硫元素价态变化规律
(1)-2价是硫元素的最低价态,含有该价态硫元素的物质有还原性;0、+4价处于中间价态,含有该价态硫元素的物质既有氧化性,又有还原性;+6价是硫元素的最高价态,含有该价态硫元素的物质有氧化性。
(2)当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态。如:
(3)有时硫的化合价会发生跳位转化。如条件发生改变时:
(4)硫元素相邻价态的物质不发生氧化还原反应。如S和H2S、S和SO2、SO2和浓H2SO4之间不发生氧化还原反应。
感谢观看
