2.2化学平衡-图像分析 课件(共17张PPT)
文档属性
| 名称 | 2.2化学平衡-图像分析 课件(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-09-30 20:41:36 | ||
图片预览






文档简介
(共17张PPT)
第二节 化学平衡
第二章 化学反应速率与化学平衡
四、图像专题
【方法指导】-———图像分析(P31)
①看图像:
一看面(即纵坐标与横坐标的意义)
二看线(即线的走向和变化趋势)
三看点(即起点、终点、交点、拐点)
四看辅助线(如等温线、等压线、平衡线等)
五看量的变化(如浓度变化、温度变化等)
②想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
③作判断:根据图像中表现的关系与所学规律相对比,作出符合判断。
1、物质的量(浓度)/速率---时间图像( n/c/ν—t图像)
正向移动
增大反应物浓度
v
t
t1
0
v正
v逆
对于可逆反应mA(g) + nB(g) pC(g) + qD(g)来说
v′正
v′逆
逆向移动
减小反应物浓度
v
t
t1
0
v正
v逆
v′逆
v′正
v'正=v'逆
v正=v逆
v'正=v'逆
v正=v逆
(1)改变某物质浓度
一个断点一个连续点
平衡Ⅰ a b c
平衡Ⅱ(a-2a) (b-2b) >2c
加压(体积缩小一半)
t
v
t1
t2
v正
v正
v逆
v逆
t
H2
t2
t1
N2
NH3
全部断点
加压平衡右移的结果:正逆速率都增大、反应物转化率增大、所有物质浓度都变大、反应物体积分数减小、生成物体积分数增大。
C
(2)改变压强
N2(g) + 3H2 (g) 2NH3(g)
平衡Ⅰ a b c
平衡Ⅱ(a/2,a) (b/2,b) (0,c/2)
减压(体积扩大到原来的2倍)
t
v
t1
t2
v逆
v正
v正
v逆
t
H2
t2
t1
N2
NH3
减压平衡左移的结果:正逆速率都减小、反应物转化率减小、所有物质浓度都减小、反应物体积分数增大、生成物体积分数减小。
C
全部断点
N2(g) + 3H2 (g) 2NH3(g)
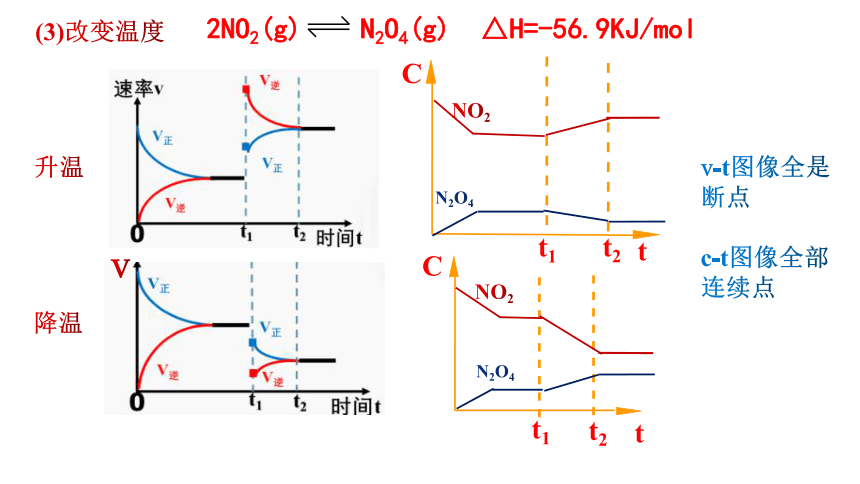
2NO2(g) N2O4(g) △H=-56.9KJ/mol
t1
t2
(3)改变温度
C
t
N2O4
NO2
v-t图像全是断点
c-t图像全部连续点
t1
t2
v
t
NO2
N2O4
C
升温
降温
例1:已知: =-92.4kJ.mol-1,反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施
增大c(N2)或c(H2)
加入催化剂
降低温度
增大压强
t3
t4
t1
t2
N2(g) + 3H2 (g) 2NH3(g)
2、转化率(或百分含量)-时间-温度(或压强)图:
例2:对于反应mA(g)+nB(g) pC(g)+qD(g)
t
A
的转化率
T1
T2
正反应吸热
T1>T2
因为T2→T1升温,α(A) ,
说明平衡正移,△H >0
t
B
的转化率
P1
P2
m+nP2>P1
因为P1→P2增压,α(B) ,说明平衡逆移,逆反应气体体积减小,故m+n解题方法:
先拐先平先平者大
t
T1
T2
A%
C%
t
P1
P2
对于反应mA(g)+nB(g) pC(g)+qD(g)
T2→T1升温,A% ,
平衡逆移,△H<0
T1>T2
P1>P2
P2→P1增压,C%不变 ,
平衡不移动,等体反应
正反应放热
m+n=p+q
先拐先平数值大
例3:对于反应mA (g) + nB (g) pC (g)+qD(g)有如图所示的关系,则:
⑴、P1 ____ P2 ;T1 ____ T2 ;
⑵、m+n ______ p+q ;
⑶、正反应为_________ 反应
<
>
吸热
定一议二
t
B%
T2P2
T1P2
T1P1
P2>P1
T1>T2
因为T1时,P1→P2增大压强,B%增大,平衡左移,逆反应是缩体反应,故m+n因为P2时,T2→T1升高温度,B%减小,平衡右移,故正反应是吸热反应
解题方法:
先拐先平数值大
<
3、百分含量(或转化率)—压强或温度图像
例4:对于反应mA(g)+nB(g) pC(g)+qD(g) ΔH
P
C%
200℃
500℃
T
A
的转化率
1.01×105Pa
1.01×106Pa
1.01×107Pa
看线(如:线的走势)
正反应 热m+n p+q
吸
>
正反应 热
m+n p+q
放
<
定一议二,做辅助线
例5:对于反应mA(g)+nB(g) pC(g)+qD(g)
正反应 热m+n p+q
吸
=
T
v
v逆
v正
T1
T2
正反应吸热
T
v
v正
v逆
正反应吸热
对于反应mA(g)+nB(g) pC(g)+qD(g)
温度由T1升到T2,v正>v逆,平衡右移,正反应吸热
温度升高,v正>v逆,平衡右移,正反应吸热
平衡点
交点为平衡状态,交点左侧为达平衡过程,右侧为平衡移动过程
4、其他图像
T
C%
450℃
正反应放热
P
A%
P1
m+n平衡点
温度升高,C%减小,平衡左移,逆反应吸热
平衡点
压强增加,A%增加,平衡左移,逆反应缩小体积
最高点、最低点为平衡状态,极值点前为达平衡过程,极值点后为平衡移动过程
对于反应mA(g)+nB(g) pC(g)+qD(g)
0
例6:下图是在其它条件一定时,反应2NO+O2 2NO2 △H<0 中NO 的最大转化率与温度的关系曲线。图中坐标A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
A
B
C
E
D
C点
T
转化率
线为平衡点
线外未平衡点
全程速率时间图:表示某个反应全程的速率随时间的变化
OC段:反应放热,使温度升高,速率加快
C以后:反应物浓度降低,速率减慢
例7: 合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图。下列说法正确的是( )
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
B
看图技巧:
改变条件瞬间,曲线对应特点:
出现连贯点,则是物质浓度发生改变;
都是断点,则是温度改变或是压强改变;
出现点重合,则是使用催化剂或是反应前后气体系数不变的反应中压强改变。
小结
第二节 化学平衡
第二章 化学反应速率与化学平衡
四、图像专题
【方法指导】-———图像分析(P31)
①看图像:
一看面(即纵坐标与横坐标的意义)
二看线(即线的走向和变化趋势)
三看点(即起点、终点、交点、拐点)
四看辅助线(如等温线、等压线、平衡线等)
五看量的变化(如浓度变化、温度变化等)
②想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
③作判断:根据图像中表现的关系与所学规律相对比,作出符合判断。
1、物质的量(浓度)/速率---时间图像( n/c/ν—t图像)
正向移动
增大反应物浓度
v
t
t1
0
v正
v逆
对于可逆反应mA(g) + nB(g) pC(g) + qD(g)来说
v′正
v′逆
逆向移动
减小反应物浓度
v
t
t1
0
v正
v逆
v′逆
v′正
v'正=v'逆
v正=v逆
v'正=v'逆
v正=v逆
(1)改变某物质浓度
一个断点一个连续点
平衡Ⅰ a b c
平衡Ⅱ(a-2a) (b-2b) >2c
加压(体积缩小一半)
t
v
t1
t2
v正
v正
v逆
v逆
t
H2
t2
t1
N2
NH3
全部断点
加压平衡右移的结果:正逆速率都增大、反应物转化率增大、所有物质浓度都变大、反应物体积分数减小、生成物体积分数增大。
C
(2)改变压强
N2(g) + 3H2 (g) 2NH3(g)
平衡Ⅰ a b c
平衡Ⅱ(a/2,a) (b/2,b) (0,c/2)
减压(体积扩大到原来的2倍)
t
v
t1
t2
v逆
v正
v正
v逆
t
H2
t2
t1
N2
NH3
减压平衡左移的结果:正逆速率都减小、反应物转化率减小、所有物质浓度都减小、反应物体积分数增大、生成物体积分数减小。
C
全部断点
N2(g) + 3H2 (g) 2NH3(g)
2NO2(g) N2O4(g) △H=-56.9KJ/mol
t1
t2
(3)改变温度
C
t
N2O4
NO2
v-t图像全是断点
c-t图像全部连续点
t1
t2
v
t
NO2
N2O4
C
升温
降温
例1:已知: =-92.4kJ.mol-1,反应过程中,反应速率的变化如图所示,请根据速率的变化回答采取的措施
增大c(N2)或c(H2)
加入催化剂
降低温度
增大压强
t3
t4
t1
t2
N2(g) + 3H2 (g) 2NH3(g)
2、转化率(或百分含量)-时间-温度(或压强)图:
例2:对于反应mA(g)+nB(g) pC(g)+qD(g)
t
A
的转化率
T1
T2
正反应吸热
T1>T2
因为T2→T1升温,α(A) ,
说明平衡正移,△H >0
t
B
的转化率
P1
P2
m+n
因为P1→P2增压,α(B) ,说明平衡逆移,逆反应气体体积减小,故m+n
先拐先平先平者大
t
T1
T2
A%
C%
t
P1
P2
对于反应mA(g)+nB(g) pC(g)+qD(g)
T2→T1升温,A% ,
平衡逆移,△H<0
T1>T2
P1>P2
P2→P1增压,C%不变 ,
平衡不移动,等体反应
正反应放热
m+n=p+q
先拐先平数值大
例3:对于反应mA (g) + nB (g) pC (g)+qD(g)有如图所示的关系,则:
⑴、P1 ____ P2 ;T1 ____ T2 ;
⑵、m+n ______ p+q ;
⑶、正反应为_________ 反应
<
>
吸热
定一议二
t
B%
T2P2
T1P2
T1P1
P2>P1
T1>T2
因为T1时,P1→P2增大压强,B%增大,平衡左移,逆反应是缩体反应,故m+n
解题方法:
先拐先平数值大
<
3、百分含量(或转化率)—压强或温度图像
例4:对于反应mA(g)+nB(g) pC(g)+qD(g) ΔH
P
C%
200℃
500℃
T
A
的转化率
1.01×105Pa
1.01×106Pa
1.01×107Pa
看线(如:线的走势)
正反应 热m+n p+q
吸
>
正反应 热
m+n p+q
放
<
定一议二,做辅助线
例5:对于反应mA(g)+nB(g) pC(g)+qD(g)
正反应 热m+n p+q
吸
=
T
v
v逆
v正
T1
T2
正反应吸热
T
v
v正
v逆
正反应吸热
对于反应mA(g)+nB(g) pC(g)+qD(g)
温度由T1升到T2,v正>v逆,平衡右移,正反应吸热
温度升高,v正>v逆,平衡右移,正反应吸热
平衡点
交点为平衡状态,交点左侧为达平衡过程,右侧为平衡移动过程
4、其他图像
T
C%
450℃
正反应放热
P
A%
P1
m+n
温度升高,C%减小,平衡左移,逆反应吸热
平衡点
压强增加,A%增加,平衡左移,逆反应缩小体积
最高点、最低点为平衡状态,极值点前为达平衡过程,极值点后为平衡移动过程
对于反应mA(g)+nB(g) pC(g)+qD(g)
0
例6:下图是在其它条件一定时,反应2NO+O2 2NO2 △H<0 中NO 的最大转化率与温度的关系曲线。图中坐标A、B、C、D、E 5点,其中表示未达平衡状态且V正>V逆的点是 。
A
B
C
E
D
C点
T
转化率
线为平衡点
线外未平衡点
全程速率时间图:表示某个反应全程的速率随时间的变化
OC段:反应放热,使温度升高,速率加快
C以后:反应物浓度降低,速率减慢
例7: 合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如图。下列说法正确的是( )
A.t1时升高了温度
B.t2时使用了催化剂
C.t3时增大了压强
D.t4时降低了温度
B
看图技巧:
改变条件瞬间,曲线对应特点:
出现连贯点,则是物质浓度发生改变;
都是断点,则是温度改变或是压强改变;
出现点重合,则是使用催化剂或是反应前后气体系数不变的反应中压强改变。
小结
