2023-2024学年人教版高中化学选择性必修二 3.4.1 配合物与超分子 课件(共19张PPT)
文档属性
| 名称 | 2023-2024学年人教版高中化学选择性必修二 3.4.1 配合物与超分子 课件(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-01 08:52:25 | ||
图片预览





文档简介
(共19张PPT)
第三章 晶体结构与性质
第四节 配合物与超分子
第一课时 配合物
探寻溶液中的铜离子
本节课任务——探寻溶液中的铜离子
【真实实验情境】
情境1向0.1mol/LCuSO4溶液中加入光亮的铁钉,
在铁钉表面出现红色的铜。
情境2向0.1mol/LCuSO4溶液中滴加1 mol/L 氨水至得到澄清
溶液,加入光亮的铁钉,无明显现象。
铜离子去哪儿了?
学习目标:
知道配位键的特点,认识简单的配位化合物的成键特征,能举例说明某些配位化合物的典型性质、存在与应用
发展“证据推理与模型认知”核心素养。
2. 能运用配位键解释某些沉淀溶解、颜色变化等实验现象
发展“宏观辨识与微观探析”核心素养。
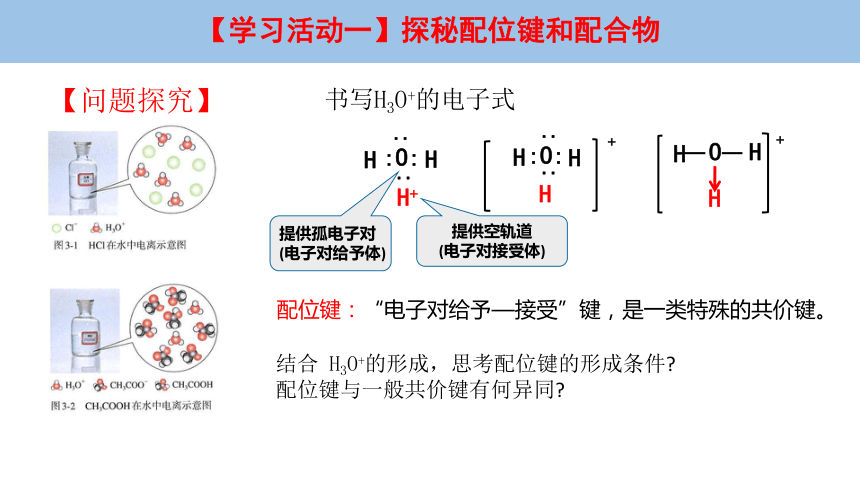
书写H3O+的电子式
【问题探究】
【学习活动一】探秘配位键和配合物
O
H
H
H
+
:O:
H
H
:
:
提供孤电子对
(电子对给予体)
提供空轨道
(电子对接受体)
H+
配位键:“电子对给予—接受”键,是一类特殊的共价键。
结合 H3O+的形成,思考配位键的形成条件
配位键与一般共价键有何异同
:O:
H
H
H
+
:
:
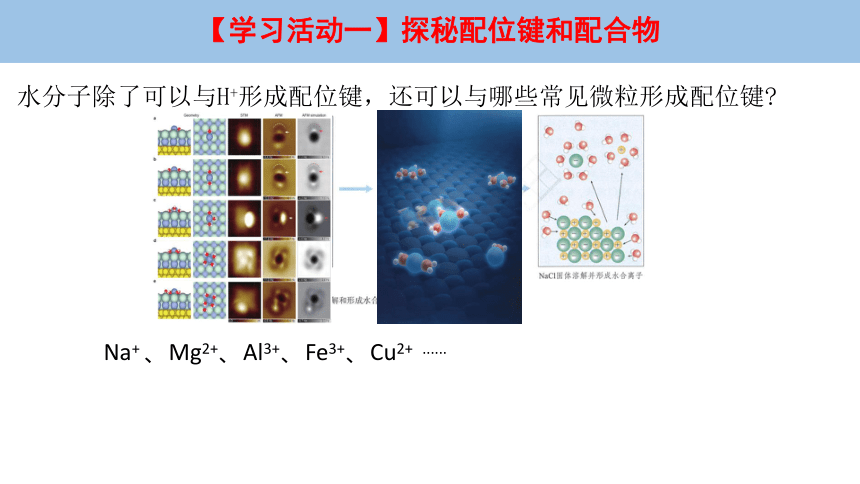
水分子除了可以与H+形成配位键,还可以与哪些常见微粒形成配位键
【学习活动一】探秘配位键和配合物
Na+ 、Mg2+、Al3+、Fe3+、Cu2+ ......
实验探究1—硫酸铜溶液中铜离子的存在形式(用点滴板进行实验)
Cu
OH2
H2O
H2O
H2O
2+
试根据以上存在形式改写CuSO4 5H2O化学式_____________________
[Cu(H2O)4]SO4 H2O
配位化合物:通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
【学习活动一】探秘配位键和配合物
四水合铜离子 配离子
天蓝色
情境1CuSO4溶液中加入光亮的铁钉,可以在铁钉表面出现红色的铜,说明什么?
[Cu(H2O)4]2+ Cu2+ + 4H2O
+
Fe
Cu+Fe2+
=
探寻到了CuSO4溶液中的铜离子,情境1目标达成!
【学习活动一】探秘配位键和配合物
结论:配离子也可以电离,存在电离平衡。
结论:配位键的强弱有大有小,配合物更易转化为稳定性更强的配合物。
【学习活动二】再探配合物的形成
实验探究2—一水合硫酸四氨合铜的形成
小组讨论并回答:先出现的沉淀是什么
后出现的深蓝色澄清溶液还是CuSO 溶液吗 结合实验探究1的学习成果,
推测产物结构。并运用平衡移动原理解释沉淀的溶解。
Cu2++2NH3·H2O===Cu(OH)2↓+2
Cu(OH)2(s) Cu2+(aq) + 2OH-(aq)
+
4NH3
[Cu(NH3)4]2+
=
Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-
[Cu(H2O)4]2+ + 4NH3 [Cu(NH3)4]2+ +4H2O
Cu
NH3
NH3
H3N
NH3
2+
四氨合铜离子
深蓝色
稳定性:[Cu(H2O)4]2+ < [Cu(NH3)4]2+
向试管2中继续加入约2mL95%乙醇,并用玻璃棒摩擦试管壁,观察实验现象。
加入乙醇之后,有物质析出,说明该物质有什么特点
[Cu(NH3)4 ]SO4 H2O
内界
中
心
离
子
配
体
配
体
数
外界
情境2中铜离子存在形式[Cu(NH3)4 ]2+,加入光亮的铁钉,无明显现象。
说明配合物内界较稳定,电离微弱。
【学习活动二】再探配合物的形成
练习:K3[Fe(CN)6]中配离子、中心离子、配体、配位原子是什么?配位数是多少?
离子化合物
配位原子
【学习活动二】再探配合物的形成
实验验证—简单离子与配离子的区别(用点滴板进行实验)
分组实验:FeCl3溶液、K3[Fe(CN)6]溶液分别滴加KSCN溶液。
按学案完成实验。
小结:形成配合物后对物质性质有哪些影响?
形成配合物时颜色常发生变化,
溶解性改变,
稳定性增强。
[Fe(CN)6]3—比Fe3+稳定
n = 1∽6,随SCN-的浓度而异
Fe3+ +nSCN- [Fe(SCN)n]3-n
【学习任务三】终探配合物的电离和转化
由实验探究1、实验探究2可知,[Cu(NH3)4]2+存在平衡:
[Cu(NH3)4]2+ Cu2+ + 4NH3
实验探究3——设计实验方案检验试管1中的Cu2+
已知Ksp[Cu(OH)2]=2.6×10-19;Ksp(CuS)=1.27×10-36
各小组讨论,利用提供的试剂形成方案,完成实验并记录现象,汇报。
思路 原理 操作 现象
方案一
方案二
......
[Cu(NH3)4]2+的电离平衡是否牢不可破?
Cu2+ + 4NH3 [Cu(NH3)4]2+
+
4NH4+
4H+
=
←平衡向左移动
CuSO4(aq) 蓝色沉淀
氨水
氨水
深蓝色溶液
酸
酸
实验探究3—[Cu(NH3)4]2+的电离平衡是否牢不可破?
加入酸、形成更难溶的物质
(加入Na2S生成CuS)、
加热等可使平衡移动。
【学习任务三】终探配合物的电离和转化
结论:通过改变外界条件,可以使配离子的电离平衡移动,实现配合物的转化。
探寻到了深蓝色溶液中的铜离子,情境2目标达成!
【练习】2014年全国卷Ⅱ第37题:
H,N,O,Cu4种元素形成一种阳离子呈轴向狭长的八面体结构(如下图所示)。
阳离子中存在的化学键类型有________________;该化合物加热时首先失去的组分是_______,判断理由是______________________________________________________。
【学习活动三】终探配合物的电离和转化
共价键,配位键
H2O
两个H2O 位于轴向上, 距离Cu2+ 较远,两者之间的作用力较弱。
分组实验— 二氨合银配离子的形成
实验探究4—设计实验方案检验刚刚获得的溶液中的Ag+
Ksp(AgCl)=1.8×10-10;Ksp (AgI)=8.3×10-17)
各小组讨论,利用提供的试剂形成方案,完成实验并记录现象,汇报。
【学习活动四】实践应用
思路 原理 操作 现象
方案一
方案二
......
Ag++Cl-=AgCl↓
AgCl+2NH3=[Ag(NH3)2]Cl
二氨合银离子
[Ag(NH3)2]+ Ag+ + 2NH3
【生活应用】人体内血红蛋白(Hb)是Fe2+卟啉配合物,Fe2+与O2结合形成配合物[Hb(O2)],而CO与血红蛋白中的Fe2+也能生成配合物[Hb(CO)]。已知37℃时,反应CO+[Hb(O2)] O2+[Hb(CO)] K=220。
[Hb(CO)]的浓度达到[Hb(O2)]浓度的0.02倍,会发生CO中毒,使人智力受损。
(1) 由以上数据,结合生活常识,比较说明配合物的稳定性。
(2)若发生CO中毒事故,治疗方案常为将中毒患者送入高压氧舱治疗,这是为什么
【学习活动四】实践应用
叶绿素
固氮酶
血红蛋白
维生素B12
电镀
王水溶金
照相技术定影
助熔剂
抗癌药物
——顺铂
污水处理
汽车尾气净化
激光材料
超导材料
在生命体
中的应用
在生产生活
中的应用
其他
领域
在医药中
的应用
在人和动物体内起输送氧气作用的血红素,是Fe的配合物;
配合物在生产和科学技术方面的应用也很广泛.
例:在医药科学、化学催化剂、新型分子材料等领域都有着广泛的应用。
配合物的应用
【总结提升】
知道配位键的特点,
认识简单的配位化合物的成键特征,
能举例说明某些配位化合物的典型性质、存在与应用
发展“证据推理与模型认知”核心素养。
2. 能运用配位键解释某些沉淀溶解、
颜色变化等实验现象
发展“宏观辨识与微观探析”核心素养。
【课后作业】
查阅资料,了解配合物在医药科学、化学催化剂、新型分子材料等领域广泛的应用。
谢谢聆听
第三章 晶体结构与性质
第四节 配合物与超分子
第一课时 配合物
探寻溶液中的铜离子
本节课任务——探寻溶液中的铜离子
【真实实验情境】
情境1向0.1mol/LCuSO4溶液中加入光亮的铁钉,
在铁钉表面出现红色的铜。
情境2向0.1mol/LCuSO4溶液中滴加1 mol/L 氨水至得到澄清
溶液,加入光亮的铁钉,无明显现象。
铜离子去哪儿了?
学习目标:
知道配位键的特点,认识简单的配位化合物的成键特征,能举例说明某些配位化合物的典型性质、存在与应用
发展“证据推理与模型认知”核心素养。
2. 能运用配位键解释某些沉淀溶解、颜色变化等实验现象
发展“宏观辨识与微观探析”核心素养。
书写H3O+的电子式
【问题探究】
【学习活动一】探秘配位键和配合物
O
H
H
H
+
:O:
H
H
:
:
提供孤电子对
(电子对给予体)
提供空轨道
(电子对接受体)
H+
配位键:“电子对给予—接受”键,是一类特殊的共价键。
结合 H3O+的形成,思考配位键的形成条件
配位键与一般共价键有何异同
:O:
H
H
H
+
:
:
水分子除了可以与H+形成配位键,还可以与哪些常见微粒形成配位键
【学习活动一】探秘配位键和配合物
Na+ 、Mg2+、Al3+、Fe3+、Cu2+ ......
实验探究1—硫酸铜溶液中铜离子的存在形式(用点滴板进行实验)
Cu
OH2
H2O
H2O
H2O
2+
试根据以上存在形式改写CuSO4 5H2O化学式_____________________
[Cu(H2O)4]SO4 H2O
配位化合物:通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
【学习活动一】探秘配位键和配合物
四水合铜离子 配离子
天蓝色
情境1CuSO4溶液中加入光亮的铁钉,可以在铁钉表面出现红色的铜,说明什么?
[Cu(H2O)4]2+ Cu2+ + 4H2O
+
Fe
Cu+Fe2+
=
探寻到了CuSO4溶液中的铜离子,情境1目标达成!
【学习活动一】探秘配位键和配合物
结论:配离子也可以电离,存在电离平衡。
结论:配位键的强弱有大有小,配合物更易转化为稳定性更强的配合物。
【学习活动二】再探配合物的形成
实验探究2—一水合硫酸四氨合铜的形成
小组讨论并回答:先出现的沉淀是什么
后出现的深蓝色澄清溶液还是CuSO 溶液吗 结合实验探究1的学习成果,
推测产物结构。并运用平衡移动原理解释沉淀的溶解。
Cu2++2NH3·H2O===Cu(OH)2↓+2
Cu(OH)2(s) Cu2+(aq) + 2OH-(aq)
+
4NH3
[Cu(NH3)4]2+
=
Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-
[Cu(H2O)4]2+ + 4NH3 [Cu(NH3)4]2+ +4H2O
Cu
NH3
NH3
H3N
NH3
2+
四氨合铜离子
深蓝色
稳定性:[Cu(H2O)4]2+ < [Cu(NH3)4]2+
向试管2中继续加入约2mL95%乙醇,并用玻璃棒摩擦试管壁,观察实验现象。
加入乙醇之后,有物质析出,说明该物质有什么特点
[Cu(NH3)4 ]SO4 H2O
内界
中
心
离
子
配
体
配
体
数
外界
情境2中铜离子存在形式[Cu(NH3)4 ]2+,加入光亮的铁钉,无明显现象。
说明配合物内界较稳定,电离微弱。
【学习活动二】再探配合物的形成
练习:K3[Fe(CN)6]中配离子、中心离子、配体、配位原子是什么?配位数是多少?
离子化合物
配位原子
【学习活动二】再探配合物的形成
实验验证—简单离子与配离子的区别(用点滴板进行实验)
分组实验:FeCl3溶液、K3[Fe(CN)6]溶液分别滴加KSCN溶液。
按学案完成实验。
小结:形成配合物后对物质性质有哪些影响?
形成配合物时颜色常发生变化,
溶解性改变,
稳定性增强。
[Fe(CN)6]3—比Fe3+稳定
n = 1∽6,随SCN-的浓度而异
Fe3+ +nSCN- [Fe(SCN)n]3-n
【学习任务三】终探配合物的电离和转化
由实验探究1、实验探究2可知,[Cu(NH3)4]2+存在平衡:
[Cu(NH3)4]2+ Cu2+ + 4NH3
实验探究3——设计实验方案检验试管1中的Cu2+
已知Ksp[Cu(OH)2]=2.6×10-19;Ksp(CuS)=1.27×10-36
各小组讨论,利用提供的试剂形成方案,完成实验并记录现象,汇报。
思路 原理 操作 现象
方案一
方案二
......
[Cu(NH3)4]2+的电离平衡是否牢不可破?
Cu2+ + 4NH3 [Cu(NH3)4]2+
+
4NH4+
4H+
=
←平衡向左移动
CuSO4(aq) 蓝色沉淀
氨水
氨水
深蓝色溶液
酸
酸
实验探究3—[Cu(NH3)4]2+的电离平衡是否牢不可破?
加入酸、形成更难溶的物质
(加入Na2S生成CuS)、
加热等可使平衡移动。
【学习任务三】终探配合物的电离和转化
结论:通过改变外界条件,可以使配离子的电离平衡移动,实现配合物的转化。
探寻到了深蓝色溶液中的铜离子,情境2目标达成!
【练习】2014年全国卷Ⅱ第37题:
H,N,O,Cu4种元素形成一种阳离子呈轴向狭长的八面体结构(如下图所示)。
阳离子中存在的化学键类型有________________;该化合物加热时首先失去的组分是_______,判断理由是______________________________________________________。
【学习活动三】终探配合物的电离和转化
共价键,配位键
H2O
两个H2O 位于轴向上, 距离Cu2+ 较远,两者之间的作用力较弱。
分组实验— 二氨合银配离子的形成
实验探究4—设计实验方案检验刚刚获得的溶液中的Ag+
Ksp(AgCl)=1.8×10-10;Ksp (AgI)=8.3×10-17)
各小组讨论,利用提供的试剂形成方案,完成实验并记录现象,汇报。
【学习活动四】实践应用
思路 原理 操作 现象
方案一
方案二
......
Ag++Cl-=AgCl↓
AgCl+2NH3=[Ag(NH3)2]Cl
二氨合银离子
[Ag(NH3)2]+ Ag+ + 2NH3
【生活应用】人体内血红蛋白(Hb)是Fe2+卟啉配合物,Fe2+与O2结合形成配合物[Hb(O2)],而CO与血红蛋白中的Fe2+也能生成配合物[Hb(CO)]。已知37℃时,反应CO+[Hb(O2)] O2+[Hb(CO)] K=220。
[Hb(CO)]的浓度达到[Hb(O2)]浓度的0.02倍,会发生CO中毒,使人智力受损。
(1) 由以上数据,结合生活常识,比较说明配合物的稳定性。
(2)若发生CO中毒事故,治疗方案常为将中毒患者送入高压氧舱治疗,这是为什么
【学习活动四】实践应用
叶绿素
固氮酶
血红蛋白
维生素B12
电镀
王水溶金
照相技术定影
助熔剂
抗癌药物
——顺铂
污水处理
汽车尾气净化
激光材料
超导材料
在生命体
中的应用
在生产生活
中的应用
其他
领域
在医药中
的应用
在人和动物体内起输送氧气作用的血红素,是Fe的配合物;
配合物在生产和科学技术方面的应用也很广泛.
例:在医药科学、化学催化剂、新型分子材料等领域都有着广泛的应用。
配合物的应用
【总结提升】
知道配位键的特点,
认识简单的配位化合物的成键特征,
能举例说明某些配位化合物的典型性质、存在与应用
发展“证据推理与模型认知”核心素养。
2. 能运用配位键解释某些沉淀溶解、
颜色变化等实验现象
发展“宏观辨识与微观探析”核心素养。
【课后作业】
查阅资料,了解配合物在医药科学、化学催化剂、新型分子材料等领域广泛的应用。
谢谢聆听
