3.4.2 羧酸 羧酸衍生物 课件(共40张PPT)
文档属性
| 名称 | 3.4.2 羧酸 羧酸衍生物 课件(共40张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-01 13:47:42 | ||
图片预览






文档简介
(共40张PPT)
第四节 羧酸 羧酸衍生物
第三章 烃的衍生物
卤代烃
醇 酚
醛 酮
羧酸 羧酸衍生物
有机合成
甲酸(蚁酸) HCOOH
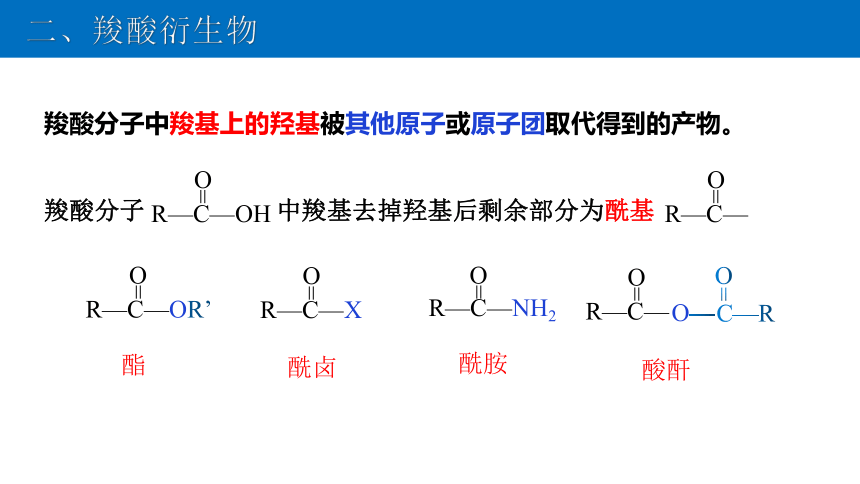
羧酸分子 中羧基去掉羟基后剩余部分为酰基
R—C—OH
O
=
R—C—OR’
O
=
酯
R—C—X
O
=
酰卤
R—C—NH2
O
=
酰胺
R—C—
O
=
R—C—
O
=
C—R
O
=
酸酐
二、羧酸衍生物
O—
羧酸分子中羧基上的羟基被其他原子或原子团取代得到的产物。
1、酯
丁酸乙酯
乙酸异戊酯
戊酸戊酯
(1)酯的物理性质、存在和用途
作溶剂,作制备饮料和糖果和糕点的酯类香料。
存在:
用途:
密度一般比水小,难溶于水,易溶于有机溶剂,许多酯也是常用的有机溶剂。
酯类广泛存在于自然界,低级酯是有芳香气味的液体,存在于各种水果和花草中。
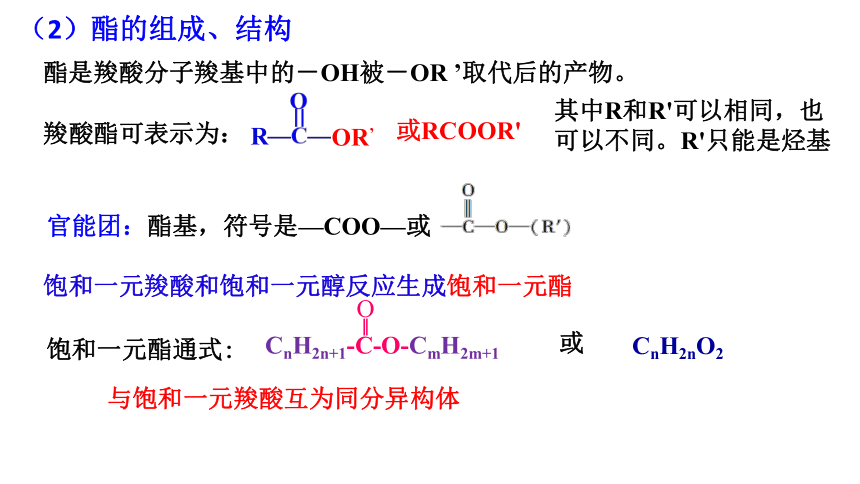
(2)酯的组成、结构
酯是羧酸分子羧基中的-OH被-OR ’取代后的产物。
官能团:酯基,符号是—COO—或
饱和一元酯通式:
与饱和一元羧酸互为同分异构体
或
CnH2nO2
饱和一元羧酸和饱和一元醇反应生成饱和一元酯
或RCOOR'
OR’
R
羧酸酯可表示为:
其中R和R'可以相同,也可以不同。R'只能是烃基
CnH2n+1-C-O-CmH2m+1
‖
O
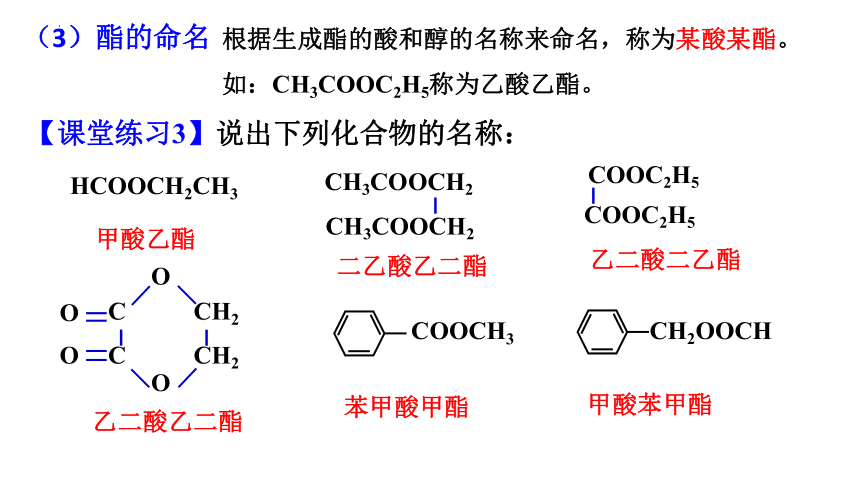
(3)酯的命名
根据生成酯的酸和醇的名称来命名,称为某酸某酯。
如:CH3COOC2H5称为乙酸乙酯。
HCOOCH2CH3
COOC2H5
COOC2H5
CH3COOCH2
CH3COOCH2
C
C
CH2
CH2
O
O
O
O
乙二酸乙二酯
乙二酸二乙酯
二乙酸乙二酯
甲酸乙酯
苯甲酸甲酯
甲酸苯甲酯
COOCH3
CH2OOCH
【课堂练习3】说出下列化合物的名称:
乙酸和乙醇反应生成乙酸乙酯的化学方程式:
(4)酯的化学性质
酯的重要化学性质之一是可以发生水解反应,生成相应的酸和醇。
CH3COOH+C2H5OH CH3COOC2H5+H2O
浓硫酸
△
【探究】 乙酸乙酯的水解
【问题】乙酸乙酯水解的速率与反应条件有着怎样的关系呢?
影响速率的外界条件:浓度、温度、催化剂、溶液的酸碱性。
研究方法——控制变量法
可逆反应
70℃
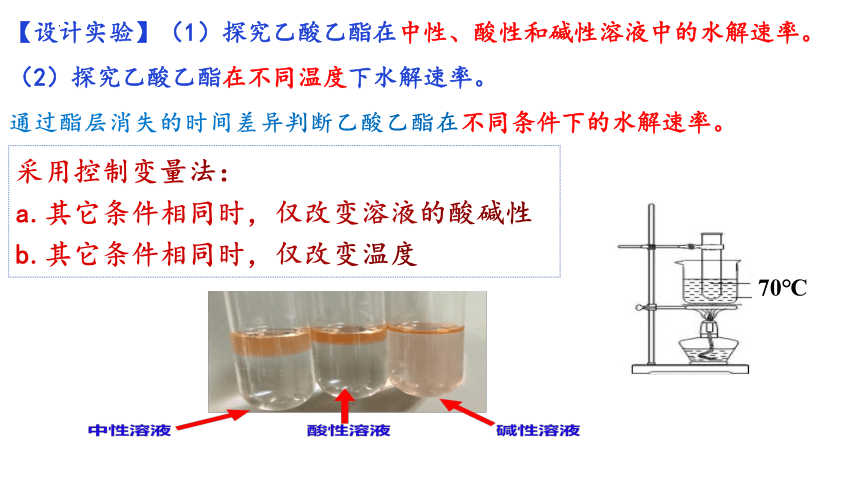
【设计实验】(1)探究乙酸乙酯在中性、酸性和碱性溶液中的水解速率。
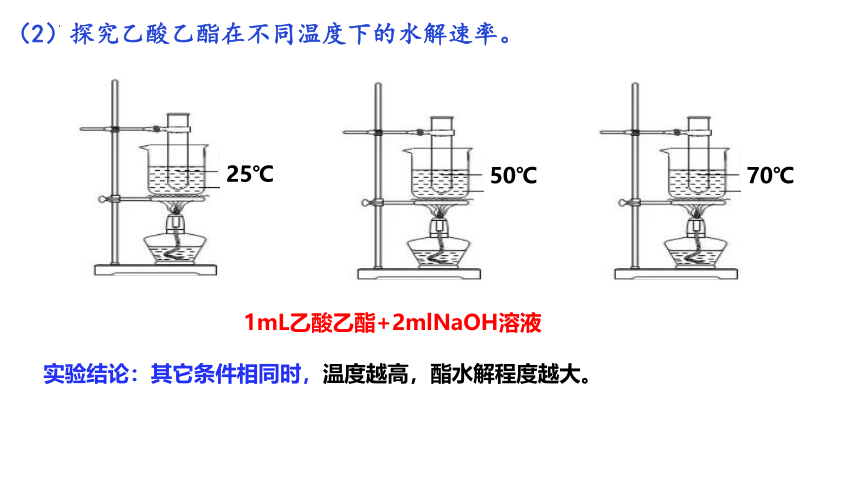
(2)探究乙酸乙酯在不同温度下水解速率。
通过酯层消失的时间差异判断乙酸乙酯在不同条件下的水解速率。
采用控制变量法:
a.其它条件相同时,仅改变溶液的酸碱性
b.其它条件相同时,仅改变温度
(1)酸碱性对酯的水解的影响:
实验分组 实验操作 现象 结论
1
2 3 1.在3支试管中各加人2 mL乙酸乙酯,再分别加入蒸馏水、5ml的稀硫酸和含有酚酞的NaOH溶液。
2.水浴加热,记录酯层消失和酯香味消失的时间。
几乎无变化(中性)
酯层变薄(酸性)
酯层消失(碱性)
酯水解速率:
碱性溶液>酸性溶液
>中性溶液
25℃
50℃
1mL乙酸乙酯+2mlNaOH溶液
70℃
实验结论:其它条件相同时,温度越高,酯水解程度越大。
(2)探究乙酸乙酯在不同温度下的水解速率。
【讨论】(1)根据化学平衡移动原理,解释乙酸乙酯在碱性条件下发生的水解反应是不可逆的。
(2)控制实验条件是科学研究中的重要方法,通过乙酸乙酯水解条件的探究,你对这一方法有何体会?
乙酸乙酯水解生成乙酸,碱中和乙酸,使生成物浓度减少,促进平衡正向移动,反应趋于完全,所以不可逆。
控制实验条件如增加反应物浓度,使用催化剂、加热等可以加快反应速率;将生成物通过反应转化成其他物质,可以使平衡正向移动,甚至可以使反应进行完全。
CH3COOC2H5+NaOH CH3COONa+C2H5OH
△
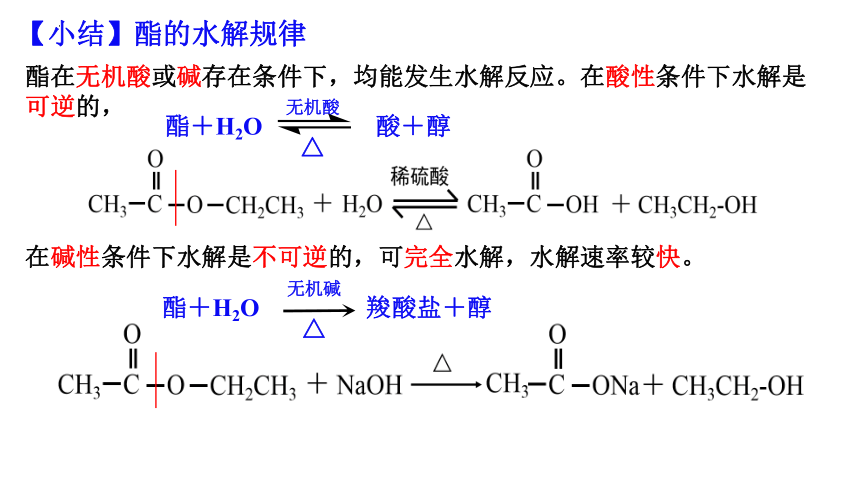
酯在无机酸或碱存在条件下,均能发生水解反应。在酸性条件下水解是可逆的,
在碱性条件下水解是不可逆的,可完全水解,水解速率较快。
【小结】酯的水解规律
酯+H2O 酸+醇
无机酸
△
酯+H2O 羧酸盐+醇
无机碱
△
酯化反应与酯水解反应的比较
酯 化 水 解
反应关系 催 化 剂
催化剂的 其他作用
加热方式
反应类型
NaOH中和酯水解生成的羧酸,提高酯的水解率
CH3COOH+C2H5OH CH3COOC2H5+H2O
浓 硫 酸
稀H2SO4或NaOH
吸水,提高CH3COOH与C2H5OH的转化率
酒精灯火焰加热
热水浴加热
酯化反应(取代反应)
水解反应(取代反应)
酯化
水解
特殊的酯——甲酸酯
H—C—O—R
O
=
甲酸酯: 具有醛基和酯基的性质
注意:能发生银镜反应及与新制Cu(OH)2悬浊液反应产生红色沉淀的有醛、甲酸、甲酸酯、甲酸盐、葡萄糖等含有醛基的物质。
【课堂练习4】用化学方程式表示在甲酸甲酯性质
CH3OH+HCOOH
HCOOCH3 +H2O
①
稀硫酸
△
HCOOCH3 +NaOH
△
CH3OH+HCOONa
Na2CO3+Cu2O +4H2O
HCOOCH3+2Cu(OH)2+2NaOH
(NH4 )2CO3+2Ag +2NH3 +H2O
②HCOOCH3+2Ag(NH3)2OH
(5)羧酸、酯的同分异构体的书写
写出C4H8O2的属于羧酸和酯的同分异构体
羧酸——基元法/取代法(用羧基取代丙烷上的氢)
C3H7—COOH
CH3—CH2—CH3
①
①
②
CH3CH2CH2COOH
CH3CHCH3
COOH
酯——分碳法
甲酸丙酯
乙酸乙酯
丙酸甲酯
HCOO
C C C
HCOO
C C
C
C COO
C C
C C COO
C
还有属于其他种类的同分异构体吗?
羟基醛、羟基酮、醚醛、醚酮等
【课堂练习5】分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有( )
A. 15种 B. 28种 C. 32种 D.40种
D
HCOO—C4H9(4种)
CH3COO—C3H7
C2H5COO—C2H5
C3H7COO—CH3
C5H10O2的酯
(2种)
(2种)
水解生成5种羧酸和8种醇。
排列组合法
泛指在生活中存在的各类劣质油,如回收的食用油、反复使用的炸油等,其主要成分是油脂。地沟油最大来源为城市大型饭店下水道的隔油池。长期食用可能会引发癌症,对人体的危害极大。
【身边的化学】——地沟油
油
常温呈液态的油脂
如花生油、芝麻油、大豆油等植物油
脂肪
常温呈固态的油脂
如牛油、羊油等动物油脂
2、油酯
日常生活中食用的油脂是由高级脂肪酸与甘油形成的酯,属于酯类化合物。
(1)油脂的结构
CH2 O C R
CH O C R'
CH2 O C R''
O
O
O
a. R、R’和R’’代表高级脂肪酸的烃基
b. 如果R、R'和R''相同,这样的油酯称为简单甘油酯
如果R、R'和R''不相同,这样的油酯称为混合甘油酯
c. 在天然油脂中, R、R'和R''一般不相同,属于混合甘油酯
元素组成:
C、H、O
C15H31COOH
C17H35COOH
C17H33COOH
C17H31COOH
不饱和脂肪酸
饱和脂肪酸
高级脂肪酸
软脂酸
硬脂酸
油酸
亚油酸
H
H
(CH2)7COOH
CH3(CH2)7
C=C
1
9
10
18
顺-9-十八碳烯酸(油酸)
H
H
(CH2)7COOH
CH3(CH2)4
C=C
CH2
C=C
H
H
顺,顺-9,12-十八碳二烯酸(亚油酸)
9
10
12
13
18
HO—CH2
HO—CH
HO—CH2
甘油(丙三醇)
【思考与讨论】请写出硬脂酸、油酸分别与丙三醇反应的化学方程式。
浓硫酸
△
C17H35COOH +
3
CH2
OH
CH
OH
CH2
OH
+3H2O
硬脂酸甘油酯
CH2
O
C
O
C17H35
CH
O
C
O
C17H35
CH2
O
C
O
C17H35
C17H33COOH+
浓硫酸
△
3
CH2
OH
CH
OH
CH2
OH
+3H2O
油酸甘油酯
CH2
O
C
O
C17H33
CH
O
C
O
C17H33
CH2
O
C
O
C17H33
(2)油脂的化学性质
油脂兼有酯类和烯烃的性质
3C17H35COOH
①水解反应
a、酸性条件
应用:工业上以油脂为原料制取高级脂肪酸和甘油
3C17H35COONa
应用:高级脂肪酸钠(或钾)盐是肥皂的有效成分,工业上利用油脂的皂化反应来制造肥皂。
b、碱性条件(皂化反应)
酒精、NaOH溶液
加热
油脂
肥皂、甘油、水等的混和液
加入细食盐
加热、搅拌
分层
皂化
盐析
【研究与实践】自制肥皂
(1)酒精的作用:
(2)皂化反应完成的判断:
溶解油脂,使反应充分
溶液完全互溶不分层
(3)盐析:加入无机盐使某些有机物溶解度减小而析出的过程。
加填充剂(硅酸钠等)
压滤、干燥成型
下层:甘油、食盐水、酒精等→分馏
上层:高级脂肪酸钠
成品肥皂
②油脂的氢化
(油脂的硬化)
CH2 OOCC17H33
CH OOCC17H33
CH2 OOCC17H33
油酸甘油酯
+3 H2
Δ
CH2 OOCC17H35
CH OOCC17H35
CH2 OOCC17H35
硬脂酸甘油酯
应用:油脂氢化制得的油脂叫人造脂肪,又称硬化油。硬化油不易被空气氧化变质,便于储存和运输,可作为制造肥皂、人造奶油的原料。
(3)油脂的用途
①油脂是人类重要的营养物质和食物之一
②油脂是重要的供能物质
③油脂能溶解一些脂溶性维生素(如维生素A、D、E、K),因此进食一定量的油脂能促进人体对食物中含有的这些维生素的吸收。
④油脂也是一种重要的工业原料,主要用来生产肥皂、高级脂肪酸和甘油等。
【问题与讨论】
纯碱溶液呈碱性,油脂在碱性条件下水解完全。温度升高,纯碱水解程度大,碱性强,有利于促进油脂的水解。
2:如何利用化学方法鉴别植物油和矿物油
植物油属于油脂,能在碱性条件下水解;矿物油的主要成分为烃类,不与碱反应。故取少量液体,加含酚酞的NaOH溶液,加热,若液体不分层,且红色变浅的为植物油;若液体分层,颜色无变化的为矿物油。
3:在油、脂肪、酯、汽油中一定能使酸性高锰酸钾溶液或溴水褪色的是
油。从结构中是否含有碳碳双键进行考虑,油一定有碳碳双键,脂肪一般没有,酯可能有,直馏汽油一般没有而裂化汽油有。
1:用热的纯碱溶液清除油污的原理是什么?
【化学与生活】——烟酰胺
常言道:“一白遮百丑”,几乎所有女生都希望自己的肌肤能够更白一点,最近几年烟酰胺火遍了全网,它是美白护肤品最常用的添加剂。
酰胺基
烟酰胺的结构简式如图 。
NH2
蛋白质一级结构中的肽键,在化学上也属于酰胺键,酰胺也是羧酸的衍生物。酰胺具有怎样的性质呢?在学习酰胺之前,下面先简单介绍一下胺
…
C=O
H—N
H—C—R1
C=O
H—N
H—C—R2
C=O
H—N
H—C—R3
C=O
H—N
H—C—R4
…
蛋白质的结构示意图
蛋白质的三级结构
蛋白质的二级结构
蛋白质的四级结构
-NH2
甲胺(CH3-NH2)
1)胺
烃基取代 中的 而形成的化合物叫做胺(R—NH2)
氨分子
氢原子
或烃分子中的 原子被 所替代得到的化合物。
氢
氨基
苯 胺
实例:
被取代的氨基(-NH2或-NHR或-NRR')
R-NHR
R-NR R
(CH3)2NH
(CH3)3N
-NH(CH3)
N-甲基苯胺
二甲胺
三甲胺
3、酰胺
①胺的结构
官能团的名称为氨基(-NH2)或
取代的氨基( NRR’,R和R’可以是氢原子或烃基)
②胺的分类
a.按照烃基结构,胺可以分为脂肪胺 和 芳香胺
b.按照氮原子上烃基数目,胺可分为伯胺、仲胺、叔胺
R—NH2
R1—NH
—
R2
R1—N—R3
—
R2
伯胺
叔胺
仲胺
R1—N—R3
—
R2
—
R4
+
季铵离子
a.低级胺是气体或易挥发液体,气味与氨相似,
高级胺为固体,胺的沸点比相对分子质量相近的烃高,但比醇和羧酸的沸点低。
b.胺都能与水分子形成氢键,低级胺易溶于水,
随碳原子数增加,胺的溶解度迅速降低,6个碳以上的胺难就溶于水。
c.芳香胺的毒性很大,能致癌。
例如,甲胺和苯胺都是合成医药、农药和染料等的重要原料。
③胺的物理性质(了解)
④用途:
胺的用途很广,是重要的化工原料。
NH3+HCl=NH4Cl
2NH3+H2SO4=(NH4)2SO4
实质:NH3+H+=NH4+
本质
那么胺是否也具有碱性呢?
+H+
N
H
H
H
N
H
H
H
H
[ ]
+
氨基的氮原子上有一对孤对电子,易与H+结合。
NH3的性质
⑤胺的化学性质
碱性气体
因此胺也具有碱性,
胺的官能团为氨基(-NH2),
氮原子上也有一对孤对电子
可与强酸反应生成有机铵盐
CH3-NH2+HCl
(CH3)2NH+HCl
(CH3)3N+HCl
(苯胺盐酸盐)
注意:“氨”“铵”“胺”的区别
氨指氨气(NH3);
铵一般出现在铵盐中;
胺是指一类含氨基(-NH2)的有机物。
如,苯胺与盐酸反应的化学方程式
+HCl
【课堂练习6】完成下列反应
CH3-NH3Cl
(CH3)2NH2Cl
(CH3)3NHCl
①定义:酰胺是羧酸分子中羟基被氨基所替代得到的化合物。
R-C-NH2
O
②酰胺结构一般表示为:
酰基
酰胺基
被取代的氨基(-NH2或-NHR或-NRR')
R-C-NHR
O
R-C-NR R
O
注意:—NH2和—CONH2都是亲水基团,与水分子能形成氢键,故低级胺、酰胺都能溶于水。
2)酰胺
乙酰胺
苯甲酰胺
N,N-二甲基甲酰胺
CH3
C
O
NH2
C
O
NH2
H
C
O
N(CH3)2
“酰基名称+某胺”
③酰胺的命名
酰胺在酸或碱存在并加热的条件下可以发生水解反应。
RCONH2 + NaOH RCOONa + NH3↑
④酰胺的化学性质
如果水解时加入碱,生成的酸就会变成盐,同时有氨气逸出。
——水解反应
H-OH
R-C-NH2
O
=
+
R-C-OH
O
=
+
NH3
反应机理:
a.与HCl溶液反应:
b.与NaOH溶液反应:
RCONH2 + H2O + HCl RCOOH + NH4Cl
【思考与讨论2】洗涤丝绸质衣物,能否选用肥皂或洗衣粉进行清洗?
丝绸本质上是蛋白质,里面含有肽键,即酰胺键。肥皂或洗衣粉水溶液呈碱性,在碱性条件下,酰胺键会水解。所以洗涤丝绸,不能用肥皂或洗衣粉,最好用洗发水。
为什么最好用洗发水进行清洗?
洗发水一般为弱酸性,pH约5~6
+ H-OH
【思考与讨论1】尿素的水解产物是什么?
催化剂
△
×
CO2+H2O
CO2+2NH3
2
H2CO3+2NH3
NH2-C-NH2
O
=
+ H-OH
催化剂
△
NH2-C-NH2
O
=
⑤酰胺的用途
【思考与讨论 】请举例说明氨、胺、酰胺和铵盐这4类物质在组成、结构、性质和用途上的不同,并设计表格进行比较。
氨 胺 酰胺 铵盐
组成元素
结构特点
化学性质
用途
N、H
C、N、H
C、O、N、H
N、H等
NH3
三角锥形
含有氨基
R-NH2
含有NH4+
含有酰胺基
具有碱性,与酸反应生成铵盐
具有碱性,与酸反应生成盐
在酸或碱存在并加热下可发生水解反应
受热易分解,与碱共热产生氨气
制冷剂,
生产硝酸和尿素
合成医药、
农药和染料
溶剂和化工原料
生产化肥、和炸药
分子由酰基 与酰氧基 相连构成的羧酸衍生物(可看作是两分子乙酸分子脱水生成的)。
O
(CH3—C—)
(CH3—C—O—)
O
酰卤:
分子由酰基与卤素原子相连构成的羧酸衍生物。
如:乙酰氯
CH3—C—Cl
O
乙酸酐:
CH3—C
O
CH3—C
O
O
乙酸酐是有机合成的重要原料。
4、酰卤与酸酐
第四节 羧酸 羧酸衍生物
第三章 烃的衍生物
卤代烃
醇 酚
醛 酮
羧酸 羧酸衍生物
有机合成
甲酸(蚁酸) HCOOH
羧酸分子 中羧基去掉羟基后剩余部分为酰基
R—C—OH
O
=
R—C—OR’
O
=
酯
R—C—X
O
=
酰卤
R—C—NH2
O
=
酰胺
R—C—
O
=
R—C—
O
=
C—R
O
=
酸酐
二、羧酸衍生物
O—
羧酸分子中羧基上的羟基被其他原子或原子团取代得到的产物。
1、酯
丁酸乙酯
乙酸异戊酯
戊酸戊酯
(1)酯的物理性质、存在和用途
作溶剂,作制备饮料和糖果和糕点的酯类香料。
存在:
用途:
密度一般比水小,难溶于水,易溶于有机溶剂,许多酯也是常用的有机溶剂。
酯类广泛存在于自然界,低级酯是有芳香气味的液体,存在于各种水果和花草中。
(2)酯的组成、结构
酯是羧酸分子羧基中的-OH被-OR ’取代后的产物。
官能团:酯基,符号是—COO—或
饱和一元酯通式:
与饱和一元羧酸互为同分异构体
或
CnH2nO2
饱和一元羧酸和饱和一元醇反应生成饱和一元酯
或RCOOR'
OR’
R
羧酸酯可表示为:
其中R和R'可以相同,也可以不同。R'只能是烃基
CnH2n+1-C-O-CmH2m+1
‖
O
(3)酯的命名
根据生成酯的酸和醇的名称来命名,称为某酸某酯。
如:CH3COOC2H5称为乙酸乙酯。
HCOOCH2CH3
COOC2H5
COOC2H5
CH3COOCH2
CH3COOCH2
C
C
CH2
CH2
O
O
O
O
乙二酸乙二酯
乙二酸二乙酯
二乙酸乙二酯
甲酸乙酯
苯甲酸甲酯
甲酸苯甲酯
COOCH3
CH2OOCH
【课堂练习3】说出下列化合物的名称:
乙酸和乙醇反应生成乙酸乙酯的化学方程式:
(4)酯的化学性质
酯的重要化学性质之一是可以发生水解反应,生成相应的酸和醇。
CH3COOH+C2H5OH CH3COOC2H5+H2O
浓硫酸
△
【探究】 乙酸乙酯的水解
【问题】乙酸乙酯水解的速率与反应条件有着怎样的关系呢?
影响速率的外界条件:浓度、温度、催化剂、溶液的酸碱性。
研究方法——控制变量法
可逆反应
70℃
【设计实验】(1)探究乙酸乙酯在中性、酸性和碱性溶液中的水解速率。
(2)探究乙酸乙酯在不同温度下水解速率。
通过酯层消失的时间差异判断乙酸乙酯在不同条件下的水解速率。
采用控制变量法:
a.其它条件相同时,仅改变溶液的酸碱性
b.其它条件相同时,仅改变温度
(1)酸碱性对酯的水解的影响:
实验分组 实验操作 现象 结论
1
2 3 1.在3支试管中各加人2 mL乙酸乙酯,再分别加入蒸馏水、5ml的稀硫酸和含有酚酞的NaOH溶液。
2.水浴加热,记录酯层消失和酯香味消失的时间。
几乎无变化(中性)
酯层变薄(酸性)
酯层消失(碱性)
酯水解速率:
碱性溶液>酸性溶液
>中性溶液
25℃
50℃
1mL乙酸乙酯+2mlNaOH溶液
70℃
实验结论:其它条件相同时,温度越高,酯水解程度越大。
(2)探究乙酸乙酯在不同温度下的水解速率。
【讨论】(1)根据化学平衡移动原理,解释乙酸乙酯在碱性条件下发生的水解反应是不可逆的。
(2)控制实验条件是科学研究中的重要方法,通过乙酸乙酯水解条件的探究,你对这一方法有何体会?
乙酸乙酯水解生成乙酸,碱中和乙酸,使生成物浓度减少,促进平衡正向移动,反应趋于完全,所以不可逆。
控制实验条件如增加反应物浓度,使用催化剂、加热等可以加快反应速率;将生成物通过反应转化成其他物质,可以使平衡正向移动,甚至可以使反应进行完全。
CH3COOC2H5+NaOH CH3COONa+C2H5OH
△
酯在无机酸或碱存在条件下,均能发生水解反应。在酸性条件下水解是可逆的,
在碱性条件下水解是不可逆的,可完全水解,水解速率较快。
【小结】酯的水解规律
酯+H2O 酸+醇
无机酸
△
酯+H2O 羧酸盐+醇
无机碱
△
酯化反应与酯水解反应的比较
酯 化 水 解
反应关系 催 化 剂
催化剂的 其他作用
加热方式
反应类型
NaOH中和酯水解生成的羧酸,提高酯的水解率
CH3COOH+C2H5OH CH3COOC2H5+H2O
浓 硫 酸
稀H2SO4或NaOH
吸水,提高CH3COOH与C2H5OH的转化率
酒精灯火焰加热
热水浴加热
酯化反应(取代反应)
水解反应(取代反应)
酯化
水解
特殊的酯——甲酸酯
H—C—O—R
O
=
甲酸酯: 具有醛基和酯基的性质
注意:能发生银镜反应及与新制Cu(OH)2悬浊液反应产生红色沉淀的有醛、甲酸、甲酸酯、甲酸盐、葡萄糖等含有醛基的物质。
【课堂练习4】用化学方程式表示在甲酸甲酯性质
CH3OH+HCOOH
HCOOCH3 +H2O
①
稀硫酸
△
HCOOCH3 +NaOH
△
CH3OH+HCOONa
Na2CO3+Cu2O +4H2O
HCOOCH3+2Cu(OH)2+2NaOH
(NH4 )2CO3+2Ag +2NH3 +H2O
②HCOOCH3+2Ag(NH3)2OH
(5)羧酸、酯的同分异构体的书写
写出C4H8O2的属于羧酸和酯的同分异构体
羧酸——基元法/取代法(用羧基取代丙烷上的氢)
C3H7—COOH
CH3—CH2—CH3
①
①
②
CH3CH2CH2COOH
CH3CHCH3
COOH
酯——分碳法
甲酸丙酯
乙酸乙酯
丙酸甲酯
HCOO
C C C
HCOO
C C
C
C COO
C C
C C COO
C
还有属于其他种类的同分异构体吗?
羟基醛、羟基酮、醚醛、醚酮等
【课堂练习5】分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的酯共有( )
A. 15种 B. 28种 C. 32种 D.40种
D
HCOO—C4H9(4种)
CH3COO—C3H7
C2H5COO—C2H5
C3H7COO—CH3
C5H10O2的酯
(2种)
(2种)
水解生成5种羧酸和8种醇。
排列组合法
泛指在生活中存在的各类劣质油,如回收的食用油、反复使用的炸油等,其主要成分是油脂。地沟油最大来源为城市大型饭店下水道的隔油池。长期食用可能会引发癌症,对人体的危害极大。
【身边的化学】——地沟油
油
常温呈液态的油脂
如花生油、芝麻油、大豆油等植物油
脂肪
常温呈固态的油脂
如牛油、羊油等动物油脂
2、油酯
日常生活中食用的油脂是由高级脂肪酸与甘油形成的酯,属于酯类化合物。
(1)油脂的结构
CH2 O C R
CH O C R'
CH2 O C R''
O
O
O
a. R、R’和R’’代表高级脂肪酸的烃基
b. 如果R、R'和R''相同,这样的油酯称为简单甘油酯
如果R、R'和R''不相同,这样的油酯称为混合甘油酯
c. 在天然油脂中, R、R'和R''一般不相同,属于混合甘油酯
元素组成:
C、H、O
C15H31COOH
C17H35COOH
C17H33COOH
C17H31COOH
不饱和脂肪酸
饱和脂肪酸
高级脂肪酸
软脂酸
硬脂酸
油酸
亚油酸
H
H
(CH2)7COOH
CH3(CH2)7
C=C
1
9
10
18
顺-9-十八碳烯酸(油酸)
H
H
(CH2)7COOH
CH3(CH2)4
C=C
CH2
C=C
H
H
顺,顺-9,12-十八碳二烯酸(亚油酸)
9
10
12
13
18
HO—CH2
HO—CH
HO—CH2
甘油(丙三醇)
【思考与讨论】请写出硬脂酸、油酸分别与丙三醇反应的化学方程式。
浓硫酸
△
C17H35COOH +
3
CH2
OH
CH
OH
CH2
OH
+3H2O
硬脂酸甘油酯
CH2
O
C
O
C17H35
CH
O
C
O
C17H35
CH2
O
C
O
C17H35
C17H33COOH+
浓硫酸
△
3
CH2
OH
CH
OH
CH2
OH
+3H2O
油酸甘油酯
CH2
O
C
O
C17H33
CH
O
C
O
C17H33
CH2
O
C
O
C17H33
(2)油脂的化学性质
油脂兼有酯类和烯烃的性质
3C17H35COOH
①水解反应
a、酸性条件
应用:工业上以油脂为原料制取高级脂肪酸和甘油
3C17H35COONa
应用:高级脂肪酸钠(或钾)盐是肥皂的有效成分,工业上利用油脂的皂化反应来制造肥皂。
b、碱性条件(皂化反应)
酒精、NaOH溶液
加热
油脂
肥皂、甘油、水等的混和液
加入细食盐
加热、搅拌
分层
皂化
盐析
【研究与实践】自制肥皂
(1)酒精的作用:
(2)皂化反应完成的判断:
溶解油脂,使反应充分
溶液完全互溶不分层
(3)盐析:加入无机盐使某些有机物溶解度减小而析出的过程。
加填充剂(硅酸钠等)
压滤、干燥成型
下层:甘油、食盐水、酒精等→分馏
上层:高级脂肪酸钠
成品肥皂
②油脂的氢化
(油脂的硬化)
CH2 OOCC17H33
CH OOCC17H33
CH2 OOCC17H33
油酸甘油酯
+3 H2
Δ
CH2 OOCC17H35
CH OOCC17H35
CH2 OOCC17H35
硬脂酸甘油酯
应用:油脂氢化制得的油脂叫人造脂肪,又称硬化油。硬化油不易被空气氧化变质,便于储存和运输,可作为制造肥皂、人造奶油的原料。
(3)油脂的用途
①油脂是人类重要的营养物质和食物之一
②油脂是重要的供能物质
③油脂能溶解一些脂溶性维生素(如维生素A、D、E、K),因此进食一定量的油脂能促进人体对食物中含有的这些维生素的吸收。
④油脂也是一种重要的工业原料,主要用来生产肥皂、高级脂肪酸和甘油等。
【问题与讨论】
纯碱溶液呈碱性,油脂在碱性条件下水解完全。温度升高,纯碱水解程度大,碱性强,有利于促进油脂的水解。
2:如何利用化学方法鉴别植物油和矿物油
植物油属于油脂,能在碱性条件下水解;矿物油的主要成分为烃类,不与碱反应。故取少量液体,加含酚酞的NaOH溶液,加热,若液体不分层,且红色变浅的为植物油;若液体分层,颜色无变化的为矿物油。
3:在油、脂肪、酯、汽油中一定能使酸性高锰酸钾溶液或溴水褪色的是
油。从结构中是否含有碳碳双键进行考虑,油一定有碳碳双键,脂肪一般没有,酯可能有,直馏汽油一般没有而裂化汽油有。
1:用热的纯碱溶液清除油污的原理是什么?
【化学与生活】——烟酰胺
常言道:“一白遮百丑”,几乎所有女生都希望自己的肌肤能够更白一点,最近几年烟酰胺火遍了全网,它是美白护肤品最常用的添加剂。
酰胺基
烟酰胺的结构简式如图 。
NH2
蛋白质一级结构中的肽键,在化学上也属于酰胺键,酰胺也是羧酸的衍生物。酰胺具有怎样的性质呢?在学习酰胺之前,下面先简单介绍一下胺
…
C=O
H—N
H—C—R1
C=O
H—N
H—C—R2
C=O
H—N
H—C—R3
C=O
H—N
H—C—R4
…
蛋白质的结构示意图
蛋白质的三级结构
蛋白质的二级结构
蛋白质的四级结构
-NH2
甲胺(CH3-NH2)
1)胺
烃基取代 中的 而形成的化合物叫做胺(R—NH2)
氨分子
氢原子
或烃分子中的 原子被 所替代得到的化合物。
氢
氨基
苯 胺
实例:
被取代的氨基(-NH2或-NHR或-NRR')
R-NHR
R-NR R
(CH3)2NH
(CH3)3N
-NH(CH3)
N-甲基苯胺
二甲胺
三甲胺
3、酰胺
①胺的结构
官能团的名称为氨基(-NH2)或
取代的氨基( NRR’,R和R’可以是氢原子或烃基)
②胺的分类
a.按照烃基结构,胺可以分为脂肪胺 和 芳香胺
b.按照氮原子上烃基数目,胺可分为伯胺、仲胺、叔胺
R—NH2
R1—NH
—
R2
R1—N—R3
—
R2
伯胺
叔胺
仲胺
R1—N—R3
—
R2
—
R4
+
季铵离子
a.低级胺是气体或易挥发液体,气味与氨相似,
高级胺为固体,胺的沸点比相对分子质量相近的烃高,但比醇和羧酸的沸点低。
b.胺都能与水分子形成氢键,低级胺易溶于水,
随碳原子数增加,胺的溶解度迅速降低,6个碳以上的胺难就溶于水。
c.芳香胺的毒性很大,能致癌。
例如,甲胺和苯胺都是合成医药、农药和染料等的重要原料。
③胺的物理性质(了解)
④用途:
胺的用途很广,是重要的化工原料。
NH3+HCl=NH4Cl
2NH3+H2SO4=(NH4)2SO4
实质:NH3+H+=NH4+
本质
那么胺是否也具有碱性呢?
+H+
N
H
H
H
N
H
H
H
H
[ ]
+
氨基的氮原子上有一对孤对电子,易与H+结合。
NH3的性质
⑤胺的化学性质
碱性气体
因此胺也具有碱性,
胺的官能团为氨基(-NH2),
氮原子上也有一对孤对电子
可与强酸反应生成有机铵盐
CH3-NH2+HCl
(CH3)2NH+HCl
(CH3)3N+HCl
(苯胺盐酸盐)
注意:“氨”“铵”“胺”的区别
氨指氨气(NH3);
铵一般出现在铵盐中;
胺是指一类含氨基(-NH2)的有机物。
如,苯胺与盐酸反应的化学方程式
+HCl
【课堂练习6】完成下列反应
CH3-NH3Cl
(CH3)2NH2Cl
(CH3)3NHCl
①定义:酰胺是羧酸分子中羟基被氨基所替代得到的化合物。
R-C-NH2
O
②酰胺结构一般表示为:
酰基
酰胺基
被取代的氨基(-NH2或-NHR或-NRR')
R-C-NHR
O
R-C-NR R
O
注意:—NH2和—CONH2都是亲水基团,与水分子能形成氢键,故低级胺、酰胺都能溶于水。
2)酰胺
乙酰胺
苯甲酰胺
N,N-二甲基甲酰胺
CH3
C
O
NH2
C
O
NH2
H
C
O
N(CH3)2
“酰基名称+某胺”
③酰胺的命名
酰胺在酸或碱存在并加热的条件下可以发生水解反应。
RCONH2 + NaOH RCOONa + NH3↑
④酰胺的化学性质
如果水解时加入碱,生成的酸就会变成盐,同时有氨气逸出。
——水解反应
H-OH
R-C-NH2
O
=
+
R-C-OH
O
=
+
NH3
反应机理:
a.与HCl溶液反应:
b.与NaOH溶液反应:
RCONH2 + H2O + HCl RCOOH + NH4Cl
【思考与讨论2】洗涤丝绸质衣物,能否选用肥皂或洗衣粉进行清洗?
丝绸本质上是蛋白质,里面含有肽键,即酰胺键。肥皂或洗衣粉水溶液呈碱性,在碱性条件下,酰胺键会水解。所以洗涤丝绸,不能用肥皂或洗衣粉,最好用洗发水。
为什么最好用洗发水进行清洗?
洗发水一般为弱酸性,pH约5~6
+ H-OH
【思考与讨论1】尿素的水解产物是什么?
催化剂
△
×
CO2+H2O
CO2+2NH3
2
H2CO3+2NH3
NH2-C-NH2
O
=
+ H-OH
催化剂
△
NH2-C-NH2
O
=
⑤酰胺的用途
【思考与讨论 】请举例说明氨、胺、酰胺和铵盐这4类物质在组成、结构、性质和用途上的不同,并设计表格进行比较。
氨 胺 酰胺 铵盐
组成元素
结构特点
化学性质
用途
N、H
C、N、H
C、O、N、H
N、H等
NH3
三角锥形
含有氨基
R-NH2
含有NH4+
含有酰胺基
具有碱性,与酸反应生成铵盐
具有碱性,与酸反应生成盐
在酸或碱存在并加热下可发生水解反应
受热易分解,与碱共热产生氨气
制冷剂,
生产硝酸和尿素
合成医药、
农药和染料
溶剂和化工原料
生产化肥、和炸药
分子由酰基 与酰氧基 相连构成的羧酸衍生物(可看作是两分子乙酸分子脱水生成的)。
O
(CH3—C—)
(CH3—C—O—)
O
酰卤:
分子由酰基与卤素原子相连构成的羧酸衍生物。
如:乙酰氯
CH3—C—Cl
O
乙酸酐:
CH3—C
O
CH3—C
O
O
乙酸酐是有机合成的重要原料。
4、酰卤与酸酐
