3.5有机合成 课件(共54张PPT)
文档属性
| 名称 | 3.5有机合成 课件(共54张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-01 13:49:42 | ||
图片预览




文档简介
(共54张PPT)
第 五 节 有 机 合 成
第三章 烃的衍生物
卤代烃
醇 酚
醛 酮
羧酸 羧酸衍生物
有机合成
世界上每年合成的近百万个新化合物中约70%以上是有机化合物
化妆品香料:
苯甲酸苯甲酯
隐形眼镜材料:
聚甲基丙烯酸羟乙酯
长效缓释阿司匹林
合成纤维
塑料
合成橡胶
身边的化学
远古时代
19世纪20年代
物质丰富的今天
人类依靠自然资源,加工转化自然资源,从生物体中获得有机化合物
德国化学家维勒合成尿素,开创人工合成有机物新时代
CO(NH2) 2
有机合成的发展,使人们不仅能通过人工手段合成多种天然有机物,还可以根据实际需要设计合成具有特定结构和性能的新物质,有力地推动了材料科学和生命科学的发展。
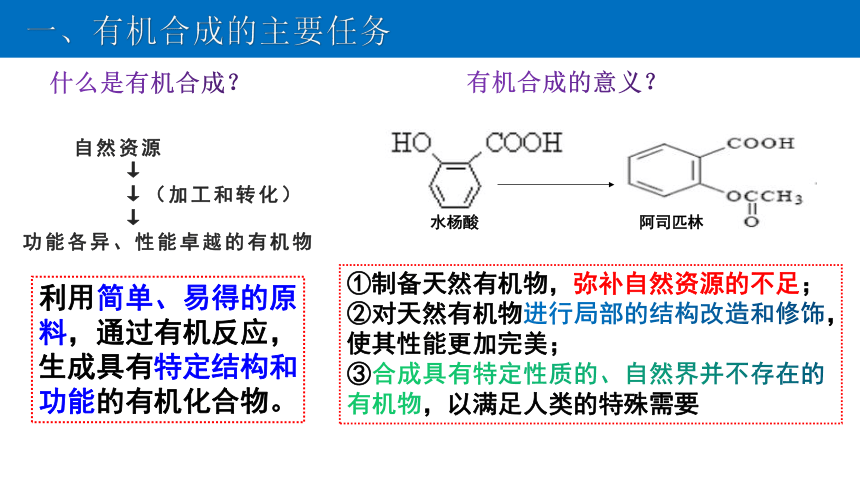
什么是有机合成 ?
一、有机合成的主要任务
自然资源
↓
↓(加工和转化)
↓
功能各异、性能卓越的有机物
利用简单、易得的原料,通过有机反应,生成具有特定结构和功能的有机化合物。
什么是有机合成?
有机合成的意义?
水杨酸
阿司匹林
①制备天然有机物,弥补自然资源的不足;
②对天然有机物进行局部的结构改造和修饰,使其性能更加完美;
③合成具有特定性质的、自然界并不存在的有机物,以满足人类的特殊需要
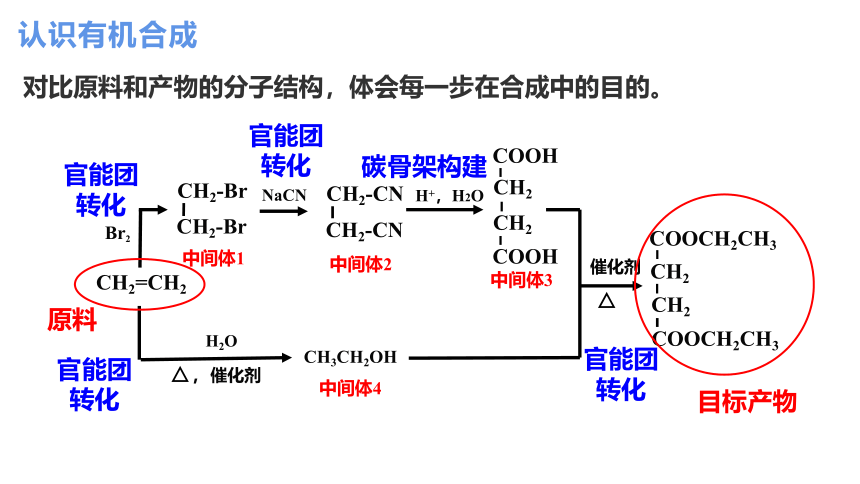
中间体1
中间体2
中间体4
官能团转化
官能团
转化
碳骨架构建
官能团
转化
官能团
转化
CH2
H+,H2O
NaCN
Br2
催化剂
H2O
,催化剂
CH2=CH2
CH2-Br
CH2-Br
CH2-CN
CH2
COOH
COOH
CH3CH2OH
COOCH2CH3
CH2
CH2
COOCH2CH3
CH2-CN
中间体3
原料
目标产物
认识有机合成
对比原料和产物的分子结构,体会每一步在合成中的目的。
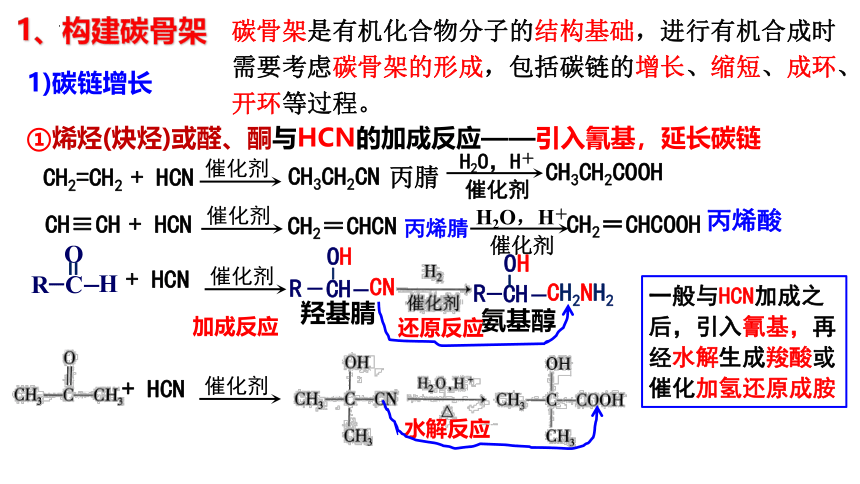
1、构建碳骨架
碳骨架是有机化合物分子的结构基础,进行有机合成时需要考虑碳骨架的形成,包括碳链的增长、缩短、成环、开环等过程。
1)碳链增长
①烯烃(炔烃)或醛、酮与HCN的加成反应——引入氰基,延长碳链
CH2=CH2 + HCN
CH≡CH + HCN
+ HCN
催化剂
催化剂
催化剂
+ HCN
催化剂
CH3CH2CN
丙烯腈
CH2=CHCN
丙腈
H2O,H+
催化剂
CH2=CHCOOH
丙烯酸
H2O,H+
催化剂
CH3CH2COOH
H
R
C
O
=
CN
R
CH
OH
-
羟基腈
CH2NH2
R
CH
OH
-
氨基醇
一般与HCN加成之后,引入氰基,再经水解生成羧酸或催化加氢还原成胺
还原反应
加成反应
水解反应
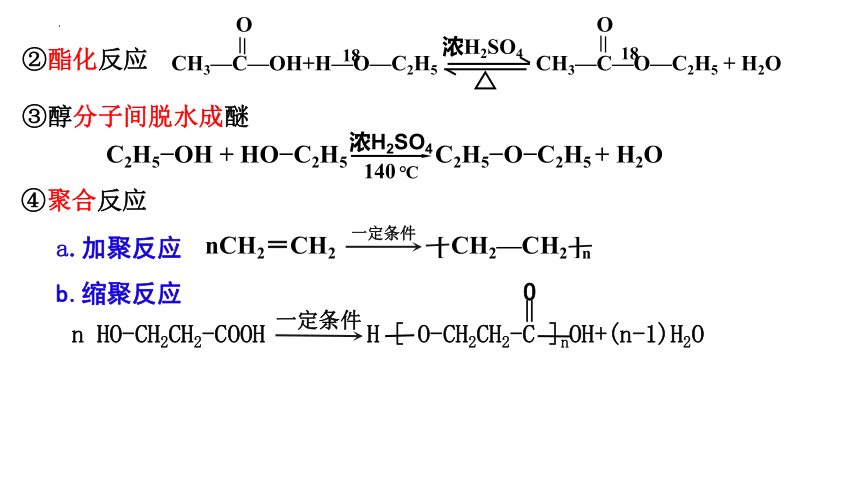
n HO-CH2CH2-COOH H [ O-CH2CH2-C ]nOH+(n-1)H2O
一定条件
④聚合反应
②酯化反应
③醇分子间脱水成醚
nCH2=CH2 [ CH2—CH2 ]n
一定条件
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
a.加聚反应
b.缩聚反应
O
‖
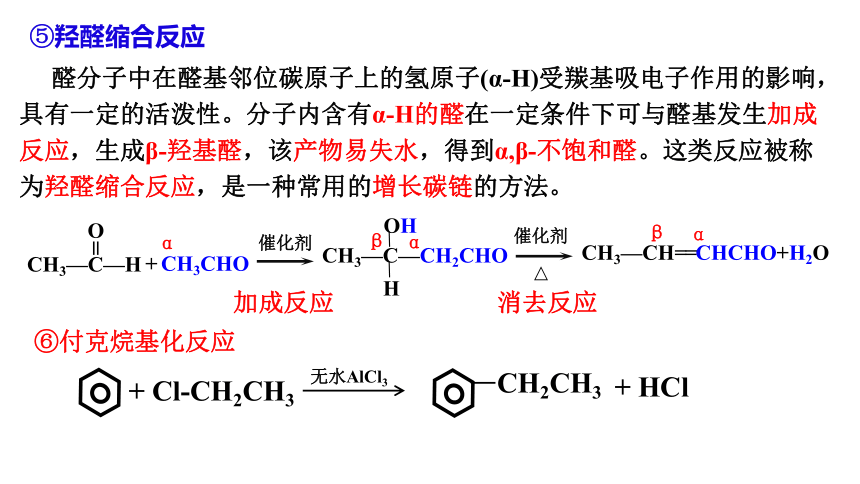
⑤羟醛缩合反应
催化剂
CH3—CH==CHCHO+H2O
α
β
CH3—C—CH2CHO
OH
H
β
α
催化剂
醛分子中在醛基邻位碳原子上的氢原子(α-H)受羰基吸电子作用的影响,具有一定的活泼性。分子内含有α-H的醛在一定条件下可与醛基发生加成反应,生成β-羟基醛,该产物易失水,得到α,β-不饱和醛。这类反应被称为羟醛缩合反应,是一种常用的增长碳链的方法。
CH3—C—H
O
+ CH3CHO
α
=
加成反应
消去反应
⑥付克烷基化反应
+ Cl-CH2CH3
无水AlCl3
CH2CH3
+ HCl
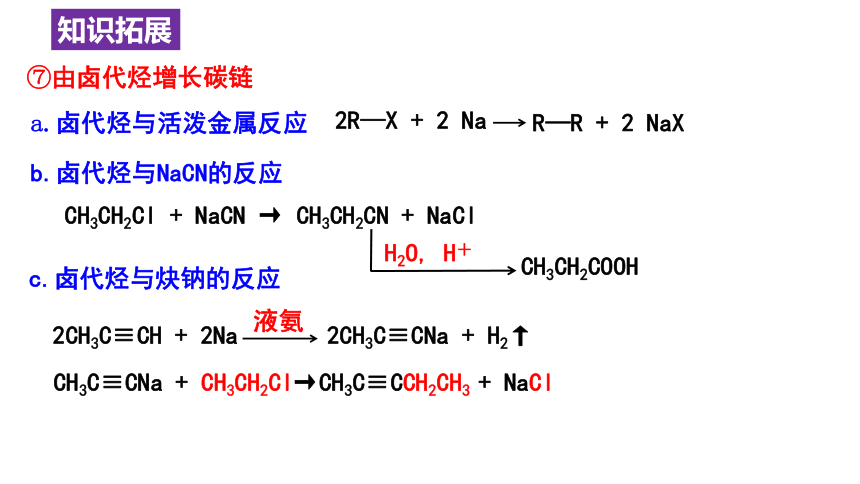
⑦由卤代烃增长碳链
2R—X + 2 Na
R—R + 2 NaX
b.卤代烃与NaCN的反应
CH3CH2Cl + NaCN → CH3CH2CN + NaCl
H2O, H+
CH3CH2COOH
a.卤代烃与活泼金属反应
c.卤代烃与炔钠的反应
2CH3C≡CH + 2Na 2CH3C≡CNa + H2↑
液氨
CH3C≡CNa + CH3CH2Cl→CH3C≡CCH2CH3 + NaCl
知识拓展
R’—Cl
+ RMgCl
R’—R
+ MgCl2
RMgCl
RCl + Mg
无水乙醚
+ RMgCl
—OMgCl
R
H2O
—OH
R
与卤代烃反应
与醛、酮反应
⑧由格氏试剂与卤代烃、醛、酮反应增长碳链
格氏试剂制备
RMgX
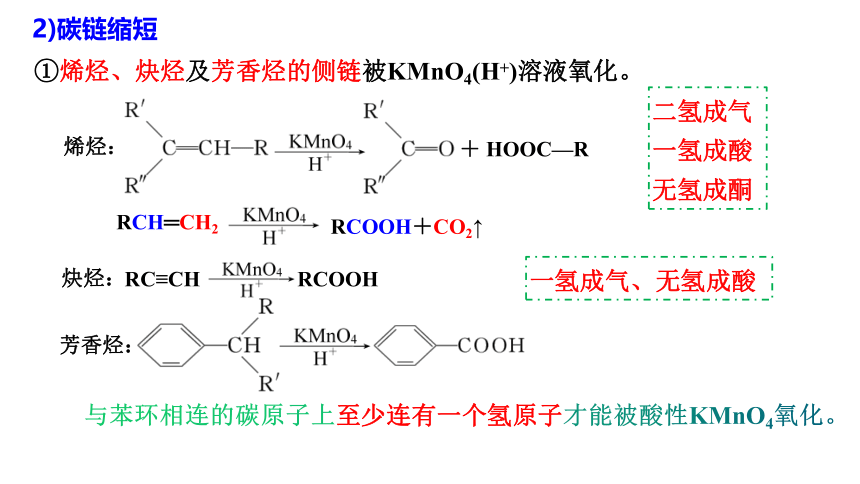
①烯烃、炔烃及芳香烃的侧链被KMnO4(H+)溶液氧化。
+ HOOC—R
烯烃:
芳香烃:
炔烃:
RCOOH
RC≡CH
二氢成气
一氢成酸
无氢成酮
一氢成气、无氢成酸
与苯环相连的碳原子上至少连有一个氢原子才能被酸性KMnO4氧化。
RCH═CH2
RCOOH+CO2↑
2)碳链缩短
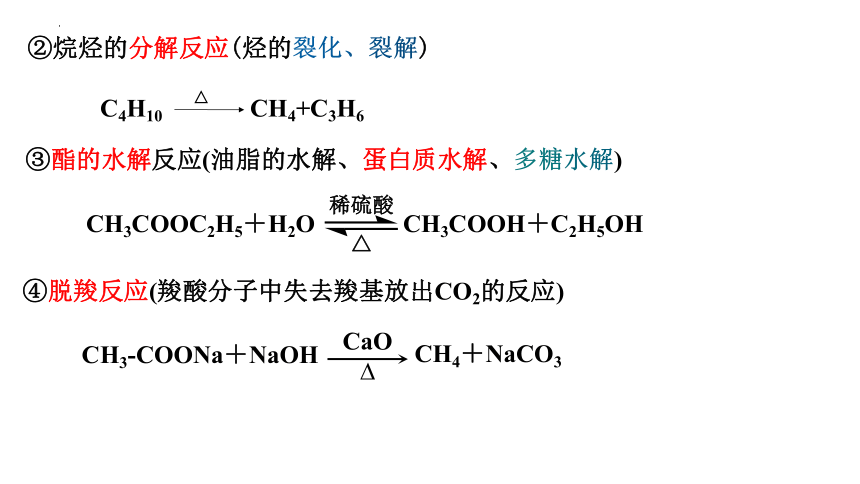
②烷烃的分解反应(烃的裂化、裂解)
C4H10 CH4+C3H6
△
③酯的水解反应(油脂的水解、蛋白质水解、多糖水解)
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
△
④脱羧反应(羧酸分子中失去羧基放出CO2的反应)
CH3-COONa+NaOH
CaO
CH4+NaCO3
共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃,如1,3-丁二烯)与含碳碳双键的化合物在一定条件下发生双烯合成反应
COOH
+
△
COOH
1
2
3
4
6
5
1
2
3
4
6
5
3CH≡CH
①双烯合成
②炔烃成环
Diels-Alder reaction
3)成环反应
【课堂练习1】已知:
,如果通过一步反应合成
所用的原料可以是( )
①1,3-丁二烯和2-丁炔
②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-丁二烯和乙炔
④2,4-己二烯和乙炔
A.①③ B.②③ C.②④ D.①④
A
③合成环酯
COOH
COOH
CH2OH
CH2OH
+
+ 2H2O
COOCH2
COOCH2
浓硫酸
△
CH3CHCH2CH2C—OH
O
═
OH
CH—CH2
O CH2
C
O
═
H3C
+H2O
2CH3—CH—C—OH
O
═
OH
+2H2O
CH3
O
C
═
O
O
C
═
O
CH3
浓H2SO4
Δ
浓H2SO4
Δ
④合成环醚
分子内脱水
分子间脱水
CH2—CH2
OH
OH
浓H2SO4
CH2—CH2
O
+H2O
+ H2O
浓硫酸
CH2OH
CH2OH
HOCH2
HOCH2
+
H2C
H2C
CH2
CH2
O
O
⑤形成环酸酐
HOOC—CH2CH2—COOH
丁二酸
O
O
O
═
═
+H2O
①环酯水解开环
②环烯烃氧化开环
KMnO4
H+
HOOC
HOOC
COOH
COOH
CH2OH
CH2OH
+
+ 2H2O
COOCH2
COOCH2
稀硫酸
△
稀H2SO4
Δ
CH2CH2
CH2—C
═
O
O
+H2O
CH2—CH2OH
CH2—C—OH
═
O
②Zn/H2O
①O3
OHCCH2CH2CH2CH2CHO
4)开环反应
高锰酸钾溶液氧化性更强,可以得到酮或羧酸。
O3氧化性相比更弱一些,往往得到醛或酮
有选择地通过取代、加成、消去、氧化、还原等有机化学反应,可以实现有机化合物类别的转化,并引入目标官能团。
还原
水解
酯化
酯
羧酸
醛
醇
卤代烃
氧化
氧化
水解
取代
烷烃
取代
烯烃
炔烃
水化
消去
水化
消去
加成
加成
氧化
加成
2、引入官能团
1)碳碳双键的引入
①醇或卤代烃的消去反应
CH3CH2OH
CH2=CH2↑+H2O
CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O
乙醇
△
②炔烃与H2、HX、X2的不完全加成(限制物质的量)可得碳碳双键
CH≡CH + Cl2
ClCH=CHCl
浓H2SO4
170℃
(注意反应条件)
CH≡CH + HBr CH2=CHBr
催化剂
△
催化剂
△
2)碳卤键的引入
①烷烃(或苯及苯的同系物)的取代
CH4 + Cl2 CH3Cl + HCl
光
+ 3Cl2
光照
+ 3HCl
注意
②醇(或酚)的取代反应
C2H5 OH + H Br C2H5 Br + H2O
△
+3Br2
+3HBr
(过量)
OH
OH
Br
Br
Br
③烯烃(或炔烃)的与X2、HX加成
CH3CH=CH2+Br2 CH3CHBrCH2Br
CH3CH=CH2+HCl CH3CHClCH3
△
催化剂
△
CH≡CH+HCl
CH2=CHCl
CH≡CH + Cl2
ClCH=CHCl
催化剂
△
3)羟基的引入
①烯烃与水的加成
CH3CH=CH2+H2O CH3CH(OH)CH3
催化剂
加热、加压
②卤代烃的水解
CH3CH2CH2Cl + NaOH CH3CH2CH2OH + NaCl
H2O
△
③酯的水解
CH3COOC2H5+NaOH CH3COONa+C2H5OH
△
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
△
④醛、酮的还原
CH3CHO +H2 CH3CH2OH
催化剂
Δ
⑤羧酸在强还原剂作用下还原成醇
RCOOH RCH2OH
LiAlH4
O
C
CH3
CH3
+
H2
催化剂
OH
CH
CH3
CH3
⑥酚盐溶液与CO2、HCl等反应
+NaCl
OH
+ HCl
ONa
+NaHCO3
OH
+ CO2+H2O
ONa
⑦羟醛缩合反应
催化剂
CH3—C—CH2CHO
OH
H
β
α
CH3—C—H
O
+ CH3CHO
α
=
4)醛基和酮羰基的引入
①烯烃氧化
②炔烃水化
③某些烯烃、炔烃被O3或酸性高锰酸钾溶液氧化
②Zn/H2O
①O3
OHCCH2CH2CH2CH2CHO
CH2=CHC= CHCH3
CH3
CO2 + HOOCC= O + HOOCCH3
CH3
R-CH2OH
Cu/Ag
△
R-CHO
R1-CH-R2
OH
Cu/Ag
△
R1-C-R2
O
醛
酮
伯醇
仲醇
④某些醇的催化氧化
5)羧基的引入
①醛的氧化反应
2CH3CHO+O2
2CH3COOH
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
△
CH3COOH
H+
②某些烯烃、炔烃、芳香烃侧链被酸性KMnO4溶液氧化的反应
C=CH-R
R1
R2
KMnO4
H+
C=O + R-COOH
R1
R2
CH≡C-R
KMnO4
H+
CO2+RCOOH
CH—
R
R1
KMnO4
H+
HOOC—
④酯、酰胺、氰基的水解反应
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
△
RCONH2 + NaOH RCOONa + NH3↑
RCONH2 + H2O + HCl RCOOH + NH4Cl
RCOOH
H+
③伯醇被酸性高锰酸钾或重铬酸钾溶液氧化的反应
KMnO4
H+
R—CH2 OH R—COOH
H2O,H+
催化剂
R-CN
R-COOH
6)酯基的引入
①酯化反应
CH3COOH+C2H5OH CH3COOC2H5+H2O
浓硫酸
△
②酰氯醇解
O
-C-
Cl
CH3
+
CH3OH
无水操作
O
-C-OCH3
+HCl
CH3
=
=
3、官能团的转化
CH3COOCH2CH3
CH3CH2OH
CH2=CH2
CH3CH2Br
CH3CHO
CH3COOH
“有机三角”
卤代烃是有机合成的桥梁!
包括官能团种类变化、数目变化、位置变化等。
1)官能团种类变化:
CH3CH2-Br
水解
CH3CH2-OH
氧化
CH3-CHO
CH3-COOH
氧化
3)官能团位置变化
2)官能团数目变化
消去
加成
CH3CH2-Br
CH2=CH2
CH2Br-CH2Br
CH3CH2OH
消去
CH2=CH2
加Br2
CH2BrCH2Br
HOCH2CH2OH
水解
CH3CH2CH2OH
CH3CH=CH2
CH3CH-CH3
Br
消去
HBr
CH3CH-CH3
OH
水解
4、官能团的消除
加成反应
1)消除不饱和键
2)消除羟基
取代、消去、酯化、氧化
3)消除醛基、酮羰基
加成、氧化
4)消除碳卤键
消去、水解
5)消除酯基、酰胺基
水解
【课堂练习2】以2-氯丁烷为主要原料合成2,3-丁二醇;1,4-丁二醇。
CH3CHCH2CH3
Cl
NaOH/醇
CH3CH=CHCH3
Br2
CH3CHCHCH3
Br
Br
NaOH/H2O
CH3CH—CHCH3
OH
OH
NaOH/醇
CH2=CHCH=CH2
HBr
CH2CH2CH2CH2
Br
Br
NaOH/H2O
CH2CH2CH2CH2
OH
OH
CH3CHCH2CH3
Cl
NaOH/醇
CH3CH=CHCH3
Br2
CH3CHCHCH3
Br
Br
【思考】下列两个有机合成设计流程有何特点?其设计的目的是什么?
通常有碳碳双键、羟基、羰基、醛基和氨基等需保护。
5、官能团的保护
1)羟基的保护
例如:
因酚羟基易被氧化,故在加入氧化剂之前将酚-OH先转化为-ONa(或-OCH3),待其他基团氧化后,再酸化使其转化为-OH。
OCH3
COOH
OH
COOH
CH3I
KMnO4/H+
H+
OCH3
CH3
OH
CH3
OH
CH3
OH
COOH
2)碳碳双键的保护
醛基、羟基和碳碳双键均容易被氧化。若只氧化醛基或羟基,则需要对碳碳双键进行保护。可以利用其与HCl等的加成反应将其保护起来,待氧化后再利用消去反应恢复碳碳双键。
C=C
NaOH/醇
△
C=C
+HX
—C—C—
X
H
相关合成反应
3)醛基的保护
醛基容易被氧化剂氧化。醛基保护一般是把醛基制成缩醛,最后再将缩醛水解得到醛基(常用乙二醇)
缩醛
OH
CHO
OH
CH
OCH3
OCH3
CH
OCH3
OCH3
O
CHO
O
CH3OH
KMnO4/H+
H2O/H+
4)氨基的保护
氨基易被O2、O3、H2O2、酸性KMn04溶液等氧化。
先用盐酸转化为铵盐,后加NaOH溶液重新转化为-NH2。
CH3
浓硝酸
浓硫酸,加热
CH3
NO2
KMnO4/H+
COOH
NO2
Fe/HCl
COOH
NH2
用甲苯制备对氨基苯甲酸,先氧化甲基后还原为氨基
有机合成发展史
19世纪20年代
德国化学家维勒合成了尿素,开创了人工合成有机物的新时代
20世纪初
德国化学家维尔施泰特通过十余步反应合成颠茄酮,总产率仅有0.75%。十几年后罗宾逊仅用3步反应便完成合成,总产率达
90%
20世纪中后期
美国化学家伍德沃德与多位化学家合作,成功合成了奎宁、胆固醇、叶绿素、红霉素、维生素B12等一系列结构复杂的天然产物,促进了有机合成技术和有机反应理论的发展
美国化学家科里提出了系统化的逆合成概念,开始利用计算机来辅助设计合成路线让合成路线的设计逐步成为有严密思维逻辑的科学过程,使有机合成进入了新的发展阶段。
二、有机合成路线的设计与实施
1、设计合成路线的基本原则
1)尽量选择步骤最少的合成路线——以保证较高的产率。
2)起始原料要廉价、易得、低毒、低污染——通常采用4个C以下的单官能团化合物和单取代苯。
3)满足“绿色化学”的要求,污染排放少。
4)操作简单、条件温和、能耗低、产物易于分离提纯。
5)尊重客观事实,按一定顺序反应。
图3-31 实验室进行有机合成使用的一种典型装置
图3-32 工业合成使用的反应釜
恒压滴液漏斗
球形冷凝管
三颈烧瓶或三口烧瓶
温度计
作用是冷凝回流
2、有机合成常用装置
3、有机合成的意义
有机合成的发展,使人们不仅能通过人工手段合成原本只能从生物体内分离、提取的天然产物,还可以根据实际需要设计合成具有特定结构和性能的新物质,为化学、生物、医学、材料等领域的研究和相关工业生产提供了坚实的物质基础,有力地促进了人类健康水平提高和社会发展进步。
4、有机合成的常见方法
基础原料
辅助原料1
中间体1
副产物1
辅助原料2
中间体2
副产物2
辅助原料3
目标化合物
这种按一定顺序进行的一系列反应就构成了合成路线
副产物3
(1)正合成分析法:
采用正向思维方法,从已知原料入手,找出合成所需要的中间体,逐步推向目标产物。
(又称顺推法)
简单、易得
碳骨架和官能团等方面的异同的比较
增加一段碳链或连上一个官能团
图3-28 有机合成过程示意图
(1)人们最初是通过发酵法由粮食制备乙酸,现在食醋仍主要以这种方式生产,工业上大量使用的乙酸是通过石油化学工业人工合成的。请以乙烯为原料,设计合理的路线合成乙酸,分析该合成过程中官能团的变化。
【思考与讨论】
CH2=CH2
中间体
H2O
CH3CH2OH
CH3CHO
辅助原料
Cu
辅助原料
H2O、催化剂
CH3COOH
基础原料
中间体
目标化合物
官能团的变化
碳碳双键→羟基→醛基→羧基
辅助原料
O2、催化剂
CH2=CH2
CH3CH2OH
O2/Cu
△
CH3CHO
CH3COOH
O2
催化剂/△
H2O
催化剂/△
(2)目前已经出现了将乙烯直接氧化生成乙酸的工艺。假定该工艺涉及的反应和(1)中合成路线的每一步反应的产率均为70%,请计算并比较这两种合成路线的总产率。
(1)中合成路线生成CH3COOH的产率为70%×70%×70%=34.3%,低于乙烯直接氧化成乙酸的产率(70%),因此,合成步骤应尽可能少,以提高产率。
CH2=CH2
CH3CH2OH
CH3CHO
CH3COOH
70%
70%
70%
CH2=CH2+O2
CH3COOH
催化剂
70%
【课堂练习3】请设计合理方案用 合成
(无机试剂任选,用反应流程图表示,并注明反应条件)。
提示:RCH=CH2 RCH2-CH2-Br
HBr
过氧化物
(2)逆合成分析法:
图3-29 逆合成分析示意图
基础原料
中间体1
目标
化合物
中间体2
(又称逆推法)
从产物出发,由后向前推,先找出产物的前一步原料(中间体),并同样找出它的前一步原料,如此继续直至到达简单的初始原料为止。
乙二酸二乙酯是一种医药和染料工业原料,请以乙烯为原料设计合成的路线。
C
O
C
O
OC2H5
OC2H5
C
O
C
O
OH
OH
CH3CH2OH
CH2
CH2
Cl
Cl
CH2
CH2
OH
OH
CH2=CH2
CH2=CH2
C—OC2H5
C—OC2H5
O
O
CH2
CH2
逆合成步骤的表示:可以用符号 “ ”表示逆推过程,
用箭头“→”表示每一步转化反应。
确定乙二酸二乙酯的基础原料为乙烯,通过以下5步反应完成合成:
CH2=CH2 +H2O
催化剂
Δ ,加压
CH3CH2 OH
1.
CH2=CH2 + Cl2
CH2
CH2
Cl
Cl
2.
CH2
CH2
Cl
Cl
+ 2NaOH
H2O
Δ
CH2
CH2
OH
OH
+ 2NaCl
3.
CH2
CH2
OH
OH
+ 2O2
催化剂
Δ
C
C
HO
OH
O
O
+ 2H2O
4.
+ 2CH3CH2 OH
C
C
HO
OH
O
O
+ 2H2O
催化剂
Δ
C
C
C2H5O
OC2H5
O
O
5.
【思考与讨论】在实际工业生产中,乙二醇还可以通过环氧乙烷与水直接化合的方法合成,而环氧乙烷则可由乙烯直接氧化得到。请比较该方法与以上合成乙二酸二乙酯中的2、3两步反应,分析生产中选择该路线的可能原因。
CH2=CH2
催化剂、△
O2
H2C—CH2
O
加压、△
H2O
CH2—CH2
OH
OH
①从原料成本的角度考虑,使用O2和H2O,比使用C12和NaOH成本更低;
②从原子利用率的角度考虑,环氧乙烷法没有副产物,原子利用率高;
③从环境保护的角度考虑,C12有毒,NaOH有腐蚀性,对环境不够友好。
【课堂练习4】苯甲酸苯甲酯 是一种有水果香气的食品香料。
请以甲苯为基础原料,使用逆合成分析法设计它的合成路线。
分析:
合成路线:
(3)综合分析法:
采用综合思维的方法,将正向或逆向推导出的几种合成途径进行比较,从而得到最佳合成路线
氟他胺
【课堂练习5】氟他胺是一种抗肿瘤药,在实验室由芳香烃A制备氟他胺的合成路线如下所示:
1. 芳香烃A的名称是 。
甲苯
2. 反应③、④的反应类型: 、 。
取代反应
还原反应
(3)写出反应⑤的反应方程式;吡啶是一种有机碱,其在反应⑤中的作用?
吡啶作用:吸收产生的HCl,提高反应物转化率
(4)设计合成路线:以苯甲醚 为原料制备对甲氧基乙酰苯胺
浓硫酸
浓硝酸
,Δ
Fe/HCl
CH3COCl
吡啶
第 五 节 有 机 合 成
第三章 烃的衍生物
卤代烃
醇 酚
醛 酮
羧酸 羧酸衍生物
有机合成
世界上每年合成的近百万个新化合物中约70%以上是有机化合物
化妆品香料:
苯甲酸苯甲酯
隐形眼镜材料:
聚甲基丙烯酸羟乙酯
长效缓释阿司匹林
合成纤维
塑料
合成橡胶
身边的化学
远古时代
19世纪20年代
物质丰富的今天
人类依靠自然资源,加工转化自然资源,从生物体中获得有机化合物
德国化学家维勒合成尿素,开创人工合成有机物新时代
CO(NH2) 2
有机合成的发展,使人们不仅能通过人工手段合成多种天然有机物,还可以根据实际需要设计合成具有特定结构和性能的新物质,有力地推动了材料科学和生命科学的发展。
什么是有机合成 ?
一、有机合成的主要任务
自然资源
↓
↓(加工和转化)
↓
功能各异、性能卓越的有机物
利用简单、易得的原料,通过有机反应,生成具有特定结构和功能的有机化合物。
什么是有机合成?
有机合成的意义?
水杨酸
阿司匹林
①制备天然有机物,弥补自然资源的不足;
②对天然有机物进行局部的结构改造和修饰,使其性能更加完美;
③合成具有特定性质的、自然界并不存在的有机物,以满足人类的特殊需要
中间体1
中间体2
中间体4
官能团转化
官能团
转化
碳骨架构建
官能团
转化
官能团
转化
CH2
H+,H2O
NaCN
Br2
催化剂
H2O
,催化剂
CH2=CH2
CH2-Br
CH2-Br
CH2-CN
CH2
COOH
COOH
CH3CH2OH
COOCH2CH3
CH2
CH2
COOCH2CH3
CH2-CN
中间体3
原料
目标产物
认识有机合成
对比原料和产物的分子结构,体会每一步在合成中的目的。
1、构建碳骨架
碳骨架是有机化合物分子的结构基础,进行有机合成时需要考虑碳骨架的形成,包括碳链的增长、缩短、成环、开环等过程。
1)碳链增长
①烯烃(炔烃)或醛、酮与HCN的加成反应——引入氰基,延长碳链
CH2=CH2 + HCN
CH≡CH + HCN
+ HCN
催化剂
催化剂
催化剂
+ HCN
催化剂
CH3CH2CN
丙烯腈
CH2=CHCN
丙腈
H2O,H+
催化剂
CH2=CHCOOH
丙烯酸
H2O,H+
催化剂
CH3CH2COOH
H
R
C
O
=
CN
R
CH
OH
-
羟基腈
CH2NH2
R
CH
OH
-
氨基醇
一般与HCN加成之后,引入氰基,再经水解生成羧酸或催化加氢还原成胺
还原反应
加成反应
水解反应
n HO-CH2CH2-COOH H [ O-CH2CH2-C ]nOH+(n-1)H2O
一定条件
④聚合反应
②酯化反应
③醇分子间脱水成醚
nCH2=CH2 [ CH2—CH2 ]n
一定条件
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
a.加聚反应
b.缩聚反应
O
‖
⑤羟醛缩合反应
催化剂
CH3—CH==CHCHO+H2O
α
β
CH3—C—CH2CHO
OH
H
β
α
催化剂
醛分子中在醛基邻位碳原子上的氢原子(α-H)受羰基吸电子作用的影响,具有一定的活泼性。分子内含有α-H的醛在一定条件下可与醛基发生加成反应,生成β-羟基醛,该产物易失水,得到α,β-不饱和醛。这类反应被称为羟醛缩合反应,是一种常用的增长碳链的方法。
CH3—C—H
O
+ CH3CHO
α
=
加成反应
消去反应
⑥付克烷基化反应
+ Cl-CH2CH3
无水AlCl3
CH2CH3
+ HCl
⑦由卤代烃增长碳链
2R—X + 2 Na
R—R + 2 NaX
b.卤代烃与NaCN的反应
CH3CH2Cl + NaCN → CH3CH2CN + NaCl
H2O, H+
CH3CH2COOH
a.卤代烃与活泼金属反应
c.卤代烃与炔钠的反应
2CH3C≡CH + 2Na 2CH3C≡CNa + H2↑
液氨
CH3C≡CNa + CH3CH2Cl→CH3C≡CCH2CH3 + NaCl
知识拓展
R’—Cl
+ RMgCl
R’—R
+ MgCl2
RMgCl
RCl + Mg
无水乙醚
+ RMgCl
—OMgCl
R
H2O
—OH
R
与卤代烃反应
与醛、酮反应
⑧由格氏试剂与卤代烃、醛、酮反应增长碳链
格氏试剂制备
RMgX
①烯烃、炔烃及芳香烃的侧链被KMnO4(H+)溶液氧化。
+ HOOC—R
烯烃:
芳香烃:
炔烃:
RCOOH
RC≡CH
二氢成气
一氢成酸
无氢成酮
一氢成气、无氢成酸
与苯环相连的碳原子上至少连有一个氢原子才能被酸性KMnO4氧化。
RCH═CH2
RCOOH+CO2↑
2)碳链缩短
②烷烃的分解反应(烃的裂化、裂解)
C4H10 CH4+C3H6
△
③酯的水解反应(油脂的水解、蛋白质水解、多糖水解)
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
△
④脱羧反应(羧酸分子中失去羧基放出CO2的反应)
CH3-COONa+NaOH
CaO
CH4+NaCO3
共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃,如1,3-丁二烯)与含碳碳双键的化合物在一定条件下发生双烯合成反应
COOH
+
△
COOH
1
2
3
4
6
5
1
2
3
4
6
5
3CH≡CH
①双烯合成
②炔烃成环
Diels-Alder reaction
3)成环反应
【课堂练习1】已知:
,如果通过一步反应合成
所用的原料可以是( )
①1,3-丁二烯和2-丁炔
②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-丁二烯和乙炔
④2,4-己二烯和乙炔
A.①③ B.②③ C.②④ D.①④
A
③合成环酯
COOH
COOH
CH2OH
CH2OH
+
+ 2H2O
COOCH2
COOCH2
浓硫酸
△
CH3CHCH2CH2C—OH
O
═
OH
CH—CH2
O CH2
C
O
═
H3C
+H2O
2CH3—CH—C—OH
O
═
OH
+2H2O
CH3
O
C
═
O
O
C
═
O
CH3
浓H2SO4
Δ
浓H2SO4
Δ
④合成环醚
分子内脱水
分子间脱水
CH2—CH2
OH
OH
浓H2SO4
CH2—CH2
O
+H2O
+ H2O
浓硫酸
CH2OH
CH2OH
HOCH2
HOCH2
+
H2C
H2C
CH2
CH2
O
O
⑤形成环酸酐
HOOC—CH2CH2—COOH
丁二酸
O
O
O
═
═
+H2O
①环酯水解开环
②环烯烃氧化开环
KMnO4
H+
HOOC
HOOC
COOH
COOH
CH2OH
CH2OH
+
+ 2H2O
COOCH2
COOCH2
稀硫酸
△
稀H2SO4
Δ
CH2CH2
CH2—C
═
O
O
+H2O
CH2—CH2OH
CH2—C—OH
═
O
②Zn/H2O
①O3
OHCCH2CH2CH2CH2CHO
4)开环反应
高锰酸钾溶液氧化性更强,可以得到酮或羧酸。
O3氧化性相比更弱一些,往往得到醛或酮
有选择地通过取代、加成、消去、氧化、还原等有机化学反应,可以实现有机化合物类别的转化,并引入目标官能团。
还原
水解
酯化
酯
羧酸
醛
醇
卤代烃
氧化
氧化
水解
取代
烷烃
取代
烯烃
炔烃
水化
消去
水化
消去
加成
加成
氧化
加成
2、引入官能团
1)碳碳双键的引入
①醇或卤代烃的消去反应
CH3CH2OH
CH2=CH2↑+H2O
CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O
乙醇
△
②炔烃与H2、HX、X2的不完全加成(限制物质的量)可得碳碳双键
CH≡CH + Cl2
ClCH=CHCl
浓H2SO4
170℃
(注意反应条件)
CH≡CH + HBr CH2=CHBr
催化剂
△
催化剂
△
2)碳卤键的引入
①烷烃(或苯及苯的同系物)的取代
CH4 + Cl2 CH3Cl + HCl
光
+ 3Cl2
光照
+ 3HCl
注意
②醇(或酚)的取代反应
C2H5 OH + H Br C2H5 Br + H2O
△
+3Br2
+3HBr
(过量)
OH
OH
Br
Br
Br
③烯烃(或炔烃)的与X2、HX加成
CH3CH=CH2+Br2 CH3CHBrCH2Br
CH3CH=CH2+HCl CH3CHClCH3
△
催化剂
△
CH≡CH+HCl
CH2=CHCl
CH≡CH + Cl2
ClCH=CHCl
催化剂
△
3)羟基的引入
①烯烃与水的加成
CH3CH=CH2+H2O CH3CH(OH)CH3
催化剂
加热、加压
②卤代烃的水解
CH3CH2CH2Cl + NaOH CH3CH2CH2OH + NaCl
H2O
△
③酯的水解
CH3COOC2H5+NaOH CH3COONa+C2H5OH
△
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
△
④醛、酮的还原
CH3CHO +H2 CH3CH2OH
催化剂
Δ
⑤羧酸在强还原剂作用下还原成醇
RCOOH RCH2OH
LiAlH4
O
C
CH3
CH3
+
H2
催化剂
OH
CH
CH3
CH3
⑥酚盐溶液与CO2、HCl等反应
+NaCl
OH
+ HCl
ONa
+NaHCO3
OH
+ CO2+H2O
ONa
⑦羟醛缩合反应
催化剂
CH3—C—CH2CHO
OH
H
β
α
CH3—C—H
O
+ CH3CHO
α
=
4)醛基和酮羰基的引入
①烯烃氧化
②炔烃水化
③某些烯烃、炔烃被O3或酸性高锰酸钾溶液氧化
②Zn/H2O
①O3
OHCCH2CH2CH2CH2CHO
CH2=CHC= CHCH3
CH3
CO2 + HOOCC= O + HOOCCH3
CH3
R-CH2OH
Cu/Ag
△
R-CHO
R1-CH-R2
OH
Cu/Ag
△
R1-C-R2
O
醛
酮
伯醇
仲醇
④某些醇的催化氧化
5)羧基的引入
①醛的氧化反应
2CH3CHO+O2
2CH3COOH
CH3CHO+2Cu(OH)2+NaOH CH3COONa+Cu2O↓+3H2O
△
CH3COOH
H+
②某些烯烃、炔烃、芳香烃侧链被酸性KMnO4溶液氧化的反应
C=CH-R
R1
R2
KMnO4
H+
C=O + R-COOH
R1
R2
CH≡C-R
KMnO4
H+
CO2+RCOOH
CH—
R
R1
KMnO4
H+
HOOC—
④酯、酰胺、氰基的水解反应
CH3COOC2H5+H2O CH3COOH+C2H5OH
稀硫酸
△
RCONH2 + NaOH RCOONa + NH3↑
RCONH2 + H2O + HCl RCOOH + NH4Cl
RCOOH
H+
③伯醇被酸性高锰酸钾或重铬酸钾溶液氧化的反应
KMnO4
H+
R—CH2 OH R—COOH
H2O,H+
催化剂
R-CN
R-COOH
6)酯基的引入
①酯化反应
CH3COOH+C2H5OH CH3COOC2H5+H2O
浓硫酸
△
②酰氯醇解
O
-C-
Cl
CH3
+
CH3OH
无水操作
O
-C-OCH3
+HCl
CH3
=
=
3、官能团的转化
CH3COOCH2CH3
CH3CH2OH
CH2=CH2
CH3CH2Br
CH3CHO
CH3COOH
“有机三角”
卤代烃是有机合成的桥梁!
包括官能团种类变化、数目变化、位置变化等。
1)官能团种类变化:
CH3CH2-Br
水解
CH3CH2-OH
氧化
CH3-CHO
CH3-COOH
氧化
3)官能团位置变化
2)官能团数目变化
消去
加成
CH3CH2-Br
CH2=CH2
CH2Br-CH2Br
CH3CH2OH
消去
CH2=CH2
加Br2
CH2BrCH2Br
HOCH2CH2OH
水解
CH3CH2CH2OH
CH3CH=CH2
CH3CH-CH3
Br
消去
HBr
CH3CH-CH3
OH
水解
4、官能团的消除
加成反应
1)消除不饱和键
2)消除羟基
取代、消去、酯化、氧化
3)消除醛基、酮羰基
加成、氧化
4)消除碳卤键
消去、水解
5)消除酯基、酰胺基
水解
【课堂练习2】以2-氯丁烷为主要原料合成2,3-丁二醇;1,4-丁二醇。
CH3CHCH2CH3
Cl
NaOH/醇
CH3CH=CHCH3
Br2
CH3CHCHCH3
Br
Br
NaOH/H2O
CH3CH—CHCH3
OH
OH
NaOH/醇
CH2=CHCH=CH2
HBr
CH2CH2CH2CH2
Br
Br
NaOH/H2O
CH2CH2CH2CH2
OH
OH
CH3CHCH2CH3
Cl
NaOH/醇
CH3CH=CHCH3
Br2
CH3CHCHCH3
Br
Br
【思考】下列两个有机合成设计流程有何特点?其设计的目的是什么?
通常有碳碳双键、羟基、羰基、醛基和氨基等需保护。
5、官能团的保护
1)羟基的保护
例如:
因酚羟基易被氧化,故在加入氧化剂之前将酚-OH先转化为-ONa(或-OCH3),待其他基团氧化后,再酸化使其转化为-OH。
OCH3
COOH
OH
COOH
CH3I
KMnO4/H+
H+
OCH3
CH3
OH
CH3
OH
CH3
OH
COOH
2)碳碳双键的保护
醛基、羟基和碳碳双键均容易被氧化。若只氧化醛基或羟基,则需要对碳碳双键进行保护。可以利用其与HCl等的加成反应将其保护起来,待氧化后再利用消去反应恢复碳碳双键。
C=C
NaOH/醇
△
C=C
+HX
—C—C—
X
H
相关合成反应
3)醛基的保护
醛基容易被氧化剂氧化。醛基保护一般是把醛基制成缩醛,最后再将缩醛水解得到醛基(常用乙二醇)
缩醛
OH
CHO
OH
CH
OCH3
OCH3
CH
OCH3
OCH3
O
CHO
O
CH3OH
KMnO4/H+
H2O/H+
4)氨基的保护
氨基易被O2、O3、H2O2、酸性KMn04溶液等氧化。
先用盐酸转化为铵盐,后加NaOH溶液重新转化为-NH2。
CH3
浓硝酸
浓硫酸,加热
CH3
NO2
KMnO4/H+
COOH
NO2
Fe/HCl
COOH
NH2
用甲苯制备对氨基苯甲酸,先氧化甲基后还原为氨基
有机合成发展史
19世纪20年代
德国化学家维勒合成了尿素,开创了人工合成有机物的新时代
20世纪初
德国化学家维尔施泰特通过十余步反应合成颠茄酮,总产率仅有0.75%。十几年后罗宾逊仅用3步反应便完成合成,总产率达
90%
20世纪中后期
美国化学家伍德沃德与多位化学家合作,成功合成了奎宁、胆固醇、叶绿素、红霉素、维生素B12等一系列结构复杂的天然产物,促进了有机合成技术和有机反应理论的发展
美国化学家科里提出了系统化的逆合成概念,开始利用计算机来辅助设计合成路线让合成路线的设计逐步成为有严密思维逻辑的科学过程,使有机合成进入了新的发展阶段。
二、有机合成路线的设计与实施
1、设计合成路线的基本原则
1)尽量选择步骤最少的合成路线——以保证较高的产率。
2)起始原料要廉价、易得、低毒、低污染——通常采用4个C以下的单官能团化合物和单取代苯。
3)满足“绿色化学”的要求,污染排放少。
4)操作简单、条件温和、能耗低、产物易于分离提纯。
5)尊重客观事实,按一定顺序反应。
图3-31 实验室进行有机合成使用的一种典型装置
图3-32 工业合成使用的反应釜
恒压滴液漏斗
球形冷凝管
三颈烧瓶或三口烧瓶
温度计
作用是冷凝回流
2、有机合成常用装置
3、有机合成的意义
有机合成的发展,使人们不仅能通过人工手段合成原本只能从生物体内分离、提取的天然产物,还可以根据实际需要设计合成具有特定结构和性能的新物质,为化学、生物、医学、材料等领域的研究和相关工业生产提供了坚实的物质基础,有力地促进了人类健康水平提高和社会发展进步。
4、有机合成的常见方法
基础原料
辅助原料1
中间体1
副产物1
辅助原料2
中间体2
副产物2
辅助原料3
目标化合物
这种按一定顺序进行的一系列反应就构成了合成路线
副产物3
(1)正合成分析法:
采用正向思维方法,从已知原料入手,找出合成所需要的中间体,逐步推向目标产物。
(又称顺推法)
简单、易得
碳骨架和官能团等方面的异同的比较
增加一段碳链或连上一个官能团
图3-28 有机合成过程示意图
(1)人们最初是通过发酵法由粮食制备乙酸,现在食醋仍主要以这种方式生产,工业上大量使用的乙酸是通过石油化学工业人工合成的。请以乙烯为原料,设计合理的路线合成乙酸,分析该合成过程中官能团的变化。
【思考与讨论】
CH2=CH2
中间体
H2O
CH3CH2OH
CH3CHO
辅助原料
Cu
辅助原料
H2O、催化剂
CH3COOH
基础原料
中间体
目标化合物
官能团的变化
碳碳双键→羟基→醛基→羧基
辅助原料
O2、催化剂
CH2=CH2
CH3CH2OH
O2/Cu
△
CH3CHO
CH3COOH
O2
催化剂/△
H2O
催化剂/△
(2)目前已经出现了将乙烯直接氧化生成乙酸的工艺。假定该工艺涉及的反应和(1)中合成路线的每一步反应的产率均为70%,请计算并比较这两种合成路线的总产率。
(1)中合成路线生成CH3COOH的产率为70%×70%×70%=34.3%,低于乙烯直接氧化成乙酸的产率(70%),因此,合成步骤应尽可能少,以提高产率。
CH2=CH2
CH3CH2OH
CH3CHO
CH3COOH
70%
70%
70%
CH2=CH2+O2
CH3COOH
催化剂
70%
【课堂练习3】请设计合理方案用 合成
(无机试剂任选,用反应流程图表示,并注明反应条件)。
提示:RCH=CH2 RCH2-CH2-Br
HBr
过氧化物
(2)逆合成分析法:
图3-29 逆合成分析示意图
基础原料
中间体1
目标
化合物
中间体2
(又称逆推法)
从产物出发,由后向前推,先找出产物的前一步原料(中间体),并同样找出它的前一步原料,如此继续直至到达简单的初始原料为止。
乙二酸二乙酯是一种医药和染料工业原料,请以乙烯为原料设计合成的路线。
C
O
C
O
OC2H5
OC2H5
C
O
C
O
OH
OH
CH3CH2OH
CH2
CH2
Cl
Cl
CH2
CH2
OH
OH
CH2=CH2
CH2=CH2
C—OC2H5
C—OC2H5
O
O
CH2
CH2
逆合成步骤的表示:可以用符号 “ ”表示逆推过程,
用箭头“→”表示每一步转化反应。
确定乙二酸二乙酯的基础原料为乙烯,通过以下5步反应完成合成:
CH2=CH2 +H2O
催化剂
Δ ,加压
CH3CH2 OH
1.
CH2=CH2 + Cl2
CH2
CH2
Cl
Cl
2.
CH2
CH2
Cl
Cl
+ 2NaOH
H2O
Δ
CH2
CH2
OH
OH
+ 2NaCl
3.
CH2
CH2
OH
OH
+ 2O2
催化剂
Δ
C
C
HO
OH
O
O
+ 2H2O
4.
+ 2CH3CH2 OH
C
C
HO
OH
O
O
+ 2H2O
催化剂
Δ
C
C
C2H5O
OC2H5
O
O
5.
【思考与讨论】在实际工业生产中,乙二醇还可以通过环氧乙烷与水直接化合的方法合成,而环氧乙烷则可由乙烯直接氧化得到。请比较该方法与以上合成乙二酸二乙酯中的2、3两步反应,分析生产中选择该路线的可能原因。
CH2=CH2
催化剂、△
O2
H2C—CH2
O
加压、△
H2O
CH2—CH2
OH
OH
①从原料成本的角度考虑,使用O2和H2O,比使用C12和NaOH成本更低;
②从原子利用率的角度考虑,环氧乙烷法没有副产物,原子利用率高;
③从环境保护的角度考虑,C12有毒,NaOH有腐蚀性,对环境不够友好。
【课堂练习4】苯甲酸苯甲酯 是一种有水果香气的食品香料。
请以甲苯为基础原料,使用逆合成分析法设计它的合成路线。
分析:
合成路线:
(3)综合分析法:
采用综合思维的方法,将正向或逆向推导出的几种合成途径进行比较,从而得到最佳合成路线
氟他胺
【课堂练习5】氟他胺是一种抗肿瘤药,在实验室由芳香烃A制备氟他胺的合成路线如下所示:
1. 芳香烃A的名称是 。
甲苯
2. 反应③、④的反应类型: 、 。
取代反应
还原反应
(3)写出反应⑤的反应方程式;吡啶是一种有机碱,其在反应⑤中的作用?
吡啶作用:吸收产生的HCl,提高反应物转化率
(4)设计合成路线:以苯甲醚 为原料制备对甲氧基乙酰苯胺
浓硫酸
浓硝酸
,Δ
Fe/HCl
CH3COCl
吡啶
