3.1 卤代烃 课件(共28张PPT)
文档属性
| 名称 | 3.1 卤代烃 课件(共28张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-01 13:50:40 | ||
图片预览




文档简介
(共28张PPT)
第一节 卤代烃
第三章 烃的衍生物
卤代烃
醇 酚
醛 酮
羧酸 羧酸衍生物
有机合成
烃分子中的氢原子被不同官能团所取代后,就能生成一系列新的不同类别的有机化合物,如卤代烃、醇、酚、醛、羧酸和酯等。这些有机化合物,从结构的角度都可以看作是由烃行生而来的,所以被称为烃的衍生物。烃的衍生物具有与烃不同的性质,这些性质主要由其分子中的官能团决定。基于官能团和化学键的特点及有机反应规律,可以推测有机化合物的化学性质,并利用其性质实现相互转化,进行有机合成。有机合成在创造新物质、提高人类生活质量和促进社会发展方面发挥着重要作用。
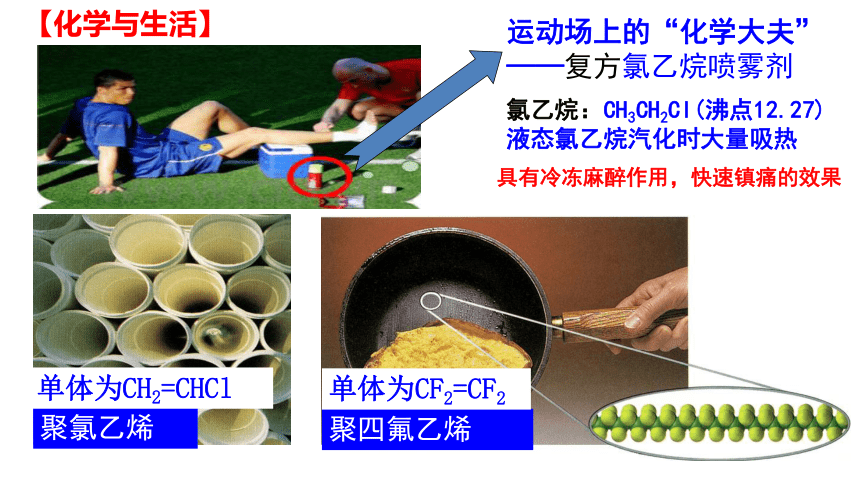
运动场上的“化学大夫”
——复方氯乙烷喷雾剂
氯乙烷:CH3CH2Cl(沸点12.27)
液态氯乙烷汽化时大量吸热
聚氯乙烯
聚四氟乙烯
单体为CH2=CHCl
单体为CF2=CF2
【化学与生活】
具有冷冻麻醉作用,快速镇痛的效果
一、卤代烃的通性
烃分子中的氢原子被卤素原子取代生成的化合物。一元卤代烃可表示为:R-X
C X 碳卤键
元素组成:一定含C、X、H(不一定)
官能团:
CH3Cl
CH2Cl2
CHCl3
CCl4
CH3—CH2Br
CH2—CH2
Br
Br
CH2=CHCl
Br
—CH2—CHCl—
n
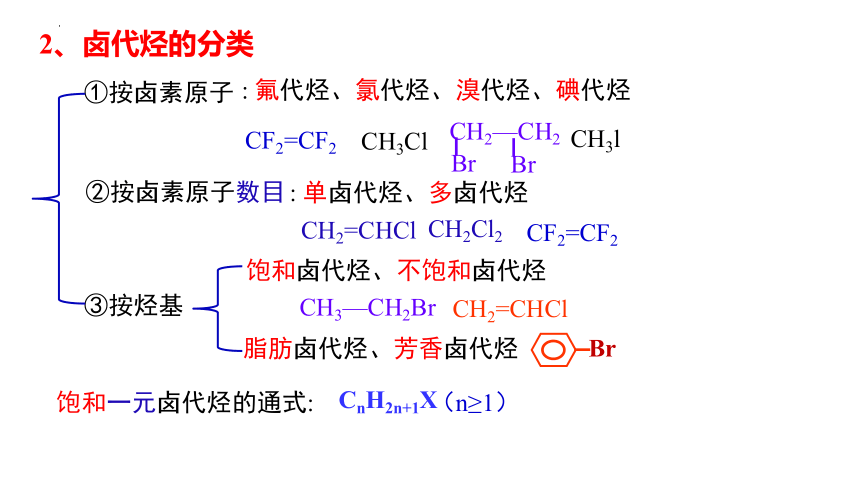
1、卤代烃的概念
①按卤素原子
②按卤素原子数目
③按烃基
: 单卤代烃、多卤代烃
饱和卤代烃、不饱和卤代烃
: 氟代烃、氯代烃、溴代烃、碘代烃
脂肪卤代烃、芳香卤代烃
CF2=CF2
CH3Cl
CH2—CH2
Br
Br
CH3l
CH3—CH2Br
CH2=CHCl
Br
饱和一元卤代烃的通式:
CnH2n+1X
(n≥1)
CH2=CHCl
CH2Cl2
CF2=CF2
2、卤代烃的分类
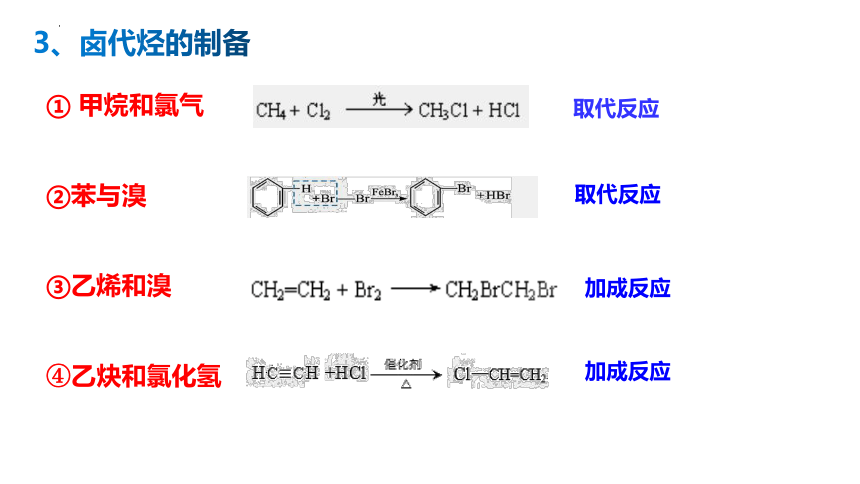
① 甲烷和氯气
②苯与溴
③乙烯和溴
④乙炔和氯化氢
取代反应
取代反应
加成反应
加成反应
3、卤代烃的制备
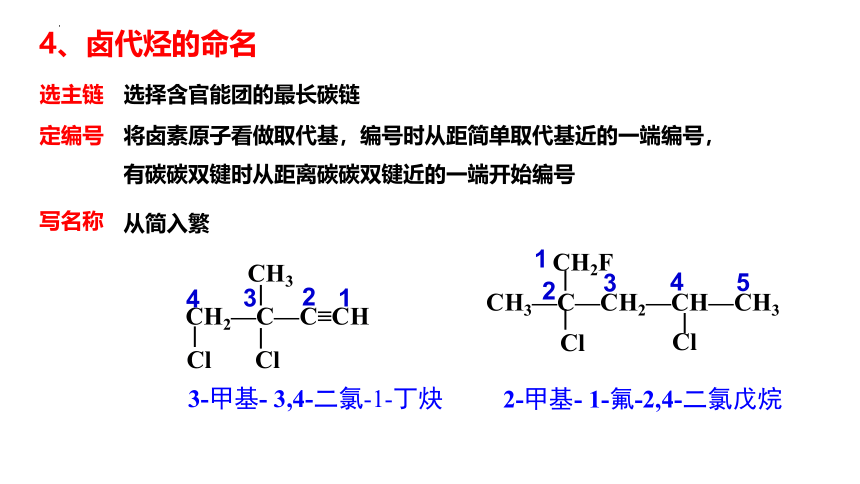
选主链
定编号
写名称
选择含官能团的最长碳链
将卤素原子看做取代基,编号时从距简单取代基近的一端编号,
有碳碳双键时从距离碳碳双键近的一端开始编号
从简入繁
CH2—C—C≡CH
Cl
CH3
Cl
3-甲基- 3,4-二氯-1-丁炔
1
2
3
4
CH3—C—CH2—CH—CH3
Cl
CH2F
Cl
2-甲基- 1-氟-2,4-二氯戊烷
1
2
3
4
5
4、卤代烃的命名
名称 结构简式 液态时密度/(g·cm-3) 沸点/℃
一氯甲烷 CH3Cl 0.916 -24
一氯乙烷 CH3CH2Cl 0.898 12
1-氯丙烷 CH3CH2CH2Cl 0.890 46
1-氯丁烷 CH3CH2CH2CH2Cl 0.886 78
1-氯戊烷 CH3CH2CH2CH2CH2Cl 0.882 108
以氯代烃的密度和沸点为例,同时结合烷烃的物理性质的变化规律,总结卤代烃的物理性质。
降低
升高
气态
5、卤代烃的物理性质
常温下除一氯甲烷、氯乙烷、氯乙烯等少数是气体外,
大多数为液体或固体。
除脂肪烃的一氟代物和一氯代物外,其余卤代烃密度都比水大。
一般随着烃基中碳原子数目的增加而减小。
卤代烃不溶于水,可溶于有机溶剂,某些卤代烃本身就是有机溶剂
熔沸点大于同碳个数的烃,随碳原子数增多,沸点依次升高(碳原子数相同时,支链越多沸点越低)。
状态
沸点
密度
溶解性
二、卤代烃的结构与性质
1、溴乙烷的组成和结构
C2H5Br
CH3CH2Br 或 C2H5Br
分子式:
结构式:
结构简式:
官能团:
C—Br
核磁共振氢谱图
(碳溴键)
球棍模型
空间填充模型
电子式:
有2种化学环境的H原子,则核磁共振有2组峰,强度比为3:2
2、溴乙烷的物理性质
颜 色:
状 态:
密 度:
溶解性:
沸 点:
无色透明
油状液体
比水大
不溶于水,
易溶于有机溶剂
沸点38.4℃
易挥发
对 比
无色
气体
-88.6 ℃
不溶于水
CH3CH3
比水小
>
卤代烃的熔沸点大于同C原子数的烃!
CH3CH2Br
分析卤代烃的结构特点,推测卤代烃具有
怎样的化学性质?
卤代烃中卤素原子吸引电子能力较强,共用电子对偏向卤素原子,使C—X键具有较强的极性,所以卤代烃具有较强的反应活性,易发生取代反应和消去反应。
碳卤键
官能团:
X
C
δ—
δ+
【思考与讨论】
例:溴乙烷和乙烷的结构相似,区别在于C-H键与C-Br键的不同。C-Br键为极性键,由于溴原子吸引电子能力强,C-Br键易断裂,使溴原子易被取代。
元素 H C Br
电负性 2.1 2.5 2.8
3、化学性质
提出问题1:
溴乙烷CH3CH2Br 在水中能否电离出Br-?
它是否为电解质?请设计实验证明。
实验:
溴乙烷
HNO3酸化后的AgNO3溶液
无明显变化
溴乙烷不是电解质,不能电离出Br-。
提出问题2:CH3CH3+水→不反应, CH3CH2Br+H2O →
科学猜测:若反应,可能有 产生。
怎样证明有Br-产生?
资料卡片:
C2H5Br与水的反应要在碱性环境下才容易进行
Br-
实验装置
实验现象
实验解释
①中溶液分层。
溴乙烷与NaOH溶液共热,产生了Br-
④中有淡黄色沉淀生成。
②中有机层厚度减小。
C2H5Br+NaOH C2H5OH+NaBr
【实验探究】
从平衡移动的角度看,NaOH不断中和氢溴酸,促进溴乙烷的水解;加热的目的是提高反应速率,且水解是吸热反应,升高温度也有利于平衡右移。水相当于是催化剂
1) 取代反应(水解反应)
反应条件:
NaOH水溶液、加热
反应原理:
羟基取代溴原子
C2H5—Br + H--OH C2H5—OH + HBr
△
NaOH + HBr == NaBr + H2O
总反应:
推广:所有卤代烃在碱性水溶液中都会发生水解反应
CH3CH2—Br + Na—OH CH3CH2—OH + NaBr
H2O
△
(1)在实验中加入过量稀硝酸的目的是什么?
①中和过量的NaOH溶液 ②检验生成的沉淀是否溶于稀HNO3
(3)检验卤代烃中的卤原子一般流程:
AgNO3溶液
NaOH溶液
水解
HNO3溶液
酸化
R-X
AgCl 白色沉淀
AgBr 浅黄色沉淀
AgI 黄色沉淀
该步骤必不可少
思考:
(2)若不加稀硝酸,直接滴加AgNO3(aq),将会看到什么现象?
过量的NaOH与AgNO3反应,产生黑褐色的Ag2O↓
NaOH+AgNO3 = AgOH↓+NaNO3
2AgOH = Ag2O↓ +H2O
在卤代烃分子中,由于卤原子的吸电子作用,不仅使得α-C带部分正电荷,也使β-C带有更少量的正电荷,从而使β-H的活泼性增强,能在强碱的作用下,失去一分子卤化氢,生成烯烃,这就是卤代烃的消去反应。
C
C
Br
H
H
H
H
H
Br
δ+
δ-
δ++
现象:
高锰酸钾酸性溶液褪色
实验:
结论:
生成的气体分子中含有不饱和碳碳键
溴乙烷与NaOH的乙醇混合液
反应原理:
CH2—CH2 +NaOH CH2=CH2↑ +NaBr +H2O
Br
H
乙醇
△
有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而形成不饱和键(双键或三键)的化合物的反应。。
消去反应:
如果将溴乙烷与强碱(如NaOH或KOH)的乙醇溶液共热,溴乙烷可以从分子中脱去HBr,生成乙烯。
2)消去反应(消除反应)
思考:在溴乙烷与NaOH的醇溶液的反应中,如何检验气体产物
(1)分析反应产生的气体中可能含有哪些杂质?
(2)为什么要在气体通入酸性KMnO4溶液前
加一个盛有水的试管?
溴乙烷、乙醇、水蒸气
①水能除去挥发出来的乙醇,乙醇也能使酸性高锰酸钾溶液褪色,干扰乙烯的检验。
(3)除酸性高锰酸钾溶液外还可以用什么来检验乙烯,此时气体还用先通入水中吗?理由是?
溴水或溴的四氯化碳溶液。
不用;乙醇与溴不反应,不会干扰乙烯的检验。
②产生的气体乙烯(含 等杂质气体)
乙醇、溴乙烷、水蒸气
发生消去反应的条件:
①烃中碳原子数≥2
②连卤原子的相邻碳原子上有氢原子
1、反应条件:
+NaOH
— C— C—
H
X
醇
C=C
+NaX+H2O
HX+NaOH ===NaX +H2O
强碱的醇溶液、加热
2、物质结构条件:
一般不利用消去反应检验卤素原子,
因为不是所有的卤代烃都能发生消去反应。
反应类型 消去反应 水解(取代)反应
反应条件
卤代烃的 断键规律
结构特点
产物特征
归纳总结
卤代烃的消去反应与取代(水解)反应的比较
NaOH醇溶液、加热
NaOH水溶液、加热
与X相连的C的邻位C上有H原子
含C—X键即可
消去HX,引入碳碳双键或碳碳三键
在碳上引入—OH,生成含—OH的有机物(醇)
无醇则有醇
有醇则无醇
波谱方法——红外光谱,核磁共振氢谱
【实验探究P54】
生成醇
生成烯烃
CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
CH3CH2CH2CH2OH、NaBr
CH3CH2CH=CH2、NaBr、H2O
+ 水
NaOH水溶液,加热
NaOH醇溶液,加热
1-溴丁烷和NaOH在不同条件下发生不同类型的反应
CH3CH2CH2CH2Br
乙醇
△
+NaOH
CH3CH2CH=CH2 ↑+ NaBr + H2O
CH3CH2CH2CH2Br
水
△
+NaOH
CH3CH2CH2CH2OH + NaBr
还可以利用溴水、溴的CCl4溶液检验丁烯。
此时不需要先通入水中。
因受热而挥发的乙醇也能使高锰酸钾褪色,所以要先通过水除去乙醇,防止干扰实验。
乙醇与溴不反应,不会干扰乙烯的检验。
2-丁烯
CH3-CH-CH2-CH3
Br
CH3-CH=CH-CH3
CH3-CH2-CH=CH2
(主产物)
1-丁烯
消去反应规则:当有多个产物时,以消H少的C原子上的H为主
“雪上加霜”
“少的更少”
扎依采夫规则
3)加成反应和加聚反应
卤代烯烃的某些化学性质与烯烃的相似,能发生加成反应和加聚反应。
聚氯乙烯和聚四氟乙烯都是用途广泛的高分子材料。
氯乙烯
聚氯乙烯
四氟乙烯
聚四氟乙烯
特富龙(Teflon)是美国杜邦公司对其研发的所有碳氢树脂的总称,包括聚四氟乙烯、聚全氟乙丙烯及各种共聚物。由于其独特优异的耐热(180℃-260℃)、耐低温(-200℃)、自润滑性及化学稳定性能等,而被称为“拒腐蚀、永不粘的特富龙”。
聚四氟乙烯不粘锅
聚四氟乙烯,俗称塑料王,具有最佳的耐热性和耐化学性,显示了独特的不粘性和润滑性。
乙烯-四氟乙烯共聚物(ETFE)
臭氧层的保护
卤代烃在日常生活中有着广泛的应用。例如,在消防上使用的卤代烃灭火剂,可应用于资料室、变电站、博物馆等场所。由于卤代烃是良好的有机溶剂,在清洗业中常用作清洗剂,应用于衣物干洗和机械零件的洗涤。有些多卤代烃,如氟氯代烷(商品名氟利昂)是含有氟和氯的烷烃衍生物,它们化学性质稳定,无毒,具有不燃烧、易挥发、易液化等特性,曾被广泛用作制冷剂和溶剂。然而,20世纪80年代以来,大量的科学研究表明使用氟利昂对臭氧层有破坏作用,使臭氧层产生"臭氧空洞",危及地球上的生物。
大气中的臭氧层可滤除大量的紫外线,保护地球上的生物,其主要反应为:研究表明,氟利昂可在强烈的紫外线作用下分解,产生的氯原子自由基会对臭氧层产生长久的破坏作用。以 CCl 3F 为例,它破坏臭氧层的反应过程可表示为:
为了保护臭氧层,国际社会于1987年制定了《关于消耗臭氧层物质的蒙特利尔议定书》,要求签约国限制生产和消费某些卤代烃,并自1989年1月1日起生效。我国于1991年6月加入该议定书。1995年,诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家。
紫外线
CCl 3F
CCl 2F·+Cl·
Cl·+O3
O2+ClO·
Cl· +O2
ClO· + O·
【科学-技术-社会】
卤代烃的功与过
溶剂
卤代烃
致冷剂
医用
灭火剂
麻醉剂
农药
氟氯烃——造成臭氧空洞的“罪魁祸首”
第一节 卤代烃
第三章 烃的衍生物
卤代烃
醇 酚
醛 酮
羧酸 羧酸衍生物
有机合成
烃分子中的氢原子被不同官能团所取代后,就能生成一系列新的不同类别的有机化合物,如卤代烃、醇、酚、醛、羧酸和酯等。这些有机化合物,从结构的角度都可以看作是由烃行生而来的,所以被称为烃的衍生物。烃的衍生物具有与烃不同的性质,这些性质主要由其分子中的官能团决定。基于官能团和化学键的特点及有机反应规律,可以推测有机化合物的化学性质,并利用其性质实现相互转化,进行有机合成。有机合成在创造新物质、提高人类生活质量和促进社会发展方面发挥着重要作用。
运动场上的“化学大夫”
——复方氯乙烷喷雾剂
氯乙烷:CH3CH2Cl(沸点12.27)
液态氯乙烷汽化时大量吸热
聚氯乙烯
聚四氟乙烯
单体为CH2=CHCl
单体为CF2=CF2
【化学与生活】
具有冷冻麻醉作用,快速镇痛的效果
一、卤代烃的通性
烃分子中的氢原子被卤素原子取代生成的化合物。一元卤代烃可表示为:R-X
C X 碳卤键
元素组成:一定含C、X、H(不一定)
官能团:
CH3Cl
CH2Cl2
CHCl3
CCl4
CH3—CH2Br
CH2—CH2
Br
Br
CH2=CHCl
Br
—CH2—CHCl—
n
1、卤代烃的概念
①按卤素原子
②按卤素原子数目
③按烃基
: 单卤代烃、多卤代烃
饱和卤代烃、不饱和卤代烃
: 氟代烃、氯代烃、溴代烃、碘代烃
脂肪卤代烃、芳香卤代烃
CF2=CF2
CH3Cl
CH2—CH2
Br
Br
CH3l
CH3—CH2Br
CH2=CHCl
Br
饱和一元卤代烃的通式:
CnH2n+1X
(n≥1)
CH2=CHCl
CH2Cl2
CF2=CF2
2、卤代烃的分类
① 甲烷和氯气
②苯与溴
③乙烯和溴
④乙炔和氯化氢
取代反应
取代反应
加成反应
加成反应
3、卤代烃的制备
选主链
定编号
写名称
选择含官能团的最长碳链
将卤素原子看做取代基,编号时从距简单取代基近的一端编号,
有碳碳双键时从距离碳碳双键近的一端开始编号
从简入繁
CH2—C—C≡CH
Cl
CH3
Cl
3-甲基- 3,4-二氯-1-丁炔
1
2
3
4
CH3—C—CH2—CH—CH3
Cl
CH2F
Cl
2-甲基- 1-氟-2,4-二氯戊烷
1
2
3
4
5
4、卤代烃的命名
名称 结构简式 液态时密度/(g·cm-3) 沸点/℃
一氯甲烷 CH3Cl 0.916 -24
一氯乙烷 CH3CH2Cl 0.898 12
1-氯丙烷 CH3CH2CH2Cl 0.890 46
1-氯丁烷 CH3CH2CH2CH2Cl 0.886 78
1-氯戊烷 CH3CH2CH2CH2CH2Cl 0.882 108
以氯代烃的密度和沸点为例,同时结合烷烃的物理性质的变化规律,总结卤代烃的物理性质。
降低
升高
气态
5、卤代烃的物理性质
常温下除一氯甲烷、氯乙烷、氯乙烯等少数是气体外,
大多数为液体或固体。
除脂肪烃的一氟代物和一氯代物外,其余卤代烃密度都比水大。
一般随着烃基中碳原子数目的增加而减小。
卤代烃不溶于水,可溶于有机溶剂,某些卤代烃本身就是有机溶剂
熔沸点大于同碳个数的烃,随碳原子数增多,沸点依次升高(碳原子数相同时,支链越多沸点越低)。
状态
沸点
密度
溶解性
二、卤代烃的结构与性质
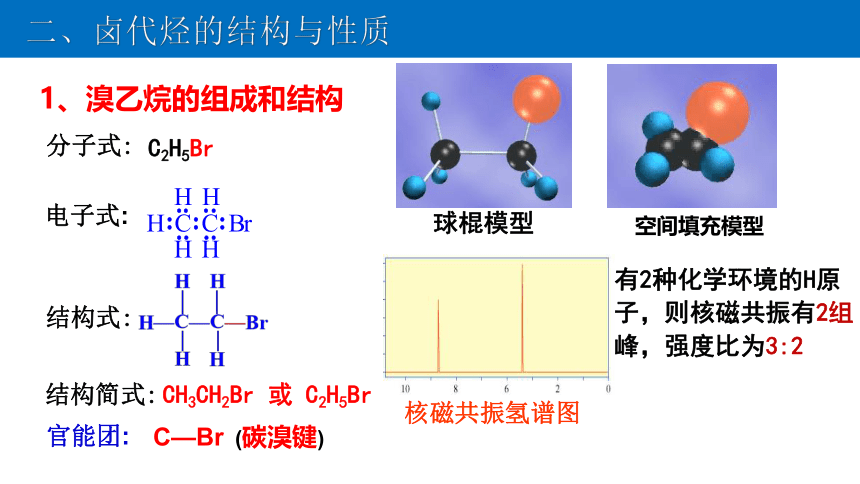
1、溴乙烷的组成和结构
C2H5Br
CH3CH2Br 或 C2H5Br
分子式:
结构式:
结构简式:
官能团:
C—Br
核磁共振氢谱图
(碳溴键)
球棍模型
空间填充模型
电子式:
有2种化学环境的H原子,则核磁共振有2组峰,强度比为3:2
2、溴乙烷的物理性质
颜 色:
状 态:
密 度:
溶解性:
沸 点:
无色透明
油状液体
比水大
不溶于水,
易溶于有机溶剂
沸点38.4℃
易挥发
对 比
无色
气体
-88.6 ℃
不溶于水
CH3CH3
比水小
>
卤代烃的熔沸点大于同C原子数的烃!
CH3CH2Br
分析卤代烃的结构特点,推测卤代烃具有
怎样的化学性质?
卤代烃中卤素原子吸引电子能力较强,共用电子对偏向卤素原子,使C—X键具有较强的极性,所以卤代烃具有较强的反应活性,易发生取代反应和消去反应。
碳卤键
官能团:
X
C
δ—
δ+
【思考与讨论】
例:溴乙烷和乙烷的结构相似,区别在于C-H键与C-Br键的不同。C-Br键为极性键,由于溴原子吸引电子能力强,C-Br键易断裂,使溴原子易被取代。
元素 H C Br
电负性 2.1 2.5 2.8
3、化学性质
提出问题1:
溴乙烷CH3CH2Br 在水中能否电离出Br-?
它是否为电解质?请设计实验证明。
实验:
溴乙烷
HNO3酸化后的AgNO3溶液
无明显变化
溴乙烷不是电解质,不能电离出Br-。
提出问题2:CH3CH3+水→不反应, CH3CH2Br+H2O →
科学猜测:若反应,可能有 产生。
怎样证明有Br-产生?
资料卡片:
C2H5Br与水的反应要在碱性环境下才容易进行
Br-
实验装置
实验现象
实验解释
①中溶液分层。
溴乙烷与NaOH溶液共热,产生了Br-
④中有淡黄色沉淀生成。
②中有机层厚度减小。
C2H5Br+NaOH C2H5OH+NaBr
【实验探究】
从平衡移动的角度看,NaOH不断中和氢溴酸,促进溴乙烷的水解;加热的目的是提高反应速率,且水解是吸热反应,升高温度也有利于平衡右移。水相当于是催化剂
1) 取代反应(水解反应)
反应条件:
NaOH水溶液、加热
反应原理:
羟基取代溴原子
C2H5—Br + H--OH C2H5—OH + HBr
△
NaOH + HBr == NaBr + H2O
总反应:
推广:所有卤代烃在碱性水溶液中都会发生水解反应
CH3CH2—Br + Na—OH CH3CH2—OH + NaBr
H2O
△
(1)在实验中加入过量稀硝酸的目的是什么?
①中和过量的NaOH溶液 ②检验生成的沉淀是否溶于稀HNO3
(3)检验卤代烃中的卤原子一般流程:
AgNO3溶液
NaOH溶液
水解
HNO3溶液
酸化
R-X
AgCl 白色沉淀
AgBr 浅黄色沉淀
AgI 黄色沉淀
该步骤必不可少
思考:
(2)若不加稀硝酸,直接滴加AgNO3(aq),将会看到什么现象?
过量的NaOH与AgNO3反应,产生黑褐色的Ag2O↓
NaOH+AgNO3 = AgOH↓+NaNO3
2AgOH = Ag2O↓ +H2O
在卤代烃分子中,由于卤原子的吸电子作用,不仅使得α-C带部分正电荷,也使β-C带有更少量的正电荷,从而使β-H的活泼性增强,能在强碱的作用下,失去一分子卤化氢,生成烯烃,这就是卤代烃的消去反应。
C
C
Br
H
H
H
H
H
Br
δ+
δ-
δ++
现象:
高锰酸钾酸性溶液褪色
实验:
结论:
生成的气体分子中含有不饱和碳碳键
溴乙烷与NaOH的乙醇混合液
反应原理:
CH2—CH2 +NaOH CH2=CH2↑ +NaBr +H2O
Br
H
乙醇
△
有机化合物在一定条件下,从一个分子中脱去一个或几个小分子(如H2O、HX等),而形成不饱和键(双键或三键)的化合物的反应。。
消去反应:
如果将溴乙烷与强碱(如NaOH或KOH)的乙醇溶液共热,溴乙烷可以从分子中脱去HBr,生成乙烯。
2)消去反应(消除反应)
思考:在溴乙烷与NaOH的醇溶液的反应中,如何检验气体产物
(1)分析反应产生的气体中可能含有哪些杂质?
(2)为什么要在气体通入酸性KMnO4溶液前
加一个盛有水的试管?
溴乙烷、乙醇、水蒸气
①水能除去挥发出来的乙醇,乙醇也能使酸性高锰酸钾溶液褪色,干扰乙烯的检验。
(3)除酸性高锰酸钾溶液外还可以用什么来检验乙烯,此时气体还用先通入水中吗?理由是?
溴水或溴的四氯化碳溶液。
不用;乙醇与溴不反应,不会干扰乙烯的检验。
②产生的气体乙烯(含 等杂质气体)
乙醇、溴乙烷、水蒸气
发生消去反应的条件:
①烃中碳原子数≥2
②连卤原子的相邻碳原子上有氢原子
1、反应条件:
+NaOH
— C— C—
H
X
醇
C=C
+NaX+H2O
HX+NaOH ===NaX +H2O
强碱的醇溶液、加热
2、物质结构条件:
一般不利用消去反应检验卤素原子,
因为不是所有的卤代烃都能发生消去反应。
反应类型 消去反应 水解(取代)反应
反应条件
卤代烃的 断键规律
结构特点
产物特征
归纳总结
卤代烃的消去反应与取代(水解)反应的比较
NaOH醇溶液、加热
NaOH水溶液、加热
与X相连的C的邻位C上有H原子
含C—X键即可
消去HX,引入碳碳双键或碳碳三键
在碳上引入—OH,生成含—OH的有机物(醇)
无醇则有醇
有醇则无醇
波谱方法——红外光谱,核磁共振氢谱
【实验探究P54】
生成醇
生成烯烃
CH3CH2CH2CH2Br
CH3CH2CH2CH2Br
CH3CH2CH2CH2OH、NaBr
CH3CH2CH=CH2、NaBr、H2O
+ 水
NaOH水溶液,加热
NaOH醇溶液,加热
1-溴丁烷和NaOH在不同条件下发生不同类型的反应
CH3CH2CH2CH2Br
乙醇
△
+NaOH
CH3CH2CH=CH2 ↑+ NaBr + H2O
CH3CH2CH2CH2Br
水
△
+NaOH
CH3CH2CH2CH2OH + NaBr
还可以利用溴水、溴的CCl4溶液检验丁烯。
此时不需要先通入水中。
因受热而挥发的乙醇也能使高锰酸钾褪色,所以要先通过水除去乙醇,防止干扰实验。
乙醇与溴不反应,不会干扰乙烯的检验。
2-丁烯
CH3-CH-CH2-CH3
Br
CH3-CH=CH-CH3
CH3-CH2-CH=CH2
(主产物)
1-丁烯
消去反应规则:当有多个产物时,以消H少的C原子上的H为主
“雪上加霜”
“少的更少”
扎依采夫规则
3)加成反应和加聚反应
卤代烯烃的某些化学性质与烯烃的相似,能发生加成反应和加聚反应。
聚氯乙烯和聚四氟乙烯都是用途广泛的高分子材料。
氯乙烯
聚氯乙烯
四氟乙烯
聚四氟乙烯
特富龙(Teflon)是美国杜邦公司对其研发的所有碳氢树脂的总称,包括聚四氟乙烯、聚全氟乙丙烯及各种共聚物。由于其独特优异的耐热(180℃-260℃)、耐低温(-200℃)、自润滑性及化学稳定性能等,而被称为“拒腐蚀、永不粘的特富龙”。
聚四氟乙烯不粘锅
聚四氟乙烯,俗称塑料王,具有最佳的耐热性和耐化学性,显示了独特的不粘性和润滑性。
乙烯-四氟乙烯共聚物(ETFE)
臭氧层的保护
卤代烃在日常生活中有着广泛的应用。例如,在消防上使用的卤代烃灭火剂,可应用于资料室、变电站、博物馆等场所。由于卤代烃是良好的有机溶剂,在清洗业中常用作清洗剂,应用于衣物干洗和机械零件的洗涤。有些多卤代烃,如氟氯代烷(商品名氟利昂)是含有氟和氯的烷烃衍生物,它们化学性质稳定,无毒,具有不燃烧、易挥发、易液化等特性,曾被广泛用作制冷剂和溶剂。然而,20世纪80年代以来,大量的科学研究表明使用氟利昂对臭氧层有破坏作用,使臭氧层产生"臭氧空洞",危及地球上的生物。
大气中的臭氧层可滤除大量的紫外线,保护地球上的生物,其主要反应为:研究表明,氟利昂可在强烈的紫外线作用下分解,产生的氯原子自由基会对臭氧层产生长久的破坏作用。以 CCl 3F 为例,它破坏臭氧层的反应过程可表示为:
为了保护臭氧层,国际社会于1987年制定了《关于消耗臭氧层物质的蒙特利尔议定书》,要求签约国限制生产和消费某些卤代烃,并自1989年1月1日起生效。我国于1991年6月加入该议定书。1995年,诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家。
紫外线
CCl 3F
CCl 2F·+Cl·
Cl·+O3
O2+ClO·
Cl· +O2
ClO· + O·
【科学-技术-社会】
卤代烃的功与过
溶剂
卤代烃
致冷剂
医用
灭火剂
麻醉剂
农药
氟氯烃——造成臭氧空洞的“罪魁祸首”
