1.2研究有机化合物的一般方法 课件(共39张PPT)
文档属性
| 名称 | 1.2研究有机化合物的一般方法 课件(共39张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 30.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-01 14:00:53 | ||
图片预览








文档简介
(共39张PPT)
第二节 研究有机化合物的一般方法
第一章 有机化合物的结构特点与研究方法
李时珍在《本草纲目》中记载,槟榔有“下水肿、通关节、健脾调中、治心痛积聚”等诸多病症。
槟榔是我国的四大南药之一
如果你是化学家,你该如何来研究槟榔中的有机化合物?一般的步骤和方法是什么?
有机物(粗品)
提取有效成分
获得晶体
测定结构
合成与修饰
广泛应用
Tu Youyou searched ancient literature on herbal medicine in her quest to develop novel malaria therapies. The plant Artemisia annua turned out to be an interesting candidate, and Tu developed a purification procedure, which rendered the active agent, Artemisinin, a drug that is remarkably effective against Malaria.
2015年
诺贝尔
生理学或医学奖
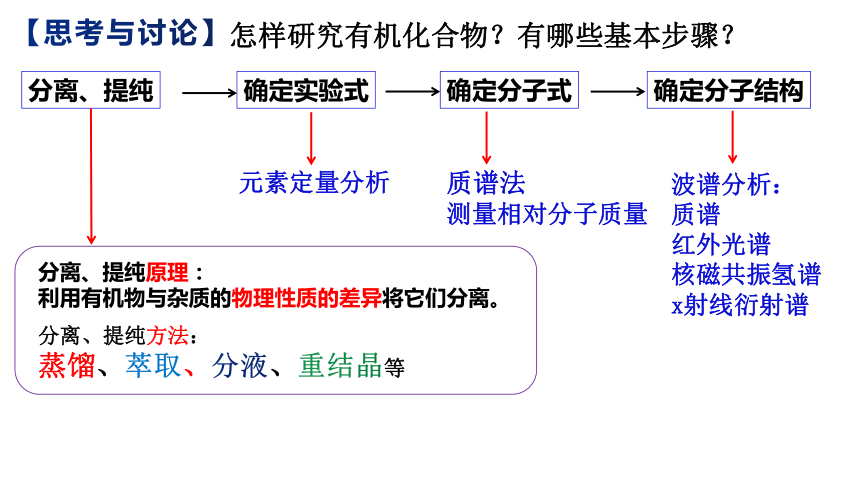
怎样研究有机化合物?有哪些基本步骤?
分离、提纯
确定实验式
确定分子式
确定分子结构
元素定量分析
质谱法
测量相对分子质量
波谱分析:
质谱
红外光谱
核磁共振氢谱
x射线衍射谱
分离、提纯原理:
利用有机物与杂质的物理性质的差异将它们分离。
分离、提纯方法:
蒸馏、萃取、分液、重结晶等
【思考与讨论】
一、分离、提纯
1、蒸馏
(2)条件:
(1)原理:
工业乙醇
工业乙醇95.6%
无水乙醇99.5%以上
蒸馏
蒸馏
吸水剂
③有机物与杂质的沸点相差较大(一般约大于30 ℃)
①液体有机物中含有少量杂质
②有机物热稳定性较强
利用沸点差异分离液体混合物。
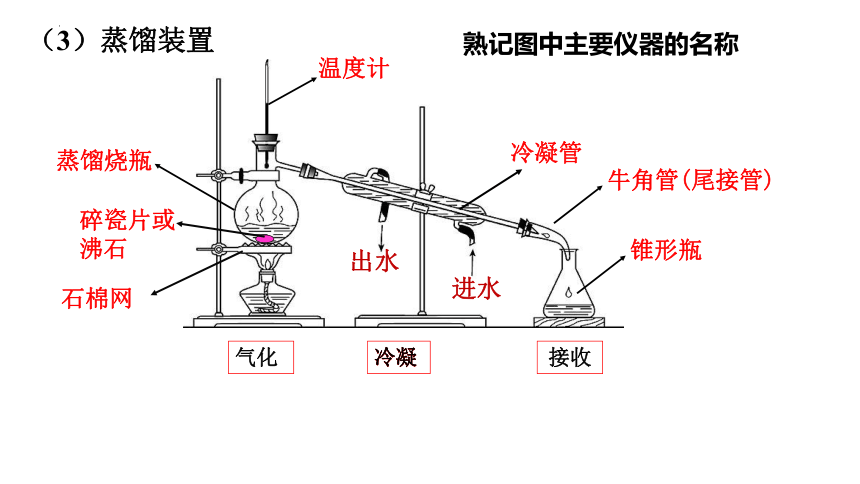
冷凝管
蒸馏烧瓶
锥形瓶
温度计
碎瓷片或沸石
进水
出水
牛角管(尾接管)
石棉网
熟记图中主要仪器的名称
气化
冷凝
冷凝
接收
(3)蒸馏装置
(4)注意事项:整体-局部:由下到上,由左到右
①使用前要检查装置的气密性;
②加热时应垫石棉网;
③烧瓶中放少量沸石或碎瓷片(防止暴沸);
④蒸馏烧瓶中所盛液体体积:1/3≤V≤2/3;
⑤温度计水银球的位置在蒸馏烧瓶支管口处;
⑥冷凝管中水的流向:下进上出;
⑦用锥形瓶收集馏分(蒸馏所得的产品)。
思考:1、先加热还是先通冷凝水?
酒精灯迟到早退、冷凝水早出晚归
2、实验中若发现未加沸石,应如何处理?
立即停止加热,冷却后,补加沸石。
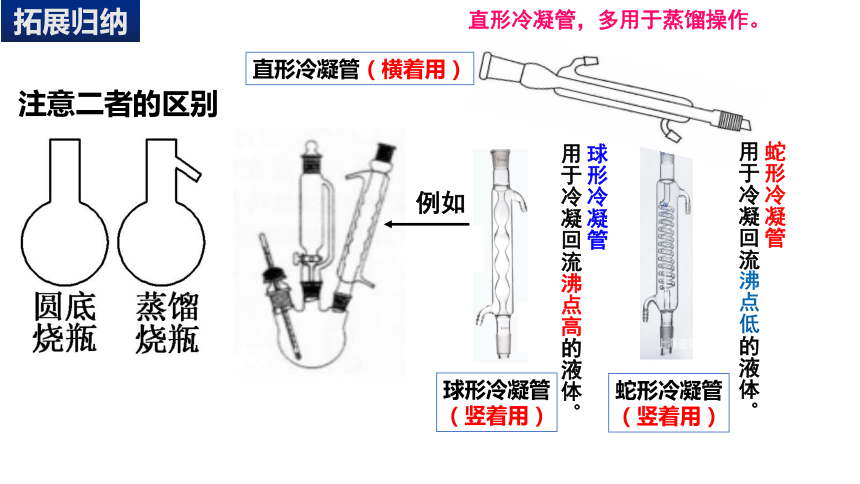
球形冷凝管
用于冷凝回流沸点高的液体。
蛇形冷凝管
用于冷凝回流沸点低的液体。
直形冷凝管,多用于蒸馏操作。
直形冷凝管(横着用)
球形冷凝管
(竖着用)
蛇形冷凝管
(竖着用)
例如
注意二者的区别
拓展归纳
泡茶
煲汤
利用混合物中一种溶质在互不相溶的两种溶剂中的溶解性不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法。
(1)根据萃取剂的类别,将萃取进行简单分类:
①液—液萃取:是利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂的过程。
②固—液萃取:是用有机溶剂从固体物质中溶解出有机物的过程 。(专用仪器设备)
2、萃取
——萃取用的溶剂
(2)萃取剂
选择条件:
①萃取剂与原溶剂互不相溶、不发生化学反应
②溶质不与萃取剂发生任何反应
③溶质在两溶剂中的溶解度有较大差别(在萃取剂中的溶解度大)
常用萃取剂:
密度小于水的:苯、乙醚、乙酸乙酯;
密度大于水的:氯仿、四氯化碳等
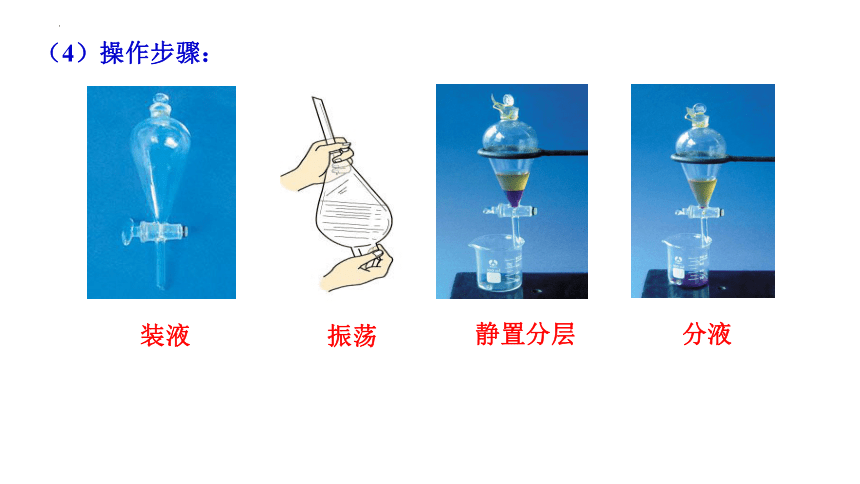
分液漏斗(梨形),烧杯,铁架台
(3)主要仪器:
静置分层
分液
振荡
装液
(4)操作步骤:
瓶塞(玻璃塞): 凹槽、小孔
①分液漏斗内液体的总体积不超过容积的2/3.
②分液漏斗下端尖嘴部分紧靠烧杯内壁。
③分液时应打开上口的玻璃塞或使塞上的凹槽对准漏斗口上的小孔,使液体能够顺利滴下;
④下层液体从下口放出,及时关闭下口活塞;
上层液体从上口倒出。
(5)注意事项:
(1)适用范围:
提纯固体有机化合物的常用方法
(2)溶剂要求:
②被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,能够冷却结晶
①杂质在此溶剂中溶解度很小或者很大,易于除去。
如果重结晶所得的晶体纯度不能达到要求,可以再次进行重结晶以提高产物的纯度。
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将其杂质除去的方法。
3、重结晶
【问题】某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸需要经过哪些步骤?
温度/℃ 25 50 75
溶解度/g 0.34 0.85 2.2
【资料】苯甲酸可用作食品防腐剂。纯净的苯甲酸为无色结晶,其结构可表示为 , 熔点122℃,沸点249℃。苯甲酸微溶于水,易溶于乙醇等有机溶剂。苯甲酸在水中的溶解度如下
重结晶法提纯苯甲酸
(3)探究——案例分析
【实验】
(1)观察粗苯甲酸样品的状态。
(2)将1g粗苯甲酸放入100mL烧杯,加入50mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
加热溶解
趁热过滤
冷却结晶
加热:使苯甲酸溶解。
趁热过滤:除去泥沙,并防止苯甲酸晶体低温析出而损失
(1)重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
【讨论】
泥沙难溶于水,氯化钠易溶于水,苯甲酸的溶解度受温度影响比较大。
步骤:加少量热水溶解,趁热过滤,除去泥沙,冷却结晶,过滤。
(2)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
玻璃棒:加热溶解——搅拌,加速苯甲酸溶解
过滤——引流
取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,证明NaCl已经被除净。
(4)如何检验提纯后的苯甲酸中氯化钠已经被除净?
不纯固体物质
残渣
(不溶性杂质)
滤液
母液
(可溶性杂质和部分被提纯物)
晶体
(产品)
加热溶解
冷却,结晶,过滤,洗涤,干燥
趁热过滤
(4)模型构建
蒸发结晶
降温结晶
结晶
将溶剂蒸发获取晶体,
此法适用于溶解度随温度变化不大的物质,
如粗盐的提纯。
将热的饱和溶液慢慢冷却后析出晶体,
此法适用于溶解度随温度变化较大的物质、含结晶水物质、受热易分解的物质。
如氯化钠和硝酸钾的分离。
拓展延伸
根据右图信息,下列实验的步骤是什么?
1.提纯KNO3、NaCl (少量)混合物中KNO3
2.提纯NaCl、KNO3 (少量)混合物中NaCl
溶解,蒸发结晶,趁热过滤,
这样首先析出的是NaCl,少量的KNO3仍残留在热的溶液中。
溶解,蒸发浓缩(目的:形成热的饱和溶液),
冷却结晶,过滤得到KNO3晶体,
杂质NaCl留在滤液中。
1.一种溶质
(1)S随T变化小—蒸发结晶
(2)
①S随T变化大
②含结晶水
③受热分解
蒸发浓缩、冷却结晶、过滤(KNO3、Na2CO3·10H2O等)
2.二种溶质,其中一种为少量杂质
主物质
(1)S随T变化大—蒸发浓缩、冷却结晶、过滤(如KNO3中少量NaCl)
(2)S随T变化小—蒸发结晶、趁热过滤(NaCl中少量KNO3)
3.二种溶质,大量共存
蒸发浓缩、趁热过滤
滤渣(S随T变化小的,NaCl)
滤液
冷却结晶、过滤
滤渣(S随T变化大的,KNO3)
归纳总结
色谱法起源于20世纪初,1906年俄国植物学家米哈伊尔·茨维特用碳酸钙填充竖立的玻璃管,以石油醚洗脱植物色素的提取液,经过一段时间洗脱之后,植物色素在碳酸钙柱中实现分离,
由一条色带分散为数条平行的色带,从而分离得到了三种色素。茨维特将这种分离、提纯有机物的方法命名为色谱法。
25年后德国化学家库恩再分离、提纯胡萝卜素异构体和维生素结构中,应用色谱法,获得了1938年诺贝尔化学奖。
此后,色谱法成为分离、提纯有机物必不可少的方法。并发展出了纸上色谱法、薄层色谱法、气相色谱法和液相色谱法等。
【科学·技术·社会】
二、确定实验式
有机物(纯净)
确定 分子式
?
首先要确定有机物中含有哪些元素
如何利用实验的方法确定有机物中C、H、O各元素的质量分数?
定量分析:
用化学方法鉴定有机物所含元素。
1、原理:将一定量的有机化合物燃烧,转化为简单的无机化合物(C-CO2,H-H2O)并通过测定无机物的质量,计算出该有机化合物分子内各元素原子的最简整数比,确定实验式(也称最简式)
定性分析:
鉴定分子内各元素原子的质量分数。
元素分析
2、元素分析方法:
①李比希元素分析法
②现代元素分析仪
①李比希法简易装置图:
原理:
一定量有机物[含C、H、(O)]
CuO
氧化
H2O
CO2
无水CaCl2吸收
浓KOH吸收
反应前后装置质量差
计算
C、H
元素
质量
用C、H、O元素原子个数比确定实验式
依据总质量减去C、H元素质量确定是否有O元素
H2O
CO2
一定量
有机物
燃烧氧化
H2O
CO2
碱液吸收
m2
干燥剂
吸收
m1
计算C、H含量
计算O含量
得出实验式
“李比希元素分析法”的原理:
【例1】含C、H、O三元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.2%,氢的质量分数为13.1%。试求该未知物A的实验式。
(2)计算该有机化合物分子内各元素原子的个数比:
【解】
(1)计算该有机化合物中氧元素的质量分数:
ω(O)=100%-52.2%-13.1%=34.7%
N(C):N(H):N(O)=
52.2%
12.01
13.1%
1.008
34.7%
16.00
:
:
=2:6:1
【答】该未知物A的实验式为C2H6O。
: 可以直接测出有机物中各元素原子的质量分数
②现代元素分析仪
知道实验式,若要确定分子式,需要什么条件?
三、确定分子式
元素定量分析
实验式
各组成原子的最简整数比
其中最精确、快捷的方法
相对分子质量
质谱法
质谱仪
相
对
丰
度
质荷比
横轴:最右边离子峰(即质荷比最大的峰)就是未知物的相对分子质量
怎样读图?
相对分子质量
质荷比最大的就是其相对分子质量
(1)定义法:M = m / n
(3)标况下有机物蒸气的密度为ρ g/L
(2)根据有机物蒸气的相对密度D
D =
=
M = 22.4L/mol× ρ g/L
(4)利用各类有机物的分子通式及相应的化学反应方程式
回顾所学知识,还有哪些方法可以求相对分子质量?
二甲醚
乙醇
写出C2H6O可能的结构:
依据质谱图:未知物A的相对分子质量为46,实验式C2H6O的相对分子质量是46,
M=[M (C2H6O)] ×n, n=1,所以未知物A的实验式 和分子式都是C2H6O
怎样确定有机物A是二甲醚,还是乙醇?
四、确定分子结构
确定官能团和化学键的类型
1、红外光谱
未知物A的红外光谱
红外光谱仪
【例2】下图是分子式为C3H6O2的有机物的红外光谱谱图,推测其结构。
CH3—C—O—CH3
O
核磁共振仪
(1)原理:处于不同化学环境中的氢原子因产生共振时吸收电磁波的频率不同,相应的信号在谱图中出现的位置也不同,具有不同的化学位移(用δ表示),而且吸收峰的面积与氢原子数成正比。
(2)应用:确定机化合物分子中有几种不同类型的氢原子
以及它们的相对数目等信息。
吸收峰数目=等效氢的种数
峰强度 (峰面积或峰高)之比=
不同等效氢的个数之比
2、核磁共振氢谱(HNMR)
未知物A的核磁共振氢谱
二甲醚的核磁共振氢谱
由未知物A(分子式为C2H6O )的核磁共振氢谱图,可以判断:
A的分子中有3中处于不同化学环境的氢原子,
个数比为3:2:1。
CH3OCH3(二甲醚)分子中的6个氢原子的化学环境相同,
对应的核磁共振氢谱图中只有一个峰
【例3】有机物的相对分子质量为70,红外光谱表征到碳碳双键和羰基的存在,该有机物的分子式 。核磁共振谱列如下图,写出可能的结构简式 。
C4H6O
CH2=CHCOCH3
3种氢原子
吸收峰数目3种
官能团:C=C,C=O
CH2=C(CH3)CHO
3、X射线衍射
(2) X射线衍射图
经过计算可获得分子结构的有关数据,如 、 等,用于有机化合物 的测定。
(1) 原理
X射线是一种波长很短的 ,它和晶体中的原子相互作用可以产生 。
电磁波
衍射图
键长
键角
晶体结构
目前,X射线衍射已成为物质结构测定的一种重要技术。
中国科学院上海有机化学研究所和中国中医研究院中药研究所等单位的科学家们通过元素分析和质谱法分析,确定青蒿素的相对分子质量为282,分子式为C15H22O5。 经红外光谱和核磁共振谱分析,确定青嵩素分子中含有酯基和甲基等结构片段。通过化学反应证明其分子中含有过氧基(—O—O—)。1975年底, 我国科学家通过X射线衍射最终测定了青蒿素的分子结构。
青蒿素分子结构的确定
【科学 技术 社会】
第二节 研究有机化合物的一般方法
第一章 有机化合物的结构特点与研究方法
李时珍在《本草纲目》中记载,槟榔有“下水肿、通关节、健脾调中、治心痛积聚”等诸多病症。
槟榔是我国的四大南药之一
如果你是化学家,你该如何来研究槟榔中的有机化合物?一般的步骤和方法是什么?
有机物(粗品)
提取有效成分
获得晶体
测定结构
合成与修饰
广泛应用
Tu Youyou searched ancient literature on herbal medicine in her quest to develop novel malaria therapies. The plant Artemisia annua turned out to be an interesting candidate, and Tu developed a purification procedure, which rendered the active agent, Artemisinin, a drug that is remarkably effective against Malaria.
2015年
诺贝尔
生理学或医学奖
怎样研究有机化合物?有哪些基本步骤?
分离、提纯
确定实验式
确定分子式
确定分子结构
元素定量分析
质谱法
测量相对分子质量
波谱分析:
质谱
红外光谱
核磁共振氢谱
x射线衍射谱
分离、提纯原理:
利用有机物与杂质的物理性质的差异将它们分离。
分离、提纯方法:
蒸馏、萃取、分液、重结晶等
【思考与讨论】
一、分离、提纯
1、蒸馏
(2)条件:
(1)原理:
工业乙醇
工业乙醇95.6%
无水乙醇99.5%以上
蒸馏
蒸馏
吸水剂
③有机物与杂质的沸点相差较大(一般约大于30 ℃)
①液体有机物中含有少量杂质
②有机物热稳定性较强
利用沸点差异分离液体混合物。
冷凝管
蒸馏烧瓶
锥形瓶
温度计
碎瓷片或沸石
进水
出水
牛角管(尾接管)
石棉网
熟记图中主要仪器的名称
气化
冷凝
冷凝
接收
(3)蒸馏装置
(4)注意事项:整体-局部:由下到上,由左到右
①使用前要检查装置的气密性;
②加热时应垫石棉网;
③烧瓶中放少量沸石或碎瓷片(防止暴沸);
④蒸馏烧瓶中所盛液体体积:1/3≤V≤2/3;
⑤温度计水银球的位置在蒸馏烧瓶支管口处;
⑥冷凝管中水的流向:下进上出;
⑦用锥形瓶收集馏分(蒸馏所得的产品)。
思考:1、先加热还是先通冷凝水?
酒精灯迟到早退、冷凝水早出晚归
2、实验中若发现未加沸石,应如何处理?
立即停止加热,冷却后,补加沸石。
球形冷凝管
用于冷凝回流沸点高的液体。
蛇形冷凝管
用于冷凝回流沸点低的液体。
直形冷凝管,多用于蒸馏操作。
直形冷凝管(横着用)
球形冷凝管
(竖着用)
蛇形冷凝管
(竖着用)
例如
注意二者的区别
拓展归纳
泡茶
煲汤
利用混合物中一种溶质在互不相溶的两种溶剂中的溶解性不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法。
(1)根据萃取剂的类别,将萃取进行简单分类:
①液—液萃取:是利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂的过程。
②固—液萃取:是用有机溶剂从固体物质中溶解出有机物的过程 。(专用仪器设备)
2、萃取
——萃取用的溶剂
(2)萃取剂
选择条件:
①萃取剂与原溶剂互不相溶、不发生化学反应
②溶质不与萃取剂发生任何反应
③溶质在两溶剂中的溶解度有较大差别(在萃取剂中的溶解度大)
常用萃取剂:
密度小于水的:苯、乙醚、乙酸乙酯;
密度大于水的:氯仿、四氯化碳等
分液漏斗(梨形),烧杯,铁架台
(3)主要仪器:
静置分层
分液
振荡
装液
(4)操作步骤:
瓶塞(玻璃塞): 凹槽、小孔
①分液漏斗内液体的总体积不超过容积的2/3.
②分液漏斗下端尖嘴部分紧靠烧杯内壁。
③分液时应打开上口的玻璃塞或使塞上的凹槽对准漏斗口上的小孔,使液体能够顺利滴下;
④下层液体从下口放出,及时关闭下口活塞;
上层液体从上口倒出。
(5)注意事项:
(1)适用范围:
提纯固体有机化合物的常用方法
(2)溶剂要求:
②被提纯的有机化合物在此溶剂中的溶解度受温度影响较大,能够冷却结晶
①杂质在此溶剂中溶解度很小或者很大,易于除去。
如果重结晶所得的晶体纯度不能达到要求,可以再次进行重结晶以提高产物的纯度。
利用被提纯物质与杂质在同一溶剂中的溶解度不同而将其杂质除去的方法。
3、重结晶
【问题】某粗苯甲酸样品中含有少量氯化钠和泥沙,提纯苯甲酸需要经过哪些步骤?
温度/℃ 25 50 75
溶解度/g 0.34 0.85 2.2
【资料】苯甲酸可用作食品防腐剂。纯净的苯甲酸为无色结晶,其结构可表示为 , 熔点122℃,沸点249℃。苯甲酸微溶于水,易溶于乙醇等有机溶剂。苯甲酸在水中的溶解度如下
重结晶法提纯苯甲酸
(3)探究——案例分析
【实验】
(1)观察粗苯甲酸样品的状态。
(2)将1g粗苯甲酸放入100mL烧杯,加入50mL蒸馏水。加热,搅拌,使粗苯甲酸充分溶解。
(3)使用漏斗趁热将溶液过滤至另一烧杯中,将滤液静置,使其缓慢冷却结晶。
(4)待滤液完全冷却后滤出晶体,并用少量蒸馏水洗涤。将晶体铺在干燥的滤纸上,晾干后称其质量。
加热溶解
趁热过滤
冷却结晶
加热:使苯甲酸溶解。
趁热过滤:除去泥沙,并防止苯甲酸晶体低温析出而损失
(1)重结晶法提纯苯甲酸的原理是什么?有哪些主要操作步骤?
【讨论】
泥沙难溶于水,氯化钠易溶于水,苯甲酸的溶解度受温度影响比较大。
步骤:加少量热水溶解,趁热过滤,除去泥沙,冷却结晶,过滤。
(2)溶解粗苯甲酸时加热的作用是什么?趁热过滤的目的是什么?
(3)实验操作中多次使用了玻璃棒,分别起到了哪些作用?
玻璃棒:加热溶解——搅拌,加速苯甲酸溶解
过滤——引流
取少量晶体溶于水,加入硝酸酸化的硝酸银溶液,若无白色沉淀生成,证明NaCl已经被除净。
(4)如何检验提纯后的苯甲酸中氯化钠已经被除净?
不纯固体物质
残渣
(不溶性杂质)
滤液
母液
(可溶性杂质和部分被提纯物)
晶体
(产品)
加热溶解
冷却,结晶,过滤,洗涤,干燥
趁热过滤
(4)模型构建
蒸发结晶
降温结晶
结晶
将溶剂蒸发获取晶体,
此法适用于溶解度随温度变化不大的物质,
如粗盐的提纯。
将热的饱和溶液慢慢冷却后析出晶体,
此法适用于溶解度随温度变化较大的物质、含结晶水物质、受热易分解的物质。
如氯化钠和硝酸钾的分离。
拓展延伸
根据右图信息,下列实验的步骤是什么?
1.提纯KNO3、NaCl (少量)混合物中KNO3
2.提纯NaCl、KNO3 (少量)混合物中NaCl
溶解,蒸发结晶,趁热过滤,
这样首先析出的是NaCl,少量的KNO3仍残留在热的溶液中。
溶解,蒸发浓缩(目的:形成热的饱和溶液),
冷却结晶,过滤得到KNO3晶体,
杂质NaCl留在滤液中。
1.一种溶质
(1)S随T变化小—蒸发结晶
(2)
①S随T变化大
②含结晶水
③受热分解
蒸发浓缩、冷却结晶、过滤(KNO3、Na2CO3·10H2O等)
2.二种溶质,其中一种为少量杂质
主物质
(1)S随T变化大—蒸发浓缩、冷却结晶、过滤(如KNO3中少量NaCl)
(2)S随T变化小—蒸发结晶、趁热过滤(NaCl中少量KNO3)
3.二种溶质,大量共存
蒸发浓缩、趁热过滤
滤渣(S随T变化小的,NaCl)
滤液
冷却结晶、过滤
滤渣(S随T变化大的,KNO3)
归纳总结
色谱法起源于20世纪初,1906年俄国植物学家米哈伊尔·茨维特用碳酸钙填充竖立的玻璃管,以石油醚洗脱植物色素的提取液,经过一段时间洗脱之后,植物色素在碳酸钙柱中实现分离,
由一条色带分散为数条平行的色带,从而分离得到了三种色素。茨维特将这种分离、提纯有机物的方法命名为色谱法。
25年后德国化学家库恩再分离、提纯胡萝卜素异构体和维生素结构中,应用色谱法,获得了1938年诺贝尔化学奖。
此后,色谱法成为分离、提纯有机物必不可少的方法。并发展出了纸上色谱法、薄层色谱法、气相色谱法和液相色谱法等。
【科学·技术·社会】
二、确定实验式
有机物(纯净)
确定 分子式
?
首先要确定有机物中含有哪些元素
如何利用实验的方法确定有机物中C、H、O各元素的质量分数?
定量分析:
用化学方法鉴定有机物所含元素。
1、原理:将一定量的有机化合物燃烧,转化为简单的无机化合物(C-CO2,H-H2O)并通过测定无机物的质量,计算出该有机化合物分子内各元素原子的最简整数比,确定实验式(也称最简式)
定性分析:
鉴定分子内各元素原子的质量分数。
元素分析
2、元素分析方法:
①李比希元素分析法
②现代元素分析仪
①李比希法简易装置图:
原理:
一定量有机物[含C、H、(O)]
CuO
氧化
H2O
CO2
无水CaCl2吸收
浓KOH吸收
反应前后装置质量差
计算
C、H
元素
质量
用C、H、O元素原子个数比确定实验式
依据总质量减去C、H元素质量确定是否有O元素
H2O
CO2
一定量
有机物
燃烧氧化
H2O
CO2
碱液吸收
m2
干燥剂
吸收
m1
计算C、H含量
计算O含量
得出实验式
“李比希元素分析法”的原理:
【例1】含C、H、O三元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为52.2%,氢的质量分数为13.1%。试求该未知物A的实验式。
(2)计算该有机化合物分子内各元素原子的个数比:
【解】
(1)计算该有机化合物中氧元素的质量分数:
ω(O)=100%-52.2%-13.1%=34.7%
N(C):N(H):N(O)=
52.2%
12.01
13.1%
1.008
34.7%
16.00
:
:
=2:6:1
【答】该未知物A的实验式为C2H6O。
: 可以直接测出有机物中各元素原子的质量分数
②现代元素分析仪
知道实验式,若要确定分子式,需要什么条件?
三、确定分子式
元素定量分析
实验式
各组成原子的最简整数比
其中最精确、快捷的方法
相对分子质量
质谱法
质谱仪
相
对
丰
度
质荷比
横轴:最右边离子峰(即质荷比最大的峰)就是未知物的相对分子质量
怎样读图?
相对分子质量
质荷比最大的就是其相对分子质量
(1)定义法:M = m / n
(3)标况下有机物蒸气的密度为ρ g/L
(2)根据有机物蒸气的相对密度D
D =
=
M = 22.4L/mol× ρ g/L
(4)利用各类有机物的分子通式及相应的化学反应方程式
回顾所学知识,还有哪些方法可以求相对分子质量?
二甲醚
乙醇
写出C2H6O可能的结构:
依据质谱图:未知物A的相对分子质量为46,实验式C2H6O的相对分子质量是46,
M=[M (C2H6O)] ×n, n=1,所以未知物A的实验式 和分子式都是C2H6O
怎样确定有机物A是二甲醚,还是乙醇?
四、确定分子结构
确定官能团和化学键的类型
1、红外光谱
未知物A的红外光谱
红外光谱仪
【例2】下图是分子式为C3H6O2的有机物的红外光谱谱图,推测其结构。
CH3—C—O—CH3
O
核磁共振仪
(1)原理:处于不同化学环境中的氢原子因产生共振时吸收电磁波的频率不同,相应的信号在谱图中出现的位置也不同,具有不同的化学位移(用δ表示),而且吸收峰的面积与氢原子数成正比。
(2)应用:确定机化合物分子中有几种不同类型的氢原子
以及它们的相对数目等信息。
吸收峰数目=等效氢的种数
峰强度 (峰面积或峰高)之比=
不同等效氢的个数之比
2、核磁共振氢谱(HNMR)
未知物A的核磁共振氢谱
二甲醚的核磁共振氢谱
由未知物A(分子式为C2H6O )的核磁共振氢谱图,可以判断:
A的分子中有3中处于不同化学环境的氢原子,
个数比为3:2:1。
CH3OCH3(二甲醚)分子中的6个氢原子的化学环境相同,
对应的核磁共振氢谱图中只有一个峰
【例3】有机物的相对分子质量为70,红外光谱表征到碳碳双键和羰基的存在,该有机物的分子式 。核磁共振谱列如下图,写出可能的结构简式 。
C4H6O
CH2=CHCOCH3
3种氢原子
吸收峰数目3种
官能团:C=C,C=O
CH2=C(CH3)CHO
3、X射线衍射
(2) X射线衍射图
经过计算可获得分子结构的有关数据,如 、 等,用于有机化合物 的测定。
(1) 原理
X射线是一种波长很短的 ,它和晶体中的原子相互作用可以产生 。
电磁波
衍射图
键长
键角
晶体结构
目前,X射线衍射已成为物质结构测定的一种重要技术。
中国科学院上海有机化学研究所和中国中医研究院中药研究所等单位的科学家们通过元素分析和质谱法分析,确定青蒿素的相对分子质量为282,分子式为C15H22O5。 经红外光谱和核磁共振谱分析,确定青嵩素分子中含有酯基和甲基等结构片段。通过化学反应证明其分子中含有过氧基(—O—O—)。1975年底, 我国科学家通过X射线衍射最终测定了青蒿素的分子结构。
青蒿素分子结构的确定
【科学 技术 社会】
