5.2.1.氮及其氧化物、氨气及铵盐、硝酸 课件(共102张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2.1.氮及其氧化物、氨气及铵盐、硝酸 课件(共102张PPT)2022-2023学年下学期高一化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 61.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-10-01 16:01:13 | ||
图片预览









文档简介
(共102张PPT)
第1课时 氮气与氮的固定
一氧化氮和二氧化氮
第五章 第二节 氮及其化合物
-3
0
+2
+4
+5
氢化物
单质
氧化物
酸
碱
盐
NH3
N2
NO 2 、N2O4
N2O
HNO3
HNO2
NO3-
NO2-
+3
NH3·H2O
氮元素的价类二维图
+1
NO
N2O3
N2O5
NH4+
学习目标
动植物蛋白质
土壤海洋中硝酸盐和铵盐
空气中的氮气
自然界中的氮元素
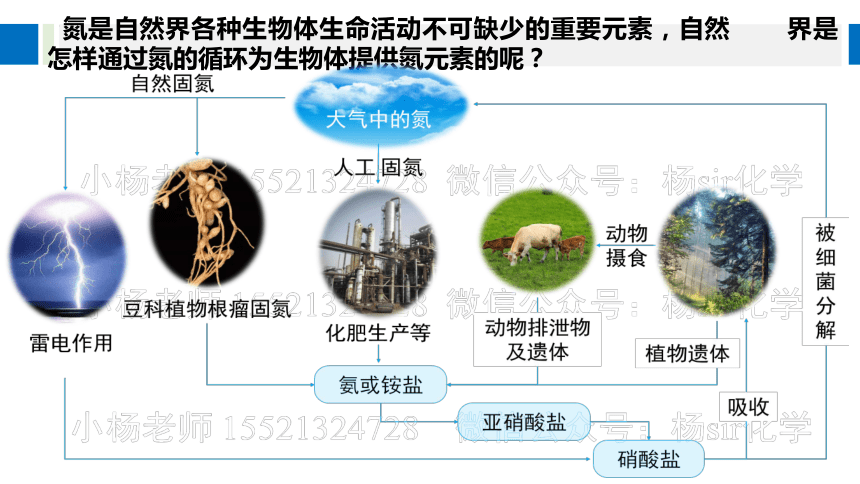
氮是自然界各种生物体生命活动不可缺少的重要元素,自然 界是怎样通过氮的循环为生物体提供氮元素的呢?
氮的固定:
将大气中游离态的氮转化为氮的化合物的过程。
思考:NH3→NH3·H2O能称为氮的固定吗?
分类
自然固氮
高能固氮(如雷雨天气N2转化为NO)
生物固氮(如豆科植物的根瘤菌固氮)
人工固氮
合成氨(工业上合成氨)
仿生固氮(某些金属有机化合物可起到根瘤菌的作用)
一、氮气与氮的固定
在超临界状态下,通过氮气物理发泡将颠覆性的弹力赋能于鞋中底,带来高回弹缓震功能,能量回归率达86.8%;
一整杯氮气啤酒里面,大约会产生3000000 个氮气气泡,口感丝滑。
氮气是惰性气体,化学性质很稳定,能更好的保存啤酒自身风味,
①游离态:在自然界里,氮元素主要以氮分子的形式存在于空气中
②化合态:部分存在于生物的蛋白质中、以及土壤、海洋中的硝酸盐和铵盐。
二 氮元素的存在及氮气物理性质
物理性质:
无色无味的气体,密度比空气略小,难溶于水,熔点、沸点比O2的低。
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/cm3
思考:如何收集氮气?
只能用排水法
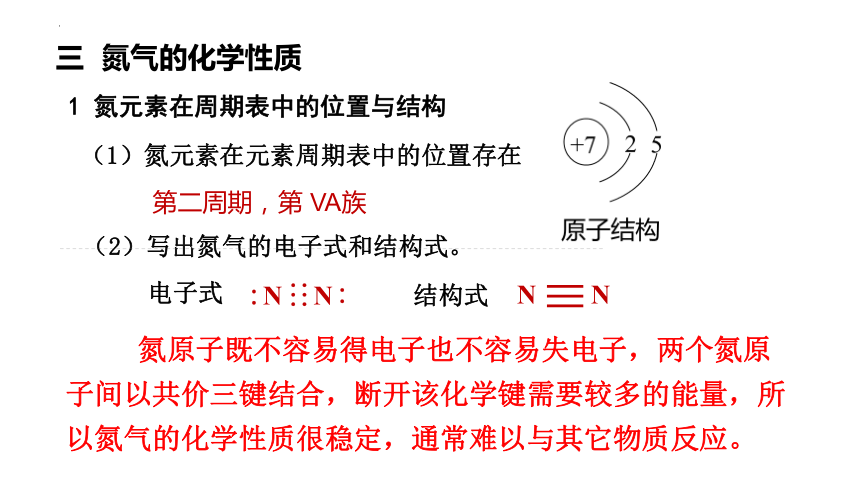
(1)氮元素在元素周期表中的位置存在
第二周期,第 VA族
(2)写出氮气的电子式和结构式。
电子式
结构式
N
N
N
N
氮原子既不容易得电子也不容易失电子,两个氮原子间以共价三键结合,断开该化学键需要较多的能量,所以氮气的化学性质很稳定,通常难以与其它物质反应。
1 氮元素在周期表中的位置与结构
三 氮气的化学性质
(1)非金属单质通性(分类观)
①与金属反应
②与非金属反应(H2、O2)
2 从物质类别视角预测氮气的化学性质(氮气是常见的非金属单质)
N2 + 3Mg Mg3N2
点燃
N2 + O2 2NO
高温或放电
N2 + 3H2 2NH3
高温、高压
催化剂
①还原性
②氧化性
a 在点燃条件下与 Mg 反应:
b N2 与 H2 反应生成 NH3 :
N2 + O2 2NO
高温或放电
N2 + 3Mg Mg3N2
点燃
N2 + 3H2 2NH3
高温、高压
催化剂
在高温、放电等条件下,氮分子获得了足够的能量,使氮氮三键断裂,氮气能够与镁、氧气、氢气等物质发生化合反应。
(2) 从化合价升降的角度预测(价态观)
氮气有何应用?
电灯泡、食品包装
——保护气
降温手术刀
——冷刀做手术
稀有的书卷保存
——延缓代谢
认识氮的氧化物
氧化物
化合价
N2O
NO
N2O3
NO2
N2O4
N2O5
+1
+2
+3
+4
+4
+5
酸性氧化物:
1、与水反应生成酸
2、与碱反应只生成一种盐和水
3、与碱性氧化物生成盐
注意:
(1)这些氧化物中只有N2O3 、N2O5是酸性氧化物,其余均为不成盐氧化物。氮的氧化物都有毒。
(2)N2O俗称“笑气”,为无色有甜味的气体,广泛应用于医药麻醉、食品加工等生产生活领域。
酸酐:某含氧酸脱去一分子水或几分子水,所剩下的部分称为该酸的酸酐,其酸酐中决定酸性的元素的化合价不变。只有含氧酸才有酸酐,无氧酸是没有酸酐的。
H2SO4、H2SO3、HNO3、HNO2、H2SiO3、H2CO3
SO3
SO2
N2O5
N2O3
SiO2
CO2
思考:二氧化氮是硝酸的酸酐吗?为什么?
哪种氧化物是亚硝酸(HNO2)的酸酐?
注意:酸酐和对应酸中的非金属元素,化合价相同。
硝酸的酸酐是N2O5
N2O3
四、一氧化氮和二氧化氮
1 物理性质
物质 颜色 状态 气味 毒性 水溶性
NO _____ 气体 _____ 有毒 ___溶于水
NO2 _______ 气体 ______ 有毒 ___溶于水
无色
无味
不
红棕色
刺激性
易
NO中毒原理:与CO相似,是通过呼吸道被人体吸入后与血红蛋白结合,使其失去携带O2的能力,导致中毒。
收集
排水法
向上排气
2 化学性质
实验操作 现象 结论
在一支50mL的注射器里充入20 mLNO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。
打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹,观察现象。振荡注射器,再观察现象。
2NO + O2 = 2NO2
无明显现象
NO不溶于水也不与水反应
气体由无色变红棕色。
震荡后气体由红棕色变无色
3NO2 + H2O =
2HNO3 + NO
思考:如果要使NO全部转化为硝酸,NO和O2又应满足怎样的比例关系?
4NO + 3O2 + 2H2O = 4HNO3
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
①
②
①×3 + ②×2得(消去NO2)
思考:通过反应可以看出,NO2直接与水反应是无法全部转化为硝酸的,如果要将NO2全部转化为HNO3,应采取什么措施?
思考:具体NO2和O2应满足怎样的比例关系?
4NO2 + O2 + 2H2O = 4HNO3
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
①
②
① + ②×2得(消去NO)
氮的氧化物溶于水剩余气体计算的原理:
氮的氧化物溶于水的问题首先看清原理实质,无论是单一气体 ( NO2 ),还是 NO、NO2、O2 中的两者或三者的混合气体溶于水,反应的实质是:
3NO2 + H2O = 2HNO3 + NO 2NO + O2 = 2NO2
故若有气体剩余只能是 NO 或 O2 ,不可能是NO2。
①NO2和O2的混合气体
②NO和O2的混合气体
(1)关系式法
③ NO2、NO、O2三种混合气体通入水中:
a.可先将NO和O2转化为NO2,再按上述各种情况分别处理。
b.也可先将NO2和H2O反应转化为NO,再按4NO+3O2+2H2O=4HNO3情况处理。
(2)电子守恒法
NO与O2的混合气体通入水中发生反应:2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,在这当中,存在着NO向NO2转化、NO2向HNO3转化的同时又生成NO的循环反应。但总体来讲,NO→HNO3,N的化合价升高是由于被O2氧化,因此可写出
(3) 原子守恒法(原子个数比法)
N(N):O(O)
<2:5
=2:5
>2:5
O2剩余
NO剩余
恰好完全反应
4NO2+O2和4NO+3O2从组成上均相当于2N2O5的组成,都与N2O5+H2O=2HNO3等效。当NO、NO2、O2的混合气体溶于水时利用混合气体中N、O原子个数比进行分析判断。
类型一:单一气体反应求体积:
1.一定条件下,将盛有12mL N0和NO2 混合气的试管到立于盛满水的水槽中,充分反应后,容器内残留6 mL的气体,则原混合气中NO与 NO 的体积比为 ( )
A.1 :3 B 3:1 C.2:3 D.3:4
A
类型2 混合气体反应求体积
2.将盛有12 mL NO 和 02混合气体的量筒倒立于盛满水的水槽中,充分反应后,量筒内还剩余2mL无色气体 则原混合气中02的体积为 ( )
A.1.5 mL B.2.4 mL C.3.6 mL D.4 mL
D
类型3混合气完全反应求体积
3.将amL一氧化氮、b mL二氧化氮、x mL氧气混合于同一试管里,将试管口倒插于水中,充分反应后试管内气体全部消失,则用 a、b表示的x的代数式是
类型4 气体溶于水求物质的浓度
4.标准状况下,在一不规则的玻璃容器内充满NO2气体后,将其倒置于水槽中,假设容器中的物质不扩散至容器外,则充分反应后容器中所得溶液的物质的量浓度近似:
A.1.0mol/L B.0.045mol/L C.0.02mol/L D.0.12mol/L
B
思考:如何检验NO、NO2?
NO的检验方法:向气体中通入少量O2或空气,气体由无色变为红棕色,则该气体为NO
NO2的检验方法:将其通入水中,若看到红棕色褪去,而在瓶口又可以重新出现红棕色,则该气体为NO2
思考:NO2和溴蒸气都是红棕色、有刺激性气味的气体,怎样加以区别?
由于NO2和Br2在性质上有不少相似性:①均具有氧化性;②溶于水均有酸生成;③均可与碱反应;④均为红棕色等。
所以不能用淀粉-KI试纸、pH试纸、NaOH溶液鉴别,但二者性质又有差别。
可用下列方法鉴别:①AgNO3溶液;②CCl4;③用水洗法。
(1) 加有机溶剂(如汽油,苯,四氯化碳等),有机层变橙红色的是溴蒸气,无变化的是NO2
(2) 加水,能使水变黄的是溴蒸气,无明显现象的是NO2 (NO2溶于水的颜色不变)
(3) 加硝酸银溶液,产生淡黄色沉淀(AgBr)的是溴蒸气,无明显现象的是NO2
煤、石油和某些金属矿物中含有硫,在燃烧或冶炼时往往会生成二氧化硫。在机动车发动机中,燃料燃烧产生的高温条件会使空气中的氮气与氧气反应,生成氮氧化物。它们会引起呼吸道疾病,危害人体健康,严重时会使人死亡。
阅读课本P16 了解二氧化硫、氮的氧化物和酸雨的产生及危害。
1.空气中SO2和NO2的主要来源
(1)SO2 主要来自于化石燃料的燃烧、( 如煤与石油 ) 含硫金属的冶炼以及制造硫酸、磷肥等产生的废气。
(2)NO2 主要来自于汽车尾气 。汽车尾气中除含有氮氧化物外,还含有一氧化碳、未燃烧的碳氢化合物、含铅化合物和颗粒等,严重污染大气,破坏环境。
我们面临着严峻的大气污染,SO2 和 NO2 是主要的污染物。
2.危害
(1)SO2和NO2是主要的大气污染物,它们能直接危害人体健康,引起呼吸道疾病;溶于水形成酸雨;
(2)氮氧化物的危害
①光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
②酸雨:NOx排入大气中,与水反应生成HNO3和HNO2
③破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
④NO与血红蛋白结合使人中毒。
3.酸雨的危害及防治措施
(1)正常雨水由于溶解了二氧化碳,其pH约为5.6,酸雨是指pH<5.6的雨、雾等形式的降水,主要由大气污染物中硫、氮的氧化物所致。
(2)形成原理
①硫酸型酸雨
②硝酸型酸雨
饮用酸化的地下水危害人类
腐蚀建筑物和工业设备
破坏土壤成分使农作物减产甚至死亡
损坏植物叶面导致森林死亡
破坏露天文物古迹
使湖泊中鱼虾死亡
(3)酸雨的危害:
①直接破坏农作物、草原、森林,使土壤、湖泊酸化;
②加速建筑物、桥梁、工业设备、运输工具及电信电缆的腐蚀。
(4)防治措施
b.研究煤的脱硫技术,改进燃烧装置和燃烧技术,减少二氧化硫和氮氧化物的排放;如选洗加工、综合开发、在煤中加入适量的生石灰、对排放的烟进行处理等
a.调整能源结构,积极开发新能源,发展清洁能源;
c.加强工厂废气的回收处理;
d.改进汽车尾气的处理技术,控制汽车尾气的排放标准。
e.种植能够吸收SO2的有关树木(如臭椿、垂柳、柳杉)等
环境问题 主要污染物 主要危害
温室效应 CO2 造成全球气候变暖,水位上升,陆地面积减小。气候干早,土地沙漠化,农业减产
酸雨 SO2、NOx 土壤酸化、水源污染、建筑物被腐蚀等
臭氧层 破坏 氟氯代烷、NOx 到达地球表面的紫外线明显增多,给人类健康(皮肤癌)及生态环境带来多方面危害
光化学 烟雾 碳氢化合物、NOx 刺激人体器官,特别是人的呼吸系统,使人生病甚至死亡
常见环境问题
环境问题 主要污染物 主要危害
白色污染 废弃塑料制品 ①在土壤中影响农作物吸收水分和养分,导致农作物减产。
②混入生活垃圾中难处理、难回收。
③易被动物当作食物吞入,导致动物死亡。
赤潮和 水华 废水中含氮、磷元素的营养物质 使水体富营养化,导致水中藻类疯长,消耗水中溶解的氧,使水体变得浑浊、水质恶化
PM2.5 颗粒物 污染空气,形成雾霾天气,增加交通事故,危害人体健康
资料卡:1998年诺贝尔奖获得者伊格纳罗发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆等功能,成为当前生命科学的研究热点,NO亦称为“明星分子”。
最新研究表明:NO吸收治疗方法可快速改善SARS重症患者的缺氧状况,缓解病情。病毒学研究同时证实,NO对SASR病毒有直接的抑制作用。
第2课时 氨和铵盐
第五章 第二节 氮及其化合物
学习目标
1.通过观察与实验了解氨气的物理性质;认识氨气、铵盐的化学性质,学会氨气的实验室制取、收集、检验的方法。
2.知道铵根离子的检验方法。
学习目标
1.通过对氨的实验室制法的学习,掌握制备气体的流程,培养学生“证据推理与模型认知”的学科素养。
2.通过氮肥能提高粮食产量解决饥饿问题,让学生感悟化学和技术对社会发展的巨大贡献。培养学生“科学态度与社会责任”的学科素养。
素养目标
情景导学
2010年广西北海市一座冷冻厂氨气罐的一个截止阀发生泄漏,大量氨气泄出,厂区周围均可闻到刺鼻的味道。在事故现场,消防官兵利用水枪对不断泄漏的氨气进行稀释。从新闻可知氨气有哪些物理性质?
思考·交流
1、为什么在氨气泄漏时工厂里会寒气逼人?
2、如何吸收弥漫在空气中的大量氨气?
3、被围困在污染区的群众怎样做才能不吸入氨气?
新知讲授
颜色 气味 状态 密度 溶解性 沸点
无色 刺激性 气体
一 氨的物理性质
比空气小
极易溶于水(约1:700)
低,易液化
思考:如何设计实验证明极易溶于水?
氨气易液化变为液氨,液氨汽化时会吸收大量的热,使周围温度急剧降低,液氨用作制冷剂。
实验验证:喷泉实验
向下排空气法
练习应用
1. 如图所示:烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )
A.a为HCl气体,b为H2O
B. a为CO2气体,b为浓NaOH溶液
C. a为Cl2气体,b为饱和NaCl溶液
D. a为Cl2气体,b为浓NaOH溶液
C
(1)与水反应
部分电离:NH3·H2O
NH4++OH-
NH3+H2O
NH3·H2O(一水合氨)
① NH3·H2O为可溶性一元弱碱,能使红色石蕊试纸变蓝。
二 氨的化学性质
1 从物质的类别角度预测NH3有哪些化学性质(NH3是碱性气体)
② NH3·H2O不稳定,易分解。
△
NH3·H2O = NH3↑+H2O
思考:氯气溶于水的混合溶液叫氯水,将氨气溶于水的混合溶液?
试剂特点:易挥发,不稳定,易分解。
保存方法:密封保存,置于阴凉处。
氨气的水溶液(俗称氨水)显弱碱性,能使酚酞溶液变红或使红色石蕊试纸变蓝。
氨水的成分:
分子:NH3·H2O、NH3、H2O
离子:NH4+、OH-、H+(极少量)
【思考】氨水、一水合氨、液氨有何区别?
名称 液氨 氨水 一水合氨
物质类别 纯净物 氢化物 非电解质 混合物 氨的水溶液 溶质为氨气 纯净物
一元弱碱
电解质
粒子种类
主要性质 不导电 不具有碱性 能导电 具有碱性 极易分解
具有碱性
存在条件 常温常压 下不存在 常温常压 下可存在 常温常压
下不存在
NH3
NH3·H2O
NH3·H2O、NH3、H2O、
NH4+ 、OH-、H+
注意:
a 在进行氨水溶质的质量分数、物质的量浓度计算时,以NH3为溶质。
b 氨水的密度小于水的密度,氨水的浓度越大,密度越小。
思考:1mol/L的氨水,是指NH3 H2O的浓度为1mol/L吗?
不是,是指溶液中NH3 、NH3 H2O、NH4+的浓度之和为1mol/L
想一想:氨水是弱碱,对吗?
氨水呈弱碱性
【实验5-6】氨与氯化氢的反应
操作
现象
解释
蘸有浓盐酸和浓氨水的玻璃棒靠近会产生大量白烟
浓氨水挥发出的NH3与浓盐酸挥发出HCl相遇形成NH4Cl固体
(2)氨气与酸反应
氨与酸的反应规律
氨几乎能与所有的酸(难溶性酸如H2SiO3除外)反应生成盐,如:
NH3 + HCl = NH4Cl
NH3 + HNO3 = NH4NO3
2NH3 + H2SO4 = (NH4)2SO4
【思考】是不是所有的浓酸遇到浓氨水,都能产生白烟?
不是,只有挥发性酸(HCl、HNO3等)遇氨气均有白烟生成;难挥发性酸H2SO4、H3PO4无此现象。
可用于NH3的检验:将一根蘸有浓盐酸的玻璃棒置于集气瓶口。
情景导学
2NH3 + 3Cl2 = N2+ 6HCl
NH3 + HCl =NH4Cl
(产生白烟现象)
管道工人用浓氨水检验氯气管道是否漏气,如果管道某处漏气,会产生白色烟雾,原理是什么
(3)氨气与盐溶液反应
可溶性的铝盐和过量的氨水反应。
应用:实验室制备Al(OH)3
3NH3·H2O+AlCl3=Al(OH)3↓+3NH4Cl
(1) 氨的还原性
(工业制硝酸的基础)
①催化氧化:
③与氯气反应:
2NH3 + 3Cl2 = N2+ 6HCl
8NH3 + 3Cl2 = N2+ 6NH4Cl
④与CuO反应:
2NH3 + 3CuO === N2+ 3H2O+Cu
(氨气少量)
(氨气足量)
此反应为浓氨水检验氯气管道是否泄漏
2 从化合价升降角度预测NH3有哪些化学性质
黑色固体变为红色,
生成气体无毒
4NH3 + 3O2 === 2N2+ 6H2O
点燃
②氨气在纯氧中燃烧:
【思考】从化合价的角度分析在一定条件下氨气能否和一氧化氮、二氧化氮反应,写出可能发生的反应。
4NH3+5NO=5N2+6H2O
8NH3+6NO2=7N2+12H2O
(治理NOx污染)
①反应原理:
②制取装置:固固加热装置
③收集方法:向下排空气法(导管要伸入到接近试管底部)
④验满方法:将湿润的红色石蕊试纸放在试管口
⑤棉花作用:减少NH3与空气的对流,吸收多余的NH3,防止污染空气
三、氨气的实验室制法
碱石灰:在NaOH的浓溶液中加入CaO,加热制成的白色固体即为碱石灰。
⑥ 干燥方法(用碱石灰)
注意:NH3不可用中性的无水CaCl2干燥,因为CaCl2可与NH3反应生成CaCl2·8NH3;也不能用酸性干燥剂(浓硫酸、P2O5、硅胶)
⑦ 尾气处理:
水或酸溶液
(防倒吸)
肚容式 倒立漏斗式 安全瓶 隔离式
思考(1)实验室能否用加热氯化铵的方法制取氨气
不能。氯化铵受热分解生成的氨气和氯化氢遇冷会重新结合生成氯化铵,得不到氨气。
(2)实验室还可以用什么方法快速制备少量氨气?
a 不能用NH4NO3,因为NH4NO3受热爆炸
b Ca(OH)2不能用KOH或NaOH代替,因两者易吸湿,易结块,不利于产生NH3,且高温下腐蚀试管
c Ca(OH)2不能用NaOH溶液代替,因NH3极易溶于水
氨气的实验室制法:快速简易制法
方法一:加热浓氨水
氨水易挥发,且氨水中的NH3·H2O受热易分解,因此可由加热浓氨水的方法获得NH3。
NH3·H2O == NH3↑+H2O
方法二:浓氨水+固体CaO(或NaOH)
CaO作用:①吸水;②吸水后放热促进NH3逸出;③增大溶液中的OH 浓度,减少NH3的溶解
NH3·H2O+CaO=NH3↑+Ca(OH)2
NaOH作用:NaOH固体溶于水放热,促进NH3·H2O分解;且OH 浓度的增大有利于NH3的逸出
⑧ 氨气的工业制法
高温高压
催化剂
N2+3H2 2NH3
NH3
硝酸
铵盐
纯碱
有机合成工业原料
用稀氨水治疗
蚊虫叮咬
消除
二氧化氮
的污染
吸收硫酸
生产中的
二氧化硫
制冷剂
NH3+H2O+SO2=NH4HSO3
四、氨的用途和保存:
五、 铵盐
1、概念:由铵根离子(NH4+)和酸根离子构成的化合物
如:NH4Cl、(NH4)2SO4、 NH4NO3
2、物理性质:一般铵盐都是白色或无色晶体且易溶于水
情景导学
有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?
铵盐是农业上常用的化肥,如(NH4)2SO4、NH4HCO3、NH4NO3、 NH4Cl等。
NH4HCO3 NH3↑ + CO2 ↑ + H2O
△
不稳定性
3、 化学性质:
①受热易分解
NH4HCO3==NH3↑+CO2↑+H2O
特点:挥发性酸(如HCl、H2CO3等)形成的铵盐,受热时分解为氨和对应的酸。
NH4NO3==N2O↑+2H2O
NH4Cl == NH3↑ + HCl↑
5NH4NO3=4N2+2HNO3+9H2O
2NH4NO3=2N2+O2+4H2O
3(NH4)2SO4 = 3SO2↑+6H2O+N2↑+ 4NH3↑
特点:氧化性酸(如HNO3、H2SO4等)形成的铵盐,受热时发生氧化还原反应,一般不产生氨气。
注意:并不是所有铵盐分解都产生氨气
铵盐受热分解的产物
(1)如果组成铵盐的酸是易挥发或易分解的酸,则固体铵盐受热分解时,氨气与酸一起挥发,冷却时又重新结合成铵盐。如NH4Cl、NH4HCO3等。
(2)如果组成铵盐的酸是难挥发性酸,则固体铵盐受热分解时,只有氨呈气态逸出,而难挥发性酸残留在容器中,如(NH4)2SO4分解的化学方程式为(NH4)2SO4 NH3↑+NH4HSO4 或
(NH4)2SO4 2NH3↑+H2SO4。
(3)如果组成铵盐的酸是具有强氧化性的酸,则在较低的温度下慢慢分解可得到NH3和相应的酸,如NH4NO3。由于生成的氨气具有还原性,硝酸具有氧化性,生成的NH3易被HNO3氧化,则反应时的温度不同,形成氮的化合物也不同,如将NH4NO3在不同的温度下加热分解分别可得到N2O、NO2、N2O3、N2等。
【思考】碘受热会升华,遇冷又会凝结成碘单质。加热试管中的氯化铵晶体,气体在试管上方又变成氯化铵晶体,二者原理相同吗?
分别用试管加热氯化铵和单质碘时,都由固体变为气体,而在试管口遇冷又凝结为固体,其本质不同,前者为化学变化,后者为物理变化。
情境:铵态氮肥(铵盐)不能与草木灰(碱性)混合使用,否则会降低肥效,这是为什么?
与碱反应
② 与碱反应
特点:在水溶液中、固相反应中均可发生
应用:检验铵根离子、制氨气
反应原理:
强碱制弱碱
铵盐与强碱浓溶液或稀溶液加热:NH4++ OH-=NH3↑+H2O
铵盐与强碱稀溶液不加热:NH4++OH- = NH3·H2O
铵盐都可与碱溶液反应生成NH3·H2O(弱碱),加热生成NH3和H2O
实验:铵根离子的检验
学以到用:NH4+的检验
固体
液体
取少量样品于研钵中,加入固体碱进行研磨。若闻到氨的刺激性气味,则样品中含有NH4+
取少量样品与碱混合于试管中,加热后,将湿润的红色石蕊试纸放在试管口,若红色石蕊试纸变蓝,则样品中含有NH4+
取少量溶液于试管中,加入浓碱溶液,微热,将湿润的红色石蕊试纸放在试管口,若红色石蕊试纸变蓝,则样品中含有NH4+
(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生)
大部分铵盐都不能与酸反应,但(NH4)2CO3和NH4HCO3能与酸反应生成CO2
③ 铵盐与酸反应
(NH4)2CO3+2HCl = 2NH4Cl+H2O+CO2↑
NH4HCO3+HCl = NH4Cl+H2O+CO2↑
铵盐在工业、农业生产中也有着重要的用途。大量的铵盐用作氮肥,硝酸氨还可用作炸药,氯化铵常用作印染和制作干电池的原料,它也用在金属焊接上除去金属表面的氧化物薄层(焊药)。
4、 铵盐的用途:
练习应用
例. 下列离子方程式正确的是( )
A.实验室用氯化铵和熟石灰制氨气:NH4+ + OH- NH3↑+ H2O
B.NaOH与NH4Cl溶液混合加热:NH4+ + OH- NH3 H2O
C.氨水中加盐酸:NH3 H2O + H+ = NH4+ + H2O
D.氨水中通入过量CO2:CO2 + NH3 H2O = 2NH4+ + CO32- + H2O
C
△
△
练习应用
例、实验室制取氨、收集、验证其还原性并进行尾气处理的装置和原理能达到实验目的的是 ( )
A.用装置甲制取氨
B.用装置乙收集氨时气体应该从a口进b口出
C.装置丙中黑色固体变成红色时还原产物一定为铜
D.可以用装置丁吸收氨,进行尾气处理
B
第3课时 硝酸 酸雨及防治
第五章 第二节 氮及其化合物
学习目标
情景导学
2010年12月在甘肃兰州高速公路G22线,一辆运输硝酸的铝槽车发生泄露事故,现场可闻到刺鼻的气味,同时大量红棕色烟雾。消防人员通过喷洒水稀释和运来纯碱进行处理,以便防止其扩散并污染黄河。
【思考】①为什么现场有大量红棕色的烟雾?
②金属可以与酸反应,为什么可以用铝槽车运输浓硝酸?
颜色 气味 状态 溶解性 挥发性
无色 刺激性 液体 与水任意比互溶
一 硝酸的物理性质
易挥发,在空气中形成白雾
【思考】浓硝酸久置后呈黄色,为什么?
质量分数为69%的硝酸为浓硝酸;质量分数为98%以上的硝酸为“发烟硝酸”
一般将浓硝酸保存在棕色试剂瓶中,并避光放置于阴凉处
1 从物质类别角度预测(具有酸的通性)
与紫色石蕊试液
与金属反应(能放出H2?)
与某些金属氧化物起反应
与碱起反应
与某些盐起反应
2HNO3+CuO=Cu(NO3)2+H2O
2HNO3 +CaCO3=Ca(NO3)2 +CO2↑+ H2O
HNO3+NaOH=NaNO3+H2O
二 硝酸的化学性质
稀硝酸使紫色石蕊试剂变红;
浓硝酸使紫色石蕊试剂先变红,后褪色。
2 从氧化还原角度预测(具有强氧化性)
Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
② 与Cu反应
(1)硝酸能与大部分金属反应(除了铂、金),将金属氧化为高价态金属的硝酸盐。但在常温下,浓硝酸能使铁、铝钝化。
① 常温下浓硝酸能使Fe、Al发生钝化.
加热时:
Fe + 6HNO3(浓) === Fe(NO3)3 + 3NO2↑ + 3H2O
△
(Fe少量)
(Fe过量)
3Fe + 8HNO3 === 3Fe(NO3)2 + 2NO↑ + 4H2O
△
实验探究
【实验5-8】硝酸与铜反应
实验装置
实验现象
加浓硝酸时,铜丝变细,产生红棕色气体,溶液呈绿色
加稀硝酸时,铜丝变细,产生无色气泡,试管上部观察到浅红棕色,溶液呈蓝色
【思考】写出铜与浓硫酸的反应方程式。对比铜与硝酸的反应,你能发现什么规律?
硝酸反应规律:
(1)硝酸的浓度越大,反应温度越高,其氧化性越强,还原剂一般被氧化为最高价态。
(2)浓硝酸的还原产物是NO2,稀硝酸的还原产物是NO,极稀硝酸可能变成N2、N2O、NH4NO3等。
(3) HNO3与金属反应一般不能产生H2(浓、稀硝酸都具有强氧化性)
氧化性:浓硝酸>稀硝酸(均比浓硫酸强)
C + 4HNO3(浓) === CO2↑ + 4NO2↑ + 2H2O
△
S + 6HNO3(浓) === H2SO4 + 6NO2↑ + 2H2O
△
(2)硝酸能与非金属反应
反应规律:热的浓硝酸可将非金属单质(碳、硫、磷等)氧化为最高价氧化物或最高价含氧酸。
(3) 与还原性物质反应
H2S,I-,Br -,SO2,SO32-,Fe2+等易被HNO3氧化
3Fe2+ + NO3-+4 H+ = 3Fe3+ + NO↑+ 2H2O
3SO32- +2H++NO3-= 3SO4 2- + 2NO↑+H2O
3 硝酸的特性(见光或受热易分解产生红棕色气体)
不稳定性,见光或受热易分解
4HNO3 4NO2↑ + O2↑ + 2H2O
光照或加热
硝酸的保存:一般将浓硝酸保存在棕色试剂瓶中,并避光放置于阴凉处。
硝酸泄漏
【思考】①在运输硝酸的铝槽车发生泄露的事故现场,为什么有大量红棕色的烟雾?
②金属可以与酸反应,为什么可以用铝槽车运输浓硝酸?
思考③:硝酸是无色、易挥发、有刺激性气味的液体。为什么久置的硝酸会变为黄色?如何去除硝酸的黄色?
浓硝酸不稳定,见光或受热会分解生成NO2,NO2溶于浓硝酸使溶液显黄色。
向浓硝酸中通入氧气(或空气)
4NO2+O2+2H2O=4HNO3
去除硝酸的黄色方法:
思考④:铜投入稀硫酸中不会溶解,再向溶液中投入KNO3固体,铜会不会溶解 为什么
会溶解。
NO3-的强氧化性:在H+的环境下有强氧化性,中性或碱性环境下无氧化性。
重要的化工产品,又是重要的化工原料,主要用于医药、炸药(TNT)、染料、化肥等,化学试剂
三 硝酸的用途
第一阶段:工业合成氨
第二阶段: 氨的催化氧化:4NH3+5O2=4NO+6H2O
第三阶段: NO2的生成和吸收:
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
尾气处理:
NaOH溶液
四 硝酸的工业制法
补充:“三酸(浓盐酸、浓硫酸、浓硝酸)变稀”问题辨析。
①浓盐酸与足量的二氧化锰反应时,浓盐酸浓度逐渐变小,变为稀盐酸时不再与二氧化锰反应。
②浓硫酸与足量的铜反应时,浓硫酸浓度逐渐变小,变为稀硫酸时不再与铜反应。
③浓硝酸与足量的铜反应时,浓硝酸浓度逐渐变小,变为稀硝酸时,还原产物发生改变,生成NO。
①物性:硝酸盐均为易溶于水的晶体
②化性:不稳定,易分解
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、H、Cu、Hg、Ag
亚硝酸盐
O2
氧化物
NO2
O2
金属
NO2
O2
2KNO3 == 2KNO2 + O2↑
2Cu(NO3)2 == 2CuO + 4NO2↑+ O2↑
2AgNO3 == 2Ag + 2NO2↑+ O2↑
分解规律:
补充:硝酸盐
a、由于硝酸盐(s)在高温时受热易分解出O2,故硝酸盐在高温时是强氧化剂。(硫酸根)b、硝酸盐(aq)在酸性条件下的水溶液中,有强氧化性。 (硫酸根不具有)③硝酸盐的氧化性问题:在KNO3溶液中,加入稀硫酸再加入铜片有何现象?④NO3-的检验
步骤:硝酸盐(若是溶液要浓缩)加入浓硫酸、铜片加热
现象与结论:若有红棕色气体,证明有NO3-
反应原理(方程式):
NaNO3+H2SO4 == NaHSO4+HNO3↑
微热
Cu+ HNO3(浓) →
4 Cu(NO3)2+2NO2↑ +2H2O
劳厄和弗兰克,曾获得1914年和1925年的物理学奖,德国纳粹政府要没收他们的诺贝尔奖牌,他们辗转来到丹麦,请求丹麦同行、1922年物理学奖得主玻尔帮忙保存。1940年,纳粹德国占领丹麦,受人之托的玻尔急得团团转。同在实验室工作的一位匈牙利化学家赫维西(1943年化学奖得主)帮他想了个好主意:将奖牌放入“王水” 中,纯金奖牌便溶解了。玻尔于是将溶液瓶放在实验室架子上,来搜查的纳粹士兵果然没有发现这一秘密。战争结束后,溶液瓶里的黄金被还原后送到斯德哥尔摩,按当年的模子重新铸造,于1949年完璧归赵。
能使不溶于硝酸的金属如金、铂等溶解。
浓硝酸和浓盐酸按体积比为1∶3混合得到的混合物。
王 水
【资料卡片】
记忆方法 :“三言(盐)一笑(硝)”
思考讨论
1.加入浓硝酸时生成的红棕色气体是什么?写出反应的化学方程式。
2.加入稀硝酸时,产生的无色气体是什么?在试管上部为什么气体的颜色由无色变为红棕色?写出上述反应过程的化学方程式。
根据浓硝酸、稀硝酸分别与铜的反应观察到实验现象,思考讨论下列问题:
3Cu+8HNO3(稀) === 3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓) === Cu(NO3)2+2NO2↑+2H2O
2NO+O2===2NO2
3.装置中NaOH溶液的作用是什么?写出NO2与NaOH溶液反应的化学方程式。
答:吸收氮氧化物,以防污染环境;2NO2+2NaOH=NaNO3+NaNO2+H2O。
深度思考
2.试着写出少量/过量Fe粉分别于稀硝酸反应的方程式。
Fe + 4HNO3(稀) == Fe(NO3)3 + NO↑ + 2H2O ( Fe少量)
3Fe+ 8HNO3(稀) == 3Fe(NO3)2 + 2NO↑ + 4H2O ( Fe过量)
1.①将足量的铜加入一定体积的浓HNO3中,最终得到气体的成分是什么?为什么?
答:NO2和NO的混合气体;原因是Cu与浓HNO3反应生成NO2,随着反应的进行,HNO3的浓度变小,Cu再与稀HNO3反应生成NO。
Fe + 4H+ + NO3- == Fe3+ + NO↑ + 2H2O ( Fe少量)
3Fe + 8H+ + 2NO3- == Fe2+ + 2NO↑ + 4H2O ( Fe少量)
②将足量的铜加入一定体积的浓HNO3中,反应停止后,如果在溶液中再加入足量稀硫酸会出现什么情况
答:溶液中存在NO3-,它遇到H+后,会继续氧化铜。
练习应用
下述实验中均有红棕色气体产生,对比分析所得结论不正确的是 ( )
① ② ③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
D
练习应用
【思考】在pH=1 溶液中,能大量共存的离子组是( )
A. NH4+、I- 、NO3-、Br- B. S2-、Na+ 、SO32 - 、NO3-
C. Cu2+、NO3-、Na+ 、Cl- D. Fe2+ 、K+ 、NO3- 、SO42–
在酸性溶液中(H+),NO3-具有强氧化性,与S2-、SO32- 、I- 、Fe2+、Br- 等不能共存。
C
思考讨论
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示:
N2
H2
O2
O2
H2O
NH3
NO
NO2
HNO3
(1) 写出每一步反应的化学方程式。
(2) 请分析上述反应中的物质类别和氮元素化合价的变化情况,以及每一步反应中含氮物质发生的是氧化反应还是还原反应。
第1课时 氮气与氮的固定
一氧化氮和二氧化氮
第五章 第二节 氮及其化合物
-3
0
+2
+4
+5
氢化物
单质
氧化物
酸
碱
盐
NH3
N2
NO 2 、N2O4
N2O
HNO3
HNO2
NO3-
NO2-
+3
NH3·H2O
氮元素的价类二维图
+1
NO
N2O3
N2O5
NH4+
学习目标
动植物蛋白质
土壤海洋中硝酸盐和铵盐
空气中的氮气
自然界中的氮元素
氮是自然界各种生物体生命活动不可缺少的重要元素,自然 界是怎样通过氮的循环为生物体提供氮元素的呢?
氮的固定:
将大气中游离态的氮转化为氮的化合物的过程。
思考:NH3→NH3·H2O能称为氮的固定吗?
分类
自然固氮
高能固氮(如雷雨天气N2转化为NO)
生物固氮(如豆科植物的根瘤菌固氮)
人工固氮
合成氨(工业上合成氨)
仿生固氮(某些金属有机化合物可起到根瘤菌的作用)
一、氮气与氮的固定
在超临界状态下,通过氮气物理发泡将颠覆性的弹力赋能于鞋中底,带来高回弹缓震功能,能量回归率达86.8%;
一整杯氮气啤酒里面,大约会产生3000000 个氮气气泡,口感丝滑。
氮气是惰性气体,化学性质很稳定,能更好的保存啤酒自身风味,
①游离态:在自然界里,氮元素主要以氮分子的形式存在于空气中
②化合态:部分存在于生物的蛋白质中、以及土壤、海洋中的硝酸盐和铵盐。
二 氮元素的存在及氮气物理性质
物理性质:
无色无味的气体,密度比空气略小,难溶于水,熔点、沸点比O2的低。
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/cm3
思考:如何收集氮气?
只能用排水法
(1)氮元素在元素周期表中的位置存在
第二周期,第 VA族
(2)写出氮气的电子式和结构式。
电子式
结构式
N
N
N
N
氮原子既不容易得电子也不容易失电子,两个氮原子间以共价三键结合,断开该化学键需要较多的能量,所以氮气的化学性质很稳定,通常难以与其它物质反应。
1 氮元素在周期表中的位置与结构
三 氮气的化学性质
(1)非金属单质通性(分类观)
①与金属反应
②与非金属反应(H2、O2)
2 从物质类别视角预测氮气的化学性质(氮气是常见的非金属单质)
N2 + 3Mg Mg3N2
点燃
N2 + O2 2NO
高温或放电
N2 + 3H2 2NH3
高温、高压
催化剂
①还原性
②氧化性
a 在点燃条件下与 Mg 反应:
b N2 与 H2 反应生成 NH3 :
N2 + O2 2NO
高温或放电
N2 + 3Mg Mg3N2
点燃
N2 + 3H2 2NH3
高温、高压
催化剂
在高温、放电等条件下,氮分子获得了足够的能量,使氮氮三键断裂,氮气能够与镁、氧气、氢气等物质发生化合反应。
(2) 从化合价升降的角度预测(价态观)
氮气有何应用?
电灯泡、食品包装
——保护气
降温手术刀
——冷刀做手术
稀有的书卷保存
——延缓代谢
认识氮的氧化物
氧化物
化合价
N2O
NO
N2O3
NO2
N2O4
N2O5
+1
+2
+3
+4
+4
+5
酸性氧化物:
1、与水反应生成酸
2、与碱反应只生成一种盐和水
3、与碱性氧化物生成盐
注意:
(1)这些氧化物中只有N2O3 、N2O5是酸性氧化物,其余均为不成盐氧化物。氮的氧化物都有毒。
(2)N2O俗称“笑气”,为无色有甜味的气体,广泛应用于医药麻醉、食品加工等生产生活领域。
酸酐:某含氧酸脱去一分子水或几分子水,所剩下的部分称为该酸的酸酐,其酸酐中决定酸性的元素的化合价不变。只有含氧酸才有酸酐,无氧酸是没有酸酐的。
H2SO4、H2SO3、HNO3、HNO2、H2SiO3、H2CO3
SO3
SO2
N2O5
N2O3
SiO2
CO2
思考:二氧化氮是硝酸的酸酐吗?为什么?
哪种氧化物是亚硝酸(HNO2)的酸酐?
注意:酸酐和对应酸中的非金属元素,化合价相同。
硝酸的酸酐是N2O5
N2O3
四、一氧化氮和二氧化氮
1 物理性质
物质 颜色 状态 气味 毒性 水溶性
NO _____ 气体 _____ 有毒 ___溶于水
NO2 _______ 气体 ______ 有毒 ___溶于水
无色
无味
不
红棕色
刺激性
易
NO中毒原理:与CO相似,是通过呼吸道被人体吸入后与血红蛋白结合,使其失去携带O2的能力,导致中毒。
收集
排水法
向上排气
2 化学性质
实验操作 现象 结论
在一支50mL的注射器里充入20 mLNO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。
打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹,观察现象。振荡注射器,再观察现象。
2NO + O2 = 2NO2
无明显现象
NO不溶于水也不与水反应
气体由无色变红棕色。
震荡后气体由红棕色变无色
3NO2 + H2O =
2HNO3 + NO
思考:如果要使NO全部转化为硝酸,NO和O2又应满足怎样的比例关系?
4NO + 3O2 + 2H2O = 4HNO3
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
①
②
①×3 + ②×2得(消去NO2)
思考:通过反应可以看出,NO2直接与水反应是无法全部转化为硝酸的,如果要将NO2全部转化为HNO3,应采取什么措施?
思考:具体NO2和O2应满足怎样的比例关系?
4NO2 + O2 + 2H2O = 4HNO3
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
①
②
① + ②×2得(消去NO)
氮的氧化物溶于水剩余气体计算的原理:
氮的氧化物溶于水的问题首先看清原理实质,无论是单一气体 ( NO2 ),还是 NO、NO2、O2 中的两者或三者的混合气体溶于水,反应的实质是:
3NO2 + H2O = 2HNO3 + NO 2NO + O2 = 2NO2
故若有气体剩余只能是 NO 或 O2 ,不可能是NO2。
①NO2和O2的混合气体
②NO和O2的混合气体
(1)关系式法
③ NO2、NO、O2三种混合气体通入水中:
a.可先将NO和O2转化为NO2,再按上述各种情况分别处理。
b.也可先将NO2和H2O反应转化为NO,再按4NO+3O2+2H2O=4HNO3情况处理。
(2)电子守恒法
NO与O2的混合气体通入水中发生反应:2NO+O2=2NO2、3NO2+H2O=2HNO3+NO,在这当中,存在着NO向NO2转化、NO2向HNO3转化的同时又生成NO的循环反应。但总体来讲,NO→HNO3,N的化合价升高是由于被O2氧化,因此可写出
(3) 原子守恒法(原子个数比法)
N(N):O(O)
<2:5
=2:5
>2:5
O2剩余
NO剩余
恰好完全反应
4NO2+O2和4NO+3O2从组成上均相当于2N2O5的组成,都与N2O5+H2O=2HNO3等效。当NO、NO2、O2的混合气体溶于水时利用混合气体中N、O原子个数比进行分析判断。
类型一:单一气体反应求体积:
1.一定条件下,将盛有12mL N0和NO2 混合气的试管到立于盛满水的水槽中,充分反应后,容器内残留6 mL的气体,则原混合气中NO与 NO 的体积比为 ( )
A.1 :3 B 3:1 C.2:3 D.3:4
A
类型2 混合气体反应求体积
2.将盛有12 mL NO 和 02混合气体的量筒倒立于盛满水的水槽中,充分反应后,量筒内还剩余2mL无色气体 则原混合气中02的体积为 ( )
A.1.5 mL B.2.4 mL C.3.6 mL D.4 mL
D
类型3混合气完全反应求体积
3.将amL一氧化氮、b mL二氧化氮、x mL氧气混合于同一试管里,将试管口倒插于水中,充分反应后试管内气体全部消失,则用 a、b表示的x的代数式是
类型4 气体溶于水求物质的浓度
4.标准状况下,在一不规则的玻璃容器内充满NO2气体后,将其倒置于水槽中,假设容器中的物质不扩散至容器外,则充分反应后容器中所得溶液的物质的量浓度近似:
A.1.0mol/L B.0.045mol/L C.0.02mol/L D.0.12mol/L
B
思考:如何检验NO、NO2?
NO的检验方法:向气体中通入少量O2或空气,气体由无色变为红棕色,则该气体为NO
NO2的检验方法:将其通入水中,若看到红棕色褪去,而在瓶口又可以重新出现红棕色,则该气体为NO2
思考:NO2和溴蒸气都是红棕色、有刺激性气味的气体,怎样加以区别?
由于NO2和Br2在性质上有不少相似性:①均具有氧化性;②溶于水均有酸生成;③均可与碱反应;④均为红棕色等。
所以不能用淀粉-KI试纸、pH试纸、NaOH溶液鉴别,但二者性质又有差别。
可用下列方法鉴别:①AgNO3溶液;②CCl4;③用水洗法。
(1) 加有机溶剂(如汽油,苯,四氯化碳等),有机层变橙红色的是溴蒸气,无变化的是NO2
(2) 加水,能使水变黄的是溴蒸气,无明显现象的是NO2 (NO2溶于水的颜色不变)
(3) 加硝酸银溶液,产生淡黄色沉淀(AgBr)的是溴蒸气,无明显现象的是NO2
煤、石油和某些金属矿物中含有硫,在燃烧或冶炼时往往会生成二氧化硫。在机动车发动机中,燃料燃烧产生的高温条件会使空气中的氮气与氧气反应,生成氮氧化物。它们会引起呼吸道疾病,危害人体健康,严重时会使人死亡。
阅读课本P16 了解二氧化硫、氮的氧化物和酸雨的产生及危害。
1.空气中SO2和NO2的主要来源
(1)SO2 主要来自于化石燃料的燃烧、( 如煤与石油 ) 含硫金属的冶炼以及制造硫酸、磷肥等产生的废气。
(2)NO2 主要来自于汽车尾气 。汽车尾气中除含有氮氧化物外,还含有一氧化碳、未燃烧的碳氢化合物、含铅化合物和颗粒等,严重污染大气,破坏环境。
我们面临着严峻的大气污染,SO2 和 NO2 是主要的污染物。
2.危害
(1)SO2和NO2是主要的大气污染物,它们能直接危害人体健康,引起呼吸道疾病;溶于水形成酸雨;
(2)氮氧化物的危害
①光化学烟雾:NOx在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
②酸雨:NOx排入大气中,与水反应生成HNO3和HNO2
③破坏臭氧层:NO2可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
④NO与血红蛋白结合使人中毒。
3.酸雨的危害及防治措施
(1)正常雨水由于溶解了二氧化碳,其pH约为5.6,酸雨是指pH<5.6的雨、雾等形式的降水,主要由大气污染物中硫、氮的氧化物所致。
(2)形成原理
①硫酸型酸雨
②硝酸型酸雨
饮用酸化的地下水危害人类
腐蚀建筑物和工业设备
破坏土壤成分使农作物减产甚至死亡
损坏植物叶面导致森林死亡
破坏露天文物古迹
使湖泊中鱼虾死亡
(3)酸雨的危害:
①直接破坏农作物、草原、森林,使土壤、湖泊酸化;
②加速建筑物、桥梁、工业设备、运输工具及电信电缆的腐蚀。
(4)防治措施
b.研究煤的脱硫技术,改进燃烧装置和燃烧技术,减少二氧化硫和氮氧化物的排放;如选洗加工、综合开发、在煤中加入适量的生石灰、对排放的烟进行处理等
a.调整能源结构,积极开发新能源,发展清洁能源;
c.加强工厂废气的回收处理;
d.改进汽车尾气的处理技术,控制汽车尾气的排放标准。
e.种植能够吸收SO2的有关树木(如臭椿、垂柳、柳杉)等
环境问题 主要污染物 主要危害
温室效应 CO2 造成全球气候变暖,水位上升,陆地面积减小。气候干早,土地沙漠化,农业减产
酸雨 SO2、NOx 土壤酸化、水源污染、建筑物被腐蚀等
臭氧层 破坏 氟氯代烷、NOx 到达地球表面的紫外线明显增多,给人类健康(皮肤癌)及生态环境带来多方面危害
光化学 烟雾 碳氢化合物、NOx 刺激人体器官,特别是人的呼吸系统,使人生病甚至死亡
常见环境问题
环境问题 主要污染物 主要危害
白色污染 废弃塑料制品 ①在土壤中影响农作物吸收水分和养分,导致农作物减产。
②混入生活垃圾中难处理、难回收。
③易被动物当作食物吞入,导致动物死亡。
赤潮和 水华 废水中含氮、磷元素的营养物质 使水体富营养化,导致水中藻类疯长,消耗水中溶解的氧,使水体变得浑浊、水质恶化
PM2.5 颗粒物 污染空气,形成雾霾天气,增加交通事故,危害人体健康
资料卡:1998年诺贝尔奖获得者伊格纳罗发现少量的NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记忆等功能,成为当前生命科学的研究热点,NO亦称为“明星分子”。
最新研究表明:NO吸收治疗方法可快速改善SARS重症患者的缺氧状况,缓解病情。病毒学研究同时证实,NO对SASR病毒有直接的抑制作用。
第2课时 氨和铵盐
第五章 第二节 氮及其化合物
学习目标
1.通过观察与实验了解氨气的物理性质;认识氨气、铵盐的化学性质,学会氨气的实验室制取、收集、检验的方法。
2.知道铵根离子的检验方法。
学习目标
1.通过对氨的实验室制法的学习,掌握制备气体的流程,培养学生“证据推理与模型认知”的学科素养。
2.通过氮肥能提高粮食产量解决饥饿问题,让学生感悟化学和技术对社会发展的巨大贡献。培养学生“科学态度与社会责任”的学科素养。
素养目标
情景导学
2010年广西北海市一座冷冻厂氨气罐的一个截止阀发生泄漏,大量氨气泄出,厂区周围均可闻到刺鼻的味道。在事故现场,消防官兵利用水枪对不断泄漏的氨气进行稀释。从新闻可知氨气有哪些物理性质?
思考·交流
1、为什么在氨气泄漏时工厂里会寒气逼人?
2、如何吸收弥漫在空气中的大量氨气?
3、被围困在污染区的群众怎样做才能不吸入氨气?
新知讲授
颜色 气味 状态 密度 溶解性 沸点
无色 刺激性 气体
一 氨的物理性质
比空气小
极易溶于水(约1:700)
低,易液化
思考:如何设计实验证明极易溶于水?
氨气易液化变为液氨,液氨汽化时会吸收大量的热,使周围温度急剧降低,液氨用作制冷剂。
实验验证:喷泉实验
向下排空气法
练习应用
1. 如图所示:烧瓶中充满干燥气体a,将胶头滴管中的液体b挤入烧瓶内,轻轻震荡烧瓶,然后打开弹簧夹,烧杯中的液体呈喷泉状喷出,则a、b不可能是( )
A.a为HCl气体,b为H2O
B. a为CO2气体,b为浓NaOH溶液
C. a为Cl2气体,b为饱和NaCl溶液
D. a为Cl2气体,b为浓NaOH溶液
C
(1)与水反应
部分电离:NH3·H2O
NH4++OH-
NH3+H2O
NH3·H2O(一水合氨)
① NH3·H2O为可溶性一元弱碱,能使红色石蕊试纸变蓝。
二 氨的化学性质
1 从物质的类别角度预测NH3有哪些化学性质(NH3是碱性气体)
② NH3·H2O不稳定,易分解。
△
NH3·H2O = NH3↑+H2O
思考:氯气溶于水的混合溶液叫氯水,将氨气溶于水的混合溶液?
试剂特点:易挥发,不稳定,易分解。
保存方法:密封保存,置于阴凉处。
氨气的水溶液(俗称氨水)显弱碱性,能使酚酞溶液变红或使红色石蕊试纸变蓝。
氨水的成分:
分子:NH3·H2O、NH3、H2O
离子:NH4+、OH-、H+(极少量)
【思考】氨水、一水合氨、液氨有何区别?
名称 液氨 氨水 一水合氨
物质类别 纯净物 氢化物 非电解质 混合物 氨的水溶液 溶质为氨气 纯净物
一元弱碱
电解质
粒子种类
主要性质 不导电 不具有碱性 能导电 具有碱性 极易分解
具有碱性
存在条件 常温常压 下不存在 常温常压 下可存在 常温常压
下不存在
NH3
NH3·H2O
NH3·H2O、NH3、H2O、
NH4+ 、OH-、H+
注意:
a 在进行氨水溶质的质量分数、物质的量浓度计算时,以NH3为溶质。
b 氨水的密度小于水的密度,氨水的浓度越大,密度越小。
思考:1mol/L的氨水,是指NH3 H2O的浓度为1mol/L吗?
不是,是指溶液中NH3 、NH3 H2O、NH4+的浓度之和为1mol/L
想一想:氨水是弱碱,对吗?
氨水呈弱碱性
【实验5-6】氨与氯化氢的反应
操作
现象
解释
蘸有浓盐酸和浓氨水的玻璃棒靠近会产生大量白烟
浓氨水挥发出的NH3与浓盐酸挥发出HCl相遇形成NH4Cl固体
(2)氨气与酸反应
氨与酸的反应规律
氨几乎能与所有的酸(难溶性酸如H2SiO3除外)反应生成盐,如:
NH3 + HCl = NH4Cl
NH3 + HNO3 = NH4NO3
2NH3 + H2SO4 = (NH4)2SO4
【思考】是不是所有的浓酸遇到浓氨水,都能产生白烟?
不是,只有挥发性酸(HCl、HNO3等)遇氨气均有白烟生成;难挥发性酸H2SO4、H3PO4无此现象。
可用于NH3的检验:将一根蘸有浓盐酸的玻璃棒置于集气瓶口。
情景导学
2NH3 + 3Cl2 = N2+ 6HCl
NH3 + HCl =NH4Cl
(产生白烟现象)
管道工人用浓氨水检验氯气管道是否漏气,如果管道某处漏气,会产生白色烟雾,原理是什么
(3)氨气与盐溶液反应
可溶性的铝盐和过量的氨水反应。
应用:实验室制备Al(OH)3
3NH3·H2O+AlCl3=Al(OH)3↓+3NH4Cl
(1) 氨的还原性
(工业制硝酸的基础)
①催化氧化:
③与氯气反应:
2NH3 + 3Cl2 = N2+ 6HCl
8NH3 + 3Cl2 = N2+ 6NH4Cl
④与CuO反应:
2NH3 + 3CuO === N2+ 3H2O+Cu
(氨气少量)
(氨气足量)
此反应为浓氨水检验氯气管道是否泄漏
2 从化合价升降角度预测NH3有哪些化学性质
黑色固体变为红色,
生成气体无毒
4NH3 + 3O2 === 2N2+ 6H2O
点燃
②氨气在纯氧中燃烧:
【思考】从化合价的角度分析在一定条件下氨气能否和一氧化氮、二氧化氮反应,写出可能发生的反应。
4NH3+5NO=5N2+6H2O
8NH3+6NO2=7N2+12H2O
(治理NOx污染)
①反应原理:
②制取装置:固固加热装置
③收集方法:向下排空气法(导管要伸入到接近试管底部)
④验满方法:将湿润的红色石蕊试纸放在试管口
⑤棉花作用:减少NH3与空气的对流,吸收多余的NH3,防止污染空气
三、氨气的实验室制法
碱石灰:在NaOH的浓溶液中加入CaO,加热制成的白色固体即为碱石灰。
⑥ 干燥方法(用碱石灰)
注意:NH3不可用中性的无水CaCl2干燥,因为CaCl2可与NH3反应生成CaCl2·8NH3;也不能用酸性干燥剂(浓硫酸、P2O5、硅胶)
⑦ 尾气处理:
水或酸溶液
(防倒吸)
肚容式 倒立漏斗式 安全瓶 隔离式
思考(1)实验室能否用加热氯化铵的方法制取氨气
不能。氯化铵受热分解生成的氨气和氯化氢遇冷会重新结合生成氯化铵,得不到氨气。
(2)实验室还可以用什么方法快速制备少量氨气?
a 不能用NH4NO3,因为NH4NO3受热爆炸
b Ca(OH)2不能用KOH或NaOH代替,因两者易吸湿,易结块,不利于产生NH3,且高温下腐蚀试管
c Ca(OH)2不能用NaOH溶液代替,因NH3极易溶于水
氨气的实验室制法:快速简易制法
方法一:加热浓氨水
氨水易挥发,且氨水中的NH3·H2O受热易分解,因此可由加热浓氨水的方法获得NH3。
NH3·H2O == NH3↑+H2O
方法二:浓氨水+固体CaO(或NaOH)
CaO作用:①吸水;②吸水后放热促进NH3逸出;③增大溶液中的OH 浓度,减少NH3的溶解
NH3·H2O+CaO=NH3↑+Ca(OH)2
NaOH作用:NaOH固体溶于水放热,促进NH3·H2O分解;且OH 浓度的增大有利于NH3的逸出
⑧ 氨气的工业制法
高温高压
催化剂
N2+3H2 2NH3
NH3
硝酸
铵盐
纯碱
有机合成工业原料
用稀氨水治疗
蚊虫叮咬
消除
二氧化氮
的污染
吸收硫酸
生产中的
二氧化硫
制冷剂
NH3+H2O+SO2=NH4HSO3
四、氨的用途和保存:
五、 铵盐
1、概念:由铵根离子(NH4+)和酸根离子构成的化合物
如:NH4Cl、(NH4)2SO4、 NH4NO3
2、物理性质:一般铵盐都是白色或无色晶体且易溶于水
情景导学
有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?
铵盐是农业上常用的化肥,如(NH4)2SO4、NH4HCO3、NH4NO3、 NH4Cl等。
NH4HCO3 NH3↑ + CO2 ↑ + H2O
△
不稳定性
3、 化学性质:
①受热易分解
NH4HCO3==NH3↑+CO2↑+H2O
特点:挥发性酸(如HCl、H2CO3等)形成的铵盐,受热时分解为氨和对应的酸。
NH4NO3==N2O↑+2H2O
NH4Cl == NH3↑ + HCl↑
5NH4NO3=4N2+2HNO3+9H2O
2NH4NO3=2N2+O2+4H2O
3(NH4)2SO4 = 3SO2↑+6H2O+N2↑+ 4NH3↑
特点:氧化性酸(如HNO3、H2SO4等)形成的铵盐,受热时发生氧化还原反应,一般不产生氨气。
注意:并不是所有铵盐分解都产生氨气
铵盐受热分解的产物
(1)如果组成铵盐的酸是易挥发或易分解的酸,则固体铵盐受热分解时,氨气与酸一起挥发,冷却时又重新结合成铵盐。如NH4Cl、NH4HCO3等。
(2)如果组成铵盐的酸是难挥发性酸,则固体铵盐受热分解时,只有氨呈气态逸出,而难挥发性酸残留在容器中,如(NH4)2SO4分解的化学方程式为(NH4)2SO4 NH3↑+NH4HSO4 或
(NH4)2SO4 2NH3↑+H2SO4。
(3)如果组成铵盐的酸是具有强氧化性的酸,则在较低的温度下慢慢分解可得到NH3和相应的酸,如NH4NO3。由于生成的氨气具有还原性,硝酸具有氧化性,生成的NH3易被HNO3氧化,则反应时的温度不同,形成氮的化合物也不同,如将NH4NO3在不同的温度下加热分解分别可得到N2O、NO2、N2O3、N2等。
【思考】碘受热会升华,遇冷又会凝结成碘单质。加热试管中的氯化铵晶体,气体在试管上方又变成氯化铵晶体,二者原理相同吗?
分别用试管加热氯化铵和单质碘时,都由固体变为气体,而在试管口遇冷又凝结为固体,其本质不同,前者为化学变化,后者为物理变化。
情境:铵态氮肥(铵盐)不能与草木灰(碱性)混合使用,否则会降低肥效,这是为什么?
与碱反应
② 与碱反应
特点:在水溶液中、固相反应中均可发生
应用:检验铵根离子、制氨气
反应原理:
强碱制弱碱
铵盐与强碱浓溶液或稀溶液加热:NH4++ OH-=NH3↑+H2O
铵盐与强碱稀溶液不加热:NH4++OH- = NH3·H2O
铵盐都可与碱溶液反应生成NH3·H2O(弱碱),加热生成NH3和H2O
实验:铵根离子的检验
学以到用:NH4+的检验
固体
液体
取少量样品于研钵中,加入固体碱进行研磨。若闻到氨的刺激性气味,则样品中含有NH4+
取少量样品与碱混合于试管中,加热后,将湿润的红色石蕊试纸放在试管口,若红色石蕊试纸变蓝,则样品中含有NH4+
取少量溶液于试管中,加入浓碱溶液,微热,将湿润的红色石蕊试纸放在试管口,若红色石蕊试纸变蓝,则样品中含有NH4+
(或用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生)
大部分铵盐都不能与酸反应,但(NH4)2CO3和NH4HCO3能与酸反应生成CO2
③ 铵盐与酸反应
(NH4)2CO3+2HCl = 2NH4Cl+H2O+CO2↑
NH4HCO3+HCl = NH4Cl+H2O+CO2↑
铵盐在工业、农业生产中也有着重要的用途。大量的铵盐用作氮肥,硝酸氨还可用作炸药,氯化铵常用作印染和制作干电池的原料,它也用在金属焊接上除去金属表面的氧化物薄层(焊药)。
4、 铵盐的用途:
练习应用
例. 下列离子方程式正确的是( )
A.实验室用氯化铵和熟石灰制氨气:NH4+ + OH- NH3↑+ H2O
B.NaOH与NH4Cl溶液混合加热:NH4+ + OH- NH3 H2O
C.氨水中加盐酸:NH3 H2O + H+ = NH4+ + H2O
D.氨水中通入过量CO2:CO2 + NH3 H2O = 2NH4+ + CO32- + H2O
C
△
△
练习应用
例、实验室制取氨、收集、验证其还原性并进行尾气处理的装置和原理能达到实验目的的是 ( )
A.用装置甲制取氨
B.用装置乙收集氨时气体应该从a口进b口出
C.装置丙中黑色固体变成红色时还原产物一定为铜
D.可以用装置丁吸收氨,进行尾气处理
B
第3课时 硝酸 酸雨及防治
第五章 第二节 氮及其化合物
学习目标
情景导学
2010年12月在甘肃兰州高速公路G22线,一辆运输硝酸的铝槽车发生泄露事故,现场可闻到刺鼻的气味,同时大量红棕色烟雾。消防人员通过喷洒水稀释和运来纯碱进行处理,以便防止其扩散并污染黄河。
【思考】①为什么现场有大量红棕色的烟雾?
②金属可以与酸反应,为什么可以用铝槽车运输浓硝酸?
颜色 气味 状态 溶解性 挥发性
无色 刺激性 液体 与水任意比互溶
一 硝酸的物理性质
易挥发,在空气中形成白雾
【思考】浓硝酸久置后呈黄色,为什么?
质量分数为69%的硝酸为浓硝酸;质量分数为98%以上的硝酸为“发烟硝酸”
一般将浓硝酸保存在棕色试剂瓶中,并避光放置于阴凉处
1 从物质类别角度预测(具有酸的通性)
与紫色石蕊试液
与金属反应(能放出H2?)
与某些金属氧化物起反应
与碱起反应
与某些盐起反应
2HNO3+CuO=Cu(NO3)2+H2O
2HNO3 +CaCO3=Ca(NO3)2 +CO2↑+ H2O
HNO3+NaOH=NaNO3+H2O
二 硝酸的化学性质
稀硝酸使紫色石蕊试剂变红;
浓硝酸使紫色石蕊试剂先变红,后褪色。
2 从氧化还原角度预测(具有强氧化性)
Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O
3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
② 与Cu反应
(1)硝酸能与大部分金属反应(除了铂、金),将金属氧化为高价态金属的硝酸盐。但在常温下,浓硝酸能使铁、铝钝化。
① 常温下浓硝酸能使Fe、Al发生钝化.
加热时:
Fe + 6HNO3(浓) === Fe(NO3)3 + 3NO2↑ + 3H2O
△
(Fe少量)
(Fe过量)
3Fe + 8HNO3 === 3Fe(NO3)2 + 2NO↑ + 4H2O
△
实验探究
【实验5-8】硝酸与铜反应
实验装置
实验现象
加浓硝酸时,铜丝变细,产生红棕色气体,溶液呈绿色
加稀硝酸时,铜丝变细,产生无色气泡,试管上部观察到浅红棕色,溶液呈蓝色
【思考】写出铜与浓硫酸的反应方程式。对比铜与硝酸的反应,你能发现什么规律?
硝酸反应规律:
(1)硝酸的浓度越大,反应温度越高,其氧化性越强,还原剂一般被氧化为最高价态。
(2)浓硝酸的还原产物是NO2,稀硝酸的还原产物是NO,极稀硝酸可能变成N2、N2O、NH4NO3等。
(3) HNO3与金属反应一般不能产生H2(浓、稀硝酸都具有强氧化性)
氧化性:浓硝酸>稀硝酸(均比浓硫酸强)
C + 4HNO3(浓) === CO2↑ + 4NO2↑ + 2H2O
△
S + 6HNO3(浓) === H2SO4 + 6NO2↑ + 2H2O
△
(2)硝酸能与非金属反应
反应规律:热的浓硝酸可将非金属单质(碳、硫、磷等)氧化为最高价氧化物或最高价含氧酸。
(3) 与还原性物质反应
H2S,I-,Br -,SO2,SO32-,Fe2+等易被HNO3氧化
3Fe2+ + NO3-+4 H+ = 3Fe3+ + NO↑+ 2H2O
3SO32- +2H++NO3-= 3SO4 2- + 2NO↑+H2O
3 硝酸的特性(见光或受热易分解产生红棕色气体)
不稳定性,见光或受热易分解
4HNO3 4NO2↑ + O2↑ + 2H2O
光照或加热
硝酸的保存:一般将浓硝酸保存在棕色试剂瓶中,并避光放置于阴凉处。
硝酸泄漏
【思考】①在运输硝酸的铝槽车发生泄露的事故现场,为什么有大量红棕色的烟雾?
②金属可以与酸反应,为什么可以用铝槽车运输浓硝酸?
思考③:硝酸是无色、易挥发、有刺激性气味的液体。为什么久置的硝酸会变为黄色?如何去除硝酸的黄色?
浓硝酸不稳定,见光或受热会分解生成NO2,NO2溶于浓硝酸使溶液显黄色。
向浓硝酸中通入氧气(或空气)
4NO2+O2+2H2O=4HNO3
去除硝酸的黄色方法:
思考④:铜投入稀硫酸中不会溶解,再向溶液中投入KNO3固体,铜会不会溶解 为什么
会溶解。
NO3-的强氧化性:在H+的环境下有强氧化性,中性或碱性环境下无氧化性。
重要的化工产品,又是重要的化工原料,主要用于医药、炸药(TNT)、染料、化肥等,化学试剂
三 硝酸的用途
第一阶段:工业合成氨
第二阶段: 氨的催化氧化:4NH3+5O2=4NO+6H2O
第三阶段: NO2的生成和吸收:
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
尾气处理:
NaOH溶液
四 硝酸的工业制法
补充:“三酸(浓盐酸、浓硫酸、浓硝酸)变稀”问题辨析。
①浓盐酸与足量的二氧化锰反应时,浓盐酸浓度逐渐变小,变为稀盐酸时不再与二氧化锰反应。
②浓硫酸与足量的铜反应时,浓硫酸浓度逐渐变小,变为稀硫酸时不再与铜反应。
③浓硝酸与足量的铜反应时,浓硝酸浓度逐渐变小,变为稀硝酸时,还原产物发生改变,生成NO。
①物性:硝酸盐均为易溶于水的晶体
②化性:不稳定,易分解
K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、H、Cu、Hg、Ag
亚硝酸盐
O2
氧化物
NO2
O2
金属
NO2
O2
2KNO3 == 2KNO2 + O2↑
2Cu(NO3)2 == 2CuO + 4NO2↑+ O2↑
2AgNO3 == 2Ag + 2NO2↑+ O2↑
分解规律:
补充:硝酸盐
a、由于硝酸盐(s)在高温时受热易分解出O2,故硝酸盐在高温时是强氧化剂。(硫酸根)b、硝酸盐(aq)在酸性条件下的水溶液中,有强氧化性。 (硫酸根不具有)③硝酸盐的氧化性问题:在KNO3溶液中,加入稀硫酸再加入铜片有何现象?④NO3-的检验
步骤:硝酸盐(若是溶液要浓缩)加入浓硫酸、铜片加热
现象与结论:若有红棕色气体,证明有NO3-
反应原理(方程式):
NaNO3+H2SO4 == NaHSO4+HNO3↑
微热
Cu+ HNO3(浓) →
4 Cu(NO3)2+2NO2↑ +2H2O
劳厄和弗兰克,曾获得1914年和1925年的物理学奖,德国纳粹政府要没收他们的诺贝尔奖牌,他们辗转来到丹麦,请求丹麦同行、1922年物理学奖得主玻尔帮忙保存。1940年,纳粹德国占领丹麦,受人之托的玻尔急得团团转。同在实验室工作的一位匈牙利化学家赫维西(1943年化学奖得主)帮他想了个好主意:将奖牌放入“王水” 中,纯金奖牌便溶解了。玻尔于是将溶液瓶放在实验室架子上,来搜查的纳粹士兵果然没有发现这一秘密。战争结束后,溶液瓶里的黄金被还原后送到斯德哥尔摩,按当年的模子重新铸造,于1949年完璧归赵。
能使不溶于硝酸的金属如金、铂等溶解。
浓硝酸和浓盐酸按体积比为1∶3混合得到的混合物。
王 水
【资料卡片】
记忆方法 :“三言(盐)一笑(硝)”
思考讨论
1.加入浓硝酸时生成的红棕色气体是什么?写出反应的化学方程式。
2.加入稀硝酸时,产生的无色气体是什么?在试管上部为什么气体的颜色由无色变为红棕色?写出上述反应过程的化学方程式。
根据浓硝酸、稀硝酸分别与铜的反应观察到实验现象,思考讨论下列问题:
3Cu+8HNO3(稀) === 3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓) === Cu(NO3)2+2NO2↑+2H2O
2NO+O2===2NO2
3.装置中NaOH溶液的作用是什么?写出NO2与NaOH溶液反应的化学方程式。
答:吸收氮氧化物,以防污染环境;2NO2+2NaOH=NaNO3+NaNO2+H2O。
深度思考
2.试着写出少量/过量Fe粉分别于稀硝酸反应的方程式。
Fe + 4HNO3(稀) == Fe(NO3)3 + NO↑ + 2H2O ( Fe少量)
3Fe+ 8HNO3(稀) == 3Fe(NO3)2 + 2NO↑ + 4H2O ( Fe过量)
1.①将足量的铜加入一定体积的浓HNO3中,最终得到气体的成分是什么?为什么?
答:NO2和NO的混合气体;原因是Cu与浓HNO3反应生成NO2,随着反应的进行,HNO3的浓度变小,Cu再与稀HNO3反应生成NO。
Fe + 4H+ + NO3- == Fe3+ + NO↑ + 2H2O ( Fe少量)
3Fe + 8H+ + 2NO3- == Fe2+ + 2NO↑ + 4H2O ( Fe少量)
②将足量的铜加入一定体积的浓HNO3中,反应停止后,如果在溶液中再加入足量稀硫酸会出现什么情况
答:溶液中存在NO3-,它遇到H+后,会继续氧化铜。
练习应用
下述实验中均有红棕色气体产生,对比分析所得结论不正确的是 ( )
① ② ③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
D
练习应用
【思考】在pH=1 溶液中,能大量共存的离子组是( )
A. NH4+、I- 、NO3-、Br- B. S2-、Na+ 、SO32 - 、NO3-
C. Cu2+、NO3-、Na+ 、Cl- D. Fe2+ 、K+ 、NO3- 、SO42–
在酸性溶液中(H+),NO3-具有强氧化性,与S2-、SO32- 、I- 、Fe2+、Br- 等不能共存。
C
思考讨论
硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示:
N2
H2
O2
O2
H2O
NH3
NO
NO2
HNO3
(1) 写出每一步反应的化学方程式。
(2) 请分析上述反应中的物质类别和氮元素化合价的变化情况,以及每一步反应中含氮物质发生的是氧化反应还是还原反应。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
